Se presenta un documento de consenso del grupo de trabajo de Diabetes de la Sociedad Española de Arteriosclerosis (SEA), basado en los últimos estudios y cambios conceptuales aparecidos. En él se expone el riesgo cardiovascular en la diabetes mellitus tipo 2 (DM2) y las pautas de actuación para la prevención y tratamiento de la enfermedad cardiovascular (ECV) asociada a la DM2. Se consensúa la importancia del control lipídico, basado en el objetivo de colesterol LDL y colesterol no HDL cuando existe hipertrigliceridemia, y el de la presión arterial en la prevención y tratamiento de la ECV. Se revisan los nuevos fármacos hipoglucemiantes y sus efectos sobre la ECV, así como las pautas de tratamiento y control de la hiperglucemia. Así mismo, se considera el uso de las pautas antiagregantes. Se enfatiza la importancia de la actuación global y simultánea sobre todos los factores de riesgo para conseguir una importante reducción de eventos cardiovasculares.
Este suplemento está patrocinado por Esteve Pharmaceuticals, S.A.
A consensus document of the Diabetes working group of the Spanish Society of Arteriosclerosis (SEA) is presented, based on the latest studies and conceptual changes that have appeared. It presents the cardiovascular risk in type 2 diabetes mellitus (T2DM) and the action guidelines for the prevention and treatment of cardiovascular disease (CVD) associated with T2DM. The importance of lipid control, based on the objective of LDL-C and non-HDL-C when there is hypertriglyceridemia, and the blood pressure control in the prevention and treatment of CVD is evaluated. The new hypoglycemic drugs and their effects on CVD are reviewed, as well as the treatment and control guidelines of hyperglycemia. Likewise, the use of antiplatelet agents is considered. Emphasis is placed on the importance of global and simultaneous action on all risk factors to achieve a significant reduction in cardiovascular events.
This supplement is sponsored by Esteve Pharmaceuticals, S.A.
La diabetes mellitus tipo 2 (DM2) se asocia a alto riesgo cardiovascular (RCV), pues los pacientes con DM2 triplican el riesgo de mortalidad cardiovascular (MCV) y duplican el de mortalidad total en comparación con la población no diabética de similar edad y sexo. La enfermedad cardiovascular (ECV) constituye la principal causa de morbimortalidad de los pacientes con DM21. Las complicaciones macrovasculares están relacionadas principalmente con la enfermedad coronaria (75%), mientras que el 25% restante son manifestaciones de afectación vascular cerebral (isquemia cerebral transitoria o ictus) o de enfermedad arterial periférica (EAP).
La mayoría de los pacientes con DM2 presentan una dislipidemia mixta denominada dislipidemia aterogénica (DA), que confiere a la DM un mayor RCV.
La alta prevalencia de ECV en los pacientes con diabetes mellitus (DM) se correlaciona con la frecuente asociación con los factores de riesgo cardiovascular (FRCV) clásicos y, específicamente, con el grado de hiperglucemia. El aumento del 1% del valor de glucohemoglobina (HbA1c) se asocia a un incremento del riesgo de eventos cardiovasculares (CV) del 18%2.
Numerosos estudios han demostrado la eficacia del control glucémico para reducir las complicaciones microvasculares (retinopatía, nefropatía y neuropatía)3-5, pero su capacidad para reducir las complicaciones macrovasculares —cardiopatía isquémica (CI), EAP, ictus aterotrombótico (ACV)— no ha sido tan evidente.
Recientes estudios han demostrado que los nuevos fármacos antidiabéticos presentan seguridad CV en pacientes con DM2 con RCV alto o con ECV6-12, e incluso el tratamiento con algunos de ellos ha evidenciado una reducción de la MCV frente a la intervención estándar10-12. En pacientes con DM2 y ECV previa, el tratamiento con empagliflozina muestra beneficio CV de forma precoz a pesar de que existe una modesta reducción de la HbA1c, por lo que cabe pensar en otros mecanismos independientes del control glucémico como posible explicación de los resultados logrados13.
La prevalencia elevada de ECV en la DM2 también se ha puesto de manifiesto en un seguimiento realizado en Atención Primaria, en el que el 21% de los pacientes presentaban complicaciones macrovasculares14. En el estudio Steno, un abordaje multifactorial con un control intensivo de los FRCV fue capaz de reducir la morbimortalidad CV, beneficio que se mantuvo tras el cese de la intervención, con una mayor expectativa de vida (tras un seguimiento de más de 21 años) en el grupo de sujetos que recibió durante casi 8 años el tratamiento intensivo15. Ello nos hace considerar la importancia del abordaje global del RCV del paciente con DM que contemple, junto con la implementación de las modificaciones del estilo de vida, el adecuado control glucémico, lipídico, y de presión arterial (PA); y corrobora el concepto de «memoria metabólica» o «efecto legado», en el que una intervención precoz e intensiva confiere beneficios a largo plazo.
El conocimiento exhaustivo de las terapias para el control de la DM2, así como de aquellos fármacos que han demostrado beneficio CV, redundará en una reducción del elevado RCV que tienen estos pacientes.
Para reducir el RCV y controlar la ECV en el paciente con DM2, se debe considerar un abordaje global de todos los FRCV que integre las intervenciones no farmacológicas que favorezcan cambios hacia un estilo de vida saludable con los tratamientos farmacológicos hipolipemiante, hipoglucemiante, y antihipertensivo adaptados al RCV del paciente (fig. 1).
Intervención no farmacológicaLa optimización del estilo de vida del paciente con DM2 está ampliamente considerada como una intervención esencial16-20, no solo para mejorar el control de la DM, sino también de las comorbilidades asociadas, como la dislipidemia, la obesidad y la hipertensión arterial (HTA). Los cambios hacia un estilo de vida saludable deben incluir los siguientes aspectos:
- •
Cesación del tabaquismo.
- •
Gestión intensiva de pérdida de peso (>5%) para evitar el sobrepeso y la obesidad. Se recomiendan intervenciones en estilo de vida (asesoramiento nutricional, actividad física y el cambio de hábitos) con supervisión continua.
- •
Actividad física que combine ejercicios aeróbicos y de fuerza-resistencia de intensidad moderada o vigorosa durante al menos 150min a la semana.
- •
Preferir la ingesta de hidratos de carbono de las verduras, frutas, cereales integrales, legumbres y productos lácteos a los de otras fuentes. Limitar especialmente los alimentos procesados que contienen grasas agregadas, azúcares o sodio.
- •
Recomendar el consumo de ácidos grasos poliinsaturados n-3, presentes en el pescado, especialmente en el azul (sardina, salmón, atún, caballa, jurel, etc.).
- •
Una dieta tipo mediterráneo rica en ácidos grasos monoinsaturados (aceite de oliva virgen y frutos secos) puede beneficiar el control glucémico y de los FRCV, y por lo tanto puede ser recomendada como una alternativa eficaz21.
- •
Recomendar la ingesta de fibra en la dieta (>40g/día o 20g/1.000kcal/día).
Se recomienda que en todas las consultas se insista en los mensajes a pacientes y familiares sobre el beneficio del autocuidado, junto con la promoción del ejercicio físico, la pérdida de peso en caso de sobrepeso u obesidad, y los hábitos alimentarios saludables.
Riesgo cardiovascular en el paciente con diabetesLas guías consideran que el RCV del paciente con DM es alto o muy alto16,17, e incluso se puede clasificar como RCV extremo18 cuando coexiste ECV, debido a que existe un exceso de riesgo de mortalidad en los pacientes diabéticos tras un síndrome coronario agudo (SCA).
En el paciente con DM las lesiones arterioscleróticas son más difusas y distales, existiendo una mayor incidencia de placas rotas y trombóticas. La frecuencia de ECV en el paciente con DM es 2-5 veces superior a la del paciente sin DM, 2-4 mayor la CI, 2-4 veces mayores los ACV, y 8-10 veces mayor la EAP.
El perfil lipídico que predomina en los pacientes con DM es conocido como dislipidemia aterogénica (DA)22, fenotipo que se manifiesta frecuentemente en situaciones de insulinorresistencia (obesidad, prediabetes, DM, síndrome metabólico), en la hiperlipidemia familiar combinada, en el síndrome de ovario poliquístico y en la enfermedad renal crónica (ERC).
El metabolismo hepático alterado por la insulinorresistencia, combinado con un mayor eflujo de ácidos grasos libres, facilita la síntesis hepática de triglicéridos (TG), y de lipoproteínas de muy baja densidad (VLDL) ricas en TG (LRT). La lipasa hepática (LH) y la lipoproteína lipasa (LPL) periférica hidrolizan los TG de las LRT y remanentes de quilomicrones. La insulina es una agonista de la LPL, por lo que en situaciones de insulinorresistencia está reducido el catabolismo de las LRT y remanentes de quilomicrones, favoreciendo la hipertrigliceridemia (HTG). El exceso de LRT aumenta la expresión de la proteína de transferencia de ésteres de colesterol (CETP), aumentando la transferencia de TG desde las LRT a las lipoproteínas de alta densidad (HDL) y a las lipoproteínas de baja intensidad (LDL). Este metabolismo alterado favorece la formación de unas partículas HDL pequeñas (HDL3) pobres en colesterol y en apolipoproteína (apo) A-I, y la formación de unas LDL pequeñas y densas especialmente aterogénicas.
La DA ha sido definida23 como un disbalance entre el aumento de la concentración de las lipoproteínas proaterogénicas que contienen apo B enriquecidas en TG (LRT) y la disminución de la concentración de las lipoproteínas antiaterogénicas que contienen apo A-I (HDL). La DA también se puede definir por la alteración de 3 parámetros plasmáticos (tríada lipídica):
- •
Hipertrigliceridemia (TG ≥200mg/dL [≥2,3mmol/L]).
- •
Disminución de la concentración de las partículas HDL (≤40mg/dL [≤1,0mmol/L] en hombres; ≤45mg/dL [≤1,2 mmol/L] en mujeres).
- •
Aumento de la concentración de las partículas LDL pequeñas y densas con niveles de colesterol unido a LDL (c-LDL) normales o ligeramente aumentados.
La DA incluye también otras alteraciones del metabolismo lipídico:
- •
Aumento del número de partículas aterogénicas (VLDL, lipoproteínas de densidad intermedia [IDL], LDL).
- •
Aumento de la concentración de apo B y de los niveles plasmáticos del colesterol no HDL (c-No-HDL=colesterol total [CT]−colesterol unido a HDL [c-HDL]).
- •
Aumento de partículas remanentes de las LRT.
- •
Disminución de la concentración de apo A-I.
- •
Aumento de la lipoproteína (a).
- •
Aumento de la actividad enzimática de CETP.
- •
Aumento de la apo C-III (inhibidor de la LPL).
- •
Disminución de la actividad de la LPL y de la LH (disminución del catabolismo de las LRT).
La DA promueve que el RCV del paciente con DM sea especialmente elevado debido a las modificaciones estructurales y funcionales de las lipoproteínas. Las partículas LDL pequeñas y densas son más aterogénicas por varias razones: menor afinidad por el receptor hepático de LDL, mayor vida media plasmática, mayor susceptibilidad a la agregación, glucación, oxidación, y fagocitosis subendotelial, y mayor permeabilidad endotelial. Las partículas HDL pequeñas y densas son pobres en apo A-I, tienen menor capacidad de captación de colesterol, y son menos funcionales para promover el transporte reverso del colesterol de los macrófagos hacia el hígado.
En el estudio ACCORD24, el riesgo asociado de los pacientes diabéticos con DA era similar al de los pacientes con ECV previa. Un metaanálisis25 realizado con pacientes diabéticos tratados con estatinas mostró una mayor incidencia de eventos CV con niveles de c-HDL≤35mg/dL (≤0,9mmol/L) que con c-HDL>43mg/dL (≤1,1mmol/L). En un subanálisis del estudio TNT26 con pacientes que alcanzaron el objetivo terapéutico de c-LDL<70mg/dL (<1,8mmol/L), existía un 39% de aumento del riesgo de eventos CV al comparar los que tenían el c-HDL<37mg/dL (<0,9mmol/L) frente a los que tenían un c-HDL>55mg/dL (>1,4mmol/L). Por todo ello, el RCV del paciente con DM se ha llegado a equiparar con el que presenta el paciente coronario27.
En los pacientes con DM2, la DA constituye un predictor independiente de RCV más potente que la HTG o los niveles bajos de c-HDL.
Para optimizar las intervenciones farmacológicas que precisan los pacientes con DM, hay que definir previamente el RCV que presentan. No se recomienda determinar el RCV de los pacientes con DM mediante tablas de RCV desarrolladas para la población general.
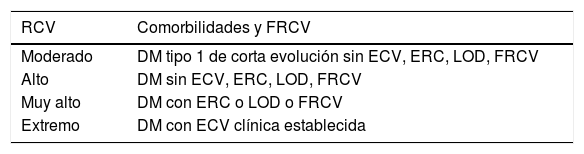
Para establecer el RCV de los pacientes con DM (tabla 1), se debe considerar la presencia de las siguientes comorbilidades, lesiones de órganos diana (LOD) y FRCV16-18:
- •
Enfermedad cardiovascular: infarto de miocardio (IM) previo, SCA, revascularización coronaria y otros procedimientos de revascularización arterial, ACV, accidente isquémico transitorio, aneurisma de la aorta, EAP, placas arterioscleróticas.
- •
Enfermedad renal crónica.
- •
Factores de riesgo cardiovascular:
- ∘
Tabaquismo.
- ∘
HTA.
- ∘
Hipercolesterolemia.
- ∘
c-HDL≤40mg/dL (≤0,9mmol/L) en hombres.
- ∘
c-HDL≤45mg/dL (≤1,2mmol/L) en mujeres.
- ∘
ECV precoz en familiar de primer grado (varones <55 años; mujeres <65 años).
Riesgo cardiovascular del paciente con DM
| RCV | Comorbilidades y FRCV |
|---|---|
| Moderado | DM tipo 1 de corta evolución sin ECV, ERC, LOD, FRCV |
| Alto | DM sin ECV, ERC, LOD, FRCV |
| Muy alto | DM con ERC o LOD o FRCV |
| Extremo | DM con ECV clínica establecida |
DM: diabetes mellitus; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; FRCV: factores de riesgo cardiovascular (dislipidemia, hipertensión, c-HDL<40 mg/dL, historia familiar de ECV en familiar de primer grado <55 años en hombres o <65 años en mujeres); LOD: lesión de órgano diana.
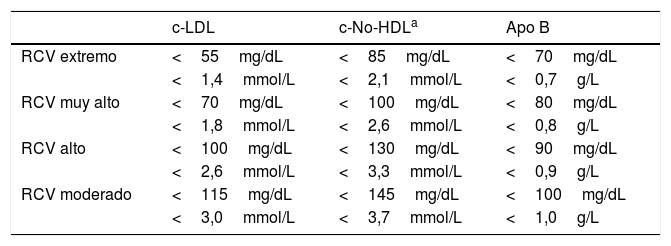
La categorización del RCV va a permitir fijar el objetivo terapéutico de c-LDL o c-No-HDL (tabla 2) del paciente con DM, y en consecuencia establecer la intensidad del tratamiento farmacológico hipolipemiante que precisa.
Objetivos lipídicos en pacientes con DM
| c-LDL | c-No-HDLa | Apo B | |
|---|---|---|---|
| RCV extremo | <55mg/dL | <85mg/dL | <70mg/dL |
| <1,4mmol/L | <2,1mmol/L | <0,7g/L | |
| RCV muy alto | <70mg/dL | <100mg/dL | <80mg/dL |
| <1,8mmol/L | <2,6mmol/L | <0,8g/L | |
| RCV alto | <100mg/dL | <130mg/dL | <90mg/dL |
| <2,6mmol/L | <3,3mmol/L | <0,9g/L | |
| RCV moderado | <115mg/dL | <145mg/dL | <100mg/dL |
| <3,0mmol/L | <3,7mmol/L | <1,0g/L |
Apo: apolipoproteína; c-LDL: colesterol unido a lipoproteínas de baja densidad; c-No-HDL: colesterol no unido a lipoproteínas de alta densidad; DM: diabetes mellitus; RCV: riesgo cardiovascular.
La intervención con estatinas para reducir el c-LDL es más eficaz que la reducción de HbA1c para disminuir el riesgo relativo (RR) de enfermedad coronaria en los pacientes con DM227. Hay suficiente evidencia científica disponible, tanto en ensayos clínicos28-30 como en metaanálisis31,32, que demuestra que el tratamiento con estatinas reduce significativamente la morbimortalidad por eventos CV en pacientes con DM, por lo que la terapia farmacológica con estatinas no debe retrasarse, sino iniciarse simultáneamente con los cambios hacia un estilo de vida saludable.
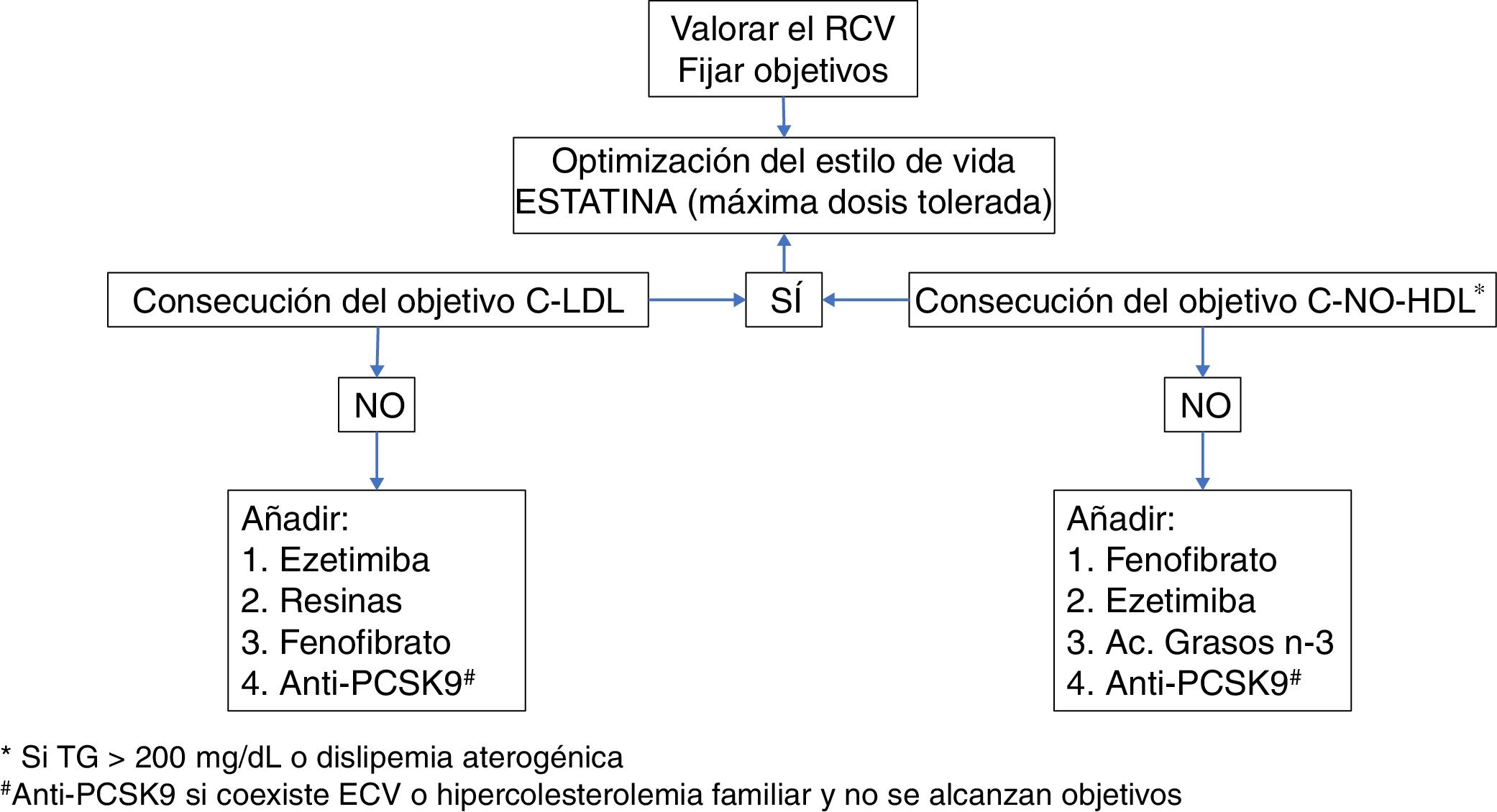
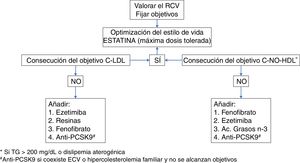
Las guías16,17 recomiendan utilizar estatinas a las máximas dosis toleradas y necesarias para alcanzar los objetivos terapéuticos adecuados al RCV del paciente (tabla 2), en general para la consecución del objetivo primario de c-LDL, o para alcanzar el objetivo secundario de c-No-HDL en los pacientes con HTG o con DA (fig. 2).
Tratamiento hipolipemiante en el paciente con diabetes.
c-LDL: colesterol unido a lipoproteínas de baja densidad; c-No-HDL: colesterol no unido a lipoproteínas de alta densidad; ECV: enfermedad cardiovascular; PCSK9: proproteína convertasa subtilisina-kesina tipo 9; RCV: riesgo cardiovascular; TG: triglicéridos.
*Si TG>200mg/dL o dislipidemia aterogénica.
#Anti-PCSK9 si coexiste ECV o hipercolesterolemia familiar y no se alcanzan objetivos.
La fórmula de Friedewald (c-LDL=CT−[TG/5]−[c-HDL]mg/dL) (c-LDL=CT−[TG/2,17]−[c-HDL]mmol/L) es el método utilizado para determinar los niveles plasmáticos de c-LDL, asumiendo una razón CT/VLDL constante. Como los niveles de VLDL están alterados en situaciones de HTG o con DA, la fórmula ofrece niveles de c-LDL poco aproximados a partir de TG>200mg/dL. En estos casos puede ser útil la cuantificación de apo B por métodos inmunoturbidimétricos, aunque fijar como objetivo el c-No-HDL es más barato, sencillo y eficaz.
Existe una alta prevalencia (43,5%) de ERC en la población con DM233. En estos pacientes es mejor utilizar aquellas estatinas con menor eliminación renal, como atorvastatina, fluvastatina y pitavastatina, y considerar la disminución de dosis de las demás estatinas según la tasa de filtrado glomerular estimado (FGe).
En los pacientes diabéticos polimedicados hay que considerar las posibles reacciones adversas por las interacciones farmacológicas más frecuentes producidas con atorvastatina, lovastatina y simvastatina y el citocromo P450 (3A4) (tabla 3).
Principales características diferenciales de las estatinas
| Vías metabólicas enzimáticas |
| Vía del citocromo (CYP3A4): lovastatina, simvastatina y atorvastatina. Mayor riesgo de interacción con otros fármacos que utilizan esta vía |
| Vía del citocromo (CYP2C9): fluvastatina. Pitavastatina y rosuvastatina usan mínimamente esta vía. Menor riesgo de interacción |
| Sulfonación: pravastatina |
| Enfermedad renal crónica |
| Deben utilizarse estatinas con alta eliminación biliar y escasa eliminación renal: atorvastatina, fluvastatina y pitavastatina |
| Diabetogenicidad |
| Las estatinas más potentes (rosuvastatina y atorvastatina) a las dosis más altas presentan mayor riesgo de diabetogenicidad |
| Pitavastatina presenta menor riesgo |
Desde que en el estudio JUPITER34 se detectó una mayor incidencia de DM en el grupo con rosuvastatina35, varios metaanálisis36-38 han puesto de manifiesto que el tratamiento de estatinas a largo plazo puede empeorar el metabolismo hidrocarbonado y aumenta el riesgo de nuevos casos de DM, por lo que se recomienda considerar su efecto diabetógeno39. Sin embargo, no todas las estatinas tienen el mismo efecto diabetógeno. Así, los estudios con pravastatina muestran resultados contradictorios. Mientras que el estudio WOSCOPS40 muestra disminución, el estudio LIPID41 es neutral, y el estudio PROSPER42 informa de un aumento de la incidencia de DM. Los estudios que comparan el efecto diabetógeno de las estatinas muestran que el aumento de la incidencia de nuevos casos de DM depende de la dosis utilizada37 y de la potencia de la estatina38.
En contra del posible efecto de clase, los estudios con pitavastatina43-45 muestran mejoría en los niveles de HbA1c y disminución en la incidencia de DM, por lo que se ha recomendado su uso en pacientes con DM o con riesgo de desarrollar DM46.
El aumento de riesgo de incidencia de DM no debe modificar la indicación de estatinas, al ser muy bajo comparado con el beneficio en la reducción de eventos CV: un nuevo caso de DM2 por cada 9 eventos CV evitados36.
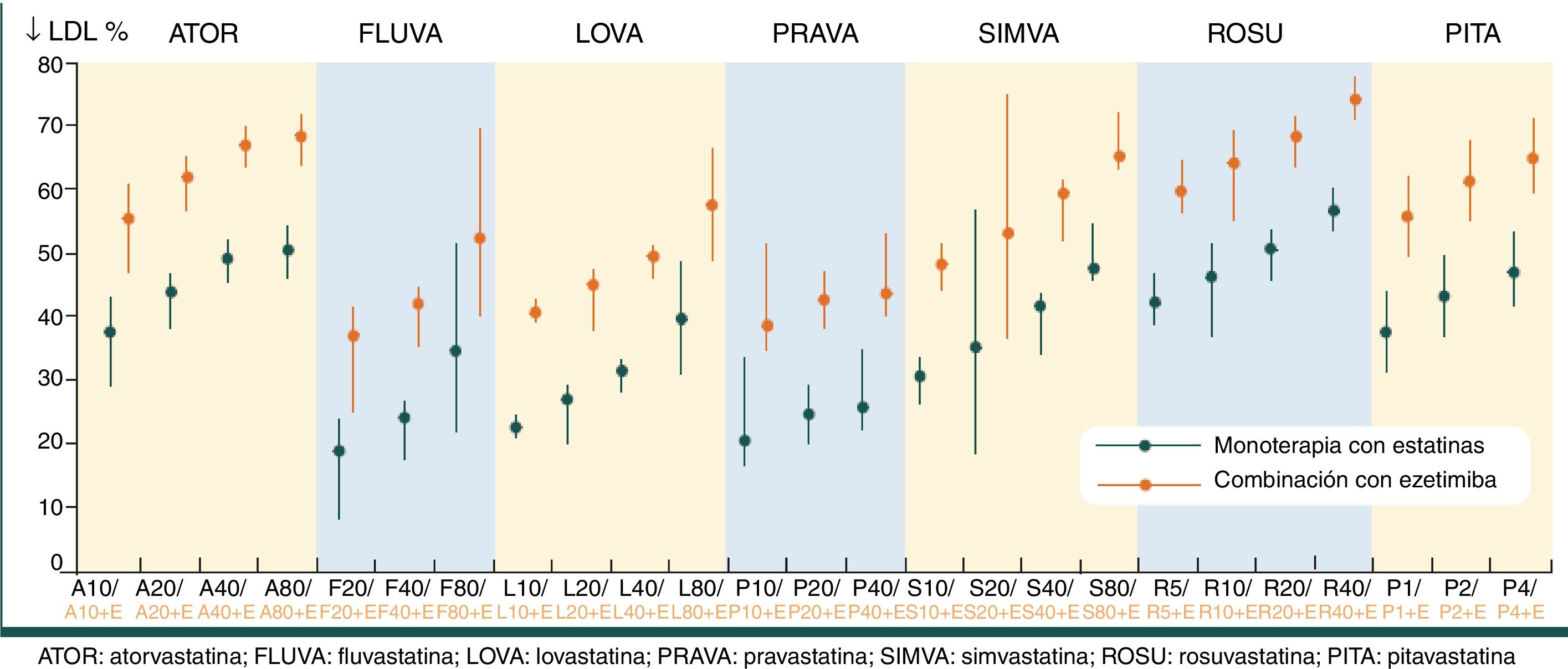
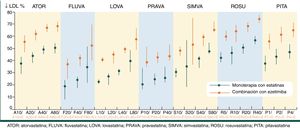
Es importante considerar las principales características diferenciales de las estatinas con el fin de optimizar su prescripción (tabla 3) y valorar la intensidad terapéutica hipocolesterolemiante conseguida con estatinas a diferentes dosis17 (fig. 3), para adecuarla al objetivo de control específico para cada categoría de riesgo.
Intensidad terapéutica hipocolesterolemiante conseguida con estatinas en monoterapia y combinadas con ezetimiba.
Fuente: modificado de Catapano et al.17.
El riesgo residual se define como el riesgo de eventos CV que persiste a pesar de la consecución de los objetivos para c-LDL, HbA1c y PA una vez tomadas las medidas terapéuticas convencionales22. A pesar de alcanzar niveles óptimos de c-LDL con el tratamiento intensivo con estatinas24,47, persiste un riesgo residual debido a la influencia de otros FRCV y a que los niveles alcanzados de c-No-HDL, apo B y el número de partículas de LDL sean subóptimos48. Aunque las lipoproteínas LDL son las más aterogénicas, otras lipoproteínas con apo B y triglicéridos (LRT y sus remanentes) también lo son porque son retenidas en el tejido conectivo subendotelial y favorecen la formación de la placa de ateroma. Por ello, para optimizar el tratamiento farmacológico, es esencial considerar el impacto que tiene la DA sobre el riesgo residual del paciente con DM49.
En pacientes diabéticos con intolerancia a estatinas o con DA, es necesario combinar las dosis máximas toleradas de estatinas con otros agentes hipolipemiantes (fig. 2). Si no se alcanzan los objetivos de c-LDL, el fármaco de elección en el tratamiento combinado con estatinas es la ezetimiba50, inhibidor de la absorción intestinal de colesterol que parece ser más eficaz en diabéticos que en no diabéticos51. Según la guía Kidney Disease: Improving Global Outcomes (KDIGO)52, el tratamiento combinado de estatinas con ezetimiba también está indicado en pacientes con ERC, pues reduce la morbimortalidad CV53. En la figura 3 se muestra la reducción esperable de los niveles de c-LDL conseguida con diferentes estatinas y dosis, tanto en monoterapia como combinadas con ezetimiba17.
Como alternativa si no hay HTG, se pueden utilizar fijadores de ácidos biliares (resinas de intercambio aniónico)54 como la colestiramina y el colesevelam.
El fenofibrato actúa sobre los 3 niveles de la tríada lipídica. Disminuye la HTG al activar la enzima LPL favoreciendo la degradación de las LRT, disminuye la densidad de las partículas LDL, y mejora la producción de las partículas HDL al incrementar la síntesis de apo A-I. Es el fármaco de elección combinado con estatinas si no se alcanzan los objetivos de c-No-HDL. Está especialmente indicado para reducir el riesgo residual en pacientes diabéticos con DA23,55,56, con HTG moderada (TG: 200-500mg/dL [2,3-5,6mmol/L]), HTG severa (TG: 500-1.000mg/dL [5,6-11,3mmol/L], o con riesgo de pancreatitis aguda (TG≥1.000mg/dL [≥11,3mmol/L]). Dado que puede empeorar el FGe, está contraindicado en los estadios 4 y 5 de ERC, y se debe tener la precaución de no superar la dosis de 100mg/día en pacientes con estadio 2 de ERC (FGe: 60-89mL/min/1,73m2), y de 50mg/día en estadio 3 de ERC (FGe: 30-59mL/min/1,73m2)57. El gemfibrozilo está contraindicado en el tratamiento combinado con estatinas por incrementar el riesgo de miopatía16,17.
Los ácidos grasos n-3 también estimulan la actividad de la LPL constituyendo una alternativa y complemento terapéutico en pacientes diabéticos con HTG grave e insuficiencia renal58.
Los anticuerpos monoclonales de la proproteína convertasa subtilisina-kesina tipo 9 (anti-PCSK9) están indicados añadirlos al tratamiento combinado de ezetimiba y estatinas a dosis máximas toleradas en pacientes diabéticos con ECV ateromatosa o hipercolesterolemia familiar que no hayan alcanzado los objetivos de c-LDL59,60.
En pacientes diabéticos con ERC no es preciso ajustar dosis de ezetimiba, resinas, ácidos grasos n-3 o anti-PCSK9.
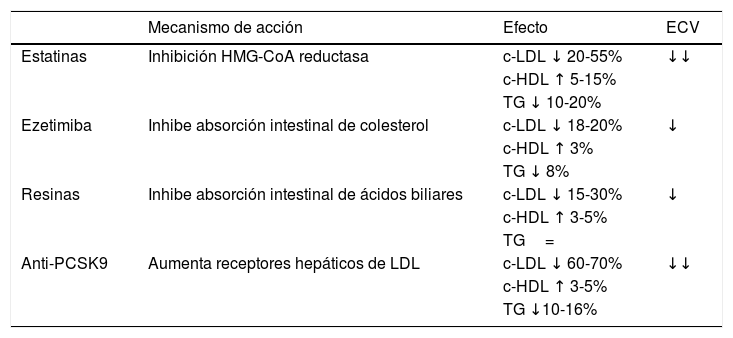
El mecanismo de acción de los fármacos hipolipemiantes, efecto sobre el perfil lipídico y su influencia sobre el riesgo de ECV se muestran en la tabla 4.
Mecanismo de acción y efectos de los fármacos hipolipemiantes
| Mecanismo de acción | Efecto | ECV | |
|---|---|---|---|
| Estatinas | Inhibición HMG-CoA reductasa | c-LDL ↓ 20-55% | ↓↓ |
| c-HDL ↑ 5-15% | |||
| TG ↓ 10-20% | |||
| Ezetimiba | Inhibe absorción intestinal de colesterol | c-LDL ↓ 18-20% | ↓ |
| c-HDL ↑ 3% | |||
| TG ↓ 8% | |||
| Resinas | Inhibe absorción intestinal de ácidos biliares | c-LDL ↓ 15-30% | ↓ |
| c-HDL ↑ 3-5% | |||
| TG= | |||
| Anti-PCSK9 | Aumenta receptores hepáticos de LDL | c-LDL ↓ 60-70% | ↓↓ |
| c-HDL ↑ 3-5% | |||
| TG ↓10-16% |
Anti-PCSK9: anticuerpos monoclonales de la proproteína convertasa subtilisina-kesina tipo 9; c-HDL: colesterol unido a lipoproteínas de alta densidad; c-LDL: colesterol unido a lipoproteínas de baja densidad; ECV: enfermedad cardiovascular; HMG-CoA: hidroximetilglutaril-coenzima A; TG: triglicéridos.
En la figura 2 se puede observar un algoritmo de decisión referente al tratamiento hipolipemiante en el paciente con DM2.
Manejo farmacológico de la hiperglucemiaEl fármaco antidiabético ideal debería actuar sobre todas las alteraciones fisiopatológicas de la DM, ser bien tolerado, tener un efecto duradero, no provocar hipoglucemias, facilitar la pérdida de peso, mejorar el resto de los FRCV, y demostrar una disminución de la morbimortalidad CV y total a largo plazo, todo ello con un coste razonable.
El objetivo glucémico debe adaptarse a las características del paciente para evitar los riesgos inherentes a la situación de hipoglucemia.
Metformina (biguanida)La metformina (MET) se sigue considerando en la actualidad el fármaco más seguro, eficaz y coste-efectivo para iniciar la terapia farmacológica, por lo que se recomienda como primer escalón terapéutico de la DM219,20. Además de su efecto beneficioso sobre el control glucémico, mejora la disfunción endotelial, la hemostasia, el estrés oxidativo, la resistencia a la insulina, el perfil lipídico y la redistribución de la grasa.
Estudios observacionales de cohortes muestran que el tratamiento con MET, en comparación con sulfonilureas (SU), se ha asociado con reducción de MCV y mortalidad total61.
Un ensayo relativamente pequeño de 390 pacientes tratados con insulina, asignados al azar a MET o placebo y con seguimiento de 4,3 años, confirmó que la MET reducía los eventos macrovasculares, mejoraba el peso corporal y el control glucémico, y disminuía los requerimientos de insulina. Estos beneficios llevaron a los investigadores a concluir que el tratamiento con MET debería continuar después de la introducción de insulina en cualquier paciente con DM2, a menos que estuviera contraindicado62.
En una revisión sistemática con pacientes con DM2 en la que se compara la MET y SU con nuevas familias de antidiabéticos63, se refuerza a la MET, en comparación con las SU, como fármaco en la primera línea de tratamiento, por su seguridad CV y efectos beneficiosos sobre la HbA1c, el peso y la MCV.
Un metaanálisis de 17 estudios observacionales64, con pacientes diabéticos con deterioro moderado de la función renal, insuficiencia cardíaca congestiva (ICC) o enfermedad hepática crónica, comparó regímenes médicos que incluían o no MET. El uso de MET se asoció con una reducción de la mortalidad total en los 3 grupos de pacientes y con menos reingresos por insuficiencia cardíaca (IC) en pacientes con ERC o ICC.
La US Food and Drug Administration (FDA)65 recomendó en 2016 una modificación de la ficha técnica de MET. En la actualidad, puede utilizarse en aquellos pacientes con un FGe≥45mL/min/1,73m2, no debe iniciarse con un FGe<45mL/min/1,73m2, se debe considerar la relación riesgo-beneficio de la continuación de la terapia con un FGe entre 45 y 30mL/min/1,73m2 (ante un deterioro de la función renal procede una reducción de la dosis de MET o su retirada), y está contraindicada con FGe<30mL/min/1,73m2.
El uso continuado de MET en ancianos se asocia con deficiencia de vitamina B12, por lo que se recomienda monitorizar los niveles de cianocobalamina.
SulfonilureasLas SU son fármacos secretagogos que actúan sobre un receptor asociado al canal de KATP estimulando la liberación de insulina. En la actualidad existe una discusión sobre los efectos CV de las SU como tratamiento de segunda línea asociada a MET. En el metaanálisis de Varvaki Rados et al.66 la utilización de las SU de segunda o tercera generación no se asoció con mayor riesgo de MCV o de mortalidad total. Tampoco las SU de segunda y tercera generación se asociaron con mayor riesgo de infarto agudo de miocardio (IAM) o de ACV.
Por el contrario, una revisión sistemática de los estudios observacionales relacionados con las SU y la seguridad CV concluye que el tratamiento con SU se asociaría con un aumento del riesgo de ECV y mortalidad total en la mayoría de los estudios que no tuvieran grandes sesgos relacionados con el diseño de los mismos67.
El metaanálisis de Phung et al.68, que incluyó 1.325.446 pacientes seguidos entre 0,46 y 10,4 años en 33 estudios observacionales, concluía que las SU comparadas con otros antidiabéticos incrementaban el RR de mortalidad cardíaca coronaria, bien solas (RR: 1,27; [IC95%: 1,18-1,34]), o bien con MET (RR: 1,26 [IC95%: 1,17-1,35]). También aumentaban el riesgo de un objetivo compuesto (MCV, IAM, ictus, y hospitalización por ECV), bien solas (RR: 1,10; [IC95%: 1,04-1,16]), o bien con MET (RR: 1,18 [IC95%: 1,13-1,24]).
La revisión sistemática de Simpson et al.69 muestra un comportamiento heterogéneo de las diferentes SU sobre el RCV. El RR de MCV para la gliclazida frente a la glibenclamida (comparador) fue de 0,60 (IC95%: 0,45-0,84); de 0,79 (IC95%: 0,57-1,11) para la glimepirida, de 1,01 (IC95%: 0,72-1,43) para la glipizida, de 1,11 (IC95%: 0,79-1,55) para la tolbutamida, y de 1,45 (IC95%: 0,88-2,44) para la clorpropamida, siendo la gliclazida la SU con menor riesgo de MCV y mortalidad total.
Así pues, es recomendable evitar el uso de glibenclamida y, en el caso de requerir tratamiento con SU, utilizar preferentemente la gliclazida, glipizida o glimepirida, ya que parecen más seguras. Se deberían evitar las SU en pacientes ancianos por las posibles secuelas derivadas de las hipoglucemias clínicas o subclínicas. Estudios pendientes de finalizar, como el CAROLINA70, quizás puedan aclarar más estos conceptos.
En relación con la utilización de las SU en la ERC, la gliclazida se puede utilizar en estadio 3a (FGe: 45-59mL/min/1,73m2), y la glipizida ajustando dosis. La glimepirida se puede emplear ajustando la dosis, solo si FGe>60mL/min/1,73m2. La glibenclamida no se debe utilizar en ERC.
Meglitinidas (glinidas)Son secretagogos de acción corta que actúan sobre un receptor diferente al de las SU. En España la nateglinida solo está autorizada en asociación. Repaglinida y nateglinida no determinan beneficios sobre los FRCV clásicos. En un estudio en 740 pacientes ancianos con DM2 hospitalizados por CI y tratados con repaglinida, no se encontró mayor MCV en comparación con glibenclamida o gliclazida, en un seguimiento de 30 días71.
La repaglinida se puede utilizar en cualquier estadio de ERC. La nateglinida se puede emplear ajustando dosis en pacientes con ERC estadio 3. Las glinidas no se pueden usar en insuficiencia hepática ni asociar a gemfibrozilo.
Tiazolidindionas (glitazonas)La pioglitazona, única molécula comercializada en España de esta familia, activa los receptores nucleares PPARγ mejorando la sensibilidad a la insulina. Aumenta la reabsorción renal de agua y sodio por lo que puede empeorar la IC, especialmente en individuos con disfunción diastólica72. Otros efectos secundarios derivados de la utilización de glitazonas son: edemas periféricos, ganancia de peso, anemia dilucional, y riesgo de fracturas (sobre todo en mujeres).
En el estudio PROACTIVE, la pioglitazona se asoció con un aumento de la incidencia de IC severa, sin aumento de la mortalidad total. En un subestudio del PROACTIVE se encontró que la pioglitazona redujo la incidencia de IAM subsecuente en un 16% y en un 47% la recurrencia de ACV73.
El estudio PERISCOPE en DM2 se asoció con reducción del volumen de la placa de ateroma74. Otros trabajos han evidenciado un efecto beneficioso sobre el grosor de la íntima-media carotídea asociado con disminución de c-LDL, aumento de c-HDL o con mejoría de la sensibilidad a la insulina75.
Inhibidores de alfa-glucosidasasLos inhibidores de las alfa-glucosidasas (acarbosa y miglitol) limitan la acción de las enzimas que permiten la obtención de glucosa a partir de los hidratos de carbono del tubo digestivo (almidón, dextrina y disacáridos), demorando su absorción y reduciendo la glucemia posprandial. Tienen una baja eficacia en disminución de la HbA1c y elevada frecuencia de efectos secundarios gastrointestinales (flatulencia, diarrea) en monoterapia y, especialmente, si se emplean junto con MET19,20. La acarbosa está contraindicada en insuficiencia hepática grave. El miglitol está contraindicado en ERC.
Inhibidores de la dipeptidil peptidasa-4 (iDPP-4) (gliptinas)Los inhibidores de la dipeptidil peptidasa-4 (iDPP-4) impiden la acción de la dipeptidil peptidasa-4 (DPP-4) que inactiva el péptido similar al glucagón tipo 1 (GLP-1) aumentando la vida media de las incretinas, favoreciendo la liberación de insulina y reduciendo los niveles de glucagón de forma dependiente de la glucemia. Constituyen un grupo de antidiabéticos seguro desde un punto de vista CV, aunque según los resultados de los estudios realizados a instancias de la FDA a partir del 2008 no demuestran beneficio en la reducción de la morbimortalidad CV. Son fármacos que no inducen incremento de peso y presentan muy baja probabilidad de producir hipoglucemias.
Existen 3 grandes estudios prospectivos, aleatorizados, diseñados para evaluar el impacto de fármacos de esta clase sobre la ECV. El estudio SAVOR TIMI-53, con saxagliptina, corroboró la seguridad CV de este fármaco, pero tuvo como hallazgo inesperado una mayor incidencia (27%) de hospitalización por IC, hecho que no se asoció con aumento de mortalidad8. En el estudio EXAMINE con alogliptina, se observó que en 85 pacientes (3,1%) que recibieron alogliptina se produjo hospitalización por IC, en comparación con los 79 (2,9%) incluidos en el grupo placebo (hazard ratio [HR]: 1,07; [IC95%: 0,79-1,46]). No obstante, el tratamiento con alogliptina no tuvo efecto sobre los eventos compuestos de MCV y hospitalización por IC en el análisis post hoc (HR: 1,00; [IC95%: 0,82-1,21])6, mientras que el estudio TECOS, realizado con sitagliptina, mostró seguridad CV y no se observaron diferencias entre los 2 grupos (sitagliptina versus placebo) en el riesgo de hospitalización por IC7.
Se han publicado 2 revisiones sistemáticas que estudiaron el riesgo de los iDDP-4 de hospitalización por IC y de producir eventos CV, sin observar aumento de ambas variables76-78.
La seguridad CV de vildagliptina valorada en un metaanálisis (>17.000 pacientes) y en un estudio en práctica clínica real muestra que vildagliptina no se asocia a un aumento del riesgo de eventos adversos CV, incluido el riesgo de IC, en relación con los comparadores79,80.
Están pendientes de finalizar los estudios CAROLINA70 y CARMELINA81, que valorarán la seguridad CV de linagliptina frente a SU y frente a placebo, respectivamente.
Todos los iDPP-4 requieren ajuste de dosis en ERC, salvo linagliptina.
Inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT-2) (gliflozinas)Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT-2) impiden la reabsorción de sodio y glucosa en el tubo contorneado proximal favoreciendo la glucosuria. En un estudio observacional realizado en pacientes con DM2, la utilización de iSGLT-2 se asoció con una reducción en la hospitalización por IC, en la MCV, y en la mortalidad total82. Los ensayos clínicos con iSGLT-2 han demostrado12,83 una disminución del riesgo de hospitalización por IC y del riesgo del objetivo combinado de eventos cardiovasculares principales (MACE) compuesto por MCV, IAM no fatal y ACV no fatal.
Al margen de su efecto sobre el perfil glucémico, los beneficios CV de este grupo farmacológico pueden atribuirse a la pérdida de peso y disminución de la PA como consecuencia del aumento de la diuresis y glucosuria, y a la reducción de la albuminuria84. Como efecto adverso, presentan una mayor incidencia de infecciones genitourinarias.
El estudio EMPAREG12, realizado con empagliflozina versus placebo en pacientes diabéticos con ECV previa, mostró una reducción del 14% del riesgo de MACE, del 38% de la MCV, del 32% de la mortalidad total, y del 35% de hospitalización por IC, aunque no hubo diferencias significativas en la reducción del riesgo de IAM y ACV no fatales. También hubo una reducción del 39% en el riesgo de nueva nefropatía o empeoramiento de nefropatía previa. Su acción beneficiosa, más allá de la atribuible a la mejora del control glucémico, se mostró de forma precoz (a partir de los 3 meses). Ello comporta que la empagliflozina se pueda considerar para reducir el RCV en pacientes diabéticos con ECV previa19.
En el estudio CANVAS83 se evaluaron los efectos CV de la canagliflozina versus placebo en pacientes mayoritariamente (65%) con DM2 y ECV previa. También demostró una reducción del 14% en el objetivo primario de MACE en el grupo de canagliflozina y del 33% en el riesgo de hospitalización por IC. Sin embargo, no hubo diferencias significativas al analizar por separado los objetivos individuales de los MACE (MCV, IAM no fatal y ACV no fatal). Los resultados renales mostraron una reducción del 27% del riesgo en la progresión de la albuminuria, y del 40% de un objetivo compuesto formado por reducción sostenida del FGe, necesidad de trasplante renal y de muerte por causa renal. En cuanto a los acontecimientos adversos, el grupo canagliflozina mostró un mayor riesgo de fracturas (HR: 1,23 [IC95%: 0,99-1,52]) y amputaciones (HR: 1,97 [IC95%: 1,41-2,75]).
A la espera de los resultados sobre seguridad CV de la dapagliflozina con el estudio DECLARE TIMI 58, un estudio de Toulis et al., realizado en Atención Primaria en el Reino Unido con el seguimiento de 22.124 pacientes con DM2 (4.444 de ellos en tratamiento con dapagliflozina), concluyó que el grupo de pacientes que recibió este fármaco tuvo un menor riesgo de mortalidad total85.
En el estudio CVD-REAL82, los iSGLT-2 evaluados fueron fundamentalmente canagliflozina (52,7%) y dapagliflozina (41,8%). En una población de 309.046 pacientes con DM2, en la que solo el 13% presentaba antecedentes de ECV, el tratamiento con iSGLT-2 versus otros antidiabéticos no insulínicos mostró reducciones del 39% en hospitalización por IC, y del 51% en la mortalidad total.
Agonistas del receptor GLP-1 (arGLP-1)Los agonistas del receptor GLP-1 (arGLP-1) son péptidos análogos al GLP-1 obtenidos por tecnología de ADN recombinante. Su administración es subcutánea y su vida media es más larga que los GLP-1 por ser más resistentes a la acción de la DPP-4. Los arGLP-1 suprimen la secreción de glucagón posprandial, enlentecen el vaciado gástrico y estimulan la sensación de saciedad. También tienen efectos pleiotrópicos sobre el sistema CV, reducen la PA y el peso en pacientes con sobrepeso u obesidad y no provocan hipoglucemias. Se ha postulado que los arGLP-1 estimularían directamente los receptores GLP-1 de los vasos de miocardio, aunque la tendencia a aumentar la frecuencia cardíaca podría aumentar el RCV.
Los arGLP-1 se clasifican por la duración de su acción en arGLP-1 de acción larga (albiglutida, dulaglutida, exenatida semanal, liraglutida, semaglutida y taspoglutida), y de acción corta (exenatida 2 veces al día, y lixisenatida).
Existen estudios de seguridad CV con lixisenatida, liraglutida y semaglutida. El estudio ELIXA9 es un ensayo clínico realizado con lixisenatida versus placebo en pacientes con DM2 con antecedentes de SCA. El objetivo primario fue evaluar los efectos sobre la morbimortalidad, con un objetivo compuesto con MCV, IAM no fatal, ACV no fatal, y hospitalización por angina inestable. Demostró su no inferioridad, sin aumentar el riesgo de eventos secundarios adversos: hipoglucemias, número de pancreatitis ni cáncer pancreático.
En el estudio LEADER10, la liraglutida no solo demostró su no inferioridad, sino que además mostró una reducción del 13% en ECV y un 22% en la MCV. También se produjeron reducciones estadísticamente no significativas en la incidencia de IAM e ictus no fatales.
En el estudio SUSTAIN11, el tratamiento con semaglutida —arGLP-1 no comercializado en España— redujo el objetivo primario un 26%, fundamentalmente por disminución del ACV un 39% y un 26% del IAM, aunque la MCV apenas se modificó. Sin embargo, se evidenció un claro empeoramiento de las complicaciones en la retinopatía diabética y no se puede descartar que se debiera a un efecto directo del fármaco.
Existe un metaanálisis86 que, comparando los diferentes arGLP-1 (albiglutida, dulaglutida, exenatida semanal, liraglutida, taspoglutida, exenatida 2 veces al día, y lixisenatida frente a placebo), concluyó que todos los arGLP-1 disminuían el peso corporal y mejoraban el control glucémico y metabólico, aunque incrementando el riesgo de efectos adversos gastrointestinales frente a placebo. Exenatida semanal es el que tuvo menor riesgo de presentar vómitos. No hubo diferencias en el riesgo de hipoglucemia entre los 3 agentes. No se encontraron diferencias entre los arGLP-1 de acción corta entre sí, y los de acción larga entre sí. Dulaglutida, liraglutida o exenatida semanal fueron superiores a exenatida 2 veces al día y a lixisenatida en la reducción de la HbA1c y la glucemia basal.
InsulinaSe puede considerar iniciar la terapia con insulina (con o sin otros hipoglucemiantes) en pacientes recientemente diagnosticados de DM2 sintomáticos o con HbA1c≥10%19,20.
En los pacientes con DM2 que no logran los objetivos de HbA1c no se debe demorar la intensificación de la farmacoterapia, incluida la insulina.
El estudio ORIGIN valoró la tasa de eventos macro y microvasculares con la administración de insulina glargina versus tratamiento estándar. No hubo diferencias entre los grupos de comparación en cuanto a MACE, MCV o eventos microvasculares87.
La insulina se puede utilizar en cualquier estadio de ERC.
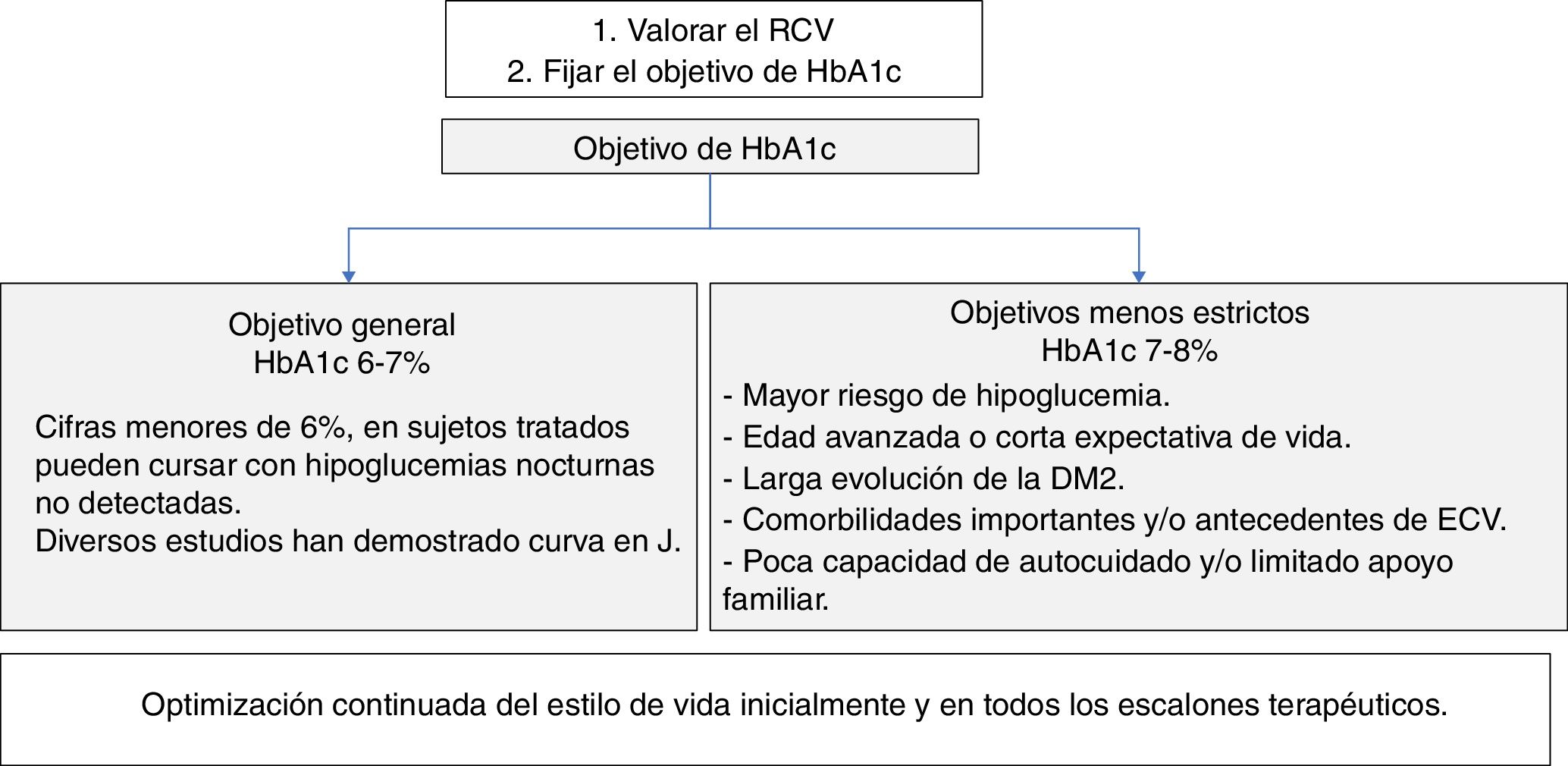
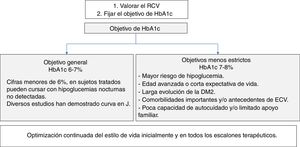
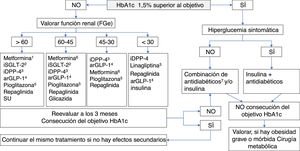
Objetivos de control de HbA1cPara establecer el objetivo de HbA1c en los pacientes con DM2 (fig. 4) hay que evaluar de forma conjunta la edad del paciente, las comorbilidades y el riesgo de hipoglucemia18-20.
La American Association of Clinical Endocrinologists/American College of Endocrinology (AACE/ACE)18 apoya un objetivo primario de HbA1c de ≤6,5% para la mayoría de los pacientes con DM2, y un objetivo entre 6,5 y 8% en pacientes con importantes comorbilidades, esperanza de vida limitada o riesgo de hipoglucemia, o si el objetivo primario no puede lograrse sin resultados adversos. Estas mismas situaciones las define la American Diabetes Association (ADA) con HbA1c<7% y <8%, respectivamente19. Según la ADA, se podría sugerir objetivos de HbA1c<6,5% en pacientes con DM de corta duración, DM2 tratada solo con estilo de vida o MET, larga esperanza de vida o sin ECV. Para evitar el riesgo de hipoglucemias, se debe tener mayor prudencia al establecer objetivos estrictos ante pacientes con DM de larga evolución, presencia de antecedentes de ECV, poca capacidad de autocuidado o limitado apoyo familiar.
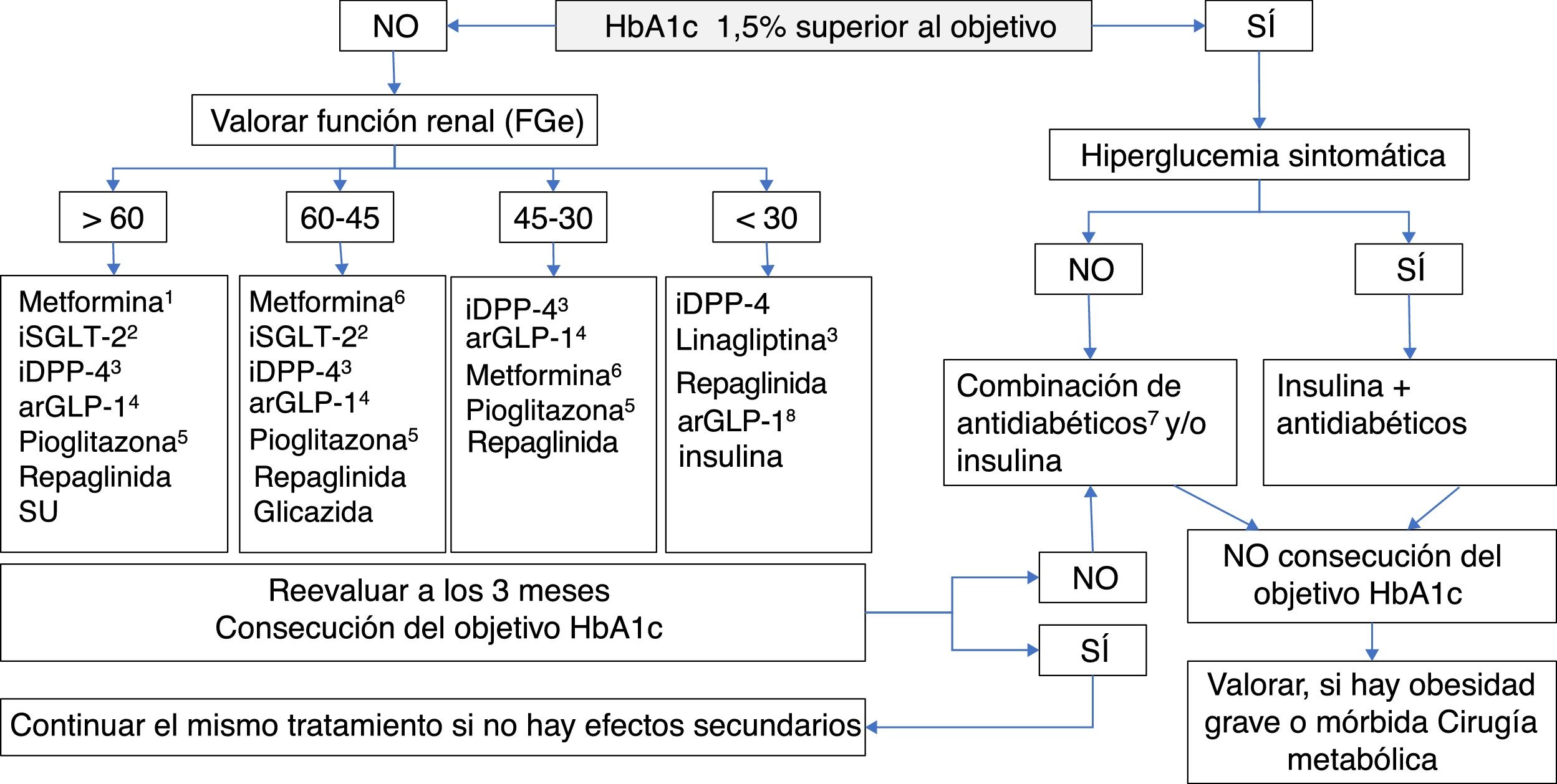
La intervención farmacológica para el control del metabolismo glucídico en el diabético sitúa a la MET en el primer nivel. Si el objetivo de control de HbA1c está lejano o no se consigue en 3 meses, habría que añadir otro fármaco adecuado a las comorbilidades del paciente y siempre considerando la importancia de las modificaciones del estilo de vida. En la tabla 5 se indica el tratamiento farmacológico hipoglucemiante en los pacientes con DM2 en situaciones especiales, y en la figura 5 se muestra un algoritmo de los objetivos y la decisión del tratamiento.
Tratamiento farmacológico hipoglucemiante en pacientes con DM2 en situaciones especiales
| Primer nivel | Segundo nivel | |
|---|---|---|
| ERC | ▪ iDPP-4 ajustando dosis; linagliptina no precisa ajuste ▪ Metformina: reducir 50% dosis en estadio 3a. No iniciar en estadio 3b y considerar la relación riesgo-beneficio de la continuación de la terapia | ▪ Repaglinida ▪ arGLP-1. Considerar su uso en pacientes obesos; ajustar dosis de exenatida. ▪ Insulina basal ▪ Pioglitazona. Utilizar con cautela, vigilar la aparición de edemas. Contraindicado en IC |
| Obesidad | ▪ Metformina | ▪ arGLP-1 ▪ iSGLT-2 |
| Síndrome metabólico | ▪ Metformina | ▪ iSGLT-2 ▪ arGLP-1. Considerar su uso en pacientes obesos ▪ Pioglitazona. Considerar su uso si alta resistencia ínsulínica o en esteatosis hepática. Vigilar la aparición de edemas. Contraindicado en IC |
| Anciano frágil | ▪ Metformina | ▪ iDPP-4 |
| Enfermedad cardiovascular | ▪ Metformina | ▪ iSGLT-2. Beneficios demostrados en prevención CV ▪ arGLP-1: liraglutida, semaglutida. Beneficios demostrados en prevención CV |
arGLP-1: agonistas del receptor del péptido semejante al glucagón tipo 1; CV: cardiovascular; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; IC: insuficiencia cardíaca; iDPP-4: inhibidores de la dipeptidil peptidasa-4; iSGLT-2: inhibidores del cotransportador sodio-glucosa tipo 2.
Tratamiento antidiabético en el paciente con DM tipo 2.
aRGLP1: agonistas del receptor del péptido semejante al glucagón tipo 1; DM: diabetes mellitus; FGe: filtrado glomerular estimado; HbA1c: glucohemoglobina; IDPP4: inhibidores de la dipeptidil peptidasa-4; ISGLT2: inhibidores del cotransportador sodio-glucosa tipo 2.
1 Fármaco de elección para iniciar la terapia farmacológica, en ausencia de contraindicaciones. Introducción gradual para minimizar efectos adversos digestivos. 2 Fármacos aconsejables en caso de antecedentes de ECV. No utilizar canagliflozina en caso de arteriopatía periférica (riesgo de amputación). En filtrados glomerulares de 45 a 60 se debe reducir la dosis de empagliflozina y canagliflozina y suspender dapagliflozina. 3 Fármacos a considerar en pacientes > 75 años con comorbilidades (anciano frágil). Ajustar la dosis de iDPP-4 en caso de ERC, excepto con linagliptina, que no precisa ajuste de la dosis. 4 Indicados especialmente en pacientes obesos. Liraglutida ha demostrado reducir la mortalidad cardiovascular en diabéticos con antecedentes de ECV. En caso de ERC ajustar la dosis de exenatida. 5 Contraindicado en insuficiencia cardiaca (grado III/IV), vigilar edemas. Considerar su uso en alta resistencia insulínica o en esteatosis hepática. 6 ERC estadio 3a: reducir dosis 50%. ERC estadio 3b: no iniciar y considerar la relación riesgo-beneficio de la continuación de la terapia. 7 Utilizar los antidiabéticos adecuados según la función renal y RCV. Está contraindicada la combinación arGLP-1 e iDPP-4. 8 Algunos arGLP1 disponen de indicación hasta con FG de 15.
La HTA es una comorbilidad frecuentemente asociada a la DM2. La prevalencia de HTA en España es mayor entre los pacientes diabéticos que entre los no diabéticos. En el estudio Di@bet.es, la prevalencia de pacientes en tratamiento farmacológico antihipertensivo o con presión arterial sistólica (PAS)/presión arterial diastólica (PAD) >140/90mmHg es del 83,3% en pacientes diabéticos, 77% en los sujetos prediabéticos, y 34,3% en los no diabéticos88.
Existe una relación conocida entre la HTA y el aumento de la MCV, de ACV, CI, fibrilación auricular e IC, entre otras enfermedades89-91. Además, existe una estrecha relación entre la HTA y la aparición de albuminuria, pues su presencia se asocia a mayor prevalencia de HTA en los pacientes diabéticos92.
El control de la cifras de PA en el paciente con DM2 ha demostrado ser una herramienta fundamental para el descenso de la morbimortalidad CV93. Por tanto, es necesario realizar un correcto y precoz diagnóstico de HTA, y tratar adecuadamente según la evaluación previa del daño orgánico asociado a la HTA.
Diagnóstico de hipertensión en el paciente diabéticoSe debe medir la PA en todas las visitas que el paciente diabético realice a la consulta médica o de enfermería19,20,94. La medida de la PA debe realizarse con corrección, especialmente en el momento del diagnóstico o para la toma de decisiones terapéuticas. Para evitar errores, el paciente debe guardar reposo, no haber fumado, permanecer con el brazo y los pies apoyados, y tener la vejiga vacía. Deben realizarse 3 tomas separadas y utilizar la media aritmética como valor de PA.
En caso de utilización de aparatos de medida semiautomáticos deben utilizarse preferiblemente los de manguito braquial, y solo los validados por alguno de los protocolos habituales95. Hay que recordar que estos dispositivos no son eficaces en caso de presencia de arritmias y especialmente fibrilación auricular, por lo que en estas situaciones se recomienda la toma simultánea del pulso arterial.
En la evaluación diagnóstica de la HTA en el paciente con DM2, se deben tener en cuenta dos consideraciones de particular importancia: la hipotensión ortostática y el ritmo circadiano de la PA. La hipotensión ortostática, producida por la disfunción del sistema nervioso autónomo y descontrol de los mecanismos de regulación de la PA, es muy frecuente en el paciente diabético, especialmente en los ancianos96. Por ello, se recomienda la correcta toma de PA en sedestación, y después de estar 3min en bipedestación. Una diferencia mayor de 20mmHg en la PAS o de 10mmHg en la PAD serían diagnósticas de hipotensión ortostática, lo que podría condicionar la elección del fármaco hipotensor.
En segundo lugar, el ritmo circadiano de la PA tiene relación con el RCV tanto en la población general como en los diabéticos97. El restablecimiento de un patrón circadiano con descenso nocturno de la PA en el paciente diabético parece asociarse a un beneficio en la reducción del daño orgánico asociado. Por ello, se recomienda la realización de una monitorización ambulatoria de la presión arterial de 24h (MAPA) en todos los pacientes con una PA>140/90mmHg en el momento del diagnóstico de DM, y con una periodicidad anual en todos los pacientes en tratamiento farmacológico antihipertensivo98.
Los criterios diagnósticos de HTA se indican en la tabla 6.
Beneficios y objetivos del tratamiento antihipertensivo en diabetes mellitus tipo 2El beneficio del tratamiento antihipertensivo se obtiene fundamentalmente por el control de la cifras de PA. Es esencial que tanto el médico como el paciente se impliquen y colaboren en la consecución de las cifras objetivo de PA.
Los principales estudios de intervención con fármacos antihipertensivos en pacientes con DM2 de alto riesgo por presentar ECV, u otros FRCV, han sido ACCORD BP99 y ADVANCE BP100. En el estudio ACCORD BP, el grupo de tratamiento intensivo (media: 3,4 fármacos) redujo la PA hasta 119,3/64,4mmHg versus 133,5/70,5mmHg con la terapia estándar (media: 2,1 fármacos). Aunque no hubo diferencias en el objetivo primario compuesto de MACE, sí hubo una reducción del 41% en la tasa anual de ictus, acompañándose sin embargo de un incremento de los efectos secundarios (hipotensión, elevación de creatinina sérica y alteraciones hidroelectrolíticas). En el estudio ADVANCE BP, se comparó frente a placebo una combinación fija de perindopril e indapamida. El grupo de tratamiento redujo la PA hasta 136/73mmHg (5,6 y 2,2mmHg de PAS/PAD más que el grupo placebo), reduciendo un 9% el objetivo primario compuesto de riesgo de MACE, eventos microvasculares y renales. Los riesgos de MCV y mortalidad total también se redujeron un 18 y 14%, respectivamente. El seguimiento a 6 años confirmó la persistencia del efecto beneficioso101.
Los metaanálisis de estudios clínicos que incluyeron pacientes diabéticos han demostrado beneficio del tratamiento farmacológico antihipertensivo en aquellos pacientes que presentaban una PAS inicial >140mmHg93,102. Por debajo de esas cifras al inicio del tratamiento, persiste la reducción de ictus, pero no del resto de eventos CV. Este beneficio se obtiene mayoritariamente en los pacientes que alcanzan PAS<140mmHg. No existen ensayos clínicos que muestren que el beneficio en pacientes hipertensos con DM2 sea mejor con el tratamiento con objetivo de PAS<140mmHg versus otros objetivos inferiores de PA. Sin embargo, una revisión sistemática mostró que el objetivo de 133/76mmHg proporcionó un beneficio significativo en comparación con el de 140/81mmHg para MACE, IAM, ictus y albuminuria, pero sin beneficio en MCV o mortalidad global, IC o progresión a ERC terminal103.
Existen estudios que indican que reducir la PAS a cifras cercanas a 120mmHg podría asociarse a beneficio adicional, pero sin valorar los posibles perjuicios asociados al tratamiento. Un ejemplo de ello es el reciente estudio SPRINT104, que valoró el efecto de unas cifras de control más bajas, pero no incluyó a pacientes diabéticos.
Siguiendo las recomendaciones de la mayoría de las guías de práctica clínica16,19,20,94, la mayor parte de los pacientes con DM deben ser tratados para conseguir los objetivos de PAS<140mmHg y PAD<90mmHg. La guía de HTA 2017 de la American College of Cardiology/American Heart Association (ACC/AHA)105 indica otros objetivos de control más estrictos (PAS entre 125-130mmHg y PAD entre 80-90mmHg) para los pacientes hipertensos con DM.
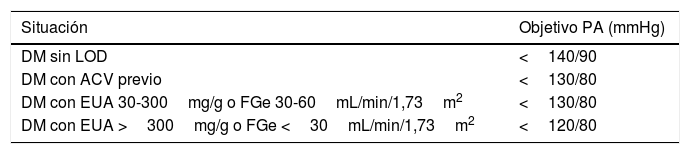
En aquellos pacientes con DM y nefropatía incipiente demostrada por una excreción urinaria de albúmina (EUA) entre 30-300mg/g, o con FGe entre 30-60mL/min/1,73m2, o para la prevención secundaria tras un ACV previo, puede considerarse un objetivo de PA<130/80mmHg siempre que se considere seguro el uso de combinaciones farmacológicas que suelen ser necesarias para alcanzar estos objetivos.
En pacientes con EUA>300mg/g, o con FGe<30mL/min/1,73m2, o creatinina >1,5mg/dL puede valorarse un objetivo de PA<120/80mmHg con los mismos criterios de seguridad, y en colaboración con el nefrólogo que esté siguiendo al paciente.
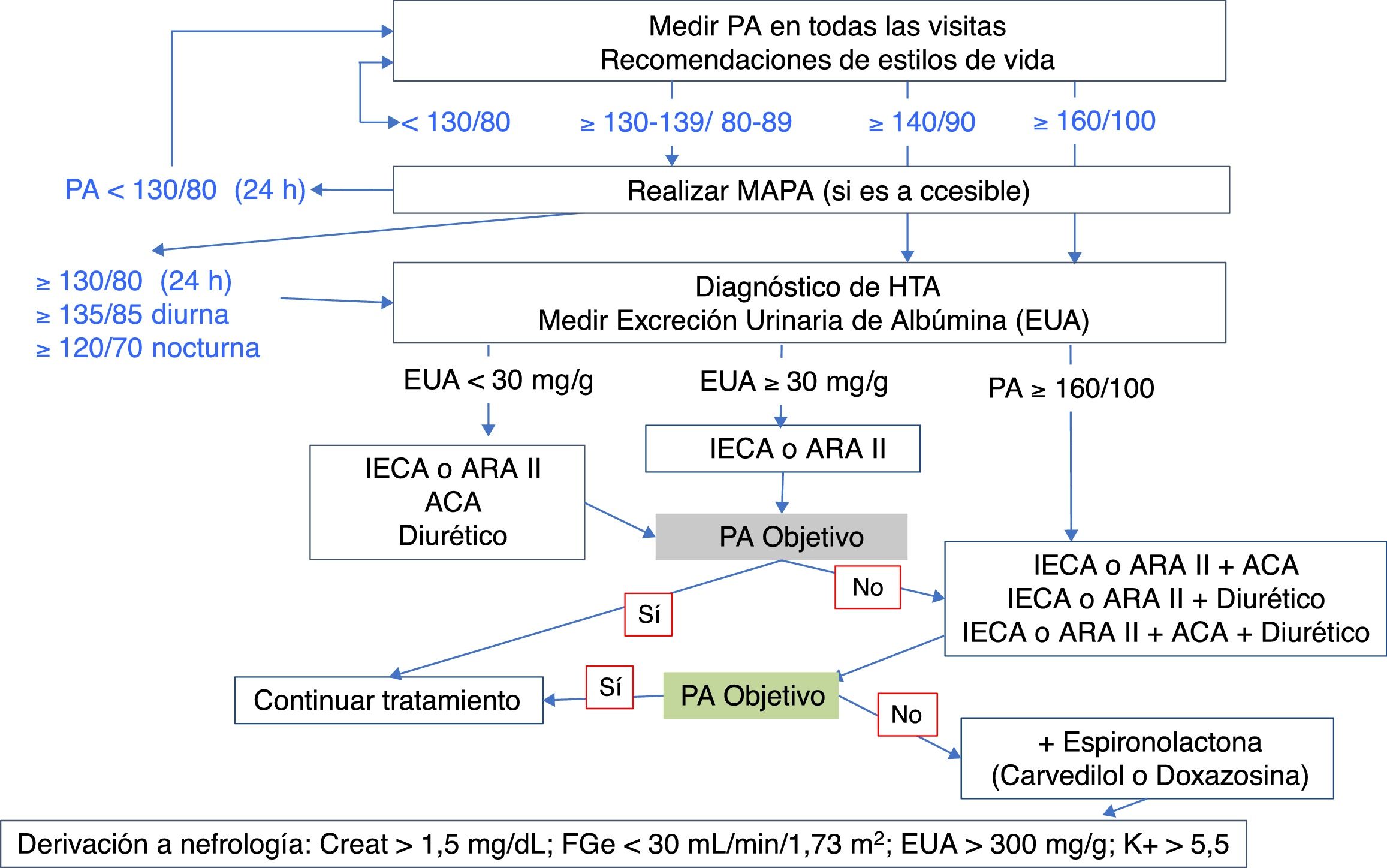
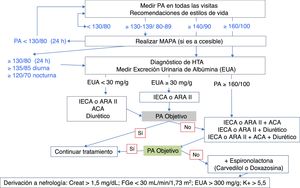
En la tabla 7 se indican los objetivos de PA en el paciente diabético, y en la figura 6 se muestra un algoritmo de manejo de la HTA en pacientes con DM2.
Objetivos de PA en el paciente con diabetes
| Situación | Objetivo PA (mmHg) |
|---|---|
| DM sin LOD | <140/90 |
| DM con ACV previo | <130/80 |
| DM con EUA 30-300mg/g o FGe 30-60mL/min/1,73m2 | <130/80 |
| DM con EUA >300mg/g o FGe <30mL/min/1,73m2 | <120/80 |
ACV: accidente cerebrovascular; DM: diabetes mellitus; EUA: excreción urinaria de albúmina; FGe: tasa de filtrado glomerular estimado; LOD: lesión de órgano diana; PA: presión arterial.
Algoritmo de manejo de la HTA en pacientes con DM2.
ACA: calcioantagonistas; ARA II: antagonistas de los receptores de angiotensina II; DM2: diabetes mellitus tipo 2; HTA: hipertensión arterial; IECA: inhibidores de la enzima de conversión de angiotensina; MAPA: monitorización ambulatoria de la presión arterial de 24h; PA: presión arterial.
Los 4 grupos farmacológicos que han demostrado ser eficaces para reducir eventos CV en pacientes con DM son los inhibidores de la enzima de conversión de angiotensina (IECA), los antagonistas de los receptores de angiotensina II (ARA II), los calcioantagonistas (ACA) dihidropiridínicos, y los diuréticos tiazídicos. Cualquiera de ellos puede utilizarse en monoterapia como primera opción en el paciente diabético hipertenso sin nefropatía y PA<160/100mmHg.
La elección del fármaco antihipertensivo se justifica atendiendo a la cifra inicial de PA y al patrón circadiano de la PA (MAPA), valorando su capacidad para reducir la progresión de la nefropatía cuando está presente, o para prevenir eventos CV o MCV.
IECA/ARA IIEn el paciente con EUA entre 30-300mg/g o nefropatía diabética, los IECA y los ARA II han demostrado disminuir su progresión106-109, por lo que son de primera elección en monoterapia. Están especialmente indicados en pacientes con IC. Son neutros en el metabolismo lipídico, y podrían incrementar la respuesta a insulina y enlentecer la progresión de la retinopatía. El efecto secundario más frecuente de los IECA es la tos. Se deben monitorizar la función renal (puede reducirse inicialmente) y el potasio sérico que tiende a elevarse, especialmente con FGe<45mL/min/1,73m2.
La consecución de los objetivos de PA, sobre todo en pacientes con PA>160/100mmHg, va a requerir en muchas ocasiones la combinación de fármacos94, siendo uno de ellos IECA o ARA II.
Diuréticos tiazídicosLos diuréticos tiazídicos pueden incrementar el efecto hipotensor de los IECA. Esta asociación limita los efectos secundarios de los diuréticos como la hipokalemia, hiperuricemia e HTG. Sin embargo, los diuréticos tiazídicos pueden elevar la glucemia. Aún así, el estudio ADVANCE demostró beneficio CV persistente con la asociación de perindopril e indapamida100,101. Las dosis bajas de diuréticos tiazídicos (12,5mg de hidroclorotiazida o 25mg de clortalidona) no suelen acompañarse de efectos secundarios significativos. Es preferible la asociación con diuréticos de asa de larga duración como torasemida o furosemida si el FGe es <30mL/min/1,73m2.
Calcioantagonistas (ACA)El estudio ACCOMPLISH comparó la asociación de benazepril con amlodipino o con hidroclorotiazida en 6.946 pacientes diabéticos, demostrando un mayor beneficio CV con la primera combinación110. Los ACA, tanto amlodipino como los no dihidropiridínicos (diltiazem y verapamilo), son eficaces en monoterapia y carecen de efectos adversos en el metabolismo lipídico y de los hidratos de carbono. Sin embargo, podrían aumentar el riesgo de IC en monoterapia, en comparación con los diuréticos.
Tratamiento combinadoBasado en los resultados observados en el subgrupo de pacientes diabéticos del estudio ONTARGET111 y el estudio ALTITUDE112, no se recomienda la asociación de IECA con ARA II o aliskiren, debido a la falta de beneficio adicional y al incremento de efectos adversos asociados (hiperkalemia, hipotensión y fracaso renal agudo).
En los pacientes con PA≥160/100mmHg confirmada en consulta, se debe valorar el tratamiento combinado con 2 fármacos. En pacientes que necesiten más de un fármaco, y en presencia de un patrón circadiano sin descenso nocturno de la PA (descenso inferior al 10% en el promedio de la PA nocturna respecto a la diurna), se recomienda la administración de uno de los fármacos por la noche, ya que un mejor control de la PA nocturna se asoció a menor riesgo de MACE98,113. Teniendo en cuenta que la administración de las combinaciones de fármacos en un solo comprimido facilita la adherencia al tratamiento, el médico debe valorar estas dos cuestiones al decidir el esquema terapéutico complejo de estos pacientes.
En los pacientes que no se controlen con la asociación de un IECA o ARA II con un diurético o con un ACA, debe utilizarse la combinación de los 3 tipos de fármacos.
La HTA resistente se define como la ausencia de control de la PA pese al cumplimiento de medidas no farmacológicas, y la utilización de un diurético y otros 2 fármacos a dosis máximas recomendadas. Antes de diagnosticar HTA resistente se debe descartar previamente: causas de HTA secundaria, seudorresistencia por falta de cumplimentación, HTA enmascarada y reacción de alerta94.
En pacientes con HTA resistente, la recomendación es añadir antagonistas de los receptores de mineralocorticoides o de la aldosterona (espironolactona, eplerenona) pues disminuyen la albuminuria y tienen efecto beneficioso en la IC114. Se debe vigilar los niveles de potasio debido al alto riesgo de hiperkalemia grave, especialmente en asociación con IECA o ARA II o con FGe<45mL/min/1,73m2.
Los betabloqueantes no son fármacos antihipertensivos de elección en diabéticos, pero no están contraindicados. Hay que tener precaución por el enmascaramiento del control metabólico y los síntomas de hiperglucemia, así como por el riesgo de empeoramiento de la EAP. El carvedilol, un bloqueante alfa y beta, es el fármaco de elección dentro de este grupo115.
Los alfabloqueantes, sobre todo doxazosina, pueden considerarse en pacientes varones con sintomatología prostática. Sin embargo, no están indicados en IC, y tienen riesgo de hipotensión ortostática, algo frecuente en diabéticos116.
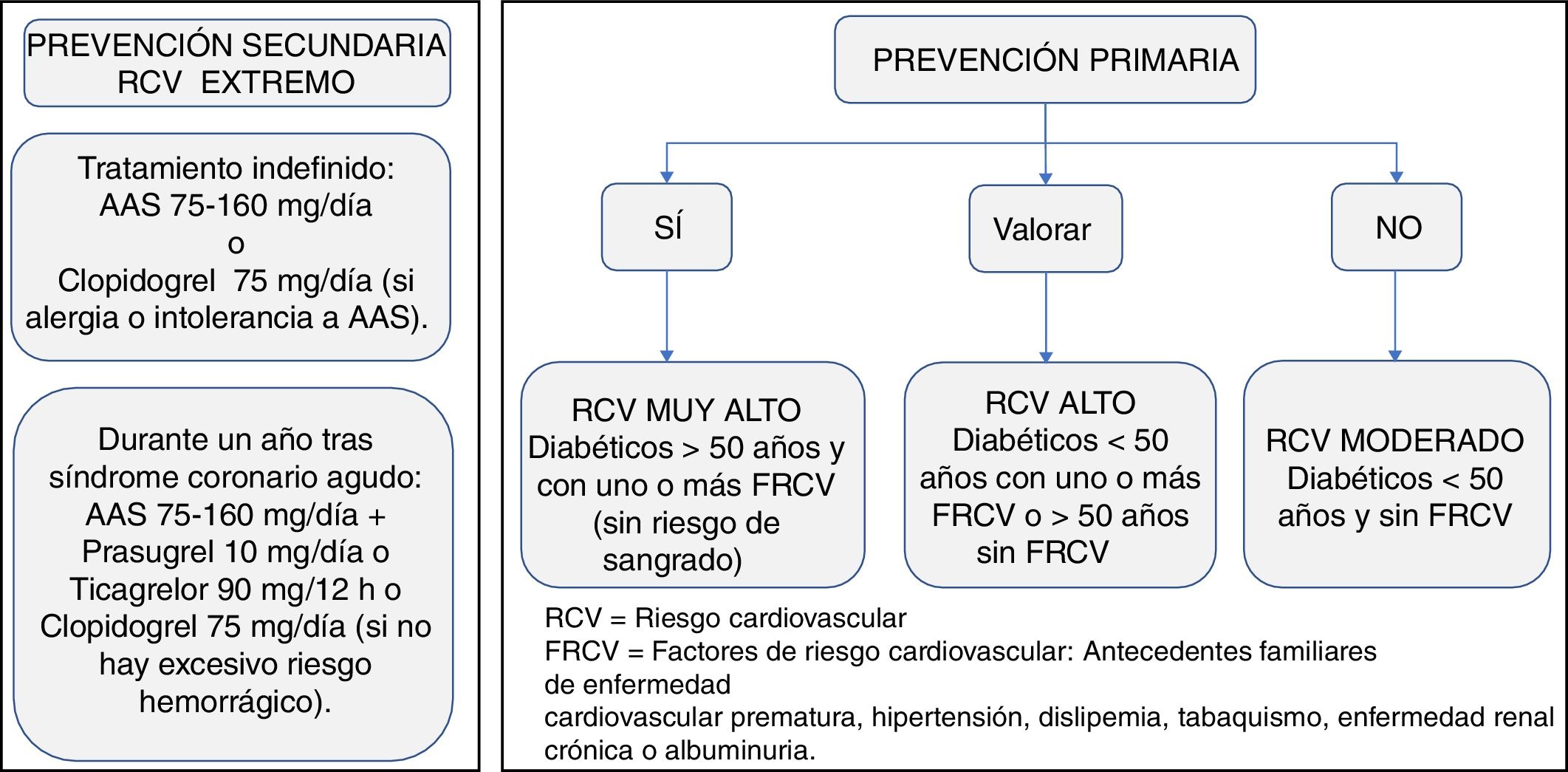
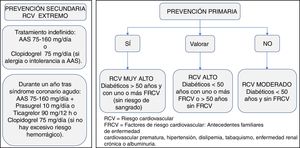
Manejo de la terapia antitrombóticaPrevención primariaExisten pocas evidencias sobre la necesidad de antiagregación con ácido acetilsalicílico (AAS) en pacientes diabéticos sin ECV. La antiagregación con AAS (75-160mg/día) puede considerarse en pacientes con DM2 mayores de 50 años con RCV muy alto, si no tienen aumentado el riesgo de sangrado y si tienen al menos un FRCV adicional: antecedentes familiares de ECV prematura, HTA, dislipidemia, tabaquismo o ERC/albuminuria (evidencia C)19,20.
En pacientes con DM2 menores de 50 años, con RCV muy alto y uno o más FRCV o en mayores de 50 años con RCV muy alto sin FRCV, se puede considerar la terapia con AAS según juicio clínico (evidencia E).
No se recomienda el uso de AAS para la prevención de la ECV aterosclerótica en adultos con DM2 y RCV moderado, menores de 50 años sin otros FRCV. En ellos, es probable que los posibles efectos adversos hemorrágicos puedan superar a los posibles beneficios (evidencia C)19,20.
Prevención secundariaDespués de un SCA, está indicado el tratamiento antiagregante mantenido a largo plazo con dosis bajas de aspirina (AAS) (75-160mg). Se recomienda el uso de AAS a todo paciente con DM2 en prevención secundaria (evidencia A)19,20.
Los pacientes con verdadera intolerancia al AAS pueden recibir monoterapia de clopidogrel (75mg/día) para la prevencion secundaria a largo plazo (evidencia B)19.
Los inhibidores del receptor P2Y12 más potentes (prasugrel o ticagrelor) aumentan los beneficios respecto al clopidogrel, con reducciones absolutas del riesgo en pacientes con DM117.
En los pacientes diabéticos con SCA o con intervención coronaria percutánea, se recomienda el tratamiento antiagregante plaquetario doble (TAPD) con AAS y un inhibidor del receptor P2Y12 —prasugrel 10mg/día o ticagrelor 90mg/12h (o clopidogrel 75mg/día si los anteriores no están disponibles o están contraindicados)— durante un año, excepto cuando haya contraindicaciones, como un riesgo hemorrágico excesivo (evidencia A)19,118. Para los pacientes con riesgo alto de complicaciones hemorrágicas importantes, debe considerarse interrumpir el tratamiento inhibidor del P2Y12 a los 6 meses.
No se recomienda usar el ticagrelor o el prasugrel como parte del tratamiento antitrombótico triple con AAS y anticoagulación oral.
En los pacientes con TAPD y riesgo alto de hemorragia gastrointestinal, se recomienda utilizar un inhibidor de la bomba de protones.
En la figura 7 se puede observar un algoritmo sobre el tratamiento antitrombótico a considerar en el paciente con DM2.
Conclusiones y resumenLa DM2 es una enfermedad metabólica caracterizada por la presencia de hiperglucemia, en la que la ECV es la principal causa de morbimortalidad. Un abordaje multifactorial con un control intensivo de los FRCV ha demostrado reducir las complicaciones vasculares y prolongar la expectativa de vida de los diabéticos15.
La adecuación del tratamiento farmacológico a las características de cada diabético, con el empleo de fármacos que hayan demostrado reducir la morbimortalidad CV, proporciona beneficios en la reducción de las complicaciones micro y macrovasculares.
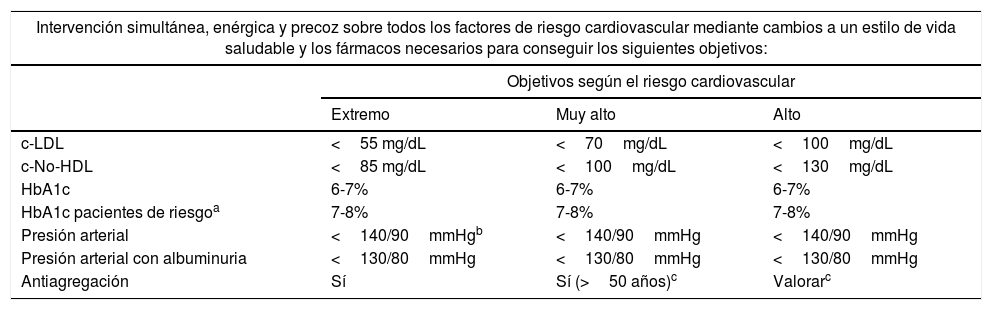
En la tabla 8 se muestra un resumen de los objetivos para la prevención y el tratamiento de la ECV en la DM2. Una intervención precoz adaptada al RCV que presenta el paciente diabético y que contemple, junto con la necesaria implementación de las modificaciones del estilo de vida, el óptimo control glucémico, lipídico, de presión arterial, y la antiagregación en los casos necesarios, es fundamental para reducir el RCV y controlar la ECV en el paciente con DM2.
Resumen de los objetivos para la prevención y el tratamiento de la enfermedad cardiovascular en pacientes con DM2
| Intervención simultánea, enérgica y precoz sobre todos los factores de riesgo cardiovascular mediante cambios a un estilo de vida saludable y los fármacos necesarios para conseguir los siguientes objetivos: | |||
|---|---|---|---|
| Objetivos según el riesgo cardiovascular | |||
| Extremo | Muy alto | Alto | |
| c-LDL | <55 mg/dL | <70mg/dL | <100mg/dL |
| c-No-HDL | <85 mg/dL | <100mg/dL | <130mg/dL |
| HbA1c | 6-7% | 6-7% | 6-7% |
| HbA1c pacientes de riesgoa | 7-8% | 7-8% | 7-8% |
| Presión arterial | <140/90mmHgb | <140/90mmHg | <140/90mmHg |
| Presión arterial con albuminuria | <130/80mmHg | <130/80mmHg | <130/80mmHg |
| Antiagregación | Sí | Sí (>50 años)c | Valorarc |
c-LDL: colesterol unido a lipoproteínas de baja densidad; c-No-HDL: colesterol no unido a lipoproteínas de alta densidad; DM2: diabetes mellitus tipo 2; HbA1c: glucohemoglobina.
Este suplemento cuenta con el patrocinio de Esteve Pharmaceuticals, S.A.
Conflicto de interesesEl Dr. Juan F. Ascaso declara haber recibido honorarios por colaboraciones con Amgen, Ferrer, MSD, Mylan SA y Sanofi no relacionadas con el presente trabajo.
El Dr. Antonio Ruiz-García declara haber recibido honorarios por colaboraciones con AstraZeneca, Casen Recordati, Esteve, Ferrer inCode, MSD, Novartis, Rubió y Sanofi no relacionadas con el presente trabajo.
El Dr. Xavier Pintó declara haber recibido honorarios de Amgen, Esteve, Ferrer, Lacer, Merck, Myland, Rubió y Sanofi por la realización de conferencias.
Los Dres. Ezequiel Arranz-Martínez, Ignacio Morón-Merchante, Vicente Pascual-Fuster, Juan J Tamarit y Ferran Trias-Villagut declaran no tener conflicto de intereses.