La infección invasiva por Candida es una complicación cada vez más frecuente en el paciente adulto hospitalizado. La disponibilidad de nuevos antifúngicos con menor toxicidad y gran eficacia ha añadido gran complejidad al tratamiento de la infección fúngica. De forma paralela, los costes derivados de dicho tratamiento se han incrementado de forma considerable. Encontrar el equilibrio entre el mayor beneficio para el paciente con el menor coste es en la actualidad uno de los objetivos de las recomendaciones en el tratamiento de la candidiasis invasiva. En esta revisión se analizan dichas recomendaciones para el tratamiento de la candidemia y otras como la esofagitis, peritonitis, candidiasis ocular, osteoarticular, cardiovascular, del sistema nervioso central, infección urinaria y candidiasis crónica diseminada.
Invasive candidiasis is progressively increasing in frequency as a complication of the hospitalised adult patient. The availability of new antifungal drugs with lower toxicity and high efficacy has increased the complexity of managing of these infections. In parallel, the costs of the treatment of invasive fungal infections have considerably increased. Finding of a balance between the best benefit for the patient with the less costs is, nowadays, one of the main objectives of the current recommendations for the management of invasive candidiasis. In this review, the recommendations for the management of candidemia and other forms of invasive candidiasis (esophagitis, peritonitis, ocular, cardiovascular and osteoarticular candidiasis, central nervous system and urinary tract candidiasis, and chronic disseminated candidiasis) are analysed.
El tratamiento de la candidiasis invasiva ha experimentado un incremento en su complejidad debido a la aparición de nuevos fármacos antifúngicos (azoles y candinas) con menos efectos adversos y una gran eficacia antifúngica. De forma paralela, los costes atribuibles a la infección fúngica se han incrementado de forma significativa1. En este escenario, las recomendaciones sobre el tratamiento de la infección fúngica en general y de la candidiasis invasiva en particular cobran un papel fundamental para mantener el equilibrio entre beneficio para el paciente y coste del tratamiento.
Existen muchas recomendaciones para guiar al clínico en el tratamiento de la candidiasis invasiva. En el desarrollo de esta revisión se analizarán las guías clínicas de la Infectious Disease Society of America (IDSA)2, las recomendaciones del panel de expertos de la European Society of Clinical Microbiology and Infectious Diseases (ESCMID)3 y el documento de consenso de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)4. Aunque no es el objetivo de esta revisión hacer recomendaciones diferentes a las consensuadas por los expertos que han elaborado las guías antes mencionadas, sí se añaden comentarios a algunos puntos que no han sido tratados en las guías de referencia y que pueden resultar de utilidad para el lector.
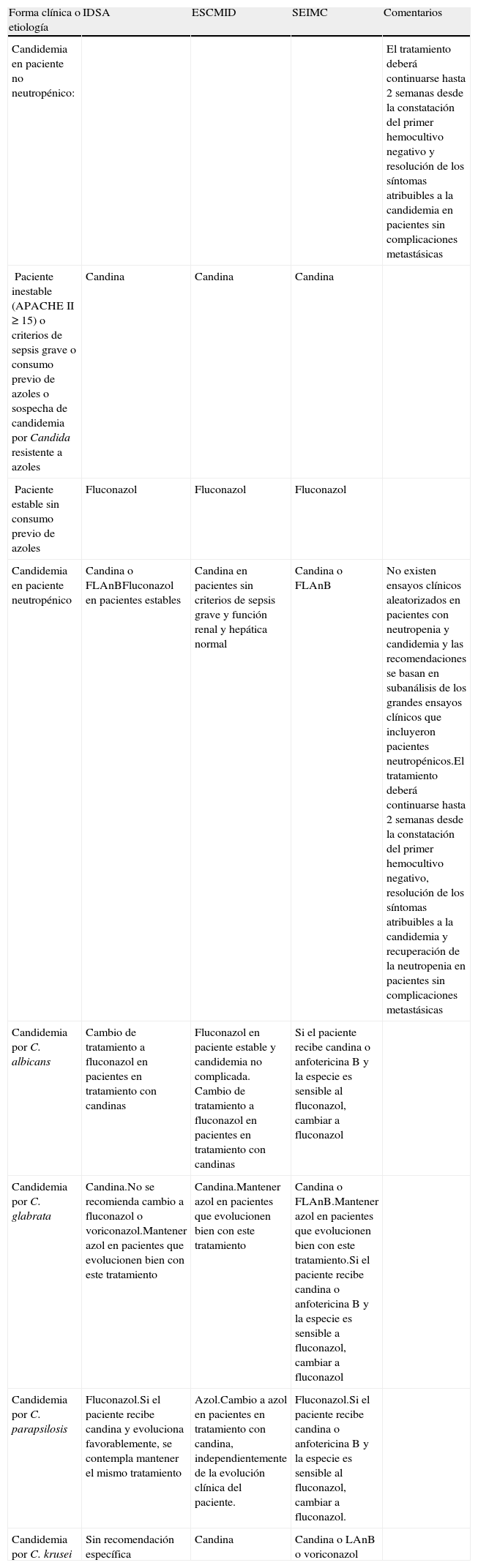
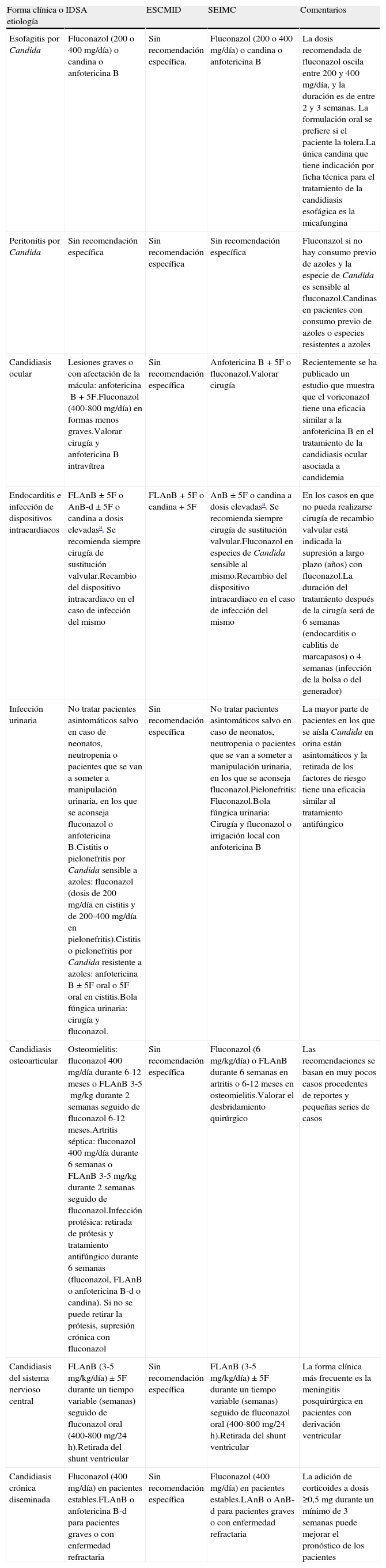
La tabla 1 muestra las recomendaciones para el tratamiento de la candidemia, y la tabla 2, las recomendaciones para otras formas de candidiasis invasiva.
Resumen de las recomendaciones en el tratamiento de la candidemia de las guías IDSA, ESCMID y SEIMC. Solo se incluyen las recomendaciones de primera línea (se excluyen comentarios acerca de tratamientos alternativos)
| Forma clínica o etiología | IDSA | ESCMID | SEIMC | Comentarios |
| Candidemia en paciente no neutropénico: | El tratamiento deberá continuarse hasta 2 semanas desde la constatación del primer hemocultivo negativo y resolución de los síntomas atribuibles a la candidemia en pacientes sin complicaciones metastásicas | |||
| Paciente inestable (APACHEII≥15) o criterios de sepsis grave o consumo previo de azoles o sospecha de candidemia por Candida resistente a azoles | Candina | Candina | Candina | |
| Paciente estable sin consumo previo de azoles | Fluconazol | Fluconazol | Fluconazol | |
| Candidemia en paciente neutropénico | Candina o FLAnBFluconazol en pacientes estables | Candina en pacientes sin criterios de sepsis grave y función renal y hepática normal | Candina o FLAnB | No existen ensayos clínicos aleatorizados en pacientes con neutropenia y candidemia y las recomendaciones se basan en subanálisis de los grandes ensayos clínicos que incluyeron pacientes neutropénicos.El tratamiento deberá continuarse hasta 2 semanas desde la constatación del primer hemocultivo negativo, resolución de los síntomas atribuibles a la candidemia y recuperación de la neutropenia en pacientes sin complicaciones metastásicas |
| Candidemia por C. albicans | Cambio de tratamiento a fluconazol en pacientes en tratamiento con candinas | Fluconazol en paciente estable y candidemia no complicada. Cambio de tratamiento a fluconazol en pacientes en tratamiento con candinas | Si el paciente recibe candina o anfotericina B y la especie es sensible al fluconazol, cambiar a fluconazol | |
| Candidemia por C. glabrata | Candina.No se recomienda cambio a fluconazol o voriconazol.Mantener azol en pacientes que evolucionen bien con este tratamiento | Candina.Mantener azol en pacientes que evolucionen bien con este tratamiento | Candina o FLAnB.Mantener azol en pacientes que evolucionen bien con este tratamiento.Si el paciente recibe candina o anfotericina B y la especie es sensible a fluconazol, cambiar a fluconazol | |
| Candidemia por C. parapsilosis | Fluconazol.Si el paciente recibe candina y evoluciona favorablemente, se contempla mantener el mismo tratamiento | Azol.Cambio a azol en pacientes en tratamiento con candina, independientemente de la evolución clínica del paciente. | Fluconazol.Si el paciente recibe candina o anfotericina B y la especie es sensible al fluconazol, cambiar a fluconazol. | |
| Candidemia por C. krusei | Sin recomendación específica | Candina | Candina o LAnB o voriconazol |
APACHE: acute physiology and chronic health evaluation; FLAnB: formulaciones lipídicas de anfotericina B; LAnB: anfotericina B liposomal.
Dosis recomendadas de los antifúngicos para el tratamiento de la candidemia:
- •
Caspofungina: dosis de carga 70 y 50mg/día
- •
Micafungina: 100mg/día (sin dosis de carga)
- •
Anidulafungina: dosis de carga de 200 y 100mg/día
- •
Formulaciones lipídicas de anfotericina B: 3-5mg/kg/día
- •
Fluconazol: dosis de carga de 800mg (o 12mg/kg) seguida de 400mg/día (o 6mg/kg).
- •
Voriconazol: dosis de carga 400mg (o 6mg/kg) cada 12h (2 dosis) seguido de 200mg/12h (o 3mg/kg/12h).
Resumen de las recomendaciones para el tratamiento de la candidiasis invasiva según su localización de las guías IDSA, ESCMID y SEIMC. Solo se incluyen las recomendaciones de primera línea (se excluyen comentarios acerca de tratamientos alternativos)
| Forma clínica o etiología | IDSA | ESCMID | SEIMC | Comentarios |
| Esofagitis por Candida | Fluconazol (200 o 400mg/día) o candina o anfotericina B | Sin recomendación específica. | Fluconazol (200 o 400mg/día) o candina o anfotericina B | La dosis recomendada de fluconazol oscila entre 200 y 400mg/día, y la duración es de entre 2 y 3 semanas. La formulación oral se prefiere si el paciente la tolera.La única candina que tiene indicación por ficha técnica para el tratamiento de la candidiasis esofágica es la micafungina |
| Peritonitis por Candida | Sin recomendación específica | Sin recomendación específica | Sin recomendación específica | Fluconazol si no hay consumo previo de azoles y la especie de Candida es sensible al fluconazol.Candinas en pacientes con consumo previo de azoles o especies resistentes a azoles |
| Candidiasis ocular | Lesiones graves o con afectación de la mácula: anfotericinaB+5F.Fluconazol (400-800mg/día) en formas menos graves.Valorar cirugía y anfotericinaB intravítrea | Sin recomendación específica | AnfotericinaB+5F o fluconazol.Valorar cirugía | Recientemente se ha publicado un estudio que muestra que el voriconazol tiene una eficacia similar a la anfotericinaB en el tratamiento de la candidiasis ocular asociada a candidemia |
| Endocarditis e infección de dispositivos intracardiacos | FLAnB±5F o AnB-d±5F o candina a dosis elevadasa. Se recomienda siempre cirugía de sustitución valvular.Recambio del dispositivo intracardiaco en el caso de infección del mismo | FLAnB+5F o candina+5F | AnB±5F o candina a dosis elevadasa. Se recomienda siempre cirugía de sustitución valvular.Fluconazol en especies de Candida sensible al mismo.Recambio del dispositivo intracardiaco en el caso de infección del mismo | En los casos en que no pueda realizarse cirugía de recambio valvular está indicada la supresión a largo plazo (años) con fluconazol.La duración del tratamiento después de la cirugía será de 6 semanas (endocarditis o cablitis de marcapasos) o 4 semanas (infección de la bolsa o del generador) |
| Infección urinaria | No tratar pacientes asintomáticos salvo en caso de neonatos, neutropenia o pacientes que se van a someter a manipulación urinaria, en los que se aconseja fluconazol o anfotericinaB.Cistitis o pielonefritis por Candida sensible a azoles: fluconazol (dosis de 200mg/día en cistitis y de 200-400mg/día en pielonefritis).Cistitis o pielonefritis por Candida resistente a azoles: anfotericinaB±5F oral o 5F oral en cistitis.Bola fúngica urinaria: cirugía y fluconazol. | Sin recomendación específica | No tratar pacientes asintomáticos salvo en caso de neonatos, neutropenia o pacientes que se van a someter a manipulación urinaria, en los que se aconseja fluconazol.Pielonefritis: Fluconazol.Bola fúngica urinaria: Cirugía y fluconazol o irrigación local con anfotericinaB | La mayor parte de pacientes en los que se aísla Candida en orina están asintomáticos y la retirada de los factores de riesgo tiene una eficacia similar al tratamiento antifúngico |
| Candidiasis osteoarticular | Osteomielitis: fluconazol 400mg/día durante 6-12 meses o FLAnB 3-5mg/kg durante 2 semanas seguido de fluconazol 6-12 meses.Artritis séptica: fluconazol 400mg/día durante 6 semanas o FLAnB 3-5mg/kg durante 2 semanas seguido de fluconazol.Infección protésica: retirada de prótesis y tratamiento antifúngico durante 6 semanas (fluconazol, FLAnB o anfotericinaB-d o candina). Si no se puede retirar la prótesis, supresión crónica con fluconazol | Sin recomendación específica | Fluconazol (6mg/kg/día) o FLAnB durante 6 semanas en artritis o 6-12 meses en osteomielitis.Valorar el desbridamiento quirúrgico | Las recomendaciones se basan en muy pocos casos procedentes de reportes y pequeñas series de casos |
| Candidiasis del sistema nervioso central | FLAnB (3-5mg/kg/día)±5F durante un tiempo variable (semanas) seguido de fluconazol oral (400-800mg/24h).Retirada del shunt ventricular | Sin recomendación específica | FLAnB (3-5mg/kg/día)±5F durante un tiempo variable (semanas) seguido de fluconazol oral (400-800mg/24h).Retirada del shunt ventricular | La forma clínica más frecuente es la meningitis posquirúrgica en pacientes con derivación ventricular |
| Candidiasis crónica diseminada | Fluconazol (400mg/día) en pacientes estables.FLAnB o anfotericinaB-d para pacientes graves o con enfermedad refractaria | Sin recomendación específica | Fluconazol (400mg/día) en pacientes estables.LAnB o AnB-d para pacientes graves o con enfermedad refractaria | La adición de corticoides a dosis ≥0,5mg durante un mínimo de 3 semanas puede mejorar el pronóstico de los pacientes |
Anfotericina B-d: anfotericina B deoxicolato; FLAnB: formulaciones lipídicas de anfotericina B; 5F: flucitosina.
Dosis recomendadas de los antifúngicos:
- •
Caspofungina: Dosis de carga de 70 y 50mg/día
- •
Micafungina: 100mg/día (sin dosis de carga)
- •
Anidulafungina: dosis de carga de 200 y 100mg/día.
- •
Formulaciones lipídicas de anfotericina B: 3-5mg/kg/día.
- •
Fluconazol: dosis de carga de 800mg (o 12mg/kg) seguida de 400mg/día (o 6mg/kg).
- •
Voriconazol: dosis de carga de 400mg (o 6mg/kg) cada 12h (2 dosis) seguida de 200mg/12h (o 3mg/kg/12h).
- •
Anfotericina B deoxicolato: 0,3-0,7mg/kg/día, dependiendo del sitio de infección
- •
Flucitosina: 100mg/kg/día dividido en 4 tomas.
Definimos candidemia como el aislamiento en hemocultivo de especies de Candida. Aunque hay pacientes en los que la candidemia puede resolverse de forma espontánea, no existe ninguna variable que prediga esta evolución y, por consiguiente, la recomendación es que todo paciente con aislamiento de Candida en sangre, independientemente de si la muestra ha sido obtenida a través del catéter o por punción venosa, debe recibir tratamiento antifúngico eficaz3.
La incidencia de candidemia en pacientes hospitalizados ha experimentado un incremento progresivo en los últimos años5. Este hecho es debido a un incremento de pacientes en riesgo de sufrir esta complicación (pacientes ingresados en unidades de cuidados intensivos, posquirúrgicos, neutropénicos, neonatos prematuros e inmunodeprimidos en general)6. Desde el punto de vista clínico la candidemia se manifestará como sepsis, sepsis grave o shock séptico de origen nosocomial. En España, la incidencia de candidemia se estima en 4,3 episodios por 100.000 habitantes, y la especie de Candida que causa candidemia con mayor frecuencia es C. albicans7. La mortalidad global de la candidemia en España se estima en el 44%7.
Consideraciones generales en la evaluación y el tratamiento no farmacológico del paciente con candidemiaEn el algoritmo de decisiones en un paciente con candidemia debemos tener en cuenta no solo el fármaco antifúngico a emplear sino también otras medidas que pueden influir de forma muy importante en el pronóstico del paciente.
Uno de los principales factores asociados a una mejoría del pronóstico de la candidemia es la precocidad de inicio del tratamiento antifúngico. Si el tratamiento antifúngico se inicia en el momento de la positividad de los hemocultivos o durante las primeras 12h, la mortalidad de los pacientes se sitúa entre el 10 y el 15%; por el contrario, si el inicio del tratamiento se retrasa 48h tras la positividad del hemocultivo, la mortalidad asciende hasta el 30-35%8,9.
Otro factor clásicamente asociado a una mejoría del pronóstico de la candidemia es la retirada precoz del catéter venoso central. Las guías clínicas aconsejan retirar el catéter venoso central en un paciente con candidemia siempre que sea posible2–4. Aunque el acceso venoso central no siempre es el origen de la infección, su mantenimiento podría representar un reservorio que prolongaría la candidemia y podría incrementar el riesgo de desarrollar focos metastáticos de la infección3. El beneficio de la retirada del catéter está demostrado para el paciente no neutropénico, y su retirada se asocia con menor duración y menor mortalidad de la candidemia7,10–12. Sin embargo, Nucci et al.13 ponen en duda este factor protector mediante un análisis de 2 ensayos clínicos con micafungina frente a comparador que incluyeron 842 pacientes con candidemia: los datos del análisis multivariante no muestran una mejoría en el pronóstico cuando se realiza una retirada precoz del catéter. A pesar de los resultados de Nucci, otro estudio de la misma cohorte de pacientes sí encontró una asociación a mayor éxito terapéutico y menor mortalidad cuando se procedía a una retirada precoz del catéter14. La explicación a este resultado contradictorio probablemente es de orden metodológico15–17. Sin embargo, la recomendación más razonable en relación a este punto es individualizar la retirada del catéter venoso central y retirar precozmente todo catéter prescindible, especialmente en pacientes más graves, y sopesar el beneficio en los pacientes más dependientes del acceso venoso.
Otra cuestión relevante en el paciente con candidemia es la realización de una exploración ocular. Tanto las guías de la IDSA como las guías europeas recomiendan la realización de una exploración del fondo de ojo, dado que la incidencia de endoftalmitis o coriorretinitis por Candida se ha descrito en el 5 al 78% de pacientes con candidemia18,19. Un estudio reciente demostró afectación ocular por Candida en el 16% de los pacientes con candidemia, aunque la endoftalmitis fue rara (1,6% de los pacientes) y predominaron los casos de coriorretinitis20. La realización de una oftalmoscopia muy precoz puede dar lugar a falsos negativos en la exploración, dado que las lesiones pueden hacerse visibles durante el tratamiento de la candidemia3. La presencia de coriorretinitis o endoftalmitis por Candida implica ciertas consideraciones terapéuticas que se comentarán más adelante.
La recomendación acerca de la duración del tratamiento de la candidemia es concordante en las guías analizadas, y debe ser de 2 semanas desde la constatación del primer hemocultivo negativo y la resolución de los síntomas atribuibles en pacientes sin complicaciones metastásicas. En los pacientes neutropénicos se suspenderá el tratamiento cuando se cumplan los criterios anteriores y además se haya resuelto la neutropenia.
Tratamiento farmacológico de la candidemiaLa tabla 1 muestra el resumen de las recomendaciones en el tratamiento de la candidemia en las guías evaluadas. Para escoger el tratamiento antifúngico óptimo del paciente con candidemia, la primera diferenciación que se debe realizar es si el paciente está neutropénico o no. Ello es debido a que la mayor parte de la información acerca del pronóstico de la candidemia se ha obtenido del paciente no neutropénico y no se puede extrapolar, en la mayoría de ocasiones, el efecto terapéutico en pacientes neutropénicos.
Tratamiento de la candidemia en el paciente no neutropénicoEl fármaco para el que se dispone de mayor información sobre su eficacia en el tratamiento de la candidemia en el paciente no neutropénico es el fluconazol21–24. Existe consenso en las guías consultadas en que la dosis adecuada de fluconazol es la carga inicial con 800mg y posteriormente 400mg/día.
Las candinas han supuesto un importante avance en el tratamiento de la candidemia dada su potente acción fungicida, su buena tolerancia y seguridad, y su escasa interacción con otros fármacos. Las 3 candinas disponibles (caspofungina, micafungina y anidulafungina) se han evaluado en ensayos clínicos para el tratamiento de la candidemia23,25–27 sin que ninguna de las recomendaciones analizadas posicione una candina sobre otra en cuanto a su eficacia clínica. La anidulafungina mostró superioridad frente al fluconazol en el tratamiento de la candidemia, aunque el diseño del estudio (no inferioridad) no permite concluir que dicha asociación sea definitiva23. Por otro lado, el mayor beneficio de la anidulafungina se observó para los pacientes en una situación clínica más grave (puntuación APACHEII≥15)28.
Cuando la candidemia es causada por C. parapsilosis, el fluconazol es superior a las candinas23. Las CMI de C. parapsilosis muestran mayor frecuencia de cepas no sensibles a candinas que al fluconazol debido a mutaciones en el gen fks de Candida29.
Probablemente la única diferencia entre las 3 candinas se limite a sus características farmacocinéticas. La micafungina puede presentar valores disminuidos en el área bajo la curva y Cmax en pacientes con insuficiencia hepática moderada y grave (Child B-C) en comparación con sujetos sanos y, por lo tanto, mientras no dispongamos de información clínica para el tratamiento de la candidiasis invasiva en estos sujetos escogeríamos otra candina30,31. La caspofungina presenta una interacción con ciclosporina A que incrementa los niveles de caspofungina. Se ha descrito una mayor incidencia de hepatotoxicidad en pacientes cotratados con ciclosporina A y caspofungina32,33, aunque otros estudios han mostrado la ausencia de efectos adversos cuando se usa esta combinación34–37.
Para el tratamiento de la candidemia en el paciente no neutropénico se recomienda el uso de fluconazol en pacientes estables y sin consumo previo de azoles. En pacientes más graves (puntuación APACHEII≥15) o cuando exista consumo previo de azoles, el tratamiento recomendado es el uso de una candina. La candidemia causada por C. parapsilosis debe ser tratada con fluconazol, aunque si se ha iniciado una candina y el paciente evoluciona de forma favorable puede ser razonable mantener dicho tratamiento. La candidemia por C. glabrata debe ser tratada con una candina hasta que se desconozca la sensibilidad al fluconazol de la cepa aislada. Para la candidemia por C. krusei se aconseja el uso de candinas, anfotericinaB o voriconazol.
Tratamiento de la candidemia en el paciente neutropénicoClásicamente, la candidemia en el paciente neutropénico se ha tratado con anfotericinaB dado su amplio espectro y su eficacia fungicida. Aunque probablemente el tratamiento de la candidemia por Candida sensible con azoles sea eficaz en este subgrupo de pacientes, la mayor parte de clínicos se sienten menos cómodos usando un fungistático (como los azoles) que un fungicida (como la anfotericinaB) en pacientes neutropénicos.
Las recomendaciones sobre el tratamiento de la candidemia en el paciente neutropénico se basan en subanálisis de los grandes ensayos clínicos, ya que no existe ningún ensayo clínico aleatorizado que evalúe el tratamiento de la candidemia en el paciente neutropénico. En dichos estudios, la tasa de respuesta favorable con el uso de candinas osciló entre el 50 y el 69% de los pacientes neutropénicos25–27.
Basándonos en los datos antes mencionados, las recomendaciones para el tratamiento de la candidemia en el paciente neutropénico son una candina (concordancia entre las 3 guías) o una formulación lipídica de anfotericinaB (guías IDSA y SEIMC).
Como ya se ha mencionado previamente, es recomendable mantener el tratamiento antifúngico hasta que la neutropenia se resuelva, ya que la neutropenia persistente se asocia a un mayor riesgo de fracaso del tratamiento38.
El uso de voriconazol para el tratamiento de la candidemia en el paciente neutropénico se recomienda en los pacientes en los que se desea una cobertura adicional para hongo filamentoso39.
Tratamiento de la candidemia en pacientes y situaciones especialesCandidemia en el paciente con trasplante4Las recomendaciones de tratamiento de la candidiasis invasiva en el paciente con trasplante no difieren de las recomendaciones generales. Hay que tener en cuenta algunos hechos diferenciales en el paciente con trasplante de órgano que pueden modificar la elección del tratamiento antifúngico. En pacientes con trasplante de órgano, la administración de azoles (especialmente de voriconazol) puede generar interacciones con los fármacos inhibidores de la calcineurina e inducir mayor riesgo de hepatotoxicidad en pacientes con trasplante hepático. La anfotericina produce mayor nefrotoxicidad en los pacientes que reciben inhibidores de la calcineurina de forma concomitante. Las candinas tienen un perfil óptimo de efectos adversos e interacciones medicamentosas en estos pacientes por lo que parece razonable utilizarlas en primera línea de tratamiento, especialmente en pacientes más graves.
Candidemia en la mujer gestanteLa mayoría de azoles deben ser evitados durante el embarazo debido a que se asocian a teratogenia (categoríaC). El voriconazol y la flucitosina están formalmente contraindicados (categoríaD). Para las candinas existe mucha menos información, pero se catalogan dentro de la categoríaC. Todo ello hace que el tratamiento de elección de la candidiasis invasiva durante la gestación sea la anfotericinaB2,40.
Esofagitis por CandidaLa esofagitis por Candida es una complicación muy frecuente en pacientes con sida, aunque puede verse también en otros pacientes inmunodeprimidos (trasplante, enfermedades autoinmunes, etc.), pacientes con patología de la motilidad esofágica y, ocasionalmente, tras el consumo de antibióticos de amplio espectro en pacientes con alguna enfermedad debilitante. Generalmente se suele acompañar de afectación oral, y las manifestaciones clínicas incluyen odinofagia, disfagia y dolor retroesternal. Los hallazgos de la endoscopia digestiva son diagnósticos y no suele ser necesario realizar cultivo.
Tanto las guías de la IDSA como las de la SEIMC coinciden en que la primera línea de tratamiento de la candidiasis esofágica es el fluconazol a dosis de 200 a 400mg/día2,4. Como alternativas terapéuticas se propone el uso de anfotericinaB o una candina para pacientes con alergia o intolerancia a azoles, o en casos de esofagitis por Candida resistente al fluconazol. En la actualidad, la única candina que tiene la indicación aprobada para el tratamiento de la candidiasis esofágica es la micafungina a dosis de 150mg/día, en base a un ensayo clínico aleatorizado, controlado con placebo, de no inferioridad que comparó la micafungina a dosis de 50mg, 100mg y 150mg con fluconazol a dosis de 200mg/día41.
La duración del tratamiento de la candidiasis esofágica oscila entre 2 y 3 semanas, en función de la sintomatología del paciente.
Candidiasis peritonealCandida es un patógeno frecuente causante de peritonitis terciaria posquirúrgica, y el aislamiento de Candida en el líquido peritoneal se asocia claramente con un peor pronóstico de la peritonitis nosocomial42,43. El papel de Candida en la peritonitis de adquisición comunitaria es, como mínimo, controvertido. La incidencia de aislamiento de Candida en la peritonitis nosocomial en pacientes críticos ingresados en unidades de cuidados intensivos oscila entre el 4 y el 32%, y en la mayoría de ocasiones se trata de una peritonitis polimicrobiana (coinfección bacteriana)44,45. Las especies de Candida aisladas con mayor frecuencia en la peritonitis nosocomial son C. albicans y C. glabrata46,47. Los factores de riesgo descritos asociados al aislamiento de Candida en la peritonitis nosocomial son el sexo femenino, la peritonitis secundaria a perforación del tracto digestivo alto, la insuficiencia cardiaca asociada y el tratamiento antibiótico en las 48h previas al desarrollo de la peritonitis45. Se ha descrito una alta incidencia de peritonitis por Candida en pacientes sometidos a trasplante de páncreas48. La mortalidad de los pacientes con peritonitis nosocomial con aislamiento de Candida en un amplio estudio multicéntrico llegó a ser de hasta el 41%46.
Ninguna de las guías analizadas aporta recomendaciones para el tratamiento de la peritonitis por Candida, y la información disponible en la literatura es muy escasa. Cuando la peritonitis está producida por Candida sensible al fluconazol, los azoles son el fármaco de elección44. Por otro lado, en pacientes que han recibido azoles previamente o con especies de Candida resistentes a fluconazol, el uso de candinas es eficaz y seguro44.
Candidiasis ocularLas recomendaciones para el tratamiento de la candidiasis ocular se recogen en las guías de la IDSA y la SEIMC2,4. Ambas recomiendan usar anfotericinaB deoxicolato con 5-flucitosina (especialmente en formas graves con afectación de la mácula2) o fluconazol. Asimismo, debe realizarse una valoración por parte de un oftalmólogo para evaluar el requerimiento de una vitrectomía parcial y la administración intravítrea de anfotericinaB en pacientes con afectación grave.
Desde un punto de vista clínico, la mayoría de pacientes con afectación ocular por Candida no presentan disminución de la agudeza visual ni alteraciones en el campo visual, y la mayoría de pacientes evolucionan de forma favorable con el tratamiento20. Basándonos en este hecho, podemos decir que la afectación ocular en pacientes con candidemia está probablemente infraestimada, dado que en muchos pacientes asintomáticos no se realiza exploración ocular, y cuando se realiza muy precozmente, el resultado puede ser falsamente negativo.
En un ensayo clínico en el que se aleatorizaron 370 pacientes no neutropénicos con candidemia a recibir voriconazol o anfotericinaB seguida de fluconazol con un ratio 2:120, 60 pacientes tuvieron afectación ocular, de los que 44 correspondieron a la rama del voriconazol y 16 a la rama de la anfotericinaB deoxicolato por vía intravenosa seguida de fluconazol20. La mayoría de pacientes fueron diagnosticados de candidiasis ocular coincidiendo con el diagnóstico de la candidemia (44 pacientes, 73%). La curación de la afectación ocular se consiguió en el 93,5% de los pacientes evaluables tratados con voriconazol y en el 100% de los pacientes tratados con anfotericinaB, por lo que se puede decir que el voriconazol tiene una eficacia similar a la anfotericinaB en el tratamiento de la candidiasis ocular asociada a candidemia.
En ninguna de las recomendaciones analizadas se discute cómo debe realizarse el tratamiento del paciente con candidemia y afectación ocular concomitante. Esto es relevante, ya que muchos pacientes con candidemia pueden recibir tratamiento inicial con una candina, y es un hecho bien conocido que dichos fármacos tienen una penetración limitada al globo ocular49. Por otro lado, la información respecto al tratamiento de la endoftalmitis por Candida con el uso de candinas aporta resultados controvertidos50,51. Además, los ensayos clínicos más importantes que comparan las candinas con otros antifúngicos ofrecen muy poca información acerca de la afectación ocular concomitante23,25–27,52, aunque esto podría indicar que la coriorretinitis por Candida, que es la forma más frecuente de candidiasis ocular, podría curarse con el uso de candinas. Para el tratamiento de la endoftalmitis grave por Candida, las candinas poseen un perfil inadecuado. Basándonos en esta información, se podrían plantear las siguientes posibilidades cuando un paciente presenta candidemia y candidiasis ocular precoz (diagnosticada al inicio de la candidemia): a) si el paciente recibe tratamiento con fluconazol, voriconazol o anfotericinaB y presenta una coriorretinitis concomitante, sería razonable mantener el tratamiento; por el contrario, si la afectación ocular es grave, sería aconsejable cambiar el fluconazol por anfotericinaB+5-flucitosina; b) si el paciente inicia tratamiento con una candina y presenta una coriorretinitis leve y asintomática por Candida (se excluirían por tanto pacientes sedados e intubados), sería razonable una monitorización de la afectación ocular y cambiar el tratamiento en el caso de que exista mala evolución; por otro lado, si la afectación ocular es grave o el paciente está sedado, podríamos optar por añadir voriconazol o sustituir la candina por anfotericinaB y 5-flucitosina. Por último, en los pacientes que desarrollan una afectación ocular grave durante el curso del tratamiento parece razonable sustituir dicho tratamiento por una pauta que incluya anfotericinaB+5-flucitosina o asociar voriconazol cuando esté recibiendo una candina.
La duración del tratamiento de la candidiasis ocular dependerá de la gravedad del cuadro clínico, pero en la mayoría de ocasiones se recomienda prolongar dicho tratamiento durante 4 a 6 semanas. Para el tratamiento de consolidación los fármacos de elección son el fluconazol y el voriconazol por su administración oral, y la elección de uno u otro dependerá de la especie de Candida aislada y/o de la posibilidad o confirmación de resistencia a fluconazol.
Endocarditis e infección de dispositivos intracardiacos por CandidaTanto la endocarditis de válvula nativa como la de válvula protésica por Candida requieren cirugía de sustitución o recambio valvular para conseguir la curación de la infección, ya que el uso de cirugía y tratamiento antifúngico se asocia a mayor supervivencia del paciente53. Únicamente cuando exista una contraindicación absoluta a la cirugía se debe realizar tratamiento médico, que en la mayoría de ocasiones requerirá tratamiento antifúngico supresivo prolongado (años) o de por vida, ya que la endocarditis por Candida puede recidivar hasta varios años después del tratamiento inicial54. Con respecto a los dispositivos intracardiacos, también se aconseja la cirugía de extracción del dispositivo combinada con tratamiento antifúngico, aunque la información publicada es aún más escasa que en el caso de la endocarditis.
Las recomendaciones para el tratamiento de la endocarditis por Candida se basan principalmente en casos clínicos o series de casos publicadas. Ambas guías recomiendan el uso de anfotericinaB (formulación lipídica) con o sin 5-flucitosina para el tratamiento de la endocarditis por Candida2,4. En el apartado que analiza el uso de tratamiento antifúngico combinado en el documento de la ESCMID se recomienda también el uso de caspofungina con flucitosina para el tratamiento de la endocarditis por Candida. Se han descrito éxitos terapéuticos con el uso de caspofungina a dosis que oscilan entre 50 y 150mg/día, por lo que el uso de una candina a dosis elevadas puede representar una alternativa a la anfotericinaB. La información publicada con anidulafungina o micafungina es muy escasa.
Tras el tratamiento inicial, se aconseja cambiar el tratamiento a vía oral con fluconazol a dosis de 400-800mg si la endocarditis está causada por una cepa de Candida sensible. El cambio terapéutico debe realizarse tras haber documentado negatividad en los hemocultivos y estabilidad clínica del paciente. Cuando la especie de Candida no sea sensible al fluconazol y sí al voriconazol, puede optarse por este último para el tratamiento de consolidación. Los pacientes que tengan contraindicación para la cirugía deberán recibir tratamiento antifúngico supresivo prolongado, y el fluconazol a dosis de 400-800mg es el fármaco recomendado. La duración del tratamiento será de 6 semanas en el caso de endocarditis o cablitis del marcapasos, y de 4 semanas en el caso de infección de la bolsa o del generador, siempre después de la cirugía.
Infección urinaria por CandidaLa mayor parte de los pacientes hospitalizados que presentan funguria por Candida en relación a sondaje vesical están asintomáticos55 y eliminar los factores de riesgo (el más importante es la retirada de la sonda vesical) tiene una eficacia similar a la administración de tratamiento antifúngico en la erradicación de la candiduria56. Sin embargo, en neonatos y en pacientes inmunodeprimidos (especialmente neutropénicos), la existencia de candiduria puede ser el reflejo de una infección diseminada por Candida. Por otro lado, los pacientes con candiduria que deban ser sometidos a una manipulación urológica presentan mayor riesgo de candidemia secundaria. Por tanto, en los 3 supuestos previos (neonatos, inmunodeprimidos y pacientes que requieran manipulación urológica) está indicada la administración de tratamiento antifúngico en pacientes asintomáticos, y no lo está en todos los demás casos.
Para el tratamiento de la infección urinaria fúngica las candinas tienen un perfil inadecuado por la escasa eliminación renal de la forma activa del fármaco. Para pacientes sintomáticos con clínica de cistitis o pielonefritis, está indicado el tratamiento con fluconazol durante 2 semanas en el caso de que no haya consumo previo de azoles o la especie de Candida aislada sea sensible al fluconazol. Cuando la especie de Candida aislada sea resistente al fluconazol, se aconseja el uso de anfotericinaB con o sin flucitosina, o flucitosina en monoterapia en el caso de cistitis. Para el tratamiento de las bolas fúngicas urinarias la cirugía es fundamental para conseguir la curación de la infección. La mayor experiencia para el tratamiento de las bolas fúngicas se dispone para anfotericinaB y fluconazol, que representan el tratamiento de elección en la mayoría de ocasiones. La irrigación local con anfotericinaB puede ser de utilidad en algunos pacientes.
Candidiasis osteoarticularLa información referente al tratamiento de la osteomielitis por Candida se basa en informes de casos y en pequeñas series de casos. La mayoría del tratamiento antifúngico evaluado ha sido la anfotericinaB deoxicolato y fluconazol. Como en las osteomielitis bacterianas, la producida por Candida requerirá valorar la cirugía de desbridamiento, y la duración del tratamiento deberá prolongarse entre 6 y 12 meses para minimizar el riesgo de recaídas. Una forma peculiar de osteomielitis por Candida es la esternal, que se da en pacientes sometidos a estereotomía. La osteomielitis esternal por Candida puede asociarse a mediastinitis y experimenta un curso indolente con recidivas frecuentes57. En una serie de 11 casos, 3 pacientes requirieron esternectomía57.
Para la artritis por Candida hay, si cabe, menos información publicada. La mayoría de casos requerirán 6 semanas de tratamiento antifúngico. Las artritis de grandes articulaciones, como la artritis de cadera, requieren drenaje quirúrgico de forma habitual.
La conducta frente a la artritis protésica por Candida debe ser siempre la retirada de la prótesis, aunque se han descrito casos de curación con tratamiento antifúngico. Cuando no es posible retirar la prótesis, el paciente requerirá tratamiento antifúngico supresivo prolongado o de por vida.
Candidiasis del sistema nervioso centralLa candidiasis del sistema nervioso central puede ser una consecuencia de procedimientos neuroquirúrgicos, una expresión de una candidiasis diseminada o una infección crónica aislada.
La meningitis por Candida es una causa poco frecuente de meningitis nosocomial y representa el 5% de las meningitis adquiridas tras un procedimiento neuroquirúrgico, y la mayoría de ellas son precedidas por una meningitis bacteriana y el uso de antibióticos de amplio espectro58,59. Las otras formas de candidiasis del sistema nervioso central son muy poco frecuentes.
El tratamiento de la candidiasis del sistema nervioso central requiere el uso de fármacos que atraviesen bien la barrera hematoencefálica. En este sentido, las candinas poseen un perfil inadecuado para el uso en esta indicación, aunque se hayan publicado casos de éxito terapéutico. El tratamiento de elección es la combinación de anfotericinaB y flucitosina, dada la sinergia y las concentraciones óptimas en el sistema nervioso central. El fluconazol también consigue niveles excelentes en el líquido cefalorraquídeo y es un fármaco muy útil para consolidar la infección después del uso de anfotericinaB. No hay datos para aconsejar el voriconazol (que también consigue muy buenos niveles en el líquido cefalorraquídeo), y solo debe usarse para el tratamiento de candidiasis causadas por especies resistentes al fluconazol.
El tratamiento quirúrgico de retirada del material extraño (derivación ventricular) es fundamental para la curación del paciente, y se han descrito casos en los que la infección se ha curado tras la cirugía sin administrar tratamiento antifúngico59. Sin embargo, la recomendación más razonable es hacer tratamiento combinado (cirugía y antifúngico sistémico) en pacientes con derivación ventricular y meningitis por Candida.
Candidiasis crónica diseminadaLa candidiasis crónica diseminada (o candidiasis hepatoesplénica) es una patología casi exclusiva del paciente oncohematológico y que aparece cuando existe una recuperación de la neutropenia, momento en el que las lesiones típicas de la enfermedad (lesiones en ojo de buey) se hacen visibles mediante tomografía computarizada. En este sentido, la candidiasis crónica diseminada puede considerarse un síndrome de reconstitución inmune.
Las recomendaciones de tratamiento de este característico cuadro clínico se basan en informes de casos o pequeñas series de casos. Los pacientes estables pueden ser tratados con fluconazol a dosis de 400mg/día por vía oral. Los pacientes en peor situación, con enfermedad más extensa o con enfermedad refractaria al fluconazol, deben tratarse con anfotericinaB (deoxicolato o formulaciones lipídicas). Se han descrito tratamientos con éxito con caspofungina, micafungina y voriconazol. Para evitar la recaída, el tratamiento debe prolongarse hasta que las lesiones calcifiquen, lo cual puede suceder semanas o meses después del inicio del tratamiento. Un estudio retrospectivo mostró que el uso concomitante de corticoesteroides a dosis de 0,5mg/kg/día se acompañó de un mejor pronóstico de la candidiasis crónica diseminada60, por lo que la opción de añadir este tratamiento debe tenerse siempre en cuenta.
Conflicto de interesesEl Dr. Cervera ha recibido honorarios por ponencias por parte de Merck Sharp and Dohme, Gilead, Pfizer, Novartis y Roche, ha recibido honorarios de asesoría de Pfizer, Novartis, Astellas y Merck Sharp and Dohme, y ha recibido fondos para investigación por parte de Pfizer y Astellas.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion