Klebsiella oxytoca puede causar infecciones nosocomiales y afectar a recién nacidos vulnerables. Existen escasos trabajos que describan brotes nosocomiales en las unidades de cuidados intensivos neonatales (UCIN). En este estudio se realiza una revisión sistemática de la literatura para conocer las características principales de estos brotes y se describe la evolución de uno.
MétodosSe realizó una revisión sistemática en la base de datos Medline hasta julio de 2022, y un estudio descriptivo de un brote con 21 episodios en la UCIN de un hospital de tercer nivel, desde septiembre de 2021 a enero de 2022.
ResultadosNueve artículos cumplían los criterios de inclusión. Se encontró que la duración de los brotes fue variable, y que 4 (44,4%) se prolongaron durante un año o más. Las colonizaciones (69%) fueron más frecuentes que las infecciones (31%) y la tasa de mortalidad fue del 22,4%. En los estudios que describen las fuentes lo más frecuente fue el origen ambiental (57,1%). En nuestro brote hubo 15 colonizaciones y 6 infecciones. Las infecciones fueron conjuntivitis leves sin secuelas. El análisis mediante tipado molecular permitió detectar 4 clústeres diferentes.
ConclusionesExiste una variabilidad importante en la evolución y resultados de los brotes publicados, destacando un mayor número de colonizados, uso de técnicas de electroforesis en campo pulsado para tipado molecular e implantación de medidas de control. Finalmente, describimos un brote en el que se afectaron 21 neonatos con infecciones leves, resueltas sin secuelas y cuyas medidas para su control resultaron eficaces.
Klebsiella oxytoca can cause nosocomial infections, affecting vulnerable newborns. There are few studies describing nosocomial outbreaks in the neonatal intensive care units (NICU). In this study, a systematic review of the literature was carried out to know the main characteristics of these outbreaks and the evolution of one is described.
MethodsWe conducted a systematic review in the Medline database up to July 2022, and present a descriptive study of an outbreak with 21 episodes in the NICU of a tertiary hospital, between September 2021 and January 2022.
ResultsNine articles met the inclusion criteria. The duration of outbreaks was found to be variable, of which 4 (44.4%) lasted for a year or more. Colonization (69%) was more frequent than infections (31%) and the mortality rate was 22.4%. In studies describing sources, the most frequent was the environmental origin (57.1%). In our outbreak there were 15 colonizations and 6 infections. The infections were mild conjunctivitis without sequelae. Molecular typing analysis made it possible to detect 4 different clusters.
ConclusionsThere is an important variability in the evolution and results of the published outbreaks, highlighting a greater number of colonized, use of pulsed-field gel electrophoresis (PFGE) techniques for molecular typing and implementation of control measures. Finally, we describe an outbreak in which 21 neonates were affected with mild infections, resolved without sequelae and whose control measures were effective.
Klebsiella spp. se encuentra de forma ubicua en la naturaleza, con tasas de colonización que aumentan en el ámbito hospitalario1. Este microorganismo puede producir infecciones nosocomiales, y provoca la causa más frecuente de brotes nosocomiales en unidades de cuidados intensivos neonatales (UCIN)2. En el humano son importantes Klebsiella pneumoniae complex y Klebsiella oxytoca complex (KO)3. KO es comensal humano, pero se ha descrito como patógeno oportunista causante de distintas infecciones4,5. Además, se ha documentado como responsable de brotes, relacionados la mayoría con fuentes ambientales6. Por otra parte, los neonatos en UCIN son vulnerables a la adquisición de infecciones nosocomiales, siendo muy importante su control7, muchas veces en forma de brotes con factores favorecedores8–10. KO puede adquirir β-lactamasas de espectro extendido (BLEE) y carbapenemasas, representando los brotes que producen un riesgo creciente para los pacientes hospitalizados5,6. Así, es esencial implementar medidas para el control de brotes, como el refuerzo de la higiene de manos, la realización de cribado para conocer el alcance del brote y el aislamiento por cohortes de infectados/colonizados11.
Aunque KO puede provocar infecciones nosocomiales, no existen artículos que revisen los brotes en la UCIN; en este trabajo se realiza una revisión sistemática de la literatura para determinar su número, orígenes, duración, proporciones de infectados y colonizados, infecciones más frecuentes y las tasas de mortalidad; además, se describe la evolución de un brote sucedido en la UCIN de un hospital de tercer nivel.
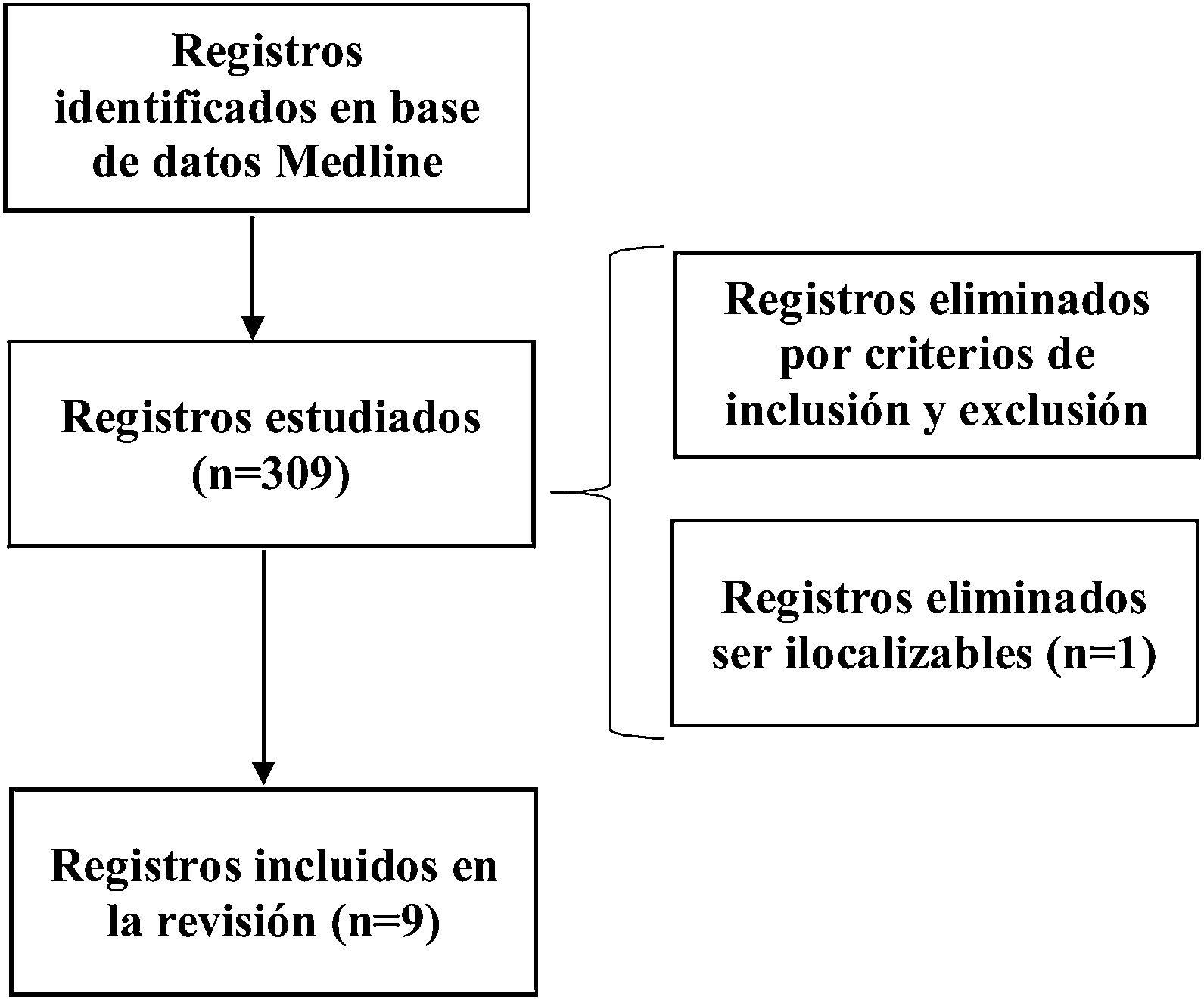
MétodosRevisión sistemáticaSe han seguido las normas PRISMA (https://prisma-statement.org//) en la base de datos Medline, a través de PubMed. Se usaron los términos (Klebsiella oxytoca AND outbreak). La búsqueda y selección de artículos fue realizada por 2 autores. Los criterios de inclusión fueron: trabajos publicados hasta el 1 de julio de 2022 sobre descripción de brotes por KO en la UCIN publicados en inglés o castellano que tuvieran al menos las siguientes variables mínimas: duración del brote y número de afectados y tipos de infección, en caso de que estuviese presente. También se revisó la bibliografía de los trabajos para reducir el número de pérdidas. No hubo rechazo de artículos por idioma (fig. 1). Para analizar el riesgo de sesgo y los resultados de los estudios individuales se usaron los ítems de la declaración de ORION para la transparencia de los brotes.
Análisis del broteSe investigó el brote ocurrido entre septiembre de 2021 y enero de 2022. Se definió «brote» como la asociación de 2 o más casos de infección relacionada con la asistencia sanitaria (IRAS) por KO en pacientes con ingreso en la UCIN. Se determinó «caso de infección» asociado al brote al paciente ingresado con muestra clínica con KO y signos y/o síntomas de IRAS en esa localización, mientras que «caso de colonización» asociada al brote se describió como paciente ingresado, con aislamiento de KO en una muestra biológica y sin signos clínicos de infección. Para cada neonato infectado/colonizado se recogieron las variables: sexo, edad gestacional, peso al nacimiento, fecha de ingreso y de alta, presencia de antibióticos al nacimiento, catéter venoso/arterial central o periférico, intubación y duración en día de cada uno de ellos, duración del ingreso en UCIN, evolución, fecha del primer cultivo positivo, colonización, tipos de infección por KO, tratamiento recibido, coinfección por otros microorganismos y ubicación del neonato en el momento de extracción de la muestra clínica con KO.
LocalizaciónLa UCIN, ubicada en la 5.ª planta del Hospital Materno Infantil del Hospital Universitario Virgen de las Nieves, cuenta con un área de cuidados básicos (20cunas), otra de cuidados intermedios (10cunas) y una tercera zona de cuidados intensivos (8cunas). En esta unidad se atiende a los lactantes en función de sus necesidades desde el momento de su nacimiento.
Medidas de control del brotePara el seguimiento del brote se implementaron medidas de prevención (medidas organizativas, vigilancia epidemiológica, medidas de prevención de la transmisión del microorganismo) y control (información, formación y medidas ambientales) del documento de Apoyo metodológico para el abordaje integral de brotes nosocomiales y del Protocolo de vigilancia y control de brotes por IRAS de la Consejería de Salud de Andalucía12,13.
Estudio microbiológico de aislados clínicos asociados a brote por el programa PIRASOALos aislados se identificaron utilizando MALDI-TOF (Biotyper, Brucker Daltonics, Billerica, MA, EE. UU.). Las pruebas de sensibilidad antimicrobiana se realizaron mediante microdilución (Microscan WalkAway, Beckman-Coulter, Brea, CA, EE. UU.) y se interpretaron según los puntos de corte de EUCAST (https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/v_11.0_Breakpoint_Tables.pdf). Las relaciones clonales entre los aislados se evaluaron mediante electroforesis en campo pulsado (PFGE). La digestión cromosómica completa del ADN se realizó con XbaI. Los fragmentos de restricción resultantes se separaron en el sistema CHEF DR-II (Bio-Rad, Alcobendas, Madrid, España) con gel de agarosa al 1%. Los geles se tiñeron con bromuro de etidio, se visualizaron con luz ultravioleta y se fotografiaron en un sistema automático de imágenes Gel Logic 200 (Kodak, Rochester, NY, EE. UU.). La conversión, normalización y análisis de patrones de banda se realizó utilizando el software Bionumerics 8.1 (AppliedMaths, Jollyville Rd., Austin, TX, EE. UU.). La tolerancia y la optimización de la posición de la banda se establecieron en 1%. Se empleó un método de grupos de pares no ponderados con media aritmética para generar un dendrograma y se utilizó el análisis del dendograma para medir la similitud genética entre aislados. Se consideraron diferentes los aislamientos con 2 o más bandas de diferencia14. Se seleccionaron aislados que diferían en una o más bandas en los ensayos PFGE para la secuenciación. Al menos se analizó un aislado de cada clúster mediante secuenciación (Ilumina®). Los fragmentos de lectura abierta sin procesar se ensamblaron de novo utilizando el software CLC Genomics Workbench, v9.1 (Qiagen Iberia, Las Rozas de Madrid, Madrid, España). Los determinantes de la resistencia se detectaron utilizando las bases de datos ResFinder (https://cge.cbs.dtu.dk/services/ResFinder) y CARD (https://card.mcmaster.ca/) y el MLST se identificó utilizando la base de datos MLST finder 2.0 (https://cge.cbs.dtu.dk/services/MLST).
Declaración de ORIONSe siguieron los criterios de The ORION statement guidelines para asegurar la transparencia en el informe de brote (https://www.ucl.ac.uk/drupal/site_antimicrobial-resistance/sites/antimicrobial-resistance/files/checklist_authors.pdf).
Aprobación éticaEl Comité de Ética de la Investigación de Granada dio su aprobación al proyecto con fecha 29de julio de 2022 y código de referencia 1385-N-22.
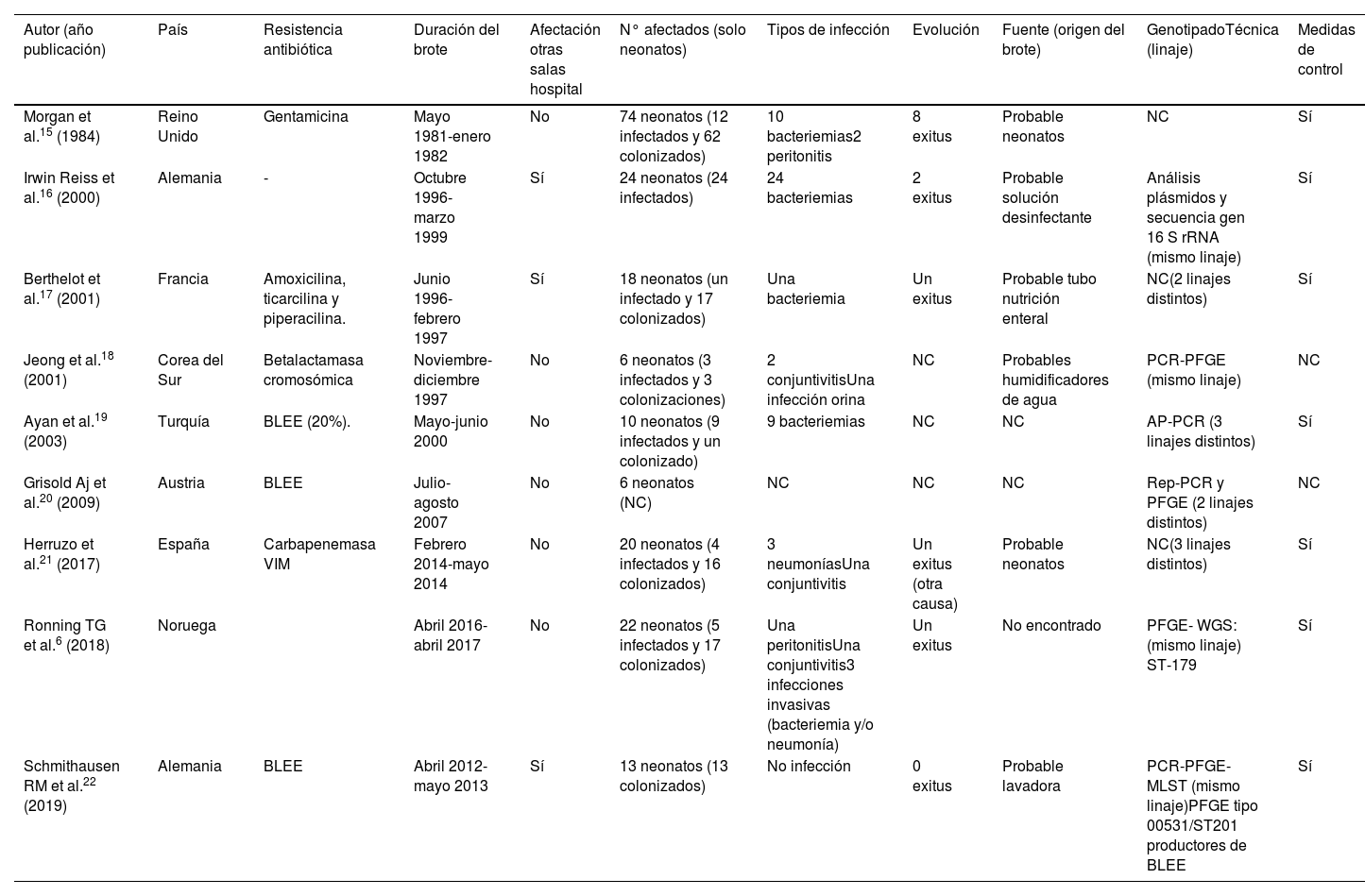
ResultadosRevisión sistemáticaLa búsqueda aportó 309 publicaciones, 10 cumplían con los criterios de inclusión especificados y 9 fueron las incluidas para la revisión, ya que una no se pudo localizar (Ethiop Med J. 1997;35(3):177-83). En la tabla 1 se incluyen las características de los 9 brotes. Todos ocurrieron en el continente europeo, salvo uno en Corea del Sur. Hubo 2 brotes en Alemania (22,2%). En 5 estudios (55,5%) KO presentó algún tipo de resistencia: en 3 brotes hubo producción de BLEE (33,3%), siendo uno CTX-M-1522; en uno hubo producción de carbapenemasa tipo VIM (11,1%)21 y en otro betalactamasa cromosómica con resistencia a aztreonam (11,1%)18. La duración del brote fue variable, desde 2 meses (n=3; 33,3%) hasta un año o más (n=4; 44,4%), siendo el de mayor duración uno desde 1996 a 1999. El resto (n=2; 22,2%) fueron de 4 y 9 meses. Respecto a la propagación, en 3 de los estudios (33,3%) KO se diseminó, además, a otras salas hospitalarias16,17,22. Considerando a los afectados encontramos un total de 193 neonatos entre colonizados e infectados de los que 58 episodios eran infecciones, 129 colonizaciones y en 6 neonatos no se documentó. En 6 estudios (66,7%) se describió la presencia de colonización e infección, en un brote (11,1%) solo hubo infección16 y en otro (11,1%) solo colonización22. Hubo un episodio en el que no se describe. El rango de colonizados va desde 1 a 62 y el rango de infecciones va desde 1 a 24. De las infecciones documentadas las más frecuentes fueron las bacteriemias (78,6%), seguidas de conjuntivitis (7,1%), neumonías, peritonitis, infecciones invasivas sin especificar (5,4%) e infección urinaria (1,8%). En las 58 infecciones descritas hubo 13 muertes (tasa de mortalidad total del 22,4%). Una de las muertes se informó como debida a otra causa distinta a la infección. No se informó en 3 estudios (33,3%) la evolución clínica de los neonatos. De las fuentes de los brotes que se documentaron (n=7; 77,8%) se consideraron como probables los propios neonatos en 2 (28,6%) y en 4 (57,1%) lo más frecuente fue el origen ambiental (solución desinfectante, lavadora, humidificadores de agua y tubo de nutrición enteral). En un 14,3% no se pudo establecer el origen más probable del brote6.
Características principales en la descripción de brotes por Klebsiella oxytoca en UCI neonatal
| Autor (año publicación) | País | Resistencia antibiótica | Duración del brote | Afectación otras salas hospital | N° afectados (solo neonatos) | Tipos de infección | Evolución | Fuente (origen del brote) | GenotipadoTécnica (linaje) | Medidas de control |
|---|---|---|---|---|---|---|---|---|---|---|
| Morgan et al.15 (1984) | Reino Unido | Gentamicina | Mayo 1981-enero 1982 | No | 74 neonatos (12 infectados y 62 colonizados) | 10 bacteriemias2 peritonitis | 8 exitus | Probable neonatos | NC | Sí |
| Irwin Reiss et al.16 (2000) | Alemania | - | Octubre 1996-marzo 1999 | Sí | 24 neonatos (24 infectados) | 24 bacteriemias | 2 exitus | Probable solución desinfectante | Análisis plásmidos y secuencia gen 16 S rRNA (mismo linaje) | Sí |
| Berthelot et al.17 (2001) | Francia | Amoxicilina, ticarcilina y piperacilina. | Junio 1996-febrero 1997 | Sí | 18 neonatos (un infectado y 17 colonizados) | Una bacteriemia | Un exitus | Probable tubo nutrición enteral | NC(2 linajes distintos) | Sí |
| Jeong et al.18 (2001) | Corea del Sur | Betalactamasa cromosómica | Noviembre-diciembre 1997 | No | 6 neonatos (3 infectados y 3 colonizaciones) | 2 conjuntivitisUna infección orina | NC | Probables humidificadores de agua | PCR-PFGE (mismo linaje) | NC |
| Ayan et al.19 (2003) | Turquía | BLEE (20%). | Mayo-junio 2000 | No | 10 neonatos (9 infectados y un colonizado) | 9 bacteriemias | NC | NC | AP-PCR (3 linajes distintos) | Sí |
| Grisold Aj et al.20 (2009) | Austria | BLEE | Julio-agosto 2007 | No | 6 neonatos (NC) | NC | NC | NC | Rep-PCR y PFGE (2 linajes distintos) | NC |
| Herruzo et al.21 (2017) | España | Carbapenemasa VIM | Febrero 2014-mayo 2014 | No | 20 neonatos (4 infectados y 16 colonizados) | 3 neumoníasUna conjuntivitis | Un exitus (otra causa) | Probable neonatos | NC(3 linajes distintos) | Sí |
| Ronning TG et al.6 (2018) | Noruega | Abril 2016-abril 2017 | No | 22 neonatos (5 infectados y 17 colonizados) | Una peritonitisUna conjuntivitis3 infecciones invasivas (bacteriemia y/o neumonía) | Un exitus | No encontrado | PFGE- WGS:(mismo linaje) ST-179 | Sí | |
| Schmithausen RM et al.22 (2019) | Alemania | BLEE | Abril 2012-mayo 2013 | Sí | 13 neonatos (13 colonizados) | No infección | 0 exitus | Probable lavadora | PCR-PFGE-MLST (mismo linaje)PFGE tipo 00531/ST201 productores de BLEE | Sí |
AP-PCR: reacción en cadena de la polimerasa cebada arbitrariamente; BLEE: betalactamasas de espectro extendido; MLST: tipificación de secuencias multilocus; NC: no consta; PCR: reacción en cadena de la polimerasa; PFGE: electroforesis en gel mediante campos pulsados; Rep-PCR: reacción en cadena de la polimerasa basada en secuencias de elementos repetitivos; WGS: secuenciación genómica completa.
En cuanto al análisis molecular para el tipado no se describió en todos los episodios de brotes. De los que sí estaban recogidos (n=6; 66,7%) las técnicas que más se usaron fueron PCR y PFGE. El tipo de linaje que se halló en cada estudio se recogió en todos salvo en uno; así, del total, el 50% de estudios recogieron un mismo linaje, el 25% fueron 3 cepas distintas y en el 25% restante 2 distintas. Finalmente, encontramos estudios en los que no consta la aplicación de medidas para el control del brote (22,2%), mientras que en el resto sí se informa de las medidas de control que se llevaron a cabo.
Análisis del broteDesarrollo del broteEl Servicio de Medicina Preventiva y Salud Pública (MP y SP) del hospital realiza la vigilancia de IRAS en la UCIN. El día 27 de septiembre de 2021 detecta 2 casos de conjuntivitis por KO en neonatos. Revisando los aislamientos microbiológicos previos en esa unidad se observa la existencia de un tercer neonato con conjuntivitis por el mismo microorganismo iniciada el día 13 de ese mismo mes. Teniendo en cuenta que todos los casos se encontraban ingresados en el mismo módulo de la UCIN y se producen en el mismo periodo (existencia de asociación espaciotemporal) MP y SP declaran el brote en el Sistema de Vigilancia Epidemiológica de Andalucía y se constituye el Grupo de mejora para el abordaje del brote ese mismo día. A partir de ese momento, con el objetivo de conocer nuevos pacientes afectados por KO en la unidad de neonatología, se continúa con la búsqueda activa de infectados y colonizados en los pacientes ingresados.
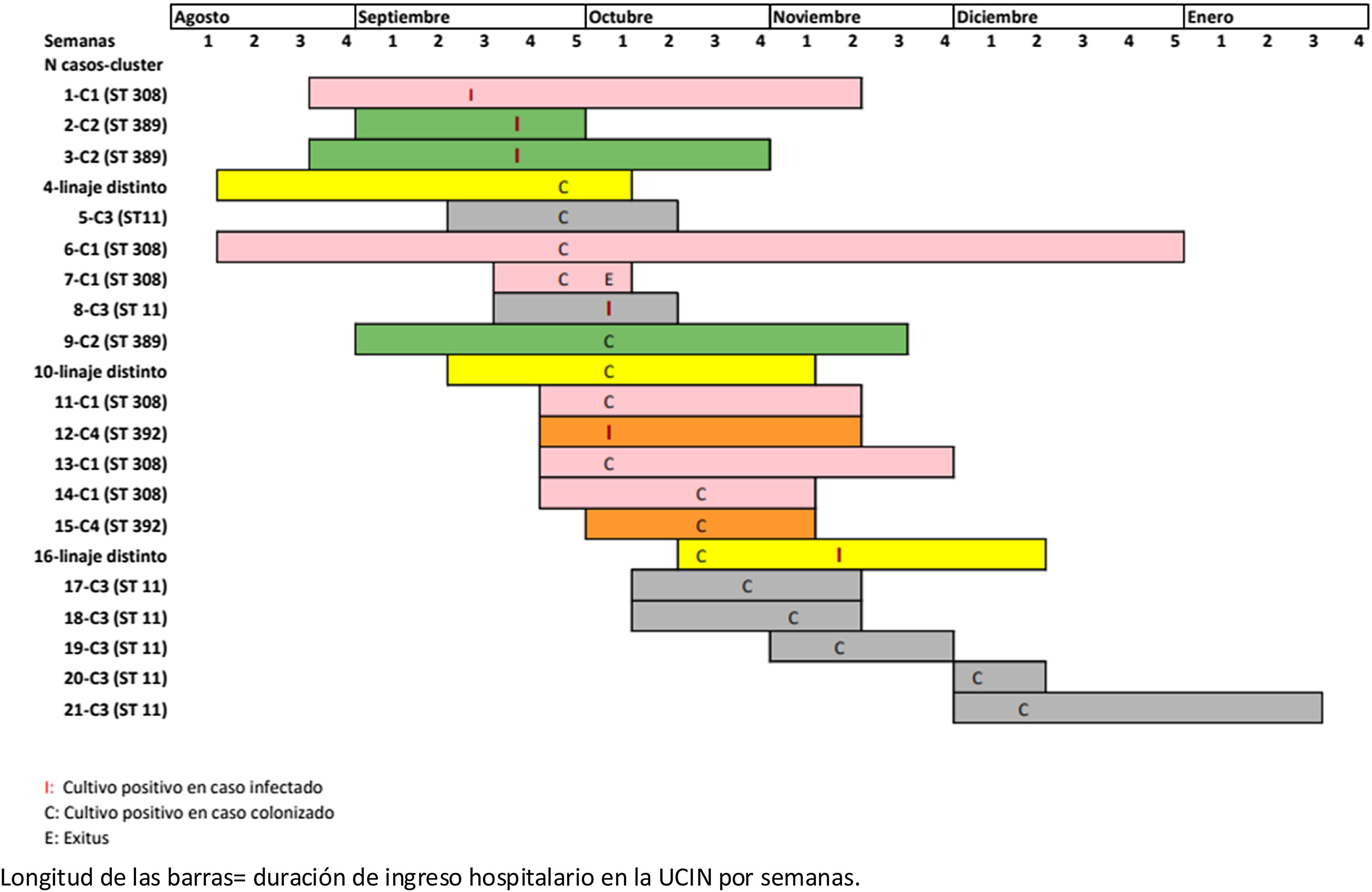
Así, con el objetivo de cuantificar la magnitud del brote y controlar su expansión se realizó semanalmente frotis rectal a todos los neonatos ingresados y durante este proceso de investigación se identificaron 6 pacientes con conjuntivitis nosocomial por KO y 15 pacientes colonizados (fig. 2). Finalmente, transcurridas al menos 4 semanas sin detección de nuevos casos de pacientes infectados o colonizados se procede al cierre del brote con fecha de 20 de enero de 2022.
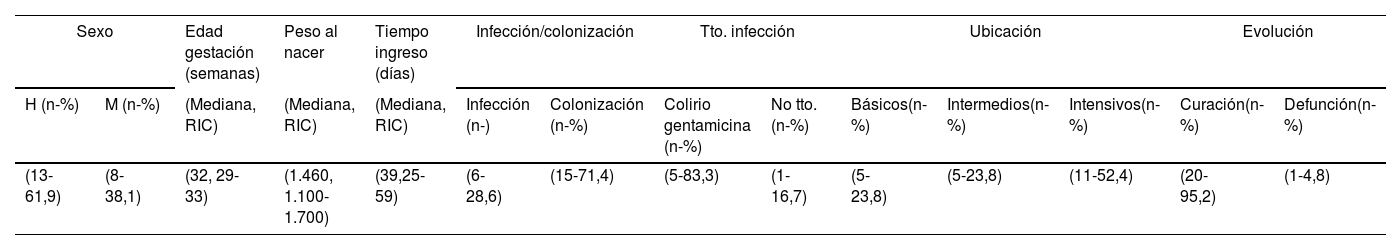
Investigación clínico-epidemiológicaDurante el periodo se analizaron 128 pacientes en la UCIN, siendo 21 (16,4%) los casos que tuvieron muestra clínica positiva con KO durante su ingreso. De los 21 neonatos (tabla 2) 13 (61,9%) fueron varones, con peso y edad gestacional media de 1.468,8g (rango: 450-3.000g y DT: 571,8) y 31,3 semanas (rango: 0-40 semanas y DT: 3,9), respectivamente. La estancia media en la UCIN fue de 45,5 días (rango: 10-135 y DT: 29,6). Tan solo se produjo el fallecimiento de un neonato cuya causa fue ajena a la infección por KO. Considerando la ubicación de los pacientes en el momento del aislamiento microbiológico 11 (52,4%) se encontraban en el módulo de críticos, 3 (14,3%) en el módulo de cuidados medios y 7 (33,3%) en el módulo de básicos.
Características generales de los neonatos hospitalizados en la UCIN (n=21)
| Sexo | Edad gestación (semanas) | Peso al nacer | Tiempo ingreso (días) | Infección/colonización | Tto. infección | Ubicación | Evolución | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H (n-%) | M (n-%) | (Mediana, RIC) | (Mediana, RIC) | (Mediana, RIC) | Infección (n-) | Colonización (n-%) | Colirio gentamicina (n-%) | No tto. (n-%) | Básicos(n-%) | Intermedios(n-%) | Intensivos(n-%) | Curación(n-%) | Defunción(n-%) |
| (13-61,9) | (8-38,1) | (32, 29-33) | (1.460, 1.100-1.700) | (39,25-59) | (6-28,6) | (15-71,4) | (5-83,3) | (1-16,7) | (5-23,8) | (5-23,8) | (11-52,4) | (20-95,2) | (1-4,8) |
H: hombre; M: mujer; RIC: rango intercuartílico; Tto: tratamiento.
En cuanto a los aislamientos detectados de los 21 casos 15 (71,4%) fueron colonizaciones y 6 (28,6%) infecciones. Todas las infecciones identificadas fueron conjuntivitis leves, y todas ellas se trataron con colirio de gentamicina (tabla 2).
Investigación microbiológicaSe estudió la sensibilidad antibiótica en los aislados conjuntivales, que compartían el mismo perfil: sensibilidad a piperacilina-tazobactam, cefotaxima, cefepima, ertapenem, imipenem, meropenem, aztreonam, ciprofloxacino, gentamicina, tobramicina, amikacina, fosfomicina y trimetoprim/sulfametoxazol.
Análisis mediante tipado molecularLos 21 aislados de K. oxytoca se enviaron al laboratorio de referencia para su análisis por PFGE y secuenciación. Tras su análisis se identificaron 4 clústeres distintos: ST11 (7; 33,3%), ST308 (6; 28,6%), ST389 (3; 14,3%) y ST392 (2; 9,5%), y en 3 neonatos los pulsotipos fueron distintos entre ellos y distintos a todos los clústeres identificados (fig. 3). El análisis permitió concluir que 2 casos de conjuntivitis y un paciente colonizado pertenecieron al mismo linaje (ST389, casos 2, 3 y 9). Los casos 1, 6, 7, 11, 13 y 14 pertenecían al clon ST308; los casos 5, 8, 17, 18, 19, 20 y 21 formaban parte del clon ST11, mientras que los casos 12 y 15 correspondían al ST392. Finalmente, los casos 4, 10 y 16 fueron distintos entre sí y al resto de casos. De esta forma en el brote se encontraron 4 cadenas de transmisión distintas.
Medidas de control del broteEn este hospital se lleva a cabo la vigilancia de las IRAS y están implantadas las medidas generales para su control, como el apoyo de la dirección hospitalaria, la educación del personal con formación periódica y a su incorporación el uso correcto de la antibioterapia, la vigilancia epidemiológica y el uso y cumplimiento de las precauciones de transmisión. Con la detección de este brote se añaden medidas a las del Programa de vigilancia y control de la infección nosocomial en la unidad de neonatología (tabla 3).
Medidas para el control del brote
| Medidas tipo organizativas |
| Creación Grupo de mejora multidisciplinar para el abordaje de este brote (27/09/2021) |
| Sesión de trabajo del Grupo de mejora multidisciplinar: análisis de la situación (18/10/2021) |
| Vigilancia epidemiológica |
| Visita a la unidad por parte de MP y SP para valorar el problema in situ (28/09/2021) |
| Búsqueda activa de nuevos casos |
| Cribado semanal de los ingresados en la unidad neonatal |
| Envío al laboratorio de referencia de aislados relacionados con el brote |
| Precauciones para prevenir la transmisión de la infección |
| Precauciones de contacto en casos (colonizados/infectados) |
| Atención a la higiene de manos y uso adecuado de guantes |
| Seguimiento por enfermería de MP y SP del cumplimiento de las medidas habituales de prevención de la infección nosocomial, especial atención a procedimientos de cuidados de pacientes, limpieza/desinfección de fómites y material, además de la correcta higiene de manos (inicio 28/09/2021). |
| Limpieza terminal de habitaciones y módulos afectados |
| Información y formación |
| Talleres formativos en grupos pequeños, incluyendo todas las categorías profesionales, sobre higiene de manos y uso adecuado de guantes (inicio 21/10/2021). |
| Información a familiares sobre medidas de aislamiento |
| Mejora de la señalización de las entradas a la unidad |
| Otras medidas |
| Cambio de grifos en la unidad para que se activen con sensor |
| Presencia de jabón antiséptico con clorhexidina en todas las jaboneras de la unidad, a las que se les ha añadido el dispensador por sensor. |
| Evacuación completa del módulo para proceder a la limpieza/desinfección terminal de la sala, incluyendo material, estantes y casilleros. Posteriormente se ha aplicado el procedimiento de desinfección mediante rayos ultravioleta (MÁQUINA XENEX) |
En este estudio llama la atención la escasez de brotes comunicados provocados por KO en las UCIN, a pesar de que, según un artículo2, Klebsiella es la primera causa de brotes en las UCIN, la mayoría por K. pneumoniae. En esta revisión sistemática se incluyeron 9 episodios en países desarrollados, de altos y medianos ingresos, según la clasificación de World Data Bank23, al igual que en otra revisión sobre brotes de Pseudomonas aeruginosa en UCIN24 y otra sobre brotes en las UCIN25. Con relación a las resistencias en KO parece haber un aumento en los brotes más cercanos a la actualidad, lo que está relacionado con el incremento de microorganismos multirresistentes26. Este hecho dificulta el tratamiento de las infecciones y aumenta la gravedad de las consecuencias. En cuanto a la proporción de afectados se observa un número elevado en la mayoría de ellos; sin embargo, en concordancia con otras revisiones7,25, el número de colonizados es mayor que el de infectados, lo que favorece la idea de que los neonatos colonizados sean uno de los principales reservorios y las manos del personal sanitario uno de los principales vectores27,28. La mortalidad en la revisión fue muy variable, alcanzando una tasa total del 22,4%, mientras que en la revisión sobre brotes por enterobacterias productoras de BLEE la tasa fue del 16%25. Aunque el origen de los brotes no se puede establecer en muchas ocasiones, destaca la probabilidad de un origen ambiental, como lavadoras, humidificadores o desinfectantes, corroborado por la evidencia científica6. La mayoría del análisis molecular consistió en PCR-PFGE, con variabilidad en los linajes presentes, como ocurre en otros brotes por bacterias gramnegativas29. En cuanto a las medidas de control se llevó a cabo al menos una en todos los brotes en los que aparecen documentadas, siendo algunas de las más frecuentes el refuerzo de la higiene de manos y el aislamiento por cohortes de los neonatos infectados/colonizados. De esta forma los brotes en UCIN por KO tienen grandes implicaciones afectando a un número importante de neonatos que adquieren la infección o colonización, pudiendo actuar como reservorio para su propagación.
En este trabajo hemos estudiado un brote multiclonal por KO que implicó a 21 neonatos de la UCIN de un hospital de tercer nivel. En la literatura se hallan bien identificados algunos factores de riesgo para la adquisición de infecciones nosocomiales en neonatos vulnerables de la UCIN, como bajo peso al nacimiento (<1.500g), prematuridad, uso de dispositivos invasivos, antibioterapia y duración de la estancia en la UCIN8. En este brote el 57,1% tuvo bajo peso al nacer, el 90,5% fue prematuro y el 95,3% tuvo algún dispositivo invasivo al menos durante 24horas. En cuanto a las tasas de mortalidad se observa la variabilidad de esta en la revisión; en nuestro brote solo tuvimos un exitus debido a otra causa. En cuanto a los casos que conforman el brote encontramos 15 colonizaciones y 6 infecciones, semejante al resto de publicaciones, con más casos de colonizados. Todas las infecciones fueron leves (conjuntivitis) y se resolvieron adecuadamente. Las medidas de vigilancia epidemiológica (cribado semanal a los ingresados en la unidad, búsqueda activa de nuevos casos y envío de los aislamientos al laboratorio de referencia) resultaron muy útiles. El tipado molecular corroboró que el brote se encontraba compuesto por 4 cadenas de transmisión distintas, pertenecientes a clones distintos, como en los brotes recogidos en la revisión.
En los brotes es posible la identificación de probables fuentes de extensión medioambiental, como lavadoras20, desinfectantes16, viales multidosis30 o tubos enterales17. Sin embargo, en otros brotes el origen permanece incierto. En nuestro brote no se llevó a cabo estudio ambiental, ya que las medidas se centraron en el cribado en neonatos y en la formación continuada en el personal de la UCIN, aparte de las medidas descritas en la tabla 3. De hecho, aunque no se puede medir qué medida influyó más en la reducción del brote, es probable que se debiera al conjunto. A pesar de que el origen de este brote no queda claro, lo más probable es que los neonatos colonizados hayan actuado como reservorio principal y se haya transmitido a otros a través de las manos del personal, descrita como una de las principales vías de continuación de brotes26, ya que los casos se encuentran espaciados en el tiempo y no hace pensar en un origen común.
El brote se dio por concluido una vez pasadas, al menos, 4 semanas sin nuevos casos infectados o colonizados, cerrándose el 20 de enero de 2022. A partir de la finalización de este brote se acordaron medidas para evitar más brotes, y en el caso de que surgieran IRAS se detectaran precozmente. Estas acciones acordadas fueron la realización de cribado rutinario mediante estudios de colonización (frotis rectal) cada 2 semanas en situación de ausencia de brote, para buscar bacterias gramnegativas diferentes a Escherichia coli; uso de viales unidosis para el cuidado ocular, y refuerzo de la higiene de manos por la UCIN, MP y SP. Desde la implementación de esas medidas hasta la actualidad no se han notificado más brotes en la UCIN.
Este estudio presenta diversas limitaciones; por un lado, aunque la revisión sistemática es exhaustiva se realizó en una sola base de datos, por lo que podría hallarse un sesgo de selección; además, hubo un artículo al que no se pudo acceder. Es reseñable también que no todos los brotes informaban de las características recogidas en la tabla 1, por lo que puede haber un sesgo en el alcance de los resultados comentados. Es necesario analizar de forma homogénea la aparición de brotes en la UCIN con el objetivo de recoger datos completos para la realización de revisiones sistemáticas.
En conclusión, hay una escasez de estudios en la literatura de brotes por KO en la UCIN. Existe una variabilidad importante en la evolución y resultados de los brotes por KO, destacando similitud en la aparición de mayor número de colonizados que infectados, uso de técnicas de PFGE para tipado molecular e implantación de medidas de control. Finalmente, se ha descrito un brote en el que se afectaron 21 neonatos con infecciones leves y cuyas medidas resultaron eficaces para controlarlo. La aplicación de las medidas acordadas tras el brote para mejorar la temprana detección de IRAS y evitar la transmisión parece que pueden llegar a tener consecuencias favorables, ya que no se han producido más brotes desde el descrito.
FinanciaciónNo se ha recibido financiación para la realización de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.