Para garantizar el bienestar y la seguridad en los pacientes críticos es necesario aplicar estrategias de analgosedación seguras que eviten la infra- y sobresedación.
ObjetivosComparar un protocolo multidisciplinar de evaluación sistemática y manejo de la analgosedación del paciente crítico con ventilación mecánica frente a la praxis habitual.
Material y métodosEstudio de cohorte con series contemporáneas, realizado en UCI polivalente de hospital terciario, febrero-noviembre de 2013-2014. Criterios de inclusión: ventilación mecánica ≥ 24h y sedación en infusión continua. Se monitorizó sedación con Richmond Agitation-Sedation Scale o índice biespectral y analgesia con escala verbal numérica o escala indicadora de conductas dolorosas. Variables de estudio: tiempo de ventilación mecánica, tiempo de destete, tiempo de soporte ventilatorio, tiempo de vía aérea artificial, tiempo de sedación en infusión, dosis diaria y frecuencia de uso de fármacos sedantes y analgésicos, estancia y mortalidad en UCI y hospitalaria, mediciones Richmond Agitation-Sedation Scale, índice biespectral, escala verbal numérica y escala indicadora de conductas dolorosas. Se empleó Kruskal Wallis y chi cuadrado, significación p<0,05.
ResultadosSe incluyeron 153 ingresos, 75 preintervención y 78 postintervención, edad 55,7±13años, 67% hombres. Ambos grupos fueron similares en cuanto a edad, motivo de ingreso y APACHE. Se disminuyó sin significación estadística el tiempo de ventilación mecánica 4 (1,4-9,2); 3,2 (1,4-8,1) días; p=0,7, días de sedación 6 (3-11); 5 (3-11) días; p=0,9, estancia hospitalaria 29 (18-52); 25 (14-41) días; p=0,1, mortalidad UCI 8 vs. 5%; p=0,4 y hospitalaria 10,6 vs. 9,4%: p=0,8. Las dosis diarias de midazolam y remifentanilo disminuyeron 347 (227-479) mg/día; 261 (159-358) mg/día; p=0,02 y 2.175 (1.427-3.285) mcg/día; 1.500 (715-2.740) mcg/día; p=0,02 respectivamente. Se incrementó el uso de remifentanilo (32 vs. 51%; p=0,01), dexmedetomidina (0 vs. 6%; p=0,02), dexquetoprofeno (60 vs.76%; p=0,03) y haloperidol (15 vs. 28%; p=0,04) y el uso de cloruro mórfico descendió (71 vs. 54%; p=0,03). Se incrementó el número de valoraciones y registro de Richmond Agitation-Sedation Scale 6 (3-17); 21 (9-39); p<0,0001, escala indicadora de conductas dolorosas 6 (3-18); 19 (8-33); p<0,001 y escala verbal numérica 4 (2-6); 8 (6-17); p<0,0001.
ConclusionesAl implementar un protocolo multidisciplinar de evaluación sistemática y manejo de la analgosedación se consigue una correcta monitorización y mayor adecuación de las dosis a las necesidades del paciente, mejorando los resultados.
Safe analgesia and sedation strategies are necessary in order to avoid under or over sedation, as well as improving the comfort and safety of critical care patients.
ObjectivesTo compare and contrast a multidisciplinary protocol of systematic evaluation and management of analgesia and sedation in a group of critical care patients on mechanical ventilation with the usual procedures.
Materials and methodsA cohort study with contemporary series was conducted in a tertiary care medical-surgical ICU February to November during 2013 and 2014. The inclusion criteria were mechanical ventilation ≥ 24h and use of sedation by continuous infusion. Sedation was monitored using the Richmond agitation-sedation scale or bispectral index, and analgesia were measured using the numeric rating scale, or behavioural indicators of pain scale. The study variables included; mechanical ventilation time, weaning time, ventilation support time, artificial airway time, continuous sedative infusion time, daily dose and frequency of analgesic and sedative drug use, hospital stay, and ICU and hospital mortality, Richmond agitation-sedation scale, bispectral index, numeric rating scale, and behavioural indicators of pain scale measurements. Kruskal Wallis and Chi2, and a significance of p<.05 were used.
ResultsThe study included 153 admissions, 75 pre-intervention and 78 post-intervention, with a mean age of 55.7±13 years old, and 67% men. Both groups showed similarities in age, reason for admission, and APACHE. There were non-significant decreases in mechanical ventilation time 4 (1.4-9.2) and 3.2 (1.4-8.1) days, respectively; p= 0.7, continuous sedative infusion time 6 (3-11) and 5 (3-11) days; p= 0.9, length of hospital stay 29 (18-52); 25 (14-41) days; p= 0.1, ICU mortality (8 vs. 5%; p= 0.4), and hospital mortality (10.6 vs. 9.4%: p= 0.8). Daily doses of midazolam and remifentanil decreased 347 (227-479) mg/day; 261 (159-358) mg/day; p= 0.02 and 2175 (1427-3285) mcg/day; 1500 (715-2740) mcg/day; p= 0.02, respectively. There were increases in the use of remifentanil (32% vs. 51%; p= 0.01), dexmedetomidine (0 vs.6%; p= 0.02), dexketoprofen (60 vs. 76%; p= 0.03), and haloperidol (15 vs.28%; p= 0.04). The use of morphine decreased (71 vs. 54%; p= 0.03). There was an increase in the number of measurements and Richmond agitation-sedation scale scores 6 (3-17); 21 (9-39); p< 0.0001, behavioural indicators of pain scale 6 (3-18); 19(8-33); p< 0.001 and numeric rating scale 4 (2-6); 8 (6-17); p< 0.0001.
ConclusionsThe implementation of a multidisciplinary protocol of systematic evaluation of analgesia and sedation management achieved an improvement in monitoring and adequacy of dose to patient needs, leading to improved outcomes.
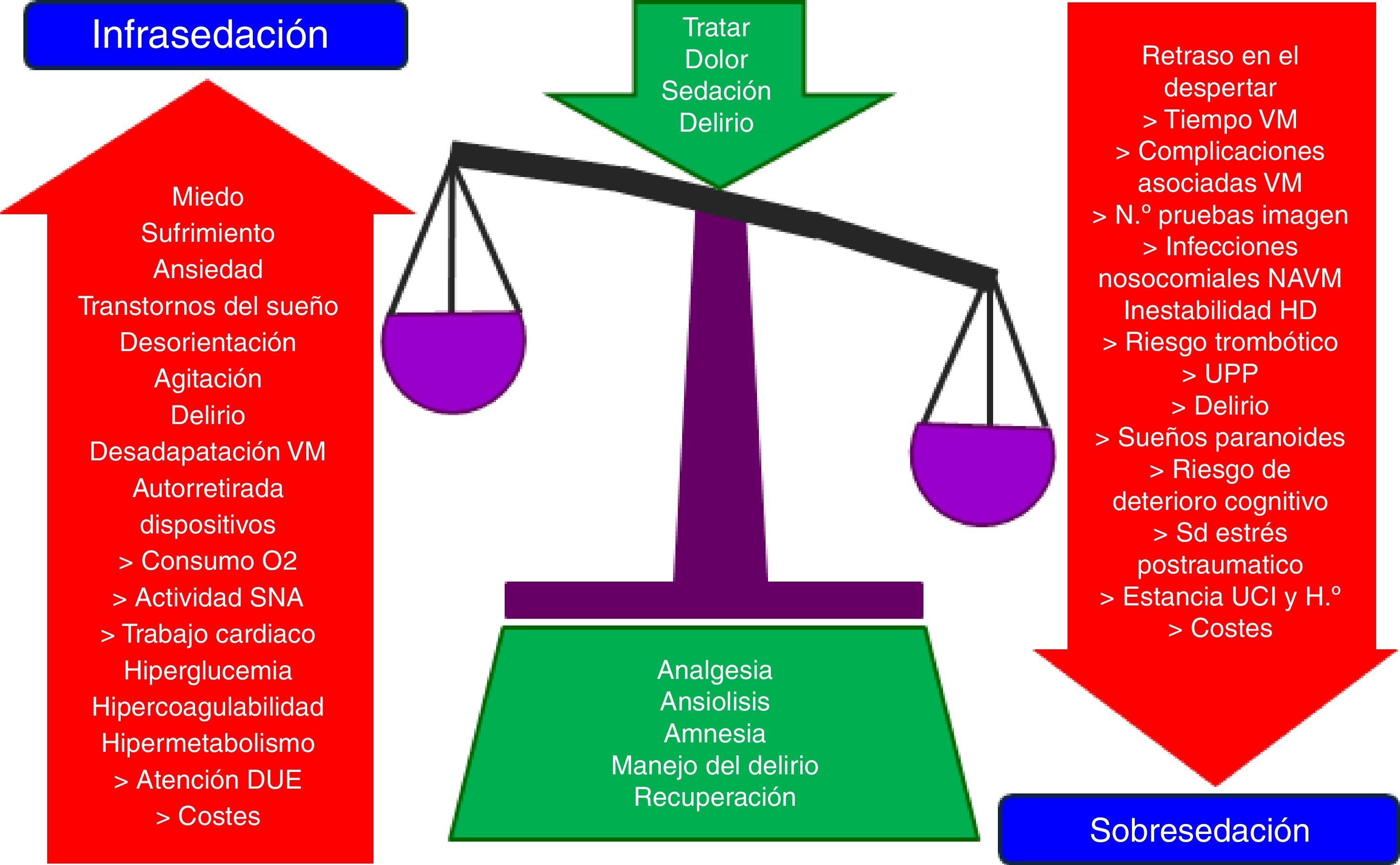
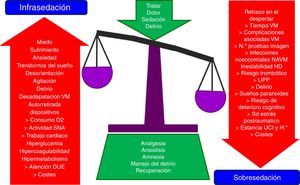
La administración de analgesia y sedación constituye una práctica habitual y uno de los pilares básicos del tratamiento del paciente crítico en las unidades de cuidados intensivos. Su objetivo fundamental es proporcionar bienestar y seguridad a los pacientes. Sin embargo, su uso no está exento de efectos adversos, derivados en su mayoría de su infra- o sobresedación, que pueden prolongar la VM, complicar la evolución y pronóstico del paciente crítico e incrementar el coste sanitario.
Este trabajo intenta demostrar cómo a través de la implementación de un protocolo de analgosedación se mejoran las prácticas de analgosedación y los resultados en los pacientes.
¿Implicaciones del estudio?Numerosos estudios justifican la importancia de desarrollar protocolos de analgesia y sedación multidisciplinares guiados por las enfermeras, que permitan prevenir la sobresedación, mantener una sedación ligera el mayor tiempo posible y dinámica, que se adapte a las necesidades del paciente de cada momento del día, garantizando su bienestar y seguridad. Tras la implementación de un protocolo multidisciplinar de evaluación sistemática y manejo de la analgosedación en nuestra unidad, hemos conseguido incrementar la correcta monitorización del dolor y la sedación y dar a conocer los objetivos de analgesia y sedación que el equipo asistencial quiere alcanzar en los pacientes. De forma que se han establecido las bases fundamentales para conseguir en un futuro que las enfermeras modifiquen y ajusten las dosis de analgosedación de forma autónoma, siguiendo algoritmos de intervención basados en la mejor evidencia y elaborados por un equipo multidisciplinar, que permitirán una importante mejora de los resultados en nuestros pacientes, ya ampliamente demostrada en numerosos estudios internacionales previos.
La analgesia y la sedación son una práctica habitual en las unidades de cuidados intensivos (UCI) y constituyen parte integral del tratamiento del paciente crítico1–7. Estas terapias son necesarias para aliviar el dolor, la ansiedad, el estrés, facilitar la aplicación de cuidados y de técnicas de soporte vital, como la ventilación mecánica artificial (VM), así como para mantener un óptimo nivel de bienestar y de seguridad en nuestros pacientes. Sin embargo, su uso no está exento de complicaciones, derivadas en su mayoría de su infra- o sobreutilización8–12 (fig. 1)13, que pueden prolongar la VM, complicar la evolución y pronóstico del paciente crítico e incrementar el coste sanitario14–18. De ahí la importancia de conseguir un nivel de analgosedación óptimo, aplicando estrategias seguras, que traten de garantizar el máximo bienestar del paciente, adaptándose a sus necesidades individuales y minimizando sus efectos adversos4,15,16,18–24. En esta última década existe una amplia evidencia de que el uso de las mínimas dosis necesarias de analgosedación, mediante la implementación de guías, algoritmos o protocolos de analgosedación (PAS), tiene importantes beneficios para el paciente como la disminución del tiempo de VM, de las dosis y tiempos de sedación, de la incidencia de neumonía asociada a ventilación mecánica y de delirio, la estancia y la mortalidad en UCI y hospitalaria14,25–46. Dado el importante impacto que han reflejado los numerosos estudios publicados en estos últimos años el grado de recomendación de los PAS y de algunas de sus intervenciones se ha incrementado notablemente y se han incorporado a guías de práctica clínica elaboradas por distintas sociedades científicas1,2,4,5,7,47–52.
La normalización de las prácticas de analgosedación en todos los pacientes que ingresan en la UCI mediante la elaboración de protocolos, permite ajustar las dosis de analgosedación para alcanzar un nivel óptimo, desarrollar una práctica basada en la evidencia, disminuir la variabilidad de la actividad asistencial y facilitar la formación del personal de nueva incorporación. Estos protocolos se deben elaborar desde una perspectiva multidisciplinar, adaptándolos a la infraestructura particular de cada centro y al tipo de paciente, centrándose primero en la analgesia y a continuación en la sedación, basándose en una adecuada monitorización del nivel de analgesia, sedación y la presencia de delirio mediante el uso de escalas validadas, e incluir la definición de objetivos de analgesia y sedación y reevaluación periódica de los mismos1,2,4–7,47–52. En estos protocolos nuestra profesión tiene un papel fundamental, ya que son las enfermeras de intensivos las que valoran continuamente al paciente, detectan cualquier cambio en su estado, le realizan cuidados que pueden ocasionarle molestias y dolor, le administran los fármacos analgésicos y sedantes necesarios y monitorizan sus efectos y eficacia13. De ahí la importancia de desarrollar protocolos de analgesia y sedación multidisciplinares guiados por las enfermeras, que permitan prevenir la sobresedación, mantener una sedación ligera el mayor tiempo posible y dinámica, que se adapte a las necesidades del paciente a lo largo del día, garantizando su bienestar y seguridad. En estos protocolos las enfermeras reajustan las dosis de los fármacos analgésicos y sedantes en función de las necesidades del paciente en cada momento del día, para alcanzar un objetivo de analgesia y sedación previamente definido por el equipo, mediante una estrecha monitorización de la analgesia y la sedación con herramientas validadas25–46.
Para mejorar las prácticas de analgosedación y los resultados en nuestros pacientes, se llevó a cabo la implementación de un PAS, que se realizó de forma progresiva debido al importante cambio en la forma de trabajo que implica la implementación de este tipo de protocolos, como es pasar de la praxis habitual en la que las enfermeras informan sobre el nivel de analgosedación a los médicos que indican la intervención, al manejo autónomo por parte de las enfermeras de las dosis de analgosedación, en base a algoritmos para alcanzar los objetivos preestablecidos. En una primera fase nuestro objetivo a alcanzar fue conseguir la evaluación sistemática de objetivos y grado de analgesia y sedación en el paciente crítico con VM, con el fin de:
- -
Mejorar los resultados en los pacientes, disminuir los tiempos de ventilación y sedación, las dosis de analgesia y sedación en infusión, la estancia y la mortalidad en UCI y hospitalaria.
- -
Incrementar la monitorización de la analgosedación.
Se realizó un estudio de cohorte en dos periodos. En el periodo preintervención, en el que se aplicó la praxis habitual de analgosedación, los datos se recogieron retrospectivamente mediante la revisión de historias clínicas de los pacientes ingresados en la UCI polivalente del Hospital 12 de Octubre del 1 de marzo al 30 de noviembre de 2013, que cumplían los criterios de inclusión posteriormente explicados. En el periodo postintervención los datos se recogieron prospectivamente, tras iniciar la implementación del PAS, del 1 marzo al 30 de noviembre de 2014. En ambos periodos de estudio el proceso de destete de la VM se realizó de la misma forma, siguiendo el criterio del facultativo responsable. El ámbito de estudio fue la UCI médico-quirúrgica de adultos de un hospital de tercer nivel que cuenta con 14 camas de cuidados intensivos y 3 de cuidados intermedios y da cobertura a toda la población adulta con patología médico-quirúrgica grave, salvo pacientes con cardiopatía o enfermedad traumática, del área de referencia. Los sujetos de estudio fueron todos los pacientes ingresados en el periodo estudiado que cumplieron los siguientes criterios:
- -
Criterios de inclusión: pacientes adultos con edad mayor o igual 18 años, que precisen VM 24 h o más y administración de sedación en infusión continua.
- -
Criterios de exclusión: pacientes que no se pueden comunicar por desconocimiento del idioma, trasladados desde otra institución donde se haya administrado sedación y aplicado VM más de 24 h, ingresados a cargo de otra UCI (periféricos), con limitación del esfuerzo terapéutico, embarazadas, en estatus epiléptico, reanimados tras parada cardiorrespiratoria, con enfermedad severa del SNC y/o hipertensión intracraneal y Glasgow al ingreso menor o igual a 8.
- 1.
Capacitación y sensibilización: para implementar este tipo de protocolos se precisa una capacitación y sensibilización previa sobre el importante papel de las enfermeras en los PAS, que se realizó mediante el desarrollo de 9 sesiones formativas de 5h de duración, así como con la entrega pre- y posformación de un cuestionario sobre conocimientos, percepción de tu unidad y opinión en cuanto a la valoración y el manejo de la analgesia, sedación y delirio del paciente crítico. A estas sesiones asistieron de forma voluntaria enfermeras de todo el área de críticos, en concreto de la UCI, a estudiar asistieron el 66% (33) de las enfermeras de la plantilla. Para conseguir la sensibilización también de los médicos al respecto se pasó el cuestionario entre todos los médicos del servicio de medicina intensiva contestando el 62% (5) de los médicos de la UCI a estudiar.
- 2.
Elaboración y difusión del PAS: se creó un grupo de analgosedación multidisciplinar que elaboró el PAS en base a las recomendaciones dadas por la evidencia científica. El protocolo incluía algoritmos de: elección de fármacos, monitorización de analgesia, sedación y delirio, manejo de la analgesia en infusión, retirada de la analgesia en infusión, sedación superficial-sedación dinámica, sedación moderada profunda-prevención de sobresedación, sedación difícil, retirada de la sedación, valoración y diagnóstico del delirio, tratamiento del delirio, síndrome de deprivación alcohólica y bloqueo neuromuscular. Se presentó el protocolo a la totalidad de la plantilla de enfermeras mediante 20 sesiones de 60 min de duración en turno de mañana y tarde y mediante una sesión para los intensivistas del servicio. Se utilizó cartelería de pared, dípticos y trípticos de escalas de sedación, analgesia y delirio, así como distintos algoritmos de bolsillo, que se colocaron también adheridos en las carpetas de las historias clínicas. Se creó un grupo de enfermeras para que actuaran como líderes locales a pie de cama, resolviendo dudas y guiando al equipo al inicio de la implementación. Se elaboró una base de datos de ACCESS en la que se recogieron todas las variables de análisis.
- 3.
Implementación: la primera semana se incrementó la plantilla de enfermeras de mañana y tarde en una presencia más, con una enfermera líder local a pie de cama. A los tres meses del inicio de la implementación se realizó un feed-back de la adhesión al protocolo y un cuestionario entre las enfermeras para conocer las barreras ante la implementación del protocolo y las posibles medidas de mejora. Se monitorizó la adhesión al protocolo mediante un checklist en cortes semanales de junio a noviembre de 2014. Se implementaron distintas medidas de mejora en estos meses para incrementar la adhesión al protocolo como: feed-back de los resultados del cuestionario sobre barreras y medidas de mejora propuestas para incrementar la adhesión al PAS entre la totalidad de la plantilla de enfermeras en 20 sesiones de 40min y una sesión dirigida a médicos del servicio, incorporación en la plantilla de tratamiento médico del objetivo de sedación, normalización de los momentos de mayor comunicación con sesiones de enfermería al inicio de cada turno y sesiones conjuntas de médicos y enfermeras a pie de cama por turno, checklist de objetivos diarios del tratamiento del paciente en la sesión conjunta del turno de mañana, comentarios sobre temas de analgesia y sedación en la sesión de sala.
- -
Frecuencia de monitorización de sedación con Richmond Agitation-Sedation Scale (RASS)53 o índice biespectral (BIS)54 y analgesia con escala verbal numérica (EVN)55 o escala indicadora de conductas dolorosas (ESCID)56.
- -
Tiempo de ventilación mecánica (TVM): días transcurridos desde el inicio de la ventilación mecánica invasiva en la UCI hasta el inicio del destete.
- -
Tiempo de destete (TD): días transcurridos desde que se aplica una presión soporte menor o igual a 12 que lleve al paciente a la desconexión definitiva de la VM, hasta que se inicie la última prueba de ventilación espontánea, bien con tubo T o presión soporte menor o igual a 8.
- -
Tiempo de soporte ventilatorio (TSV): sumatorio del TVM y el TD.
- -
Tiempo de vía aérea artificial (TVAA): días durante los cuales el paciente es portador de una vía aérea artificial en la UCI.
- -
Densidad de incidencia de reintubación por fracaso de extubación: reintubaciones producidas en las 48 h siguientes a la extubación entre el TVAA.
- -
Tiempo de sedación: días en los que el paciente recibe cualquier fármaco sedante en infusión.
- -
Dosis diaria en infusión de: midazolam, propofol, clonidina, remifentanilo, fentanilo y cloruro mórfico.
- -
Frecuencia de uso de fármacos: midazolam, propofol, dexmedetomidina, clonidina, remifentanilo, fentanilo, cloruro mórfico, tramadol, paracetamol, metamizol, dexquetoprofeno, clorazepato dipotásico, loracepam, bromacepam y haloperidol.
- -
Estancia en UCI y hospitalaria.
- -
Mortalidad en UCI y hospitalaria.
- -
Variables demográficas: edad y sexo.
- -
Variables clínicas: motivo de ingreso (patología respiratoria, neurológica, digestiva, infecciosa, cardiovascular, posquirúrgicos, otros), APACHE II al ingreso, TISS28 al ingreso, uso de relajantes neuromusculares en infusión continua (no uso, sí uso), consumo de drogas (no consumo, sí consumo) estrategia de sedación (corta duración o menor o igual a 72 h, larga duración mayor de 72 h).
- -
Variables checklist seguimiento adhesión al PAS: monitorización según protocolo de ESCID o EVN, RASS y BIS, registro objetivo de sedación, objetivo de sedación alcanzado.
Para valorar el nivel de sedación se utilizó la escala RASS53, salvo cuando los pacientes recibieron relajantes neuromusculares, que se monitorizó el BIS54. Para valorar el dolor y la eficacia del tratamiento analgésico se empleó la EVN55 en pacientes comunicativos y la ESCID56 en pacientes no comunicativos. Todos estos instrumentos de medida son herramientas validadas con un fuerte grado de recomendación.
Consideraciones éticasSe solicitó la aprobación del Comité Ético de Investigación Clínica del hospital, quien nos indicó que al tratarse de un estudio que evaluaba la implementación de un protocolo que mejoraba las prácticas de analgosedación de todos los pacientes ingresados en la UCI no se precisaba su aprobación para el estudio.
Asimismo a los familiares directos o a los propios pacientes, cuando fue posible, reclutados en la fase prospectiva tras implementar el PAS, se les solicitó la aprobación del uso de los datos de su historia clínica mediante un consentimiento informado genérico que se les entrega al ingresar en la UCI de forma rutinaria y recoge las prácticas de analgosedación, entre otros asuntos.
Análisis estadísticosLas variables cualitativas se describieron mediante su distribución de frecuencias (frecuencia relativa y absoluta). Las variables cuantitativas se resumieron mediante sus medidas de tendencia central (media o mediana), acompañadas de una medida de dispersión (desviación estándar o rango intercuartílico). Se exploró y comprobó la normalidad de las muestras de las variables estudiadas mediante el test de Kolmogorov-Smirnov. En la comprobación de la homogeneidad de los grupos se utilizó chi cuadrado. Para conocer como influyó el PAS en la monitorización de las escalas de analgesia y sedación, los tiempos de ventilación y sedación, las dosis de fármacos, la estancia en UCI y hospitalaria se utilizó Kruskal Wallis. El análisis del efecto del PAS en la frecuencia de uso de los distintos fármacos analgésicos y sedantes, la densidad de incidencia de reintubación, la mortalidad en UCI y hospitalaria se realizó con chi cuadrado. Todos los análisis se efectuaron con el paquete estadístico STATA®.
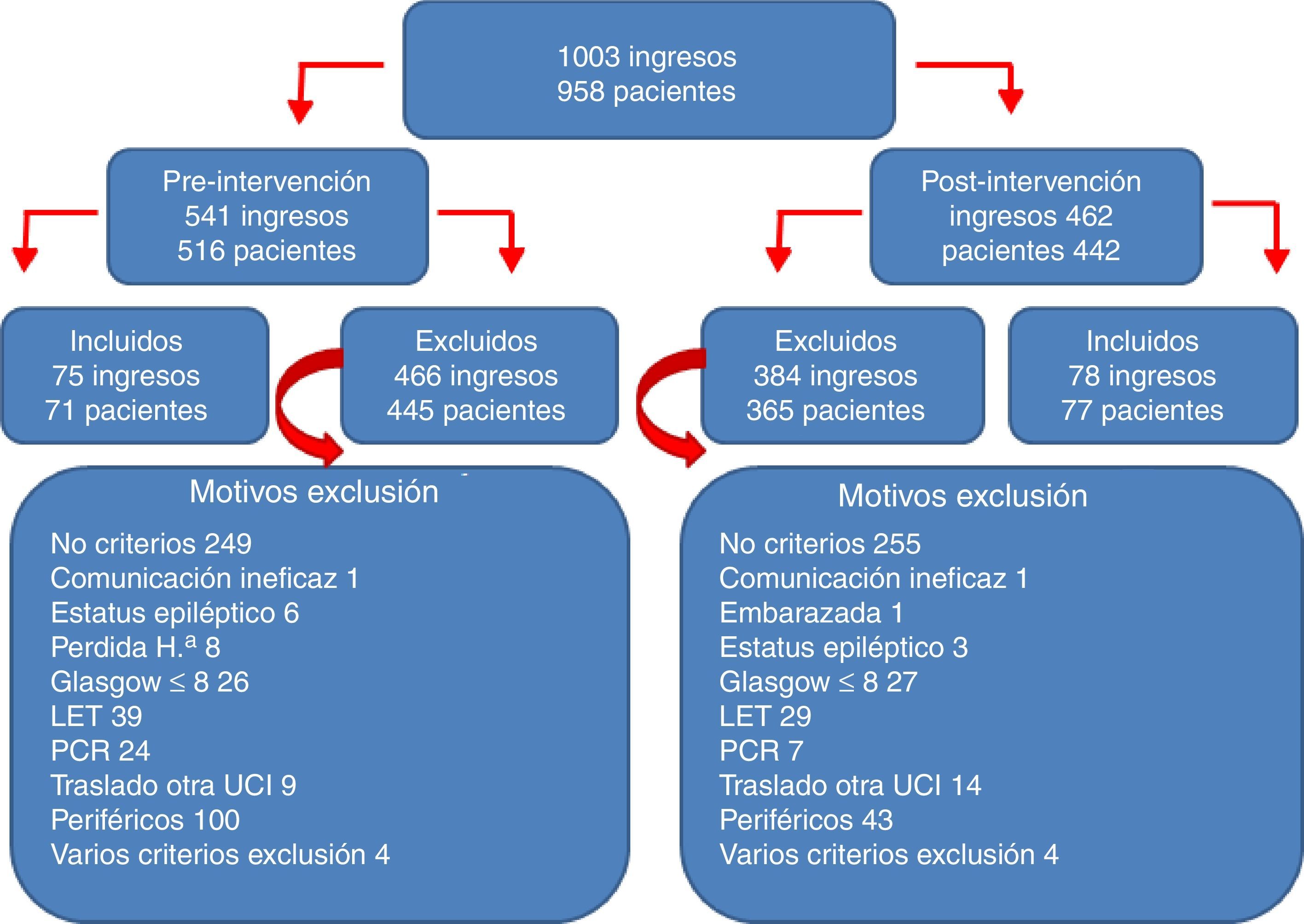
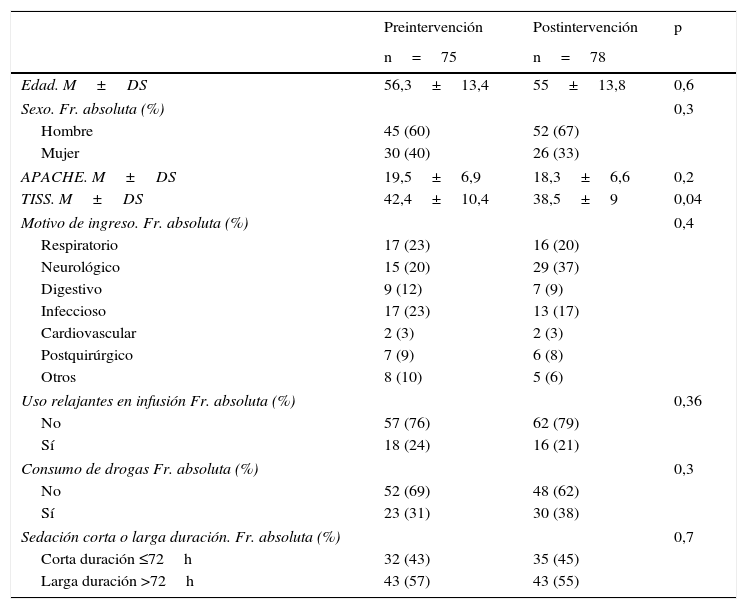
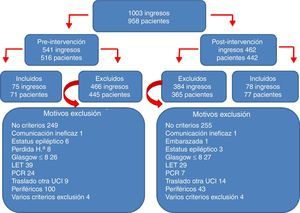
ResultadosEn el periodo de estudio se produjeron 1.003 ingresos: 541 en el periodo previo a la implementación del PAS (periodo preintervención), y 462 tras iniciar su implementación (periodo postintervención). De todos estos ingresos se incluyeron en el estudio 153 correspondientes a 148 pacientes. El algoritmo de los pacientes incluidos y excluidos en el estudio, junto con los motivos de exclusión, se reflejan en la figura 2. El 63% fueron hombres, la edad media fue de 55,7±13,6 años, el APACHE de 18,9±6,8 y el TISS28 de 40,4±9,9. Ambos grupos de estudio pre- y postintervención fueron homogéneos como se refleja en la tabla 1 (características de los pacientes pre- y postintervención).
Características de los pacientes pre- y postintervención
| Preintervención | Postintervención | p | |
|---|---|---|---|
| n=75 | n=78 | ||
| Edad. M±DS | 56,3±13,4 | 55±13,8 | 0,6 |
| Sexo. Fr. absoluta (%) | 0,3 | ||
| Hombre | 45 (60) | 52 (67) | |
| Mujer | 30 (40) | 26 (33) | |
| APACHE. M±DS | 19,5±6,9 | 18,3±6,6 | 0,2 |
| TISS. M±DS | 42,4±10,4 | 38,5±9 | 0,04 |
| Motivo de ingreso. Fr. absoluta (%) | 0,4 | ||
| Respiratorio | 17 (23) | 16 (20) | |
| Neurológico | 15 (20) | 29 (37) | |
| Digestivo | 9 (12) | 7 (9) | |
| Infeccioso | 17 (23) | 13 (17) | |
| Cardiovascular | 2 (3) | 2 (3) | |
| Postquirúrgico | 7 (9) | 6 (8) | |
| Otros | 8 (10) | 5 (6) | |
| Uso relajantes en infusión Fr. absoluta (%) | 0,36 | ||
| No | 57 (76) | 62 (79) | |
| Sí | 18 (24) | 16 (21) | |
| Consumo de drogas Fr. absoluta (%) | 0,3 | ||
| No | 52 (69) | 48 (62) | |
| Sí | 23 (31) | 30 (38) | |
| Sedación corta o larga duración. Fr. absoluta (%) | 0,7 | ||
| Corta duración ≤72h | 32 (43) | 35 (45) | |
| Larga duración >72h | 43 (57) | 43 (55) | |
DS: desviación estándar; Fr: frecuencia; M: media.
La implementación del PAS no modificó significativamente los tiempos de ventilación y sedación, como se refleja en la tabla 2 (tiempos de ventilación, sedación y reintubación pre- y postintervención), pero descendió el TVM, TSV y tiempo de sedación. El TD y el TVAA se incrementó probablemente porque casi se duplicó el número de pacientes ingresados por patología neurológica en el periodo postintervención, como se refleja en la tabla 1. La densidad de incidencia de reintubación por fracaso de la extubación también disminuyó, pasando de 4,3 a 2,5 casos por cada 1.000 días de vía aérea artificial (tabla 2).
Tiempos de ventilación, sedación y reintubación pre- y postintervención
| Preintervención | Postintervención | P | |
|---|---|---|---|
| n=75 | n=78 | ||
| TVM días. Me(IQR) | 4,08 (1,46-9,26) | 3,21 (1,41-8,13) | 0,7 |
| TD días Me(IQR) | 0,73 (0,17-2,13) | 1,04 (0,04-2,79) | 0,9 |
| TSV días Me(IQR) | 4,71 (2,13-9,27) | 4,29 (1,75-10) | 0,7 |
| TVAA días Me(IQR) | 5,19 (3,44-11,29) | 7,52 (2,49-15,42) | 0,8 |
| Tiempo sedación días Me(IQR) | 6 (3-11) | 5 (3-11) | 0,9 |
| Reintubación por fracaso de extubación | 0,83 | ||
| Casos fr. absoluta(%) | 5 (7) | 2 (3) | |
| Densidad de incidencia (n.° casos por cada 1.000 días de VAA) | 4,3 | 2,5 |
Fr: frecuencia; IQR: rango intercuartílico; Me: mediana; TD: tiempo de destete; TSV: tiempo de soporte ventilatorio; TVAA: tiempo de vía aérea artificial; TVM; tiempo de ventilación mecánica; VAA: vía aérea artificial.
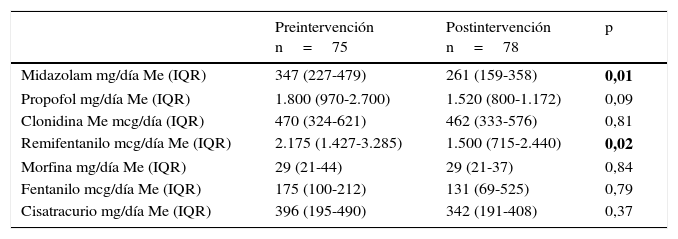
Las dosis de fármacos sedantes, analgésicos y relajantes neuromusculares en infusión descendieron tras la implementación del PAS, como se refleja en la tabla 3 (dosis de sedación, analgesia y relajación en infusión pre- y postintervención) y esta reducción fue significativa para la administración de midazolam y remifentanilo en infusión continua.
Dosis de sedación, analgesia y relajación en infusión pre- y postintervención
| Preintervención n=75 | Postintervención n=78 | p | |
|---|---|---|---|
| Midazolam mg/día Me (IQR) | 347 (227-479) | 261 (159-358) | 0,01 |
| Propofol mg/día Me (IQR) | 1.800 (970-2.700) | 1.520 (800-1.172) | 0,09 |
| Clonidina Me mcg/día (IQR) | 470 (324-621) | 462 (333-576) | 0,81 |
| Remifentanilo mcg/día Me (IQR) | 2.175 (1.427-3.285) | 1.500 (715-2.440) | 0,02 |
| Morfina mg/día Me (IQR) | 29 (21-44) | 29 (21-37) | 0,84 |
| Fentanilo mcg/día Me (IQR) | 175 (100-212) | 131 (69-525) | 0,79 |
| Cisatracurio mg/día Me (IQR) | 396 (195-490) | 342 (191-408) | 0,37 |
IQR: rango intercuartílico; Me: mediana.
Los valores en negrita tratan de resaltar las variables en las que existe significación entre el periodo pre y post-intervención.
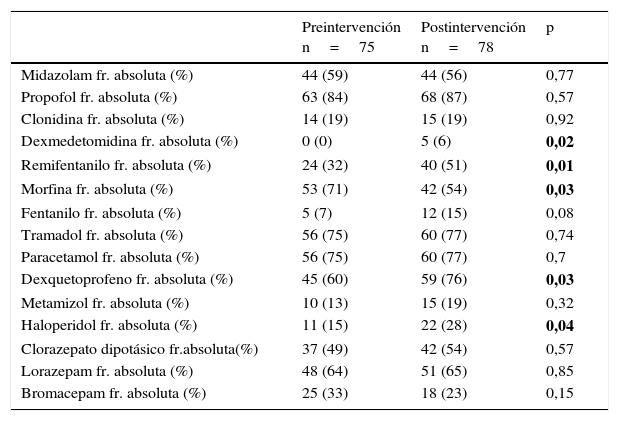
La frecuencia de uso de los distintos fármacos sedantes, analgésicos y antipsicóticos se varió tras la implementación del PAS. En concreto este cambio fue significativo en la administración de remifentanilo, dexmedetomidina, dexquetoprofeno y haloperidol incrementándose su uso y de cloruro mórfico disminuyéndose, como se puede observar en la tabla 4 (frecuencia de uso de sedantes, analgésicos y antipsicóticos).
Frecuencia de uso de sedantes, analgésicos y antipsicóticos pre- y postintervención
| Preintervención n=75 | Postintervención n=78 | p | |
|---|---|---|---|
| Midazolam fr. absoluta (%) | 44 (59) | 44 (56) | 0,77 |
| Propofol fr. absoluta (%) | 63 (84) | 68 (87) | 0,57 |
| Clonidina fr. absoluta (%) | 14 (19) | 15 (19) | 0,92 |
| Dexmedetomidina fr. absoluta (%) | 0 (0) | 5 (6) | 0,02 |
| Remifentanilo fr. absoluta (%) | 24 (32) | 40 (51) | 0,01 |
| Morfina fr. absoluta (%) | 53 (71) | 42 (54) | 0,03 |
| Fentanilo fr. absoluta (%) | 5 (7) | 12 (15) | 0,08 |
| Tramadol fr. absoluta (%) | 56 (75) | 60 (77) | 0,74 |
| Paracetamol fr. absoluta (%) | 56 (75) | 60 (77) | 0,7 |
| Dexquetoprofeno fr. absoluta (%) | 45 (60) | 59 (76) | 0,03 |
| Metamizol fr. absoluta (%) | 10 (13) | 15 (19) | 0,32 |
| Haloperidol fr. absoluta (%) | 11 (15) | 22 (28) | 0,04 |
| Clorazepato dipotásico fr.absoluta(%) | 37 (49) | 42 (54) | 0,57 |
| Lorazepam fr. absoluta (%) | 48 (64) | 51 (65) | 0,85 |
| Bromacepam fr. absoluta (%) | 25 (33) | 18 (23) | 0,15 |
fr: frecuencia.
Los valores en negrita tratan de resaltar las variables en las que existe significación entre el periodo pre y post-intervención.
La implementación del PAS también disminuyó la estancia hospitalaria, la mortalidad en UCI y hospitalaria, pero no se consiguió significación estadística, como muestra la tabla 5 (estancia y mortalidad en UCI y hospitalaria).
Estancia y mortalidad en UCI y hospitalaria
| Preintervención n=75 | Postintervención n=78 | p | |
|---|---|---|---|
| Estancia UCI días Me (IQR) | 10 (6-17) | 10 (5-18) | 0,90 |
| Estancia hospitalaria días Me (IQR) | 29 (18-52) | 25 (14-41) | 0,15 |
| Mortalidad UCI fr. absoluta (%) | 6 (8) | 4 (5) | 0,48 |
| Mortalidad hospitalaria fr. absoluta % | 8 (11) | 7 (9) | 0,80 |
Fr: frecuencia; IQR: rango intercuartílico; Me: mediana.
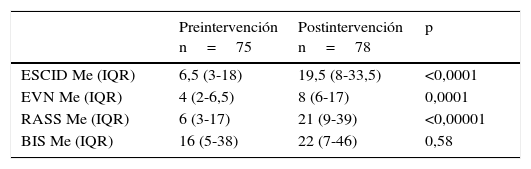
La correcta monitorización del dolor y la sedación se incrementó significativamente, aumentando la frecuencia de registro de las escalas RASS, ESCID y EVN tras la implementación del PAS, como se refleja en la tabla 6.
Frecuencia de monitorización de analgesia y sedación pre- y postintervención
| Preintervención n=75 | Postintervención n=78 | p | |
|---|---|---|---|
| ESCID Me (IQR) | 6,5 (3-18) | 19,5 (8-33,5) | <0,0001 |
| EVN Me (IQR) | 4 (2-6,5) | 8 (6-17) | 0,0001 |
| RASS Me (IQR) | 6 (3-17) | 21 (9-39) | <0,00001 |
| BIS Me (IQR) | 16 (5-38) | 22 (7-46) | 0,58 |
IQR: rango intercuartílico; Me: mediana.
La monitorización de ESCID o EVN, RASS y BIS se realizó según protocolo, es decir cada 4 h si el paciente recibía analgesia y/o sedación en infusión y estaba en el objetivo o cada 2 h si no alcanzaba el objetivo establecido, respetando descanso nocturno, o 2 h antes de la administración cuando el paciente recibía analgesia convencional, en un 64, 71 y 77% respectivamente, de los pacientes evaluados en los cortes semanales realizados para conocer la adhesión al PAS. El objetivo de sedación se registró en el 86% de los pacientes evaluados que recibían sedación en infusión durante dichos cortes. El paciente se encontraba en el objetivo de sedación establecido en el 55% de los casos analizados en el checklist de seguimiento de adhesión al protocolo.
DiscusiónA pesar de que en estos últimos años se ha producido un aumento en la implementación de los PAS, debido a su importante impacto demostrado en numerosos estudios25–46 y al incremento en el grado de recomendación e incorporación de sus intervenciones en múltiples guías de práctica clínica1,2,4,5,7,47–52, actualmente existe una amplia brecha entre la práctica asistencial y las recomendaciones dadas por la evidencia científica. La implementación de estos protocolos aún continúa siendo escasa, encontrándose en torno al 47-60%57–61. Metha et al. en su revisión publicada en 2006 identificaron que menos del 50% de los clínicos usaban protocolos de sedación3. Jackson et al. en su revisión sistemática sobre la incidencia de sedación subóptima en la UCI identificaron una preocupante incidencia de sobresedación entorno al 40-60% de las valoraciones realizadas17.
Probablemente uno de los motivos que justifican esta amplia brecha es el importante cambio en la práctica asistencial que supone la implementación de este tipo de protocolos. Las barreras a salvar para implementar con éxito estos protocolos son muy numerosas y ya han sido descritas, entre ellas se encuentran: el apoyo institucional, los conocimientos y actitudes necesarias, el nivel de experiencia y entrenamiento, el modelo de UCI abierto o cerrado, la ratio enfermera-paciente, la carga de trabajo, la gravedad del paciente, el pensamiento médico de que su implementación puede favorecer la sobresedación, la ausencia de órdenes médicas, la autonomía de las enfermeras, el trabajo en equipo y la calidad de la comunicación entre los miembros del equipo asistencial57-59,62–65. Todas estas barreras deben identificarse rápidamente y superarse a nivel institucional. Quizá la primera y más importante dificultad a salvar sea la necesidad de formación del equipo asistencial sobre herramientas validadas para monitorizar la analgesia, sedación y el delirio y el manejo de fármacos analgésicos y sedantes. En concreto a nivel nacional estos conocimientos no se adquieren en la formación pregrado y actualmente aún no se ha desarrollado la especialidad de enfermería de cuidados críticos. Por otro lado una vez salvada la dificultad de adquirir la correcta capacitación del equipo se debe hacer frente a la necesidad de conseguir que los médicos confíen en la capacitación y eficacia de las enfermeras para guiar la analgesia y sedación, ya que hasta ahora siempre ha sido una actividad exclusiva y formalmente suya. Por estos motivos los estudios publicados sobre la implementación de PAS, igual que nuestro estudio, incluyen un programa de formación para el equipo asistencial, previo a la implementación. En ellos se utilizan distintas estrategias de formación y difusión de los conocimientos, a modo de sesiones, cartelería, dípticos o trípticos de bolsillo, líderes locales a pie de cama… etc.30,32,39,40,43,66. En algunos estudios el periodo preintervención se sigue de la formación, difusión e implementación del PAS y a continuación se inicia el periodo postintervención30–32,39. En nuestro estudio, la difusión del PAS se realizó después de la serie preintervención y la implementación durante la postintervención. Este hecho consideramos que podría haber influido en la magnitud de nuestros resultados, pero por otro lado tras la implementación del PAS, hemos podido observar que para mantener y mejorar la adhesión al mismo se precisa la introducción periódica de medidas de mejora continua, que recuerden la importancia de la correcta implementación. Nuestro PAS es muy amplio, abarca un abordaje integral de todas las estrategias de analgosedación y control del delirio, y de ahí que surgiera la necesidad de que dicha implementación fuera progresiva en varias fases, una primera para conseguir la monitorización y el trabajo con objetivos y una segunda que permitiera la implementación de algoritmos de manejo de la analgesia, sedación y delirio5. Además para garantizar un adecuada adhesión a los PAS se recomienda incluir auditorías y feedback periódicos66 que incorporen, como ya hemos dicho, medidas de mejora continuas, que favorezcan la comunicación fluida y el trabajo en equipo. Sin embargo, el resultado de estas auditorías no se plasma en la mayoría de los estudios sobre implementación de PAS31, algo que sí queda reflejado en nuestro estudio, ya que consideramos necesario conocer el grado de cumplimiento del PAS para determinar su impacto.
Este estudio muestra que tras la implementación de un PAS mejora llamativamente la monitorización de la analgosedación y el establecimiento de objetivos de sedación. Conseguir este primer paso ha mejorado la seguridad de nuestras prácticas de analgosedación. Se comienza a observar el cambio en la filosofía de la sedación del paciente crítico priorizando la analgesia frente a la sedación, ya que se incrementó el uso de fentanilo, remifentanilo en infusión y de la analgesia convencional y se disminuyeron las dosis de todos los analgésicos y sedantes en infusión, con significación en la administración de midazolam y remifentanilo. Estos resultados confirman los ya descritos previamente5,26,29,31–33,35–44,46 en cuanto a que la mejora de la monitorización del dolor, la sedación y el trabajo con objetivos de sedación, optimiza las dosis de estos fármacos, mejorando el bienestar y control del dolor. Aunque no se consiguió un descenso significativo de los tiempos de ventilación, sedación y del fracaso de la extubación, como en otros estudios25–34,37,39,41,43,45,46, los resultados mejoraron durante la implementación del PAS. No haber conseguido significación podría justificarse porque no se alcanzó el manejo autónomo de las dosis de fármacos sedantes y analgésicos por parte de las enfermeras en base a la implementación de algoritmos, como en otros estudios25–46 y porque nuestros criterios de exclusión son menos restrictivos que otros29,33–35,43,45, se han incluido pacientes neurocríticos, con relajantes neuromusculares, traqueostomizados, insuficiencia hepática y renal, abuso de drogas y reingresos. El número de ingresos por patología neurológica se duplicó en el periodo postintervención, lo que puede explicar el incremento en el tiempo de destete y de vía aérea artificial tras la intervención. El uso de clorazepato dipotásico se incrementó sin significación, puesto que forma parte del algoritmo de retirada lenta de la sedación en infusión, pero también se incrementó significativamente el uso de haloperidol, incluido solo en los algoritmos de sedación difícil y tratamiento del delirio. Probablemente, aunque no fue un objetivo de esta fase de nuestro estudio, al incluir el PAS algoritmos de diagnóstico precoz, monitorización y tratamiento del delirio, el equipo se haya capacitado y sensibilizado sobre la importancia de su identificación y tratamiento precoz, traduciéndose este hecho en un aumento del uso de psicofármacos. En estudios previos la implementación de PAS ha mostrado un descenso de la estancia en UCI y hospitalaria25,26,28,29,31–33,37–39,41,45,46 y de la mortalidad28,32,39,45,67. Sin embargo en este estudio como en algunos otros, estos tiempos disminuyeron sin significación27,42–44.
Este estudio nos abre el camino hacia una analgosedación más segura, sentándose las bases fundamentales para ello, como son conocer el nivel de dolor y sedación que tienen los pacientes y el que queremos que tengan, como un objetivo a perseguir mediante el ajuste de las dosis de fármacos analgésicos y sedantes. De esta forma podremos aplicar una estrategia de analgosedación individualizada, dinámica, que se adapte a las necesidades del paciente en cada momento del día y reducir el riesgo de sobresedación. El importante cambio conseguido asegurando la monitorización del dolor y la sedación, y el trabajo con objetivos, tiene un impacto en los resultados de nuestros pacientes, pero no garantiza que alcancen el objetivo de sedación, como se demuestra en este y otros estudios67,68, para ello se hace necesario el ajuste de las dosis de estos fármacos en base a algoritmos predefinidos por las enfermeras, ya que al estar a pie de cama, identifican en todo momento las necesidades de analgesia y sedación del paciente y pueden responder de forma inmediata ante las mismas. La actividad asistencial de los médicos a veces condiciona la falta de tiempo para hacer modificaciones en las dosis de estos fármacos, lo que se traduce en una demora de las mismas69. Los PAS evitan la existencia de órdenes médicas para el ajuste de las dosis de analgosedación, esto reduce el tiempo transcurrido hasta que se modifican dichas dosis y en ocasiones evitan su uso intravenoso continuo innecesario31. Los PAS se pueden implementar de forma segura por enfermeras, permiten la toma de decisiones clínicas más rápidas a pie de cama, reducen los retrasos en el tratamiento y aseguran una atención estandarizada25–46.
Actualmente todos los estudios sobre la implementación de PAS guiados por enfermeras reflejan una mejora de la calidad de las prácticas de analgosedación y de los resultados en los pacientes25–46, salvo los estudios de Bucknall et al.70 y Elliot et al.71. Ambos estudios son realizados en Australia y aunque objetivan un incremento de los tiempos de ventilación y la estancia en UCI y hospitalaria tras la implementación de un PAS guiado por enfermeras, este aumento no es significativo, salvo en el caso de la estancia en UCI en el estudio de Elliot et al.71. El estudio de Bucknall et al.70 es un ensayo clínico aleatorizado (ECA) realizado en una UCI médico-quirúrgica y de trauma de un hospital universitario australiano. Al tratarse de un ECA realizado en una única UCI, puede implicar la contaminación de los distintos grupos de estudio cuando todas las enfermeras implementan las dos prácticas de analgosedación. En este estudio la praxis habitual del manejo de la analgosedación de las enfermeras ya incluía cierta autonomía en el ajuste de las dosis de fármacos analgésicos y sedantes, pero no de forma estandarizada. Además las enfermeras de UCI en Australia son especialistas en cuidados críticos, con una elevada capacitación para el manejo de la analgosedación y la VM, practican ampliamente la interrupción diaria de la sedación (IDS) y la ratio enfermera-paciente en las UCI es de 1-157,63,72.
La IDS es otra estrategia que permite el ajuste de las dosis de analgosedación y mejora los resultados en los pacientes ampliamente demostrada73–80. Augustes et al. en su metaanálisis sobre IDS81, muestra cómo esta estrategia no proporciona beneficios clínicos relevantes ni aumenta las complicaciones y llega a la conclusión de que el medio en el que se realiza la IDS (el tipo de paciente, las características de la unidad, el modo en que se utiliza la VM, los fármacos y ajuste de los mismos), influye de forma determinante en los resultados de la misma. Actualmente se han publicado estudios para tratar de identificar cuál es la estrategia de analgosedación que permite obtener mejores resultados, PAS guiados por enfermeras frente a protocolos con IDS82–85. Sin embargo, los resultados no son muy clarificadores, mientras que Wit et al.82 encuentran mejores resultados con un PAS guiado por enfermeras, Yiliaz et al.83 obtienen los resultados contrarios, y Mehta et al.84,85 en sus 2 estudios, no encuentran diferencias entre los resultados obtenidos por ambas estrategias, salvo un aumento de la carga de trabajo percibida por las enfermeras en el grupo de IDS. La mayoría de los estudios sobre IDS son ECA73–80, mientras que la mayoría sobre PAS son estudios de cohorte antes-después26-34,36–43,46. Existe dificultad para aplicar el mejor diseño a la hora de estudiar el impacto de los PAS. Para realizar un ECA sobre la implementación de PAS y evitar la contaminación de los grupos de estudio debería realizarse en UCI distintas con las mismas características, como es el último ECA publicado al respecto45, que no ha sido incluido en el único metaanálisis existente sobre PAS frente praxis habital, en el cual no se han obtenido diferencias significativas entre ambas estrategias12. Una reciente revisión sistemática sobre IDS y PAS guiados por enfermeras86 también refleja la ausencia de evidencias que demuestren la superioridad de una estrategia frente a otra, por este motivo en las últimas guías de práctica clínica publicadas en 20132,47, se recomienda el uso de ambas estrategias, incluso su asociación. Si bien es cierto que el modelo de trabajo, organización y la ratio enfermera-paciente de nuestras UCI probablemente se adapte mejor a la implementación de PAS guiados por enfermeras que a los protocolos con IDS, que parecen aumentar la carga asistencial, requieren muy buena optimización de los recursos, fluida comunicación y coordinación y un nivel más avanzado de capacitación de las enfermeras de cuidados críticos.
Por todos estos motivos anteriormente expuestos nos decidimos a llevar a cabo un PAS guiado por enfermeras y tras la fase inicial de su implementación hemos conseguido mejorar nuestras prácticas de analgosedación. Sin embargo, aunque se alcanzaron los objetivos propuestos en este estudio, asumimos los posibles sesgos que puede presentar, ya que no se trata del mejor diseño, así como esperamos en una segunda fase mejorar aún más los resultados en nuestros pacientes. Como posibles sesgos identificamos el hecho de que se realiza en único centro, las series son contemporáneas y al no tener informatizada la historia clínica esto supone la pérdida de datos en la serie retrospectiva. Además en la serie prospectiva se han incrementado, aunque sin significación, los ingresos de pacientes neurocríticos, lo que puede condicionar la heterogeneidad de las series de estudio. Probablemente hubiera sido interesante utilizar un análisis multivariante para conocer el impacto del PAS en los tiempos de ventilación, sedación, incidencia de neumonía asociada a ventilación mecánica y fracaso de la extubación, mortalidad y estancia en UCI y hospitalaria. Pero dado que el análisis bivariante no ha obtenido significación, se ha postergado dicho análisis para una fase más avanzada de la implementación del PAS, cuando se consiga el manejo autónomo por las enfermeras de la analgesia y la sedación, en base a algoritmos predefinidos.
ConclusionesComo conclusiones podemos decir que tras la implementación de un protocolo multidisciplinar de evaluación sistemática y manejo de la analgosedación se consigue incrementar la correcta monitorización del dolor y la sedación y dar a conocer los objetivos de analgesia y sedación, que el equipo asistencial quiere alcanzar en los pacientes. Hechos que se traducen en una mejora de la seguridad y calidad de las prácticas de analgosedación, priorizando la analgesia frente a la sedación, optimizando las dosis de analgésicos y sedantes y mejorando el bienestar, el control del dolor y los resultados en los pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el equipo multidisciplinar de la Unidad de Cuidados Intensivos de nuestro hospital, por su implicación y participación en la implantación del protocolo de analgosedación; y al servicio de estadística por su inestimable ayuda en el proceso de transcripción de los resultados.
Primer Premio SEEIUC 2015 a la Mejor comunicación oral presentada en el XLI Congreso Nacional de la Sociedad Española de Enfermería Intensiva y Unidades Coronarias (SEEIUC) celebrado en San Sebastián, 14-17 junio del 2015.