La reactivación del virus de la hepatitis B en pacientes tratados con quimioterapia es una complicación conocida. La incidencia y los factores de riesgo aún no están bien definidos. El objetivo de nuestro estudio es determinar la incidencia y los factores de riesgo de la reactivación del virus de la hepatitis B en pacientes tratados con rituximab (RTX), e investigar si la dosis acumulada de RTX es un factor de riesgo independiente para la reactivación del virus de la hepatitis B. Se revisaron de forma retrospectiva 320 pacientes tratados con RTX en nuestro hospital, de los cuales 42 (13,12%) tenían marcadores serológicos de hepatitis B. Durante el seguimiento, 9 (21%) de los 42 pacientes con marcadores serológicos del virus de la hepatitis B presentaron una reactivación. Los factores de riesgo para la reactivación del virus de la hepatitis B fueron la presencia de HBsAg positivo (p<0,05), anti-HBc aislado (p<0,05), el linfoma de la zona marginal y linfoma de células del manto (p<0,05) y la mediana de la dosis de rituximab tendió a ser mayor en los pacientes que presentaron reactivación (p=0,06).
Hepatitis B virus (HBV) reactivation after chemotherapy regimens is a well-known complication. The incidence and risk factors for HBV reactivation remain to be elucidated. We aimed to determine the incidence and risk factors for HBV reactivation in patients receiving rituximab, and the potential role of the cumulative rituximab dose in HBV reactivation. We retrospectively reviewed 320 patients receiving rituximab in our hospital. Of these, 42 (13.12%) had serological markers of hepatitis B. During follow-up, 21% (9/42) had HBV reactivation. Risk factors for reactivation were HBsAg positivity (p<0.05), isolated anti-HBc positivity (p<0.05), marginal zone lymphoma, and Mantle cell lymphoma (p<0.05). The median rituximab dose tended to be higher in patients with reactivation (p=0.06).
La reactivación del virus de la hepatitis B (VHB) en pacientes tratados con quimioterapia (QMT) es una complicación conocida que puede cursar desde formas asintomáticas hasta fallo hepático e incluso muerte1,2. En 2004, tras la publicación de 3 casos3–5 la FDA alertó sobre el riesgo de reactivación del VHB en pacientes que recibían rituximab (RTX) y solicitó la notificación de los nuevos casos, desde entonces se han publicado casos aislados y series de casos6–35. En 2011 se publicó un metaanálisis con el objeto de examinar la incidencia y las manifestaciones clínicas de la reactivación del VHB en pacientes que recibían tratamiento con RTX. La incidencia de reactivación del VHB en pacientes anti-HBc positivo varió entre 2,7-45%, siendo esta 5 veces mayor que en los pacientes que recibieron QMT sin RTX, con una mortalidad asociada entre 0-50%. La incidencia de reactivación del VHB en pacientes HBsAg positivo varió entre 16-80%31.
La reactivación del VHB depende en gran medida de la pérdida de un equilibrio entre el virus y el sistema inmune del huésped. Dentro de los factores de riesgo de reactivación asociados al virus se han descrito: la alta carga viral y los marcadores serológicos del VHB (HBs Ag positivo y anti-HBc positivo aislado)21,36,37 y como factores de riesgo asociados al huésped: el tratamiento con esteroides38, el tratamiento combinado con RTX y esteroides21,24, el diagnóstico de linfoma y el sexo masculino21,24.
Sin embargo, la incidencia y los factores de riesgo de la reactivación por VHB en los pacientes tratados con RTX no están bien definidos, y no existen estudios que hayan evaluado el efecto de las dosis acumuladas de RTX en el riesgo de reactivación. El objetivo de nuestro estudio fue por tanto determinar la incidencia y los factores de riesgo de la reactivación del VHB en pacientes tratados con RTX, e investigar si la dosis acumulada de RTX es un factor de riesgo para la reactivación del VHB.
Materiales y métodosSe revisaron de forma retrospectiva 320 pacientes tratados con RTX en nuestro hospital desde enero de 2003 hasta abril de 2011. La indicación del tratamiento fue por enfermedades hematológicas en 299 pacientes (93,5%) y por enfermedades autoinmunes en 21 pacientes (6,5%).
El RTX fue administrado a dosis de 375mg/m2, en la mayor parte de los casos combinado con QMT. Los esquemas de QMT administrados más frecuentes fueron CHOP-RTX (ciclofosfamida, doxorrubicina, vincristina y prednisona) y FC-RTX (fludarabina, ciclofosfamida).
Se investigó la presencia de HBsAg, anti-HBc y anti-HBs en los 320 pacientes tratados con RTX antes de la administración del mismo. Además se investigó la existencia de infección por el virus de la hepatitis C, virus de la hepatitis D y el VIH.
En los pacientes con marcadores serológicos de hepatitis B se calculó «la dosis acumulada de RTX», entendiéndose como tal la dosis total de RTX que los pacientes habían recibido al finalizar el tratamiento.
Se definió reactivación como el incremento de la replicación viral >1 log respecto a la carga viral basal, tanto en pacientes con infección crónica del VHB como en pacientes con infección pasada. Durante el seguimiento, se determinó la carga viral ante la sospecha diagnóstica de reactivación en el contexto de hipertransaminasemia. Además, se descartaron en todos los casos otras causas de hepatopatía: enfermedades metabólicas, autoinmunes, así como infección por otros virus hepatotropos y no hepatotropos.
Se excluyeron 2 pacientes que habían recibido tratamiento profiláctico con análogos de nucleós/tido antes de la administración de RTX. Uno de ellos, HBsAg positivo y linfoma folicular, recibió profilaxis con lamivudina; el otro paciente anti-HBc/anti-HBs positivo y enfermedad mixta del tejido conectivo, recibió profilaxis con entecavir. Ninguno presentó reactivación.
Se recogieron variables epidemiológicas, serológicas y clínicas como la edad, sexo, patrón serológico VHB, tipo de linfoma, título de anti-HBs, dosis de RTX recibida y esquema de tratamiento recibido.
Las variables categóricas fueron comparadas mediante la prueba de χ2 o Test de Fisher. Las variables cuantitativas se compararon mediante la prueba t de Student o U de Mann-Whitney. Se construyó una curva ROC para conocer la dosis de RTX con mejor sensibilidad y especificidad para predecir la reactivación.
ResultadosDe los 320 pacientes que fueron tratados con RTX, 42 tenían marcadores serológicos de hepatitis B (13,12%), 17 perfil serológico de vacunación VHB (5%), y en 20 (6%) no se había realizado serología basal. En el resto de los pacientes, los marcadores serólogicos de hepatitis B fueron negativos.
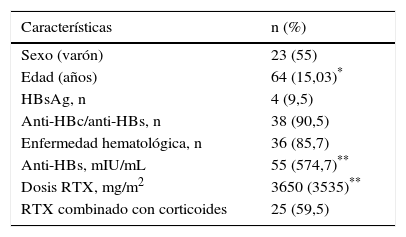
Las características basales de 42 los pacientes se resumen en la tabla 1.
Características de los pacientes tratados con RTX y marcadores VHB
De los 42 pacientes, 4 fueron HBsAg positivos, y 38 fueron anti-HBc/anti-HBs positivos, de estos 12 (32%) fueron anti-HBc positivo aislado y 26 (68%) anti-HBc/anti-HBs positivos.
El 85,7% (36/42) de los pacientes recibieron RTX por neoplasias hematológicas y el 14,3% (6/42) por enfermedades autoinmunes. Las neoplasias hematológicas más frecuentes fueron el linfoma folicular (26%), el linfoma B difuso de células grandes (14%), la leucemia linfocítica crónica (12%) y el linfoma B de la zona marginal (8%). El 54% de los pacientes eran varones y la edad media fue de 64±15 años. De los 6 pacientes con enfermedades autoinmunes, 3 presentaban artritis reumatoide, 2 púrpura trombocitopénica idiopática y uno dermatomiositis.
Los esquemas de QMT recibidos fueron CHOP-RTX en 59,5%, FC-RTX en 16,7%, RTX en el 19% y otros en el 4,8%. La mediana (RIC) de la dosis de RTX fue 3.650 (3.535) mg/m2. La mediana (RIC) del título de anti-HBs fue de 55 (574,7) mUI/mL.
Durante el seguimiento, 9 de los 42 pacientes con marcadores serológicos del VHB (21%) presentaron reactivación del VHB.
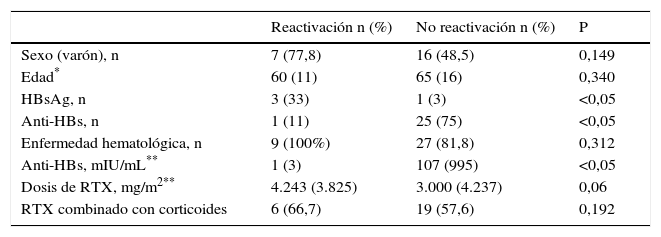
En el análisis univariante los factores asociados a la reactivación del VHB fueron: HBsAg positivo, anti-HBc aislado, el linfoma de la zona marginal y linfoma de células del manto y el título de anti-HBs; la mediana de la dosis de RTX tendió a ser mayor en los pacientes que presentaron reactivación (tabla 2).
Factores asociados a reactivación del VHB
| Reactivación n (%) | No reactivación n (%) | P | |
|---|---|---|---|
| Sexo (varón), n | 7 (77,8) | 16 (48,5) | 0,149 |
| Edad* | 60 (11) | 65 (16) | 0,340 |
| HBsAg, n | 3 (33) | 1 (3) | <0,05 |
| Anti-HBs, n | 1 (11) | 25 (75) | <0,05 |
| Enfermedad hematológica, n | 9 (100%) | 27 (81,8) | 0,312 |
| Anti-HBs, mIU/mL** | 1 (3) | 107 (995) | <0,05 |
| Dosis de RTX, mg/m2** | 4.243 (3.825) | 3.000 (4.237) | 0,06 |
| RTX combinado con corticoides | 6 (66,7) | 19 (57,6) | 0,192 |
A pesar de que la mayoría de las reactivaciones se produjeron en varones (77,8%), y que la edad de los pacientes que reactivaron fue superior, no se demostraron diferencias significativas.
En cuanto al HBsAg 33% presentaban HBsAg positivo en el grupo que reactivó, frente al 3% en el grupo que no reactivó (p<0,05). Solo el 11% de los pacientes que reactivaron presentaban AcHBs positivo frente al 75% de los que no reactivaron (p<0,05).
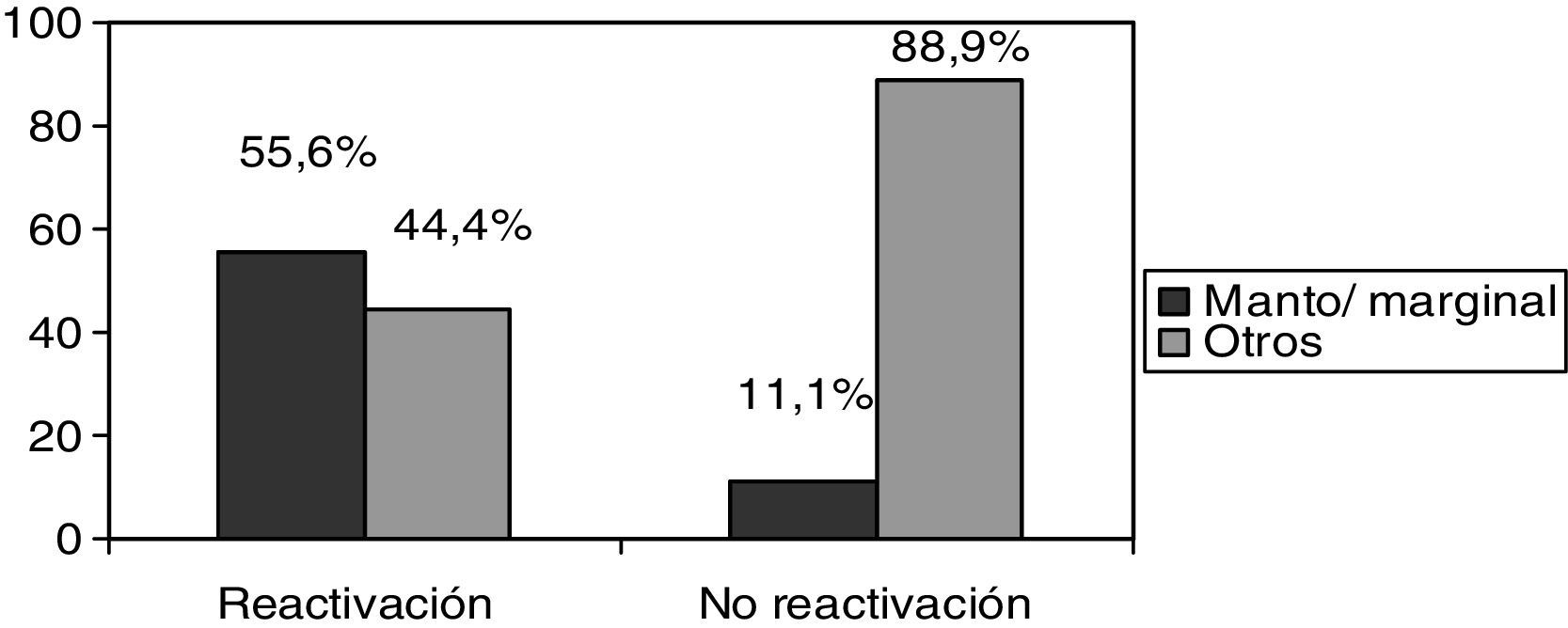
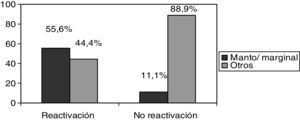
De los 9 pacientes que presentaron reactivación, todos presentaban neoplasias hematológicas y no apareció ningún caso de reactivación en los pacientes tratados con RTX por enfermedades autoinmunes. Además, los pacientes con linfomas de la zona marginal y de células del manto presentaron mayor riesgo de reactivación frente a pacientes con otros tipos de linfomas (55,6 frente a 11,1%; p<0,05) (fig. 1).
Todos los episodios de reactivación del VHB ocurrieron tras la suspensión del tratamiento con RTX y el tiempo medio de reactivación fue de 9 meses. De los 9 casos de reactivación, 6 ocurrieron tras finalizar el primer esquema (4 pacientes habían recibido CHOP-R y 2 FC-R), y 3 tras finalizar el segundo esquema (2 CHOP-R +R y 1 FC-R+R). No presentaron mayor riesgo de reactivación los pacientes que recibieron tratamiento con RTX combinado con corticoides (CHOP-R) frente a los que recibieron RTX sin corticoides (FC-R) (66,6 frente a 57,6%; p=0,192).
La evolución clínica de los 9 pacientes que presentaron reactivación fue: 2 pacientes fallecieron por insuficiencia hepática secundaria a la reactivación, 2 pacientes fallecieron por progresión de su enfermedad hematológica, y los 5 restantes están recibiendo tratamiento antiviral con respuesta virológica.
La mediana de anti-HBs fue de 1mUI/ml en los pacientes con reactivación y 107mUI/ml en los pacientes que no reactivación (p=0,037).
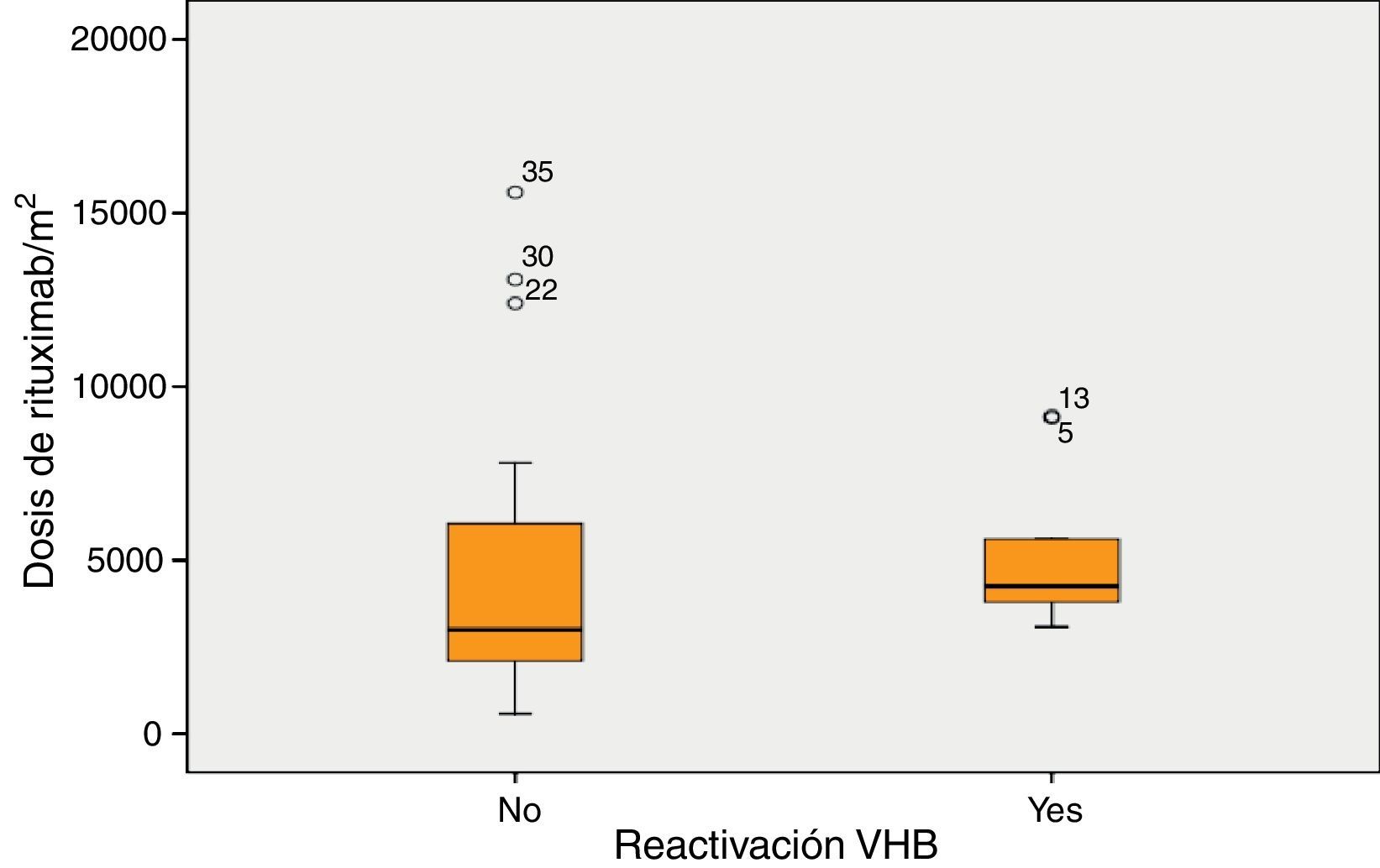
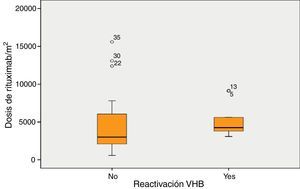
La mediana de la dosis de RTX fue 4.243mg/m2 en los pacientes que desarrollaron reactivación y 3.000mg/m2 en los pacientes que no desarrollaron reactivación (p=0,06) (fig. 2).
Según la curva ROC, la dosis de RTX a partir del cual existe mayor riesgo de reactivación es de 3.005mg/m2 (AUC del 66% IC 50-80%, una sensibilidad del 100% y una especificidad del 55%).
DiscusiónLa reactivación del VHB en pacientes tratados con QMT-RTX es una complicación conocida. Sin embargo, la incidencia y los factores de riesgo aún no están bien definidos.
El presente trabajo presenta la serie más amplia publicada a nivel nacional, y es muy posible que no se recojan nuevas series en el futuro como consecuencia de la extensión de la quimioprofilaxis. Como principal aportación, nos planteamos la hipótesis de si la dosis acumulada de RTX pudiera ser un factor de riesgo para la reactivación del VHB, factor no descrito en la literatura hasta la fecha.
Un punto importante de nuestra revisión es la elevada conciencia del problema que existe en nuestro centro, ya que tan solo en el 6% de los 320 pacientes no se había solicitado la serología del VHB antes del inicio del tratamiento con RTX. También destaca el bajo porcentaje de pacientes vacunados (5%), dato hasta cierto punto justificable por la elevada edad media de los pacientes del estudio.
La prevalencia de infección crónica (HBsAg positivo) en los pacientes que recibieron RTX fue del 1,25%, y la prevalencia de anti-HBc positivo fue del 11,8%, ambas se corresponden con la prevalencia que se describe en España39.
Globalmente la incidencia de la reactivación de la hepatitis B en nuestro estudio fue del 21% similar a la publicada previamente31.
En cuanto a los potenciales factores de riesgo para la reactivación del VHB en nuestro estudio, no obtuvimos diferencias significativas en cuanto al sexo, ni la edad, factores descritos como tales en estudios previos24. Es posible que estos resultados tengan que ver con el pequeño tamaño muestral de nuestro estudio.
Se confirma en nuestro estudio el hecho ampliamente conocido de que los pacientes HBsAg positivo presentan un riesgo elevado de reactivación del VHB36. Este dato ya era conocido en la era pre-RTX, recomendando las guías clínicas de la AASLD, EASL, así como la de la AEEH el tratamiento profiláctico antiviral en pacientes HBsAg positivo que fueran a recibir QMT con o sin RTX40–42.
Especial interés tienen los pacientes HBsAg negativo/anti-HBc positivo, ya que es en este grupo donde el riesgo de reactivación del VHB por RTX es hasta 5 veces mayor que si reciben QMT sin RTX31. Los resultados de nuestro estudio demuestran en este subgrupo de pacientes el efecto protector de los anti-HBs, y por tanto, el mayor riesgo de reactivación en los anti-HBc aislados24, hecho también descrito previamente y que ha originado la recomendación de realizar profilaxis con análogos en pacientes anti-HBc positivos si se detecta viremia positiva, e incluso valorar su empleo en los casos con viremia negativa en los que no sea posible una vigilancia estrecha40–42.
Todos los casos de reactivación ocurrieron tras la suspensión del tratamiento con RTX, siendo el tiempo medio de reactivación de 9 meses, resultado que apoya el hecho de que, al menos, el tratamiento antiviral profiláctico se debe mantener un año desde la finalización de la QMT- RTX40–42. Esto es debido a que durante la inmunosupresión inducida por la QMT (especialmente con el uso de anti-CD20 como RTX), aumenta la replicación del VHB y la infección de los hepatocitos; tras la finalización de la QMT y la posterior reconstitución inmune (que puede ocurrir hasta 9-12 meses tras la suspensión del RTX) las células inmunocompetentes atacan los hepatocitos infectados causando la recurrencia de la hepatitis B5.
De los 9 pacientes que presentaron reactivación todos ellos presentaban neoplasias hematológicas, no apareciendo ningún caso de reactivación en pacientes que fueron tratados con RTX por enfermedades autoinmunes. Es posible que este hecho tenga que ver con una menor inmunodepresión en el caso de enfermedades autoinmunes, frente a la combinación con QMT en las enfermedades hematológicas. Además, la suspensión combinada de la QMT-RTX en el contexto de neoplasias hematológicas garantizaría en mayor medida la reconstitución inmune, frente al mantenimiento de algún tipo de tratamiento inmunosupresor en pacientes con enfermedades autoinmunes.
También al estudiar el tipo de linfoma como factor de riesgo para la reactivación, observamos que los pacientes con linfomas de la zona marginal y los linfomas de células del manto presentaron mayor riesgo de reactivación, dato no descrito previamente en la literatura.
Por otro lado, en nuestro estudio no encontramos mayor riesgo de reactivación en pacientes que recibieron tratamiento combinado con corticoides a diferencia de otros trabajos previos21,24.
Por último y como conclusión de mayor relevancia en nuestro estudio, observamos que la mediana de la dosis de RTX tendió a ser mayor en los pacientes que presentaron reactivación. Por tanto a mayor dosis de RTX mayor riesgo de reactivación, este riesgo fue mayor con una dosis acumulada de RTX de 3.005mg/m2. Este dato puede explicar la no existencia de ningún caso de reactivación en pacientes que fueron tratados con RTX por enfermedades autoinmunes, ya que en estos casos la dosis acumulada de RTX fue <3.005mg/m2.
Las limitaciones de nuestro estudio son su carácter retrospectivo y el pequeño tamaño de la muestra que nos obligó a agrupar los pacientes HBsAg positivos y los HBsAg negativos en el cálculo de la dosis acumulada de RTX, y que nos impidió la realización de un análisis multivariante.
Sin embargo, nuestro estudio aporta la serie nacional más amplia y confirma en nuestro medio los factores de riesgo ya descritos. Por otro lado la observación de una mayor dosis acumulada de RTX en los pacientes con reactivación puede ser un factor más a tener en cuenta al planificar la profilaxis con análogos en pacientes con dudosa indicación y que van a recibir dosis más bajas de RTX, en espera de recomendaciones firmes sustentadas en los resultados de ensayos clínicos actualmente en marcha.
En conclusión, los pacientes con HBsAg positivo, anti-HBc aislado, títulos bajos de anti-HBs, linfoma de la zona marginal y linfoma de células del manto tratados con RTX presentan mayor riesgo de reactivación del VHB, y este riesgo aumenta con la dosis acumulada de RTX.
El futuro en este campo será aclarar si todos los pacientes anti-HBc positivos con viremia negativa deben recibir profilaxis con análogos, o es posible seleccionar un subgrupo de pacientes con menor riesgo de reactivación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.