La detección de candiduria en pacientes hospitalizados o inmunodeprimidos tiene una gran relevancia clínica. El objetivo de nuestro trabajo fue describir la frecuencia de aislamiento de diferentes especies significativas de levaduras en las muestras de orina procesadas en nuestro hospital en el periodo 2010-2013 y analizar su sensibilidad a los antifúngicos de uso habitual. La identificación de especies se realizó por siembra en un medio cromogénico, prueba de filamentación y sistemas automatizados (ASM Vitek y MALDI Biotyper), mientras que la sensibilidad a los antifúngicos se determinó con el sistema ASM Vitek. De los 632 aislamientos de levaduras obtenidos, 371 fueron Candida albicans y 261 especies de Candida no C. albicans. Las especies con mayor número de aislados resistentes fueron Candida glabrata y Candida krusei. Basados en nuestros resultados, consideramos que la identificación de la especie y el estudio de la sensibilidad a los antifúngicos deberían ser prácticas habituales por parte de los laboratorios cuando se aíslan especies diferentes a C. albicans.
Candiduria detection in hospitalized or immunocompromised patients is of great clinical significance. The aim of our study was to describe the isolation frequency of significant species of yeasts in urine samples processed in our hospital during the period 2010- 2013, and to analyze their susceptibility to commonly used antifungal agents. Species identification was performed by seeding on a chromogenic medium, the filamentation test and automated systems (ASM Vitek and MALDI Biotyper), while susceptibility was determined using the ASM Vitek system. Of the 632 yeast isolates in urine, 371 were Candida albicans species and 261 non-C. albicans Candida spp. The species with the highest number of resistant isolates were Candida glabrata and Candida krusei. Based on the results obtained, we believe that species identification and the susceptibility study should be current practice in the laboratories when species other than C. albicans are isolated.
La candiduria es un hallazgo frecuente entre pacientes inmunodeprimidos u hospitalizados, por lo que es especialmente importante en unidades de cuidados intensivos (UCI) y de neonatología, oncología y trasplantados. Habitualmente, la presencia de levaduras en la orina representa la colonización del tracto urinario, pero no su infección; sin embargo, la candiduria se asocia a una mayor mortalidad entre estos pacientes15, lo que determina la relevancia clínica de su detección. Diferentes factores de riesgo se asocian a la aparición de candiduria; algunos de los más destacados son los siguientes: diabetes mellitus, uso de antibióticos de amplio espectro, corticoterapia prolongada, empleo de fármacos inmunosupresores, largas estancias hospitalarias, neoplasias hematológicas, anomalías en el tracto urinario, sondajes urinarios o prematuridad, entre otros1,2,7.
La especie de Candida aislada con más frecuencia ha sido, clásicamente, Candida albicans; sin embargo, en diversos trabajos se ha documentado el aumento en la incidencia de otras especies de este género1,9. Algunas de estas especies son resistentes a los antifúngicos habitualmente usados14. El uso de antifúngicos, sobre todo de los azoles, ha contribuido a este hecho1.
El objetivo de este trabajo fue describir la frecuencia de aislamiento de diferentes especies de Candida en muestras de orina procesadas en el Laboratorio de Microbiología de un hospital regional español durante un periodo de 4 años y analizar el perfil de sensibilidad de estos aislados a diferentes antifúngicos.
Para ello, se analizaron de forma retrospectiva los aislamientos significativos de levaduras (definidos por recuentos del mismo agente superiores a 100000UFC/ml en al menos 2 ocasiones sucesivas y ausencia de bacteriuria concomitante) recuperados de los urocultivos de pacientes adultos (mayores de 14 años) procesados en el Laboratorio de Microbiología del Complejo Hospitalario Universitario «Virgen de las Nieves» de Granada (España) entre enero del 2010 y diciembre del 2013. Este hospital es un centro de referencia que asiste a una población de 440000 personas. Todas las muestras se obtuvieron de pacientes atendidos en Centros de Salud de Atención Primaria o ingresados en las salas de hospitalización de los 3 hospitales que componen el complejo hospitalario (Hospital General de Especialidades, Hospital Materno-Infantil y Hospital de Rehabilitación y Traumatología). La detección preliminar de levaduras en orina se hizo usando un procedimiento previamente descrito6. Todas aquellas colonias crecidas en medio CHROMagar Orientation (Becton Dickinson, Franklin Lakes, EE. UU.) con aspecto compatible con levaduras fueron subcultivadas en medio CHROMagar Candida (Becton Dickinson). Para la identificación final de especie se emplearon el subcultivo en este medio, la prueba de filamentación8 y el sistema ASM Vitek (bioMérieux, Madrid, España) o el sistema MALDI Biotyper (Bruker Daltonics, Billerica, EE. UU.). La sensibilidad a los antifúngicos se analizó con el sistema ASM Vitek para anfotericina B, caspofungina, flucitosina, fluconazol y micafungina, y fue interpretada de acuerdo con criterios y normas previamente publicados3,12,13.
Durante los años 2010 y 2011, las levaduras aisladas en orinas procedentes de pacientes atendidos en Atención Primaria se informaron como C. albicans o Candida no C. albicans, sin realizarse la identificación de especie en estas últimas. Durante este periodo, se realizó antifungigrama a todos los aislados de Candida spp. obtenidos a partir de muestras de pacientes hospitalizados. En los años 2012 y 2013 se llevó a cabo la identificación de todas las levaduras y se hizo antifungigrama a todos los aislados de Candida no C. albicans, independientemente del origen comunitario u hospitalario de la muestra.
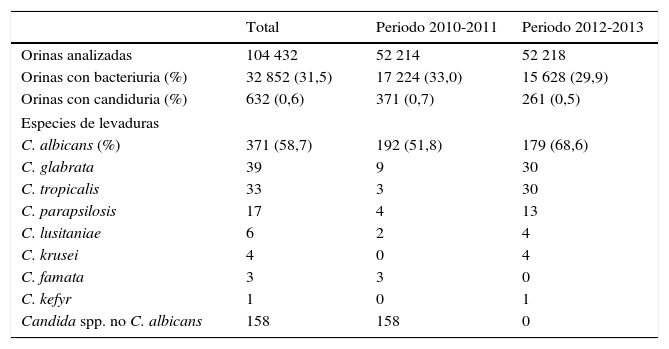
La cantidad de muestras analizadas durante estos 4 años y la frecuencia de aislamiento de las diferentes especies de levaduras se muestran en la tabla 1. Entre 2010 y 2013 se obtuvieron 632 aislamientos de levaduras en orina. De ellos, 371 (58,7%) fueron C. albicans y 261 (41,3%) otras especies: Candida glabrata (6,2%), Candida tropicalis (5,2%), Candida parapsilosis (2,7%), Candida lusitaniae (0,9%), Candida krusei (0,6%), Candida famata (0,5%), Candida kefyr (0,2%) y otras especies no C. albicans (25,0%). Estos últimos aislamientos no identificados a nivel de especie procedieron de muestras de pacientes atendidos en Atención Primaria durante 2010 y 2011.
Frecuencia de aislamiento de diferentes levaduras en urocultivos de pacientes atendidos en Centros de Salud de Atención Primaria u hospitalizados en el Complejo Universitario de Granada, España
| Total | Periodo 2010-2011 | Periodo 2012-2013 | |
|---|---|---|---|
| Orinas analizadas | 104 432 | 52 214 | 52 218 |
| Orinas con bacteriuria (%) | 32 852 (31,5) | 17 224 (33,0) | 15 628 (29,9) |
| Orinas con candiduria (%) | 632 (0,6) | 371 (0,7) | 261 (0,5) |
| Especies de levaduras | |||
| C. albicans (%) | 371 (58,7) | 192 (51,8) | 179 (68,6) |
| C. glabrata | 39 | 9 | 30 |
| C. tropicalis | 33 | 3 | 30 |
| C. parapsilosis | 17 | 4 | 13 |
| C. lusitaniae | 6 | 2 | 4 |
| C. krusei | 4 | 0 | 4 |
| C. famata | 3 | 3 | 0 |
| C. kefyr | 1 | 0 | 1 |
| Candida spp. no C. albicans | 158 | 158 | 0 |
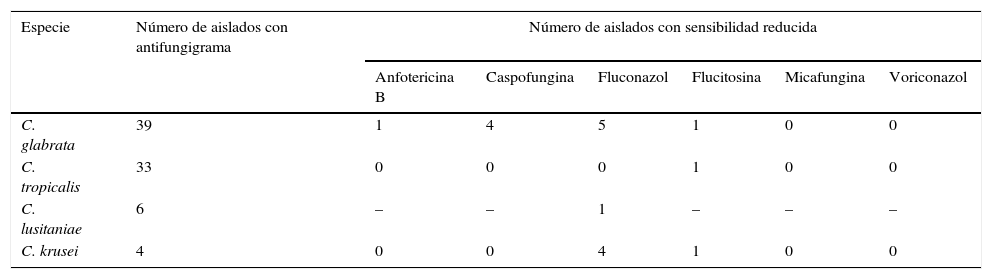
Entre los aislados a los que se hizo antifungigrama (45 de C. albicans, 39 de C. glabrata, 33 de C. tropicalis, 17 de C. parapsilosis, 6 de C. lusitaniae, 4 de C. krusei y 3 de C. famata), se encontró algún nivel de resistencia en varios de los correspondientes a C. glabrata (5 aislados con sensibilidad reducida a fluconazol, 4 aislados con sensibilidad reducida a caspofungina y un aislado con sensibilidad reducida a anfotericina B y flucitosina); en todos los de C. krusei (todos los aislados resistentes a fluconazol y uno a la vez resistente a flucitosina); en 2 de los identificados como C. lusitaniae (un aislado con sensibilidad reducida a fluconazol), y en uno de los asignados a C. tropicalis (resistente a flucitosina). Estos hallazgos se muestran en la tabla 2. Ninguno de los aislados de C. albicans, C. parapsilosis o C. famata presentó resistencia a los antifúngicos probados. No hubo levaduras con sensibilidad reducida o resistencia a micafungina.
Especies de Candida que presentaron algún nivel de resistencia a los antifúngicos
| Especie | Número de aislados con antifungigrama | Número de aislados con sensibilidad reducida | |||||
|---|---|---|---|---|---|---|---|
| Anfotericina B | Caspofungina | Fluconazol | Flucitosina | Micafungina | Voriconazol | ||
| C. glabrata | 39 | 1 | 4 | 5 | 1 | 0 | 0 |
| C. tropicalis | 33 | 0 | 0 | 0 | 1 | 0 | 0 |
| C. lusitaniae | 6 | – | – | 1 | – | – | – |
| C. krusei | 4 | 0 | 0 | 4 | 1 | 0 | 0 |
En los 4 años que comprendió este estudio, se observó un porcentaje muy alto de aislamientos de levaduras diferentes de C. albicans (41,3%) en las muestras procesadas, entre las que se incluyeron especímenes procedentes de pacientes de Atención Primaria así como de la actividad asistencial de 3 hospitales de especialidades.
Las especies de Candida diferentes de C. albicans son patógenos emergentes, que pueden colonizar superficies mucocutáneas humanas y provocar candidemia y candidiasis invasiva16. La distribución de los agentes causales de candidemia y procesos invasivos varía en función de la geografía, las condiciones de los pacientes y las unidades de hospitalización10, por lo que se necesita una vigilancia epidemiológica activa, longitudinal, en una distribución geográfica amplia, para poder observar las tendencias regionales, nacionales y globales en la distribución de las especies, así como en la resistencia antifúngica11.
El tratamiento efectivo de una candiduria clínicamente relevante es con fluconazol, anfotericina B liposomal y flucitosina4. Sin embargo, está descrito que las especies de levaduras no C. albicans tienen mayores índices de resistencia a fluconazol14. Desglosando nuestros datos por especies no C. albicans, observamos una frecuencia de aislamiento elevada de C. glabrata, C. tropicalis y C. parapsilosis, especies que suelen presentar mayor resistencia a los tratamientos empíricos habituales, como se ha descrito en diversos trabajos1,5,7. Además, la profilaxis con fluconazol, así como el uso de inmunosupresores, promueven la selección de C. glabrata7. El tratamiento alternativo con equinocandinas raramente es considerado en las infecciones del tracto urinario, debido a que estas no alcanzan altas concentraciones en orina4.
Por estas razones creemos que al aislar levaduras en orina debemos, en primer lugar, determinar la relevancia clínica del hallazgo, es decir, determinar si hay una verdadera infección o una colonización (sobre la base de la presencia de sintomatología clínica urinaria o sistémica compatible, así como de un número significativo de colonias en el cultivo) y posteriormente identificar la especie, debido a las diferencias en sensibilidad a los antifúngicos que presentan las diversas especies de Candida no C. albicans. Aunque globalmente en nuestro estudio no se encontraron elevados niveles de resistencia a antifúngicos entre las especies de Candida aisladas en orina, el porcentaje de especies diferentes de C. albicans supuso más de un 40% del total de las candidurias. Y es entre estas levaduras donde encontramos mayor nivel de resistencia, por lo que consideramos imprescindible la identificación de especie y la realización de antifungigrama en el caso de aislamientos de especies diferentes de C. albicans en muestras de orina.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.