Los microorganismos del suelo son vitales para el correcto funcionamiento de los ecosistemas, principalmente por su papel en el ciclado de nutrientes. La intensificación del uso del suelo y las prácticas agrícolas alteran negativamente la actividad microbiana. La biomasa fúngica es uno de los parámetros más utilizados para estudiar el impacto de las actividades agrícolas en la estructura y el funcionamiento del suelo. El objetivo del presente trabajo fue estimar la biomasa fúngica en un suelo del sudoeste bonaerense con el fin de obtener valores de referencia que permitan usar este parámetro como un indicador de cambios en el ecosistema y, por otro lado, demostrar que la metodología empleada es sensible a las variaciones en las condiciones climáticas. Se colectaron muestras de suelos durante 2 años consecutivos. Se prepararon frotis de suelo y se tiñeron con soluciones de distintas concentraciones de blanco de calcoflúor y luego se estimó la biomasa fúngica observando los frotis con microscopio de epifluorescencia. Los valores de biomasa fúngica estimados variaron entre 2,23 y 26,89μgCfúngico/g de suelo y estuvieron dentro del rango esperable para el tipo de suelo estudiado. La biomasa fúngica mostró una relación positiva con la temperatura y las precipitaciones. La metodología empleada resultó ser confiable, repetible y sensible a cambios en las condiciones climáticas. Los resultados podrían usarse como valores de referencia para estudiar la biomasa fúngica de suelos bajo distintas condiciones y emplearse como indicadores del impacto de las distintas prácticas agrícolas sobre el ecosistema.
Soil microorganisms are vital for ecosystem functioning because of the role they play in soil nutrient cycling. Agricultural practices and the intensification of land use have a negative effect on microbial activities and fungal biomass has been widely used as an indicator of soil health. The aim of this study was to analyze fungal biomass in soils from southwestern Buenos Aires province using direct fluorescent staining and to contribute to its use as an indicator of environmental changes in the ecosystem as well as to define its sensitivity to weather conditions. Soil samples were collected during two consecutive years. Soil smears were prepared and stained with two different concentrations of calcofluor, and the fungal biomass was estimated under an epifluorescence microscope. Soil fungal biomass varied between 2.23 and 26.89μg fungal C/g soil, being these values in the range expected for the studied soil type. The fungal biomass was positively related to temperature and precipitations. The methodology used was reliable, standardized and sensitive to weather conditions. The results of this study contribute information to evaluate fungal biomass in different soil types and support its use as an indicator of soil health for analyzing the impact of different agricultural practices.
Los microorganismos del suelo (bacterias y hongos) son una parte fundamental en ese ecosistema, ya que participan activamente en el ciclado de los nutrientes y en la descomposición de la materia orgánica muerta21,24. Más del 50% de la biomasa microbiana del suelo está constituida por hongos, los cuales, además de su importancia como degradadores, contribuyen al mantenimiento de la estructura y la humedad de ese medio, con lo que se previene su erosión21.
La productividad de un sistema agrícola está fuertemente relacionada con la actividad microbiológica del suelo43. A su vez, la intensificación del uso del suelo y las prácticas agrícolas alteran negativamente la actividad microbiana en el suelo4,31,41. Por ende, el estudio de la biomasa y la actividad microbiana del suelo es relevante para comprender el impacto que las actividades agrícolas tienen sobre la estructura y el funcionamiento del ecosistema4.
El estudio de los hongos provenientes de muestras medioambientales es complejo, en parte porque las técnicas convencionales basadas en el uso de medios de cultivo son consideradas insuficientes a partir de un análisis exhaustivo de tales muestras. Muchos hongos son incapaces de crecer en condiciones de laboratorio o solo una pequeña fracción, inferior al 1%, es cultivable. Por ello, si bien las técnicas dependientes del cultivo fueron las preferidas en el pasado, en la actualidad se considera que por sí solas son insuficientes, ya que brindan información sesgada sobre la diversidad y biomasa fúngica del suelo26. En consecuencia, la búsqueda de metodologías que permitan lograr estimaciones de biomasa confiables, independizándose del cultivo de los microorganismos, es relevante. Algunas técnicas proponen la cuantificación indirecta estimando parámetros como respiración y actividad enzimática o por medio de técnicas moleculares. Por otro lado, se han desarrollado metodologías basadas en conteo directo de los microorganismos a partir de suspensiones homogenizadas de muestras de agua y suelo8.
La investigación de los hongos en el suelo presenta una dificultad adicional, debido a que pequeñas partículas componentes de suelo, como arcillas o clastos, interfieren en la observación de las muestras. Además de la complejidad inherente al suelo, las hifas tienen una distribución heterogénea en ese ambiente, esto implica que un manejo inadecuado de la muestras puede resultar en estimaciones erróneas24.
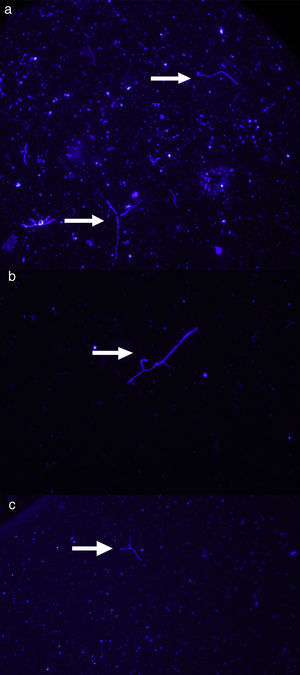
La microscopia de fluorescencia se ha usado con éxito para realizar estimaciones de biomasa fúngica y a menudo ha llevado a mejores resultados que otras técnicas2,8,24,28. El principio para realizar las estimaciones de biomasa fúngica en suelo utilizando microscopia de fluorescencia es muy sencillo: un volumen conocido de suspensión de suelo se monta sobre un área conocida de un portaobjetos y luego la muestra se tiñe con un colorante fluorescente seleccionado en función del tipo de muestra y del objetivo del estudio8. Existen distintos protocolos para realizar estimaciones de biomasa fúngica en muestras de suelo empleando microscopia de fluorescencia acoplada a tinciones específicas8,22,30,35,40. Entre los colorantes más usados para evidenciar hifas fúngicas está el blanco de calcoflúor (5-[[4-anilino-6-[bis(2-hydroxyethyl)amino]-1,3,5-triazin-2-yl]amino]-2-[(E)-2-[4-[[4-anilino-6-[bis(2-hydroxyethyl)amino]-1,3,5-triazin-2-yl]amino]-2-sulfophenyl]ethenyl]benzenesulfonic acid), conocido comercialmente como Calcofluor White, Fluorescent Brightener 28 o Tinopal. Este fluorocromo tiñe las paredes celulares, haciéndolas lucir de color azul brillante cuando son observadas con epifluorescencia. Debido a que esta metodología es fácilmente aplicable, tiene bajo costo y puede emplearse sobre muestras fijadas, muchos laboratorios han comenzado a utilizarla para la observación y el recuento de hongos a partir de muestras de suelo2,10,12,25. Esta metodología brinda estimaciones confiables y reproducibles que son comparables con las realizadas utilizando otras técnicas indirectas2.
En Argentina, las primeras investigaciones relativas a los hongos del suelo fueron realizadas hace más de 30 años empleando exclusivamente técnicas dependientes de cultivo13-15,18,20. Con el advenimiento de las técnicas independientes del cultivo, las investigaciones se complementaron con el empleo de alguna de ellas, por ejemplo, la estimación de biomasa a través de la actividad enzimática o la cuantificación del contenido de ergosterol en el suelo realizadas por Aon et al.3, Bórtoli et al.11 y Gaspar et al.19. En la última década se popularizó el uso exclusivo de metodologías independientes del cultivo, como la cuantificación del contenido de ácidos grasos del suelo empleada por Montecchia et al.27 y Vargas Gil et al.37.
Hasta la fecha, el blanco de calcoflúor no había sido empleado para cuantificar la biomasa fúngica en el suelo en Argentina. El objetivo del presente trabajo fue estimar la biomasa fúngica en un suelo del sudoeste de la provincia de Buenos Aires utilizando una tinción específica con blanco de calcoflúor acoplada a microscopia de fluorescencia, con el fin de obtener valores de referencia que permitan usar este parámetro como un indicador de cambios en el ecosistema. Asimismo, se intentó demostrar que la técnica empleada es suficientemente sensible para detectar las variaciones en la biomasa fúngica del suelo atribuibles a cambios en las condiciones climáticas.
Materiales y métodosMuestras de sueloLas muestras de suelo fueron recolectadas de una parcela sin historia de uso agrícola ubicada en la estación experimental Colonia Napostá, perteneciente a la Universidad Nacional del Sur, provincia de Buenos Aires, Argentina (38° 29′ 56″ S; 62° 17′ 36″ O). El suelo estudiado fue un haplustol típico con bajo contenido de materia orgánica (< 2%). Se realizaron 4 muestreos por año, entre los meses de mayo y junio, durante 2 años consecutivos (2010 y 2011). En cada muestreo se tomaron 4 muestras del horizonte superficial del suelo (0-10cm). Las muestras se colocaron en bolsas de polietileno estériles y se mantuvieron a 4°C; se procesaron dentro de las 24 h posteriores a la recolección, para evitar los efectos del almacenamiento sobre la comunidad microbiana29. Los datos meteorológicos fueron tomados de la estación meteorológica perteneciente al CERZOS, ubicada en el CCT-CONICET Bahía Blanca, Argentina. Se analizaron la temperatura y la precipitación durante los períodos de muestreo y se calculó la temperatura promedio y las precipitaciones acumuladas durante los 7 días previos a cada fecha de muestreo.
Suspensiones de sueloSe realizaron diluciones seriadas de las muestras de suelo utilizando solución salina estéril (0,4g MgSO4 [H2O]7; 0,02g FeSO4 [H2O]7; 0,2gK2HPO4; 0,2g [NH4]2SO4; 0,08g CaSO4; 1000ml H2O destilada). Las suspensiones con 50mg de suelo/ml se fijaron con formol al 37% y se conservaron a 4°C en oscuridad.
Preparación y tinción de los frotis de sueloSe utilizó una modificación de la técnica de Bloem y Vos8. Para preparar los frotis de suelo se utilizaron portaobjetos de inmunofluorescencia de 11mm de diámetro de campo (LabSud, Argentina). Se colocó una alícuota de 20μl de la suspensión de suelo (50mg/ml) en el centro del campo y se dejó secar completamente a temperatura ambiente. Las muestras se sembraron por cuadruplicado.
Las soluciones de blanco de calcoflúor empleadas (2,5% y 5%) (Fluorescent Brigthener 28, Sigma-Aldrich Argentina, C40H44N12O10S2) se prepararon disolviendo completamente el colorante en 5ml de NaOH al 10% (v/v) durante unos minutos. Luego se llevaron a un volumen final de 100ml con etanol al 50%, se filtraron a través de un filtro de membrana de 0,2μm diámetro (Whatman) y se conservaron a 4°C en oscuridad.
Los frotis de suelo se colocaron sobre papel absorbente húmedo y a partir de ese momento se mantuvieron en oscuridad. Las hifas fúngicas se tiñeron colocando 50μl de solución de calcoflúor sobre cada frotis durante una hora. Luego, se eliminó el exceso de colorante realizando 3 lavados de 5 min con etanol al 50% y por último un lavado de un minuto en agua destilada. Luego del lavado, los preparados se dejaron escurrir y se conservaron en oscuridad a 4°C hasta un máximo de 60 días.
Recuento de las hifas fúngicasLos frotis de suelo se montaron con una gota de aceite de inmersión de baja fluorescencia (Cicarelli, Argentina), sobre la que se colocó el cubreobjetos. Las observaciones se realizaron con un microscopio Nikon Eclipse (objetivo 20X, filtro de excitación BP 340-380nm, divisor de haz 400nm y filtro barrera LP 430nm).
Cálculos y estimacionesLa longitud total de hifas fúngicas (H) se estimó utilizando el método de intersección1. Se usó la fórmula: H=I×π×A2L; donde I es el número de intersecciones por grilla; A es el área de la grilla, y L es la longitud de las líneas de la grilla, para calcular la longitud de hifas en la grilla. Luego se calculó la longitud total de hifas por gramo de suelo (F) como F=H×10−6×AB×1S donde H es la longitud total de hifas en la grilla; A es el área del frotis; B es el área de la grilla, y S es la cantidad de suelo en el frotis. El biovolumen de hifas fúngicas por gramo de suelo (V) se estimó como V=π4W2F−W3, donde W es el ancho promedio de las hifas fúngicas (según Bloem y Vos8). A partir de V se estimó el contenido de carbono fúngico por gramo de suelo como Cfúngico/g de suelo=V×1,3×10−13g Cfúngico/μm3 utilizando un valor de carbono específico tomado de la literatura1.
Análisis estadísticoSe realizó una regresión múltiple entre los valores promedio de biomasa correspondientes a cada fecha de muestreo con el valor de temperatura y precipitación. Se realizaron Q-Q plots y análisis de residuales para verificar el cumplimiento de los supuestos del análisis. Para los cálculos y gráficos se utilizaron los paquetes stats, gridExtra y ggplot2 del software R17.
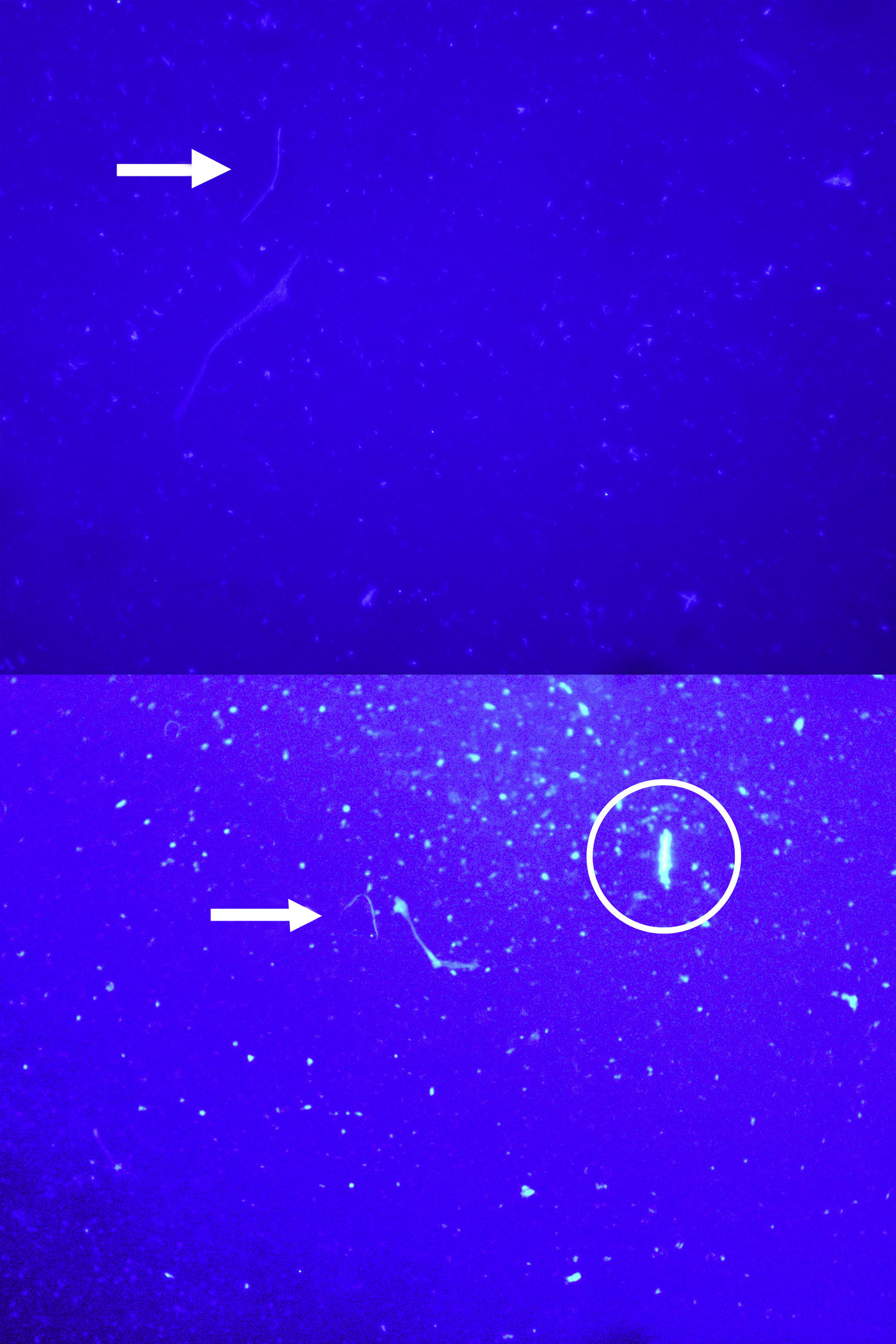
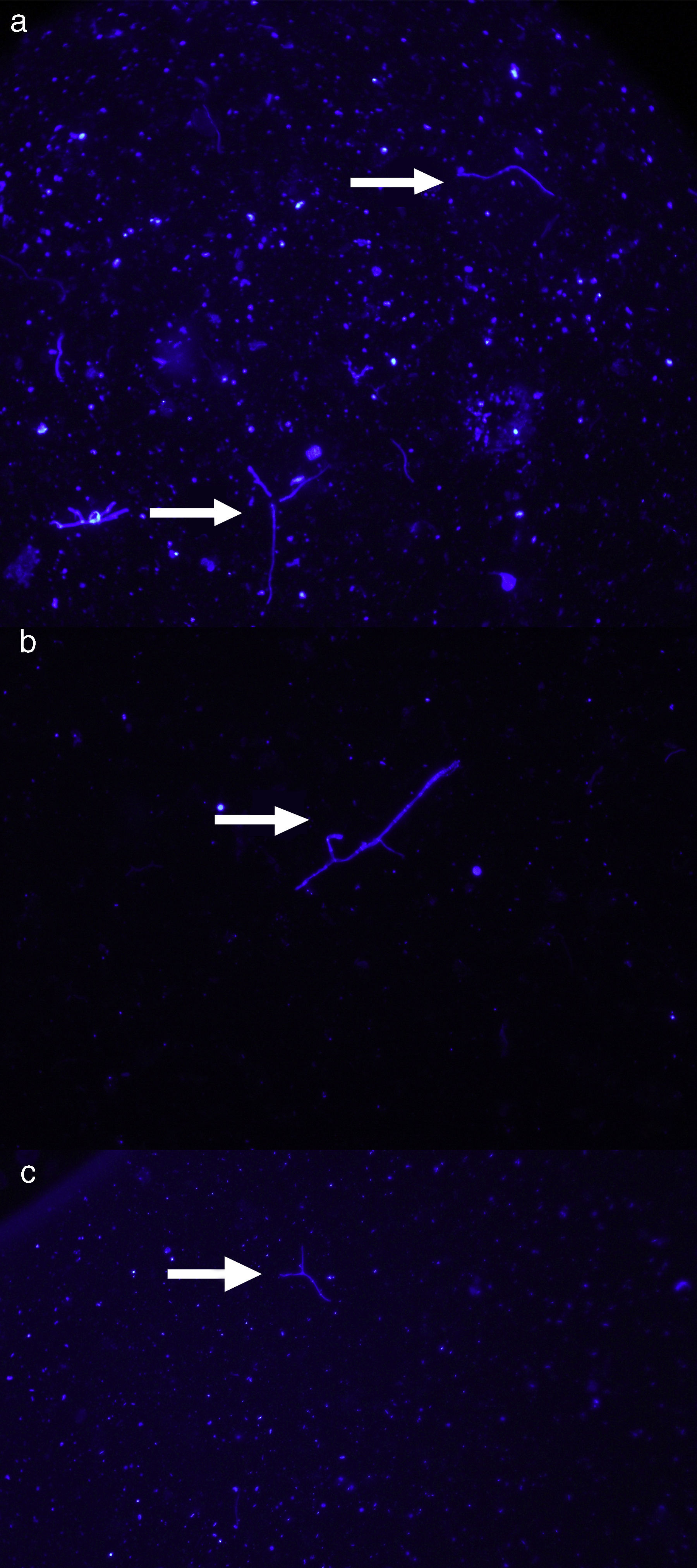
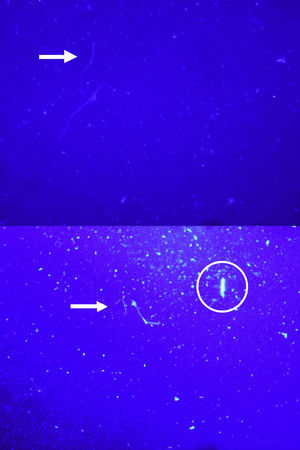
ResultadosLa intensidad de la fluorescencia en los frotis se mantuvo sin alteraciones hasta 60 días luego de la tinción. Si bien se observó tinción en los frotis teñidos con ambas concentraciones de colorante (2,5% y 5%), con la solución al 5% de calcoflúor se obtuvo una elevada tinción de fondo y se observaron grandes cristales de colorante, que dificultaron la identificación de las hifas fúngicas (figura 1). Los frotis teñidos con la solución al 2,5% de calcoflúor presentaron una tinción de fondo muy baja, con pequeños cristales del colorante. Las hifas presentaban un color azul brillante, y si bien diversas partículas de suelo se tiñeron junto con las hifas, al haber menor tinción de fondo las estructuras fúngicas fueron fácilmente distinguibles (figura 2).
La biomasa fúngica estimada tuvo un mínimo de 2,23μgCfúngico/g de suelo y un máximo de 26,89μgCfúngico/g de suelo, ambos valores registrados durante el año 2011. La biomasa fúngica promedio estimada del año 2010 varió entre 4,35 y 7,92μgCfúngico/g de suelo y la del año 2011, entre 4,75 y 20,8μgCfúngico/g de suelo.
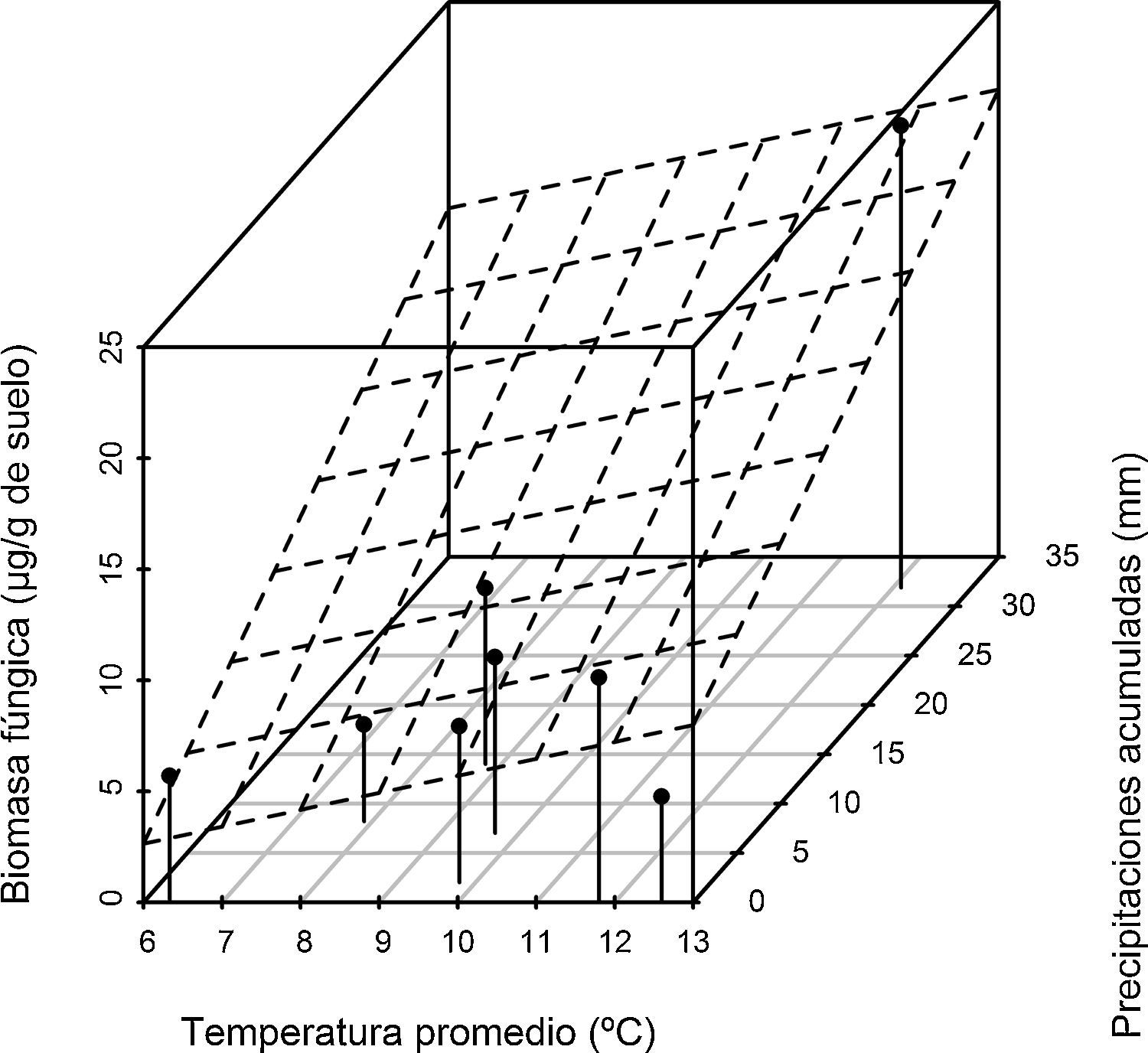
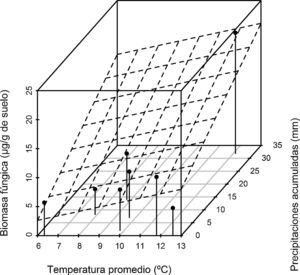
El análisis de las variables climáticas de los períodos de estudio reveló que los valores de temperatura registrados la semana previa a los muestreos fueron mayores en la temporada 2011 (F[1,6]=12,8, p<0,05). Para el caso de las precipitaciones acumuladas la semana previa a cada muestreo, no se hallaron diferencias significativas (F[1,6]=0,02, p>0,8). Sin embargo, se registró en la temporada 2011 un valor de precipitación extremo antes del tercer muestreo del año. El análisis de regresión mostró que el valor de biomasa fúngica estimada presenta una relación positiva significativa con las 2 variables ambientales analizadas, temperatura y precipitaciones (F[3,4]=13,07, p=0,015, R2=0,907), y que existe a su vez una interacción significativa entre las variables predictivas (F[1:4]=4,73, p<0,1) (figura 3).
DiscusiónExisten distintos métodos para estimar la biomasa fúngica, pero la aplicación de ninguno de ellos ha mostrado ser eficiente bajo una amplia gama de suelos y condiciones climáticas38. Las técnicas moleculares se pueden aplicar en la mayoría de los suelos y son ampliamente utilizadas para estimar la diversidad fúngica del suelo, pero no brindan información sobre la biomasa microbiana2. Por otro lado, las estimaciones de biomasa microbiana del suelo empleando observaciones microscópicas implican procedimientos más laboriosos que las técnicas indirectas, como la cuantificación de la respiración29, pero permiten diferenciar y cuantificar la biomasa fúngica independientemente de la bacteriana.
Este es el primer trabajo de Argentina que utiliza la tinción con blanco de calcoflúor acoplada a la microscopia de epifluorescencia para estimar la biomasa fúngica en un suelo. Los valores de biomasa fúngica estimados en el suelo estudiado estuvieron dentro del rango de los observados en diversos suelos agrícolas, con un contenido de materia orgánica similar o aun mayor2,16,24,32,36.
Al ser una metodología bastante reciente, todavía no ha sido empleada en distintos tipos de suelos; por ello aún no son suficientes los trabajos existentes como para realizar comparaciones vis a vis de los resultados obtenidos en suelos con características similares. A pesar de esto, los resultados estuvieron dentro del rango de los publicados en la literatura utilizando técnicas comparables2,12.
El blanco de calcoflúor, por su alta especificidad, es uno de los fluorocromos más usados en estudios de morfología y desarrollo de hongos23. El calcoflúor tiñe de color azul las paredes celulares con quitina, celulosa y otros polisacáridos con uniones ß 1,4. Su uso para estimar biomasa fúngica en muestras de suelo fue propuesto por Bloem y Vos8; sin embargo, aún no había sido empleado con dicho propósito en Argentina.
En el presente trabajo se propusieron modificaciones al protocolo original, que vuelven a la técnica fácilmente aplicable y apta para trabajar con grandes volúmenes de muestras y con los insumos disponibles en nuestro país. El colorante calcoflúor comercializado en la Argentina es una formulación sin sodio distinta de la indicada en la técnica original por Bloem y Vos8. La variación en la formulación química del colorante fue compensada con la adición de NaOH y los cristales de colorante se disolvieron completamente, con lo que se logró una tinción pareja en los frotis de suelo. A su vez, la concentración del colorante utilizado para realizar las tinciones fue menor que la recomendada previamente. Los resultados de este trabajo mostraron que en los frotis de suelo teñidos con soluciones de calcoflúor al 2,5% la tinción fue más pareja y se obtuvo menor tinción de fondo y menor cantidad de cristales de calcoflúor sin disolver. El empleo de altas concentraciones de colorante fluorescente puede ocasionar una elevada tinción de fondo, que dificulta la observación de los preparados42 y genera un sesgo en las estimaciones39.
Los frotis de suelo teñidos se conservaron sin montar y aun con esta modificación la intensidad de la fluorescencia y la tinción de fondo se mantuvieron sin variaciones luego de 60 días de almacenamiento. En concordancia con nuestros resultados, estos parámetros también se mantuvieron constantes por un período similar en otros trabajos ya publicados, pero con los preparados montados y sellados8. Esta variación vuelve a la técnica más ágil y a la vez disminuye el tiempo de manipulación de los preparados, lo cual evita su exposición y la posible disminución en la intensidad de la fluorescencia por contacto con la luz.
La magnificación utilizada para la observación de los preparados fue menor que la propuesta en la técnica original. La biomasa fúngica del suelo está estrechamente relacionada con las condiciones ambientales y la abundancia de recursos, en especial materia orgánica24; por ello, en suelos de regiones semiáridas, como los aquí estudiados, la densidad de hifas es generalmente baja. Bloem y Vos8 mencionan que al observar los preparados con una magnificación muy elevada, existe la probabilidad de subestimar la biomasa, ya que muchos de los campos observados estarían vacíos. En el presente estudio se usó una magnificación menor que la recomendada, precisamente para disminuir ese riesgo de subestimación.
La biomasa fúngica mostró una relación positiva con la temperatura y las precipitaciones. Se observaron resultados similares en otras investigaciones, en las que se destaca la marcada influencia de las condiciones climáticas sobre la actividad fúngica5-7,9,33,34. El suelo es un sistema muy complejo en el que los procesos físicos, químicos y biológicos están interrelacionados y son fuertemente influenciados por factores ambientales.
En conclusión, los resultados del presente estudio mostraron que la metodología empleada resultó ser una técnica confiable, reproducible y sensible a cambios en las condiciones climáticas. Las estimaciones de la biomasa fúngica total registradas en el suelo estudiado son comparables con las obtenidas aplicando otras técnicas de mayor complejidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue parcialmente financiado a través del proyecto PICT-FONCYT (PICT-07/00380). Los autores María Belén Vázquez y Martín Raúl Amodeo tienen una beca de investigación otorgada por CONICET.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.