La capacidad de formar biopelículas de los microorganismos patógenos en gran variedad de ambientes, superficies y condiciones trae consigo un importante riesgo, tanto para la industria alimentaria como para la salud pública. Este trabajo tuvo como objetivo evaluar y comparar los efectos de la metodología empleada y de los medios de cultivo utilizados, sobre la capacidad de una cepa de Escherichia coli verotoxigénica no O157 y una enteropatogénica de formar biopelículas sobre una superficie de poliestireno. Se ensayaron 2variantes metodológicas en cultivo estático y se utilizaron medios de cultivo con diferente composición. Los resultados mostraron que ambas cepas formaron una mayor cantidad de biopelícula en cultivo en LB suplementado con glucosa, con recambio del medio a las 24 h y la cuantificación de la biopelícula realizada a las 48 h de incubación. Dichas condiciones podrían ser utilizadas en futuros estudios sobre formación de biopelícula.
The ability to form biofilms of pathogenic microorganisms in a wide variety of environments, surfaces and conditions constitute an important risk, both for the food industry and for public health. The aim of this work was to evaluate and to compare the effects of the methodology applied and the culture medium used on the ability of a non-O157 verotoxigenic Escherichia coli strain and an enteropathogenic strain to form biofilm on polystyrene surface. Two methodological variants were tested in static culture and culture mediums with different composition were used. The results showed that both strains were able to form a greater biofilm under culture in LB supplemented with glucose, with medium replacement at 24h and the quantification of the biofilm carried out at 48h of incubation. These conditions could be used in future studies on biofilm formation.
Escherichia coli verotoxigénica (VTEC) y E. coli enteropatogénica (EPEC) son importantes patógenos relacionados con la salud pública.
VTEC puede causar colitis hemorrágica y síndrome urémico hemolítico (SUH), el que afecta especialmente a niños menores de 5 años, personas mayores y pacientes inmunocomprometidos11. El ganado bovino de diferentes sistemas de producción ha sido identificado como el principal reservorio de VTEC9,13. Diversos alimentos, como la carne, la leche y sus subproductos, así como los jugos de fruta sin pasteurizar y el agua contaminada, son las principales vías de contagio en brotes y casos esporádicos de SUH11. También debe considerarse el contagio por contacto directo persona a persona o por contacto directo o indirecto con heces bovinas y el ambiente de animales.
EPEC se asocia con casos de diarrea infantil aguda o persistente y, al igual que otras E. coli diarreagénicas, se transmite por vía fecal-oral a través de manos, agua y alimentos contaminados. El principal reservorio de EPEC es el humano, especialmente los niños con diarrea y los niños o los adultos que son portadores asintomáticos, aunque se ha encontrado, además, en varias especies animales como pollos y alimentos derivados1.
En el entorno natural, la mayor parte de los microorganismos viven en comunidades adheridas a una superficie biótica o abiótica, o formando conglomerados dispersos denominados biopelículas. Estas comunidades de células sésiles crecen embebidas en una matriz orgánica polimérica producida por las propias células y poseen diferencias profundas en cuanto a la tasa de crecimiento y a la transcripción génica respecto de sus contrapartes planctónicas7. La biopelícula formada ofrece a los microorganismos distintas ventajas adaptativas: protege de la acción de los agentes adversos, incrementa la disponibilidad de nutrientes para su crecimiento, facilita el aprovechamiento del agua reduciendo la posibilidad de deshidratación y favorece la transferencia de material genético (ADN), entre otras. Estas circunstancias logran incrementar su capacidad de supervivencia frente a condiciones adversas del ambiente natural y frente a métodos habituales de desinfección y la aplicación de antibióticos2,15.
La posibilidad de los microorganismos patógenos de formar biopelícula en variedad de ambientes y condiciones trae consigo un importante riesgo tanto para la industria alimentaria como para la salud pública. En la industria alimentaria es muy común la presencia de biopelículas en cañerías y equipos compuestos por diferentes materiales (incluyendo plástico, cristal, madera, acero inoxidable) e incluso sobre los alimentos producidos.
Las biopelículas formadas en condiciones favorables pueden proteger a los microorganismos potencialmente patógenos frente a los desinfectantes utilizados para descontaminar los ambientes y las superficies de procesamiento de alimentos2. Esto podría causar la contaminación de las materias primas y del producto final, y las consecuencias de dicha contaminación abarcan desde pérdidas económicas hasta el desarrollo de enfermedades.
Diferentes estudios de laboratorio han intentado comprender la dinámica del desarrollo de las biopelículas, las condiciones en que se forman y cómo permanecen en el tiempo. Se sabe que las biopelículas son un punto estable en un ciclo biológico que incluye la iniciación, la maduración, el mantenimiento y la disolución, en el que las bacterias parecen iniciar el desarrollo de la biopelículas en respuesta a señales ambientales específicas, como, por ejemplo, la disponibilidad de nutrientes7. Además del contenido nutricional del medio, otras señales ambientales que pueden influir en la formación de biopelículas son la temperatura, la osmolaridad, el pH, el hierro y el oxígeno12,14.
Se ha informado que algunas cepas de E. coli K-12 y Vibrio cholerae no crecen en medios mínimos, a menos que sean suplementados con aminoácidos, mientras que E. coli O157:H7 se ha considerado mejor formadora de biopelícula en medios con bajo contenido de nutrientes y suplementados con glucosa6. Otros estudios indicaron que serotipos VTEC no O157 fueron formadores de biopelícula en medios nutritivos a diferentes temperaturas y sobre distintas superficies12. De la misma manera, EPEC fue caracterizada como buena formadora de biopelícula sobre poliestireno y vidrio en medios mínimos suplementados con glucosa4.
Actualmente, se cuenta con diversas metodologías e instrumentos para la detección y el estudio de biopelículas. Estos procedimientos incluyen desde la observación directa por medio de cultivos continuos, a través de microscopia electrónica o confocal, hasta la observación indirecta a través de cultivos estáticos en microplacas o de la morfología de colonias en medios de cultivo sólidos3.
Dentro de los cultivos en microplacas existen variaciones en cuanto a los medios de cultivo utilizados, las temperaturas de incubación, el inóculo inicial y el análisis de los datos obtenidos, los que tienden a adecuarse según el microorganismo que se desea estudiar7,10. En trabajos anteriores de nuestra autoría se ha demostrado la diferencia de crecimiento entre medios nutritivos y medios mínimos en cepas VTEC y EPEC sobre superficie de poliestireno8, que dieron lugar a otros estudios respecto a los efectos que podría tener la variación de otros factores, como el tiempo de incubación y la técnica aplicada para la evaluación de la formación de biopelícula, aspectos sobre los que se focaliza el presente estudio.
Este trabajo tuvo como objetivo evaluar y comparar los efectos de la metodología aplicada y los medios de cultivo utilizados sobre la capacidad de formar biopelícula sobre una superficie de poliestireno de 2cepas de E. coli, una de ellas VTEC no O157 y la otra EPEC. Ambos aislamientos provinieron del cepario del Laboratorio de Inmunoquímica y Biotecnologíaa, estos fueron el O103:H2 (vt1, vt2, eae, ehxA, efa1, espP, subA, fimCD, ehaA, agn43) y el O108:H9 (eaeβ, fimCD).
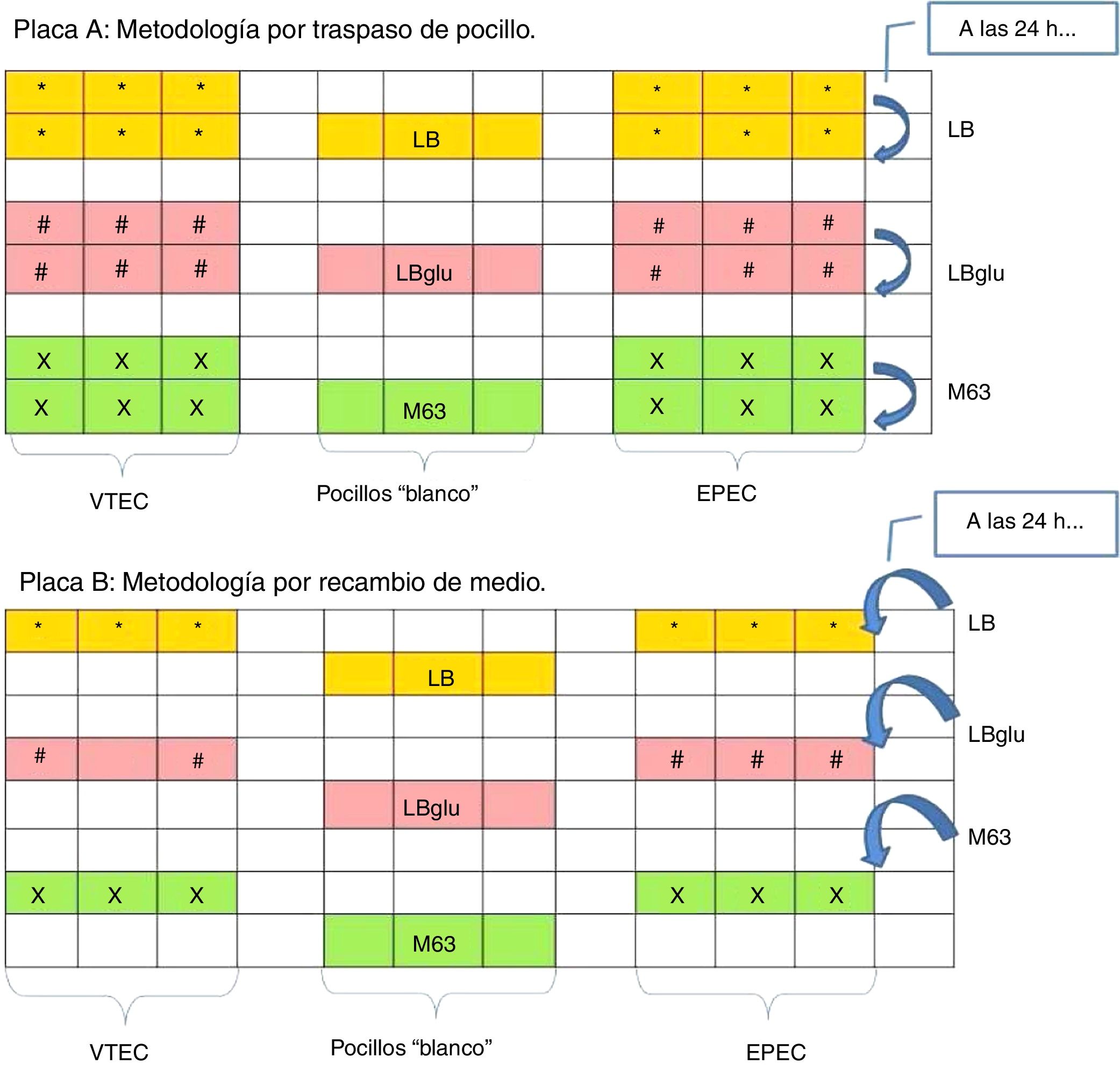
Se comparó la formación de biopelícula de ambas cepas mediante el uso de 2metodologías, según lo descripto por Danese et al.5 (en adelante, metodología A) y por Villegas et al.14 (en adelante, metodología B), utilizando 3medios de cultivo distintos, a saber: a) caldo nutritivo Luria Bertani (LB, Britania); b) caldo LB suplementado con glucosa (Mallinckrodt) al 0,5% (LBglu), y c) medio mínimo suplementado con glucosa al 0,8% (M63). Además, se ensayaron 2variantes respecto del tiempo total de incubación: 72 h o 48 h.
Cada cepa conservada a –70°C fue reactivada en LB a 37°C overnight con agitación (150rpm). Se midió la densidad óptica (DO) de cada cultivo y se realizaron diluciones ajustando la DO a 0,5 (equivalente a 2,5×108 UFC/ml, aproximadamente). Una alícuota (10μl) de la dilución apropiada de cada cepa fue sembrada en pocillos que contenían 190μl de cada medio estéril (LB, LBglu y M63; proporción final 1:20) en 2microplacas de poliestireno de 96 pocillos (Corning), a las que se denominó A y B de acuerdo con el tipo de intervención que se practicó en ellas 24h después. Se señalan a continuación esas intervenciones:
- –
Metodología A: se tomaron 10μl de cada pocillo y se sembraron en nuevos pocillos con 190μl del medio fresco estéril correspondiente (fig. 1, panel superior).
- –
Metodología B: se retiró todo el contenido de los pocillos y se agregaron 200μl del medio estéril correspondiente (fig. 1, panel inferior).
A partir de ese momento, las microplacas se continuaron incubando de modo estático a 37°C por 24 o 48 h más, de modo que el tiempo de cultivo total hasta la evaluación de la biopelícula fue de 48 h o de 72 h.
Las placas que fueron expuestas a un tiempo de incubación de 48h sufrieron, además, una modificación en el medio de cultivo en el cual las bacterias fueron incubadas las primeras 24h (ambas cepas se sembraron en 190μl de LB) y al término de ese tiempo se procedió con las intervenciones propuestas.
Las microplacas se revelaron mediante la técnica del cristal violeta (CV). Brevemente, se retiró el contenido de todos los pocillos, se lavaron con agua bidestilada estéril y se fijaron con 200μl de metanol (Biopack) durante 15min a temperatura ambiente. Los pocillos se tiñeron con 200μl (Microplacas de 96 pocillos Corning, Thermo Fisher Scientific) de CV al 0,1% durante 20min. El colorante adherido a las biopelículas se eluyó con 200μl de alcohol 96% y se leyó la DO570 en un lector de microplacas Labsystem Multiscan EX (I.C.T, S.L. Instrumentación Científica Técnica, S.L.).
Para cada cepa se utilizaron 3 pocillos consecutivos cuyas DO fueron promediadas y corregidas por una DO de corte, obtenida con la suma del promedio de las DO de los pocillos control (3 pocillos de cada medio estéril no inoculado) y 3veces su desviación estándar10. De acuerdo con las DO corregidas, las cepas fueron clasificadas en 4categorías:
- –
No formadoras de biopelícula (NFB): DOcorregida < DOcorte.
- –
Débiles formadoras de biopelícula (DFB): DOcorte ≤ DOcorregida < 2DOcorte.
- –
Moderadas formadoras de biopelícula (MFB): 2DOcorte ≤ DOcorregida < 4DOcorte.
- –
Fuertes formadoras de biopelícula (FFB): DOcorregida > 4DOcorte.
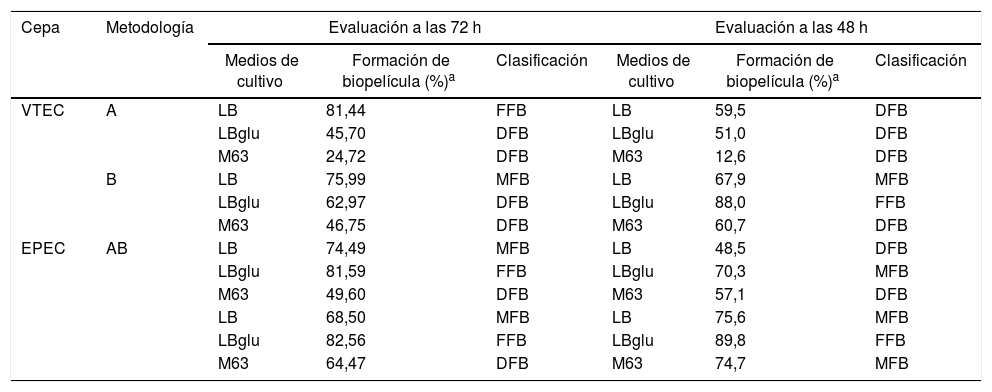
Se realizaron 2experimentos independientes que fueron analizados mediante ANOVA con el programa InfoStat 2015e (Universidad Nacional de Córdoba, Argentina). Para una mejor comprensión de la información, las DO corregidas se expresaron en porcentajes, tomando como 100% la DO promedio de cada cepa. Los porcentajes obtenidos para cada ensayo independiente fueron promediados y se muestran en la tabla 1.
Formación de biopelícula en placas de poliestireno de 2cepas de Escherichia coli, una VTEC y otra EPEC
| Cepa | Metodología | Evaluación a las 72 h | Evaluación a las 48 h | ||||
|---|---|---|---|---|---|---|---|
| Medios de cultivo | Formación de biopelícula (%)a | Clasificación | Medios de cultivo | Formación de biopelícula (%)a | Clasificación | ||
| VTEC | A | LB | 81,44 | FFB | LB | 59,5 | DFB |
| LBglu | 45,70 | DFB | LBglu | 51,0 | DFB | ||
| M63 | 24,72 | DFB | M63 | 12,6 | DFB | ||
| B | LB | 75,99 | MFB | LB | 67,9 | MFB | |
| LBglu | 62,97 | DFB | LBglu | 88,0 | FFB | ||
| M63 | 46,75 | DFB | M63 | 60,7 | DFB | ||
| EPEC | AB | LB | 74,49 | MFB | LB | 48,5 | DFB |
| LBglu | 81,59 | FFB | LBglu | 70,3 | MFB | ||
| M63 | 49,60 | DFB | M63 | 57,1 | DFB | ||
| LB | 68,50 | MFB | LB | 75,6 | MFB | ||
| LBglu | 82,56 | FFB | LBglu | 89,8 | FFB | ||
| M63 | 64,47 | DFB | M63 | 74,7 | MFB | ||
Con un tiempo de incubación total de 72 h (tabla 1, sector izquierdo), se encontraron diferencias significativas en la formación de biopelícula de las 2cepas con respecto al medio de cultivo utilizado (p = 0,0316), independientemente de la metodología empleada (p = 0,3413), en este caso los medios LB y LBglu fueron los que promovieron una mayor formación de biopelícula en las cepas VTEC y EPEC, respectivamente (p < 0,05). La cepa VTEC se clasificó como DFB en los medios LBglu y M63, y como FFB y MFB en LB (metodología A y B, respectivamente). La cepa EPEC fue considerada como DFB en M63, como MFB en LB y como FFB en LBglu, con las 2metodologías abordadas.
Con un tiempo de incubación total más corto, de 48 h (tabla 1, sector derecho), no se obtuvieron diferencias significativas respecto del medio de cultivo utilizado (p = 0,0744), pero sí respecto de la metodología empleada (p = 0,0067): fue la metodología B (con recambio del medio) aquella que permitió un mejor desarrollo de biopelícula. En este caso, la cepa VTEC se mostró como DFB en los 3medios de cultivo evaluados con la metodología A, pero con la metodología B resultó DFB solo en M63, ya que fue MFB en LB y FFB en LBglu. La cepa EPEC mantuvo un comportamiento similar que con 72 h de incubación y formó más biopelícula en el medio LBglu con ambas metodologías (MFB con metodología A y FFB con la metodología B), pero en este caso la metodología B llevó siempre a una mayor formación de biopelícula. Se debe destacar que ambas cepas resultaron FFB en LBglu con la metodología B y 48 h de incubación. Los datos relacionados con las DO obtenidas para cada tiempo de incubación y metodología empleada se muestran en el Material Suplementario.
La capacidad para formar biopelículas sobre superficies por parte de microorganismos potencialmente patógenos, como los aquí evaluados, se vincula directamente con la persistencia de estos en el ambiente y con su transmisión4. Para evitar el establecimiento de biopelículas y la posible contaminación cruzada es preciso llevar a cabo estrategias de control y mantener buenas prácticas de manufactura. Particularmente en la industria alimentaria, se debe prevenir la deposición de residuos orgánicos y su acumulación en aquellas superficies, tuberías y utensilios que puedan estar en contacto con los alimentos o las materias primas.
Dentro de la variedad de técnicas que se pueden utilizar para el estudio y la detección de biopelículas, este trabajo evaluó la influencia de la composición de los medios de cultivo que se emplean y 2metodologías diferentes, ambas en cultivo estático, sobre la formación de biopelícula de una cepa VTEC y de otra EPEC. Se pudo observar que ambas cepas resultaron formadoras de biopelícula en todos los medios de cultivo ensayados y con ambas metodologías de trabajo. Llama la atención que la cepa VTEC formó más biopelícula en medio LB cuando este se evaluó a las 72 h —cualquiera haya sido la metodología de trabajo—, pero que frente a una incubación más corta y con la metodología de recambio del medio de cultivo, es decir la metodología B, hubo mayor formación de biopelícula en LBglu. Esto puede vincularse con requerimientos diferentes por parte de cada cepa y el impacto de las distintas metodologías de evaluación. Podría suceder que frente a un mayor tiempo de incubación, los residuos metabólicos generados por la utilización de la glucosa en el medio LBglu y M63 afecten al desarrollo de VTEC de una manera distinta del de EPEC. A diferencia de otros informes que describen EPEC como buena formadora de biopelícula en medios mínimos con glucosa4, la cepa EPEC evaluada en este trabajo fue una fuerte formadora de biopelícula en un medio nutritivo suplementado con glucosa con ambas metodologías de trabajo y ambos tiempos de incubación.
Se ha estudiado la producción de biopelícula de E. coli y otras enterobacterias en distintos medios, como caldo tripticasa soya (TSB), peptona bacto (BP) y medios mínimos (MSM) suplementados con distintas fuentes de carbono (glucosa, manosa, glicerol, ácido láctico, entre otras). Se ha indicado que en medios mínimos suplementados con glucosa, las bacterias desarrollaron mejor las biopelícula, con una matriz extracelular más gruesa6. En nuestro estudio, sin embargo, se observó mayor formación de biopelícula cuando se empleó un medio nutritivo con glucosa. Esto concuerda con otras investigaciones que han encontrado que esta incorporación resultó favorecedora para al desarrollo de la biopelícula en E. coli O157:H7, posiblemente debido a que este hidrato de carbono serviría como sustrato para la formación de la matriz de exopolisacáridos y, por ende, aumentaría la cuantificación de la biomasa total14.
Habitualmente, se utilizan distintos tiempos de incubado para los ensayos de formación de biopelícula en condiciones estáticas, que varían desde 24 h hasta 5 días o más. La elección del tiempo de incubación depende de los objetivos propuestos y del microorganismo involucrado12. Dado que el desarrollo de las biopelículas transcurre en etapas similares a las descriptas para el crecimiento de las contrapartes planctónicas, resulta necesario encontrar la etapa de maduración de la biopelícula, que es la que está directamente relacionada con la resistencia a antibióticos o a agentes desinfectantes15.
Como conclusión, las cepas VTEC y EPEC evaluadas en este estudio fueron capaces de formar biopelícula sobre superficies de uso cotidiano, como el poliestireno, con mayor intensidad en medios de crecimiento nutritivos que en medios mínimos. La metodología B —que implicó el recambio del medio de cultivo en el mismo pocillo— junto con el uso de LB suplementado con glucosa y un tiempo de incubado de 48 h fueron las condiciones más favorables para el desarrollo de biopelículas en ambas cepas. En estudios recientes, la utilización de esta metodología ha brindado resultados reproducibles en la comparación de la formación de biopelícula de 30 cepas VTEC provenientes de bovinos y de casos clínicos de humanos; también ha permitido evaluar la formación de biopelícula frente a distintas condiciones de estrés físico-químico y térmico de cepas VTEC y EPEC aisladas de diversos reservorios (Cáceres, resultados no publicados).
La estandarización de las técnicas para evaluar la formación microbiana de biopelículas demanda tiempo, ya que en este proceso influyen diversas variables. En este estudio se identificaron cuáles son el medio de cultivo y la metodología de trabajo más adecuados para evaluar la producción de biopelícula por parte de 2cepas patógenas de E. coli.
FinanciaciónFONCyT-PICT 2013/1749 y SECAT-UNCPBA.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses
Los autores agradecen María R. Ortiz, técnica del Laboratorio de Inmunoquímica y Biotecnología (UNCPBA, Tandil, Buenos Aires, Argentina) por su asistencia técnica y colaboración en la realización de este trabajo.