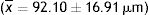En los últimos años, la relación entre la microbiota intestinal (MI), el hospedero y las enfermedades crónicas no transmisibles ha generado interés por conocer de qué manera es posible mantener esa comunidad en el hospedero. Las bacterias ácido lácticas (BAL) son bacterias gram positivas con actividad probiótica y beneficios demostrados para la salud, como la disminución de la masa de grasa corporal y del riesgo de padecer diabetes mellitus tipo 2. Uno de los principales mecanismos de colonización y supervivencia de las bacterias es la producción de biopelículas (BP) y la utilización de prebióticos como sustrato para lograr un equilibrio de la MI. Sin embargo, no existe evidencia suficiente para demostrar que los fructanos de agave (FA) promueven la formación de BP. El objetivo de este trabajo fue evaluar in vitro la formación de BP de un consorcio de BAL integrado por Lactobacillus delbrueckii ssp. lactis, L. delbrueckii ssp. bulgaricus y Streptococcus thermophilus en presencia de FA a distintas concentraciones: 0%, 0,1%, 4%, 8% y 16%. La adición de 0,1% de FA se correlacionó con una mayor capacidad para producir BP, de modo que se podría modular la formación de BP de estas bacterias mediante ese agregado. Las BP pueden tener un efecto positivo en el hospedero favoreciendo la homeostasis intestinal, la resistencia a la colonización, la estabilidad para la digestión de alimentos y las modificaciones químicas de los fármacos, además de tener efectos benéficos para la salud.
In recent years the relationship between the intestinal microbiota, the host and chronic non-communicable diseases has brought interest into the study of its formation and maintenance in the host. Lactic acid bacteria (BAL) are Gram-positive bacteria with probiotic activity, which have been associated with many health benefits, such as decreased body fat mass and lower risk of type II diabetes mellitus. One of the main colonization mechanisms and bacteria survival strategies is the production of biofilms and the use of prebiotics as substrates to achieve a balance within intestinal microbiota. However, there is not enough evidence to demonstrate the biofilm formation in the presence of agave fructans (AF). This study aimed to evaluate in vitro the biofilm formation in a consortium of lactic acid bacteria: Lactobacillus delbrueckii ssp. lactis, Lactobacillus delbrueckii ssp. bulgaricus y Streptococcus thermophilus in the presence of AF at different concentrations: 0%, 0,1%, 4%, 8% y 16%. The addition of 0,1% of AF correlates with the best capacity for biofilm formation. The findings imply the possibility of modulating the biofilm formation of lactic acid bacteria with AF. These results can contribute positively to the host, by generating intestinal homeostasis, colonization resistance, stability to food digestion and chemical modifications of drugs and carry out beneficial functions to the health.
Las interacciones simbióticas están ampliamente extendidas en la naturaleza y el ser humano no es la excepción. La mucosa intestinal humana es el nicho de aproximadamente 10 trillones de simbiontes1 que, en su conjunto, reciben el nombre de microbiota intestinal (MI)10. La MI está compuesta por bacterias (filos Firmicutes, Bacteroidetes, Actinobacteria, Fusobacteria, Proteobacteria, Verrucomicrobia y Cianobacteria), arqueas, protozoos, bacteriófagos, virus que infectan organismos eucarióticos y hongos1.
La composición y dinámica de la MI y la colonización del hospedero están determinadas por diversos factores, incluidos el estado dietético-nutricional, el ambiente, el estilo de vida, el binomio salud-enfermedad y la ingesta de fármacos, como antibióticos9. La MI desempeña una amplia variedad de funciones metabólicas: participa en la digestión y obtención de energía mediante la hidrólisis de los componentes de la dieta (glúcidos, proteínas y lípidos) y en la síntesis de vitaminas (K, B12, biotina, ácido fólico y ácido pantoténico); además, favorece la absorción de diversos minerales como calcio, fósforo, magnesio y hierro8. Cuando la homeostasis de la MI se altera (disbiosis), se inicia un proceso inflamatorio de la mucosa intestinal, lo que conduce al desarrollo de enfermedades crónicas e infecciones oportunistas9. De ahí la importancia de mantener la homeostasis de la MI (eubiosis) para preservar la salud del individuo.
Actualmente, está demostrado que el desarrollo y mantenimiento de una MI sana puede lograrse a través de diversos mecanismos, por ejemplo, mediante una dieta rica en fibra y baja en grasa y disminuyendo el uso de antibióticos. Por otro lado, también se ha documentado el uso de compuestos bioactivos, provenientes principalmente de alimentos vegetales12, conocidos como prebióticos. Algunos ejemplos de prebióticos son los fructooligosacáridos (FOS), los galactooligosacáridos (GOS), la lactulosa y los oligosacáridos de la leche humana (HMO), a los que actualmente se suman como candidatos a prebióticos algunos minerales, polifenoles y ácidos grasos poliinsaturados18.
Los FOS son los prebióticos vegetales más frecuentemente utilizados en la terapia nutricional. Químicamente son oligosacáridos lineales de fructosa con enlaces β (2→1); dentro de este grupo, la inulina es uno de los FOS mejor caracterizados5,26. La inulina otorga varios beneficios a la salud: tiene efectos antioxidantes, disminuye la obesidad, la resistencia a la insulina, la inflamación y la hiperuricemia, y mejora la mucosa intestinal, las enfermedades renales y el metabolismo de los lípidos, entre otros30. Los beneficios de la inulina se relacionan con la mejoría de la MI dado que estimula el crecimiento de bacterias simbióticas benéficas (p. ej., bifidobacterias, lactobacilos, Aureobasidium pullulans y Escherichia coli no patogénica) que pueden fermentar los prebióticos24,27. Estas bacterias benéficas reciben el nombre de probióticos y pueden obtenerse exógenamente a través de la alimentación o de suplementos.
Los beneficios de los probióticos incluyen mejoría en enfermedades relacionadas con el intestino, el hígado y el sistema inmunitario, en enfermedades neurodegenerativas y en la obesidad, así como en la aterosclerosis, la depresión, las enfermedades infecciosas, las alergias, el síndrome metabólico, el cáncer y la diabetes mellitus8,20,32.
Los probióticos más usados son las bacterias ácido lácticas (BAL), como Lactobacillus spp. y Bifidobacterium spp., y también especies de Saccharomyces25. La eficacia de los probióticos depende, principalmente, de las propiedades microbiológicas y fisiológicas de las cepas seleccionadas8, así como de las características bioquímicas de los prebióticos5. Existen preparaciones probióticas que se comercializan, como el VSL#334, que ya ha sido analizado en ensayos con humanos. Este producto está compuesto de cuatro cepas de Lactobacillus spp., tres de Bifidobacterium spp. y una de Streptococcus spp.11,19,33 y su uso se asoció con importantes mejorías en el tracto gastrointestinal25. Otra preparación que incluye una mezcla de 11 cepas de Lactobacillus spp. y Bifidobacterium spp. mostró un alto potencial para el manejo del síndrome de intestino irritable a través de la inmunomodulación en el hospedero7.
Un aspecto importante para el mantenimiento de la MI en el intestino es la adhesión de las bacterias sobre las células epiteliales o la mucosa. Este proceso está relacionado con la formación de una biopelícula (BP). Las bacterias son capaces de formar BP una vez que alcanzan una densidad poblacional tal que la comunicación entre ellas es sincrónica (quorum sensing). La BP es un agregado de microorganismos dentro de una matriz de biopolímeros compuesta por el hospedero y el microorganismo, que se adhiere a partículas de alimento, a la mucosa o al epitelio28. Los problemas en el desarrollo de la BP y su contacto con la mucosa están asociados a enfermedades intestinales, de tal modo que la formación de la BP contribuye a la homeostasis del intestino y a la organización, comunicación, estabilidad y resiliencia de la MI, así como a la digestión de los alimentos y modificación de algunos fármacos en el hospedero17,38. En este sentido, la BP se está convirtiendo en un nuevo biomarcador para detectar algunas enfermedades como el cáncer colorrectal y la enfermedad de intestino irritable17.
La formación de la BP es un aspecto que debe ser considerado al momento de establecer consorcios bacterianos como posibles simbióticos para mejorar la MI. Por ello, este trabajo tuvo como objetivo evaluar in vitro la formación de BP de un consorcio de BAL, Lactobacillus delbrueckii ssp. lactis, L. delbrueckii ssp. bulgaricus y Streptococcus thermophilus, en presencia de fructanos comerciales originarios de agave (FCOA), tipo inulina.
Materiales y métodosCondiciones de cultivoLas cepas L. delbrueckii ssp. lactis, L. delbrueckii ssp. bulgaricus y S. thermophilus se adquirieron de Danisco France S.A. (Dangé Saint Romain, Francia). Estas se encontraban liofilizadas y se activaron en medio de cultivo Man Rogosa Sharpe (MRS) (BD Bioxon) a 37°C por 24 horas en atmósfera microaerofílica, en contenedores de anaerobiosis de la marca Merck TM® (KGaA, Darmstadt, Alemania) al 5% de O2.
Efecto prebiótico de fructanos de agave sobre BALPara evaluar la capacidad prebiótica de los fructanos de agave (FA) en las BAL de interés, se inoculó 500μl de un cultivo fresco del consorcio en Erlenmeyer con 50ml de caldo MRS previamente suplementado con FA (inulina) a distintas concentraciones: 0,1%, 4%, 8% y 16%. Estos cultivos se incubaron a 37°C durante 69 horas en las condiciones de anaerobiosis antes descritas. Transcurrido ese tiempo, se determinó la densidad óptica (DO) de los cultivos empleando alícuotas de 200μl y se la comparó con la DO inicial (que fue 0,1 en todos los casos). La DO se midió a una longitud de onda de 620nm en un lector de placas microtiter (Labsystems Multiskan Ascent 354). Se incluyeron controles negativos de caldo MRS y caldo MRS adicionado con FA.
El análisis estadístico de los resultados incluyó la prueba de análisis de la varianza (ANOVA) y comparaciones múltiples con la prueba de Tukey; se empleó el software GraphPAD Prism 8.0.1. Dotmatics.
Inducción de la formación de biopelícula en presencia de FAPara evaluar la inducción de BP en presencia de FCOA, se usó el producto comercial Organic agave inulin® (enature taste feel evolution), México. Los cultivos de BAL se prepararon inoculando 500μl de los cultivos frescos previamente activados en medio MRS adicionado con fructanos al 0,1%, 4%, 8% y 16%. La formación de BP se ensayó en microplacas MicrotiterTM de 96 pocillos de fondo plano, en cada pocillo se colocó 200μl de MRS adicionado con el consorcio de cepas y los FA, todos los tratamientos se incubaron bajo las condiciones ya descritas durante 69 horas.
Tinción con cristal violetaPara visualizar la producción de BP, al término de la incubación se desechó el sobrenadante y se realizaron cuatro lavados con agua destilada mediante agitación vigorosa para eliminar las bacterias no adheridas, luego se dejó secar la microplaca a temperatura ambiente durante 20 minutos. Las BP adheridas en los pocillos fueron teñidas con 200μl de violeta de genciana (Golden Bell®, México) al 0,1% durante cinco minutos, después el colorante fue retirado por decantación y los pocillos se lavaron nuevamente cuatro veces con 200μl de agua destilada. Las microplacas se dejaron secar a temperatura ambiente durante una hora, luego se añadió 200μl de caldo MRS y se dejó reposar durante cinco minutos. Para cuantificar la BP, las microplacas se llevaron a un lector de ELISA (Labsystems Multiskan Ascent 354) para medir la DO a 540nm; se incluyó la lectura de un control negativo.
Clasificación de la capacidad de formación de biopelículaPara clasificar el estímulo para la formación de BP ejercido por los FA sobre las BAL, se usaron placas de microtitulación. En función de la DO leída y de acuerdo con la clasificación propuesta por Manijeh et al.17, se delimitaron cuatro categorías de capacidad de formación de BP: no formadoras (0), débilmente formadoras (+), moderadamente formadoras (++) y fuertemente formadoras (+++) (tabla 1). El punto de corte del control (densidad óptica del control negativo [DOc]) se definió como tres desviaciones estándar (DE) más la DO media de los controles: DOc=DO media de los controles+(3x DE de los controles). La DO final de cada una de las muestras se calculó como el valor de la DO medido menos el valor de DOc. Si dicha resta daba un valor negativo, este se anotaba como 0, mientras que cualquier valor positivo indicaba la producción de BP29.
Clasificación de la formación de BP basada en la DO medida a 540nm16
| No formadoras (0) | DO ≤ DOc |
| Débilmente formadoras (+) | DOc <DO ≤ 2(DOc) |
| Moderadamente formadoras (++) | 2 (DOc) <DO ≤ 3(DOc) |
| Fuertemente formadoras (+++) | 3 (DOc) <DO |
BP: biopelícula; DO: densidad óptica; DOc: densidad óptica del control negativo.
La viabilidad bacteriana posterior a la formación de BP se determinó tomando 50μl de sobrenadante del ensayo de inducción y sembrándolo en cajas de Petri que contenían agar MRS. Estas placas se incubaron en las condiciones de anaerobiosis descritas por 24 horas; con este ensayo se verificó la viabilidad de las bacterias formadoras de BP.
ResultadosDeterminación del crecimiento de BAL en presencia de FALos FA indujeron el crecimiento de las BAL de manera significativa, como se observa en la figura 1. En todos los casos, la biomasa bacteriana en el punto final (69 horas) se incrementó con respecto al punto inicial (0 horas). En este sentido, los mayores incrementos se observaron con concentraciones de FA del 0,1% y 4%; sin embargo, se esperaría que a mayor concentración fuera proporcional el incremento de la biomasa.
Crecimiento del consorcio de BAL en ausencia o presencia de FA a distintas concentraciones.
Se muestran valores de media± DE. Uno (*), dos (**) o tres (***) asteriscos indican diferencias significativas para p <0,05; p <0,01 y p <0,001, respectivamente.
BAL: bacterias ácido lácticas; DE: desviación estándar; FA: fructanos de agave.
Una vez comprobado el uso de los FA como fuente de carbono durante el crecimiento bacteriano, se decidió analizar la capacidad de los FA para promover la formación de BP. A la concentración de 0,1%, los FA mostraron una estimulación en la producción de BP con respecto al control (fig. 2). De acuerdo con los valores de DO obtenidos, el tipo de BP fue débil en los controles en ausencia de FA y fuerte en presencia de 0,1% de FA. A la concentración de 0,1%, la formación de BP fue casi dos veces mayor con respecto al control. Sin embargo, cuando se añadió 4%, 8% y 16% de FA, no se observó incremento en la producción de BP.
Formación de BP in vitro del consorcio de BAL en ausencia o presencia de FA a distintas concentraciones.
Se muestran valores de media±DE. Control: muestra no inoculada. Tres (***) asteriscos indican diferencias significativas para p <0,001.
BAL: bacterias ácido lácticas; BP: biopelícula; DE: desviación estándar; FA: fructanos de agave.
Aunque la inducción de la biomasa bacteriana en cultivos con 0,1% y con 4% de FA fue de similar magnitud (fig. 1), no sucedió lo mismo con la producción de BP, ya que no se observó incremento de la formación de BP en los cultivos a los que se les añadió concentraciones de FA de 4%, 8% y 16%.
La figura 3 muestra que hubo crecimiento bacteriano luego de 24 horas de incubación a partir de la siembra de todas las muestras enriquecidas con FA, lo que implica que el consorcio siguió viable tras la formación de la BP después de 69 horas de incubación en presencia FA. Asimismo, se puede notar el mayor efecto positivo de los FA a concentraciones del 0,1% y 4% con respecto a las concentraciones de 8% y 16%.
Viabilidad bacteriana posformación de BP.
Se muestra el crecimiento en MRS luego de 24 horas de incubación de alícuotas de cultivos controles no adicionados con FA (a) y de cultivos adicionados con 0,1% (b), 4% (c), 8% (d) y 16% (e) de FA.
BP: biopelícula; FA: fructanos de agave; MRS: Man Rogosa Sharpe.
De acuerdo con los valores obtenidos en una medición de punto final de DO a 540nm, las BAL se clasificaron en las siguientes cuatro categorías de tipo semicuantitativo: no formadoras de BP, débilmente formadoras, moderadamente formadoras y fuertemente formadoras.
Para establecer los límites, a partir de tres muestras consideradas como control negativo, se calculó la media, que fue 0,04. Para llegar al valor del punto de corte estándar (DOce), a ese valor se le sumó tres veces la DE de los controles, que fue 0,043.
Así, los valores superiores a 0,169 se consideraron indicadores de muestras formadoras de BP para este consorcio de BAL (tabla 2). El consorcio se comportó como débilmente formador de BP en ausencia de FA al 0,1% (la DO se ubicó entre 0,169 y 0,338) y como fuertemente formador de BP en presencia de FA al 0,1% (la DO superó el umbral de 0,507).
Clasificación semicuantitativa de la capacidad de formación de BP de BAL
| Clasificación | Fórmula | Rangos |
|---|---|---|
| No formadoras (0) | DO 540 ≤ DOce | DO ≤ 0,169 |
| Débilmente formadoras (+) | DOc <DO 540 ≤ 2(DOce) | (0,169 <DO ≤ 0,338) |
| Moderadamente formadoras (++) | 2 (DOce) <DO 540 ≤ 3 (DOce) | (0,338 <DO ≤ 0,507) |
| Fuertemente formadoras (+++) | 3 (DOce) <DO 540 | (0,507 <DO) |
BAL: bacterias ácido lácticas; BP: biopelícula; DO: densidad óptica; DOc: densidad óptica del control negativo; DOce: punto de corte estándar del control.
En los últimos años, se han investigado minuciosamente los efectos perjudiciales para la salud humana de la formación de BP por bacterias patógenas gram negativas. Sin embargo, no se ha investigado extensivamente el beneficio que puede implicar para la salud humana la producción de BP de bacterias gram positivas, particularmente de las BAL, consideradas probióticos. Si bien varios estudios han investigado la capacidad de formación de BP de cepas de Lactobacillus4,31,37, la evaluación de la formación de BP de las BAL en presencia de un sustrato específico, como los FA, ha sido poco explorada, aun cuando estos ya han sido considerados prebióticos.
Es importante evaluar la BP producida por bacterias calificadas como probióticos, ya que, de acuerdo con Kubota et al.14, la presencia de las BP, particularmente en BAL, funciona como un mecanismo de defensa frente a la colonización de otros microorganismos, es decir, las protegería frente a un ambiente hostil y evitaría la colonización por bacterias patógenas. Las BAL consideradas formadoras de BP corresponden a Lactobacillusrhamnosus13, Lactobacillus plantarum14 y L. rhamnosus GG3. En este estudio nos hemos centrado en la BP mixta formada por L. delbrueckii ssp. lactis, L. delbrueckii ssp. bulgaricus y S. thermophilus; los resultados obtenidos son similares a los reportados por Rezaei et al.24, quienes encontraron que los microorganismos que formaron BP más fuertes fueron L. delbrueckii, L. plantarum, L. delbrueckii ssp. lactis, Lactobacillus brevis y L. lactis subsp. lactis, e incluso tuvieron efectos antibacterianos más notorios en comparación con las bacterias que se encontraban en forma planctónica. Ya se ha evidenciado que algunas BAL poseen los genes y las enzimas requeridas para llevar a cabo la fermentación de fructanos, para su posterior utilización16. Sin embargo, existe un vacío con respecto a las funciones específicas de estos genes. Tampoco se ha determinado qué especies de BAL tienen afinidad por sustratos específicos, como los fructanos, ni qué concentración es la más adecuada para que haya un efecto de estimulación en la producción de exopolisacáridos (EPS) y la formación de BP.
En este estudio se utilizaron FA y se comprobó que el consorcio microbiano de BAL evaluado fue capaz de utilizarlos mediante la fermentación para obtener energía y aumentar la biomasa y la formación de BP. Esto concuerda con los resultados publicados por Probert et al.23, quienes informaron que los géneros Lactobacillus y Bifidobacterium presentan enzimas denominadas fructosil-furanosidasas, las que pueden degradar los enlaces β de los fructanos, por lo que esta característica les permite crecer en los medios que incluyan dichos carbohidratos como fuente energética. Asimismo, Cerning et al.6 y Oleksy et al.21 mencionan que las fuentes de carbono y nitrógeno pueden estar implicadas directamente en el rendimiento y la composición de los exopolisacáridos biosintetizados por Lactobacillus para la formación de BP, así como también en las interacciones entre distintas fuentes de carbono en un mismo medio de cultivo.
En este estudio se utilizó un tiempo de fermentación de 69 horas, un pH de 4 y una temperatura de 33°C. Adesulu et al.2 y Wang et al.35 informaron que el tiempo de cultivo, la temperatura y el pH influyen en el crecimiento y la producción de EPS por BAL para la formación de BP.
El tiempo de incubación utilizado en nuestros experimentos se considera dentro de los parámetros de un cultivo de fermentación prolongada; incluso microscópicamente se observó que las BP se encontraban en la etapa de maduración e iniciando la etapa de dispersión. Los valores de la DO 540nm reflejan una disminución en la producción de BP de las muestras de BAL+FA al 4%, 8% y 16%, ya que a esas concentraciones se consideran formadores de BP débil. Esto podría ser el resultado de la producción de enzimas que degradan la BP por parte de estas bacterias. En el 2000, Phan et al.22 informaron por primera vez que se detectan hidrolasas de glucósidos al final de la fase de crecimiento logarítmico y en la fase de declive en los cultivos de L. rhamnosus R, lo que puede explicar la degradación de EPS en cultivos prolongados de BAL. Estos resultados fueron confirmados por Tsuda et al.33 y por Zhang et al.37, quienes comunicaron que la disminución en las cantidades de EPS para la formación de BP después de una incubación prolongada de diferentes cepas de Lactobacillus productoras de EPS se debía a la acción de las glucohidrolasas en el cultivo, que catalizan la degradación de los exopolisacáridos. De la misma forma, Lin et al.15 y Yang et al.36 mencionan que la posible presencia de glucohidrolasas que hidrolizan EPS a monómeros podría causar la disminución en el rendimiento de EPS durante la fermentación prolongada, y, por lo tanto, la disminución en la formación de BP. Sin embargo, Skyberg et al.29 reportaron que la cantidad de BP fue sensiblemente mayor en los medios mínimos, tal como se observó en el presente estudio y en concordancia con lo informado en investigaciones anteriores, Sadekuzzaman et al.26 mostraron que tanto la adherencia bacteriana como la formación de BP son estimuladas en condiciones de escasez de nutrientes en el medio. Nuestros resultados indican que las condiciones experimentales son fundamentales y que es necesario seguir evaluando diferentes concentraciones de FA y distintos tiempos de fermentación para llegar a conclusiones más firmes con respecto de los efectos in vitro de los FA sobre las BAL y la formación de BP.
ConclusionesLos FCOA (compuestos con beneficios para la salud ya reportados en la literatura) en una concentración del 0,1% fueron capaces de estimular el crecimiento bacteriano y la producción de exopolisacáridos para la formación de BP de tipo fuerte en un consorcio de BAL compuesto por L. delbrueckii ssp. lactis, L. delbrueckii ssp. bulgaricus y S. thermophilus. Se comprobó que la disponibilidad de fructanos es importante para que estas bacterias puedan tener el sustrato necesario para producir exopolisacáridos y formar la BP como método de supervivencia. Estos hallazgos sugieren la posibilidad de modular la formación de BP de las BAL a partir del uso de FCOA al 0,1% para aumentar su supervivencia y permitir que ejerzan funciones benéficas para la salud humana, evitando el desequilibrio de la MI y previniendo las enfermedades relacionadas con ese desbalance.
AgradecimientosMCC Condado-Huerta agradece a CONACYT por la beca de posgrado otorgada número 741677.
FinanciaciónNo se contó con entidad financiera. Solo con apoyo de beca de manutención otorgada a la autora por parte del Consejo Nacional de Ciencia y Tecnología (CONACYT) con número 741677.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.