Aunque el colesterol unido a las lipoproteínas de baja densidad (c-LDL) está bien establecido como un factor de riesgo de las enfermedades cardiovasculares; existe frecuentemente un patrón dislipidémico más complejo que contribuye a la formación de la placa arteriosclerótica. El colesterol no HDL (c-NO-HDL) se utiliza para la estimación de la cantidad total de lipoproteínas aterogénicas en plasma, algunas de las cuales no son determinadas habitualmente en la práctica clínica diaria. El c-NO-HDL se calcula fácilmente a partir de la sustracción de la cifra de colesterol total plasmático el contenido de colesterol vehiculizado por las lipoproteínas de alta densidad. El c-NO-HDL presenta una superioridad predictora sobre el c-LDL para estimar el riesgo de eventos cardiovasculares mayores en los estudios epidemiológicos. Los estudios genéticos mediante análisis del genoma completo, junto a los basados en la aleatorización mendeliana, apuntan al carácter etiológico del c-NO-HDL sobre la cardiopatía isquémica (CI). Los estudios de intervención, y los metaanálisis de ellos derivados, cierran el círculo causal entre c-NO-HDL y CI al demostrar que cualquier intervención que haga disminuir las concentraciones del primero aminora la incidencia de la cardiopatía arteriosclerótica. La guía europea ESC/EAS 2016 para el manejo de las dislipidemias contempla al c-NO-HDL como una diana terapéutica con una recomendación clase iia (debería realizarse), nivel B (datos de un único RCT o de varios no RCT), y fija su objetivo en menor de 100 o 130mg/dl para aquellos pacientes con muy alto riesgo o alto riesgo, respectivamente. Estos valores a lograr de c-NO-HDL se calculan fácilmente añadiendo 30mg/dl a los objetivos c-LDL.
Although cholesterol linked to low-density lipoproteins (c-LDL) is well established as a risk factor for cardiovascular disease, there is often a more complex dyslipidaemia pattern that contributes to the formation of atherosclerotic plaque. Non-HDL cholesterol (c-NO-HDL) is used to estimate the total amount of atherogenic lipoproteins in plasma, some of which are not usually determined in daily clinical practice. c-NO-HDL is easily calculated from the subtraction of total plasma cholesterol from the cholesterol content carried by high density lipoproteins. The c-NO-HDL has a predictive value superior to that of C-LDL to estimate the risk of major cardiovascular events in epidemiological studies. Genetic studies by analysis of the complete genome, together with those based on Mendelian randomisation, point to the aetiological character of c-NO-HDL on ischaemic heart disease (IHD). Intervention studies, and the meta-analyses derived from them, close the causal circle between c-NO-HDL and IHD, by demonstrating that any intervention that decreases the concentrations of the former reduces the incidence of arteriosclerotic heart disease. The European ESC/EAS 2016 guide for the management of dyslipidaemia considers c-NO-HDL as a therapeutic target with a Class IIa recommendation (should be performed) Level B (data from a single randomised clinical trial [RCT]) or from several non-RCTs), and sets its target at less than 100 or 130mg/dL for those patients with very high risk or high risk, respectively. These achievable c-NO-HDL values are easily calculated by adding 30mg/dL to the c-LDL targets.
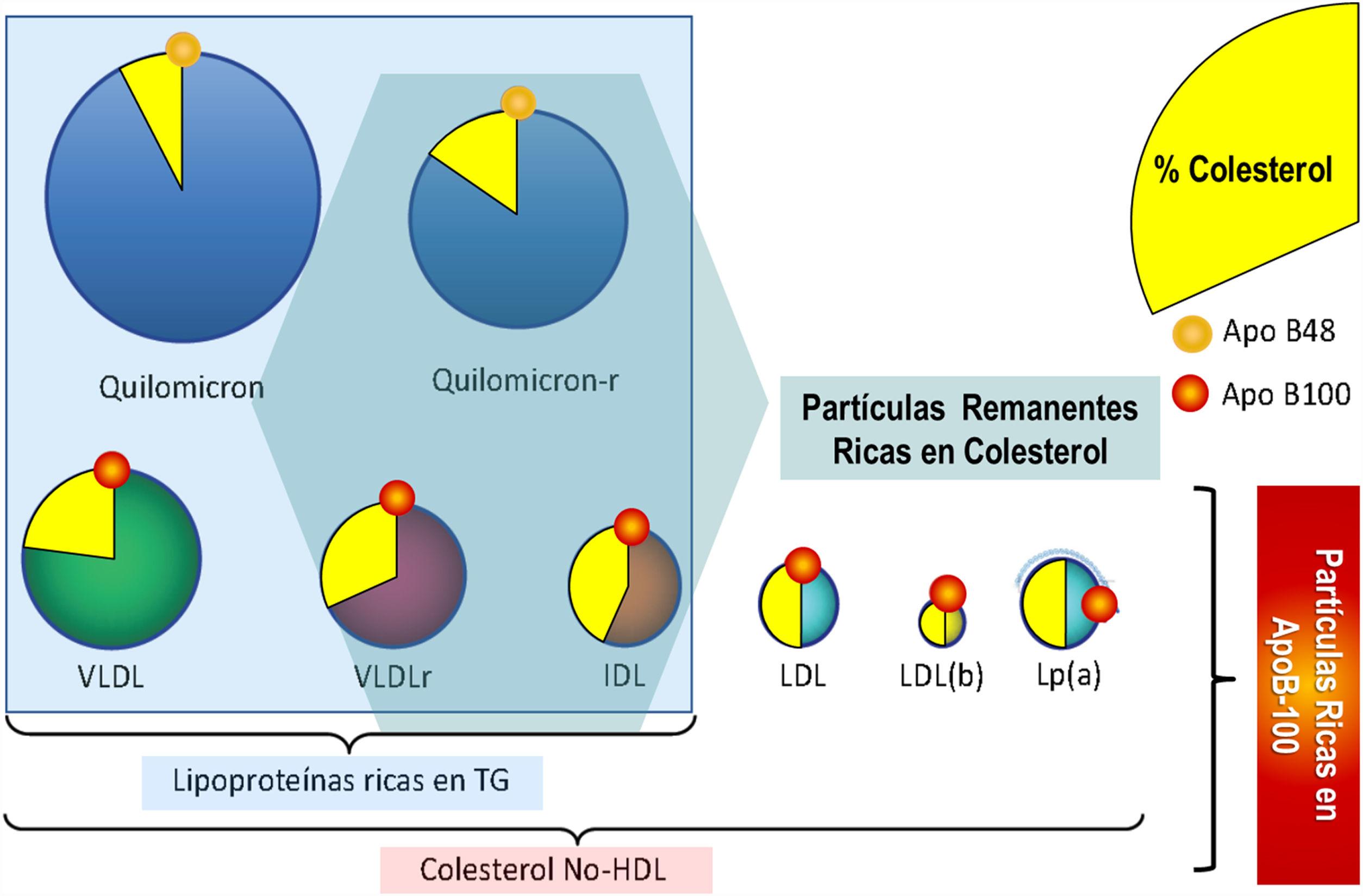
Aunque el colesterol unido a las lipoproteínas de baja densidad (c-LDL) está bien establecido como un factor de riesgo de las enfermedades cardiovasculares (ECV)1, existe frecuentemente un patrón dislipidémico más complejo que contribuye a la formación de la placa de arteriosclerótica constituido por niveles elevados de triglicéridos (TG), remanentes de quilomicrones, lipoproteínas de muy baja densidad (VLDL) y de densidad intermedia, lipoproteína (a) y una subfracción de las lipoproteínas LDL denominadas pequeñas y densas (fig. 1). Las concentraciones elevadas de estas lipoproteínas aterogénicas se asocian con el riesgo de ECV incluso en presencia de niveles bajos de c-LDL2.
Distribución de las lipoproteínas ricas en triglicéridos y las partículas que abarca el colesterol no HDL.
apoB: apolipoproteína B; HDL: lipoproteínas de alta densidad; IDL lipoproteínas de densidad intermedia; LDL(b): subfracción de lipoproteínas LDL pequeñas y densas; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína (a); Quilomicron-R: quilomicrón residual; TG: triglicéridos; VLDL: lipoproteínas de muy baja densidad; VLDLr: lipoproteínas de muy baja densidad residuales.
Adaptada con permiso de Hernández-Mijares A, Ascaso JF, Blasco M, Brea A, Díaz A, Mantilla T, et al.. Residual cardiovascular risk of lipid origin. Components and pathophysiological aspects. Clin Investig Arterioscler. 2018 Sep 24. [Epub ahead of print]. doi: 10.1016/j.arteri.2018.06.007.
La presencia de una hipertrigliceridemia refleja un elevado número de alguno de los tipos de lipoproteínas ricas en TG, que se relacionan de forma variable con el riesgo cardiovascular (RCV). Así, la mayoría de las partículas de quilomicrones son demasiado grandes para entrar en la pared arterial y, por lo tanto, el colesterol que contienen no son una amenaza para su integridad. Sin embargo, tras la deslipidización parcial de los quilomicrones y de las VLDL, sus partículas remanentes (TRL) presentan una composición empobrecida en TG pero elevada en colesterol. Aquellas con un diámetro inferior a 70nm —que por su tamaño llevan más cantidad de colesterol por partícula que las LDL3— pueden penetrar en la íntima arterial, donde se unen selectivamente a la matriz del tejido conectivo. Allí pueden ser captadas por los receptores basurero de los macrófagos residentes sin necesidad de oxidarse previamente, como precisan las LDL, para formar células espumosas contribuyendo de esta manera a la formación y progresión de la placa4. Es principalmente este contenido de colesterol de las TRL el que contribuye directamente a la progresión de la aterosclerosis, en lugar de los TG mismos5. Los remanentes de TRL también han demostrado promover la disfunción endotelial, inhibir la fibrinólisis, favorecer la coagulación mediante la activación plaquetaria y fomentar la inflamación vascular, fenómenos que conjuntamente potencian la aterogénesis6.
Definición del colesterol no HDLEl colesterol no HDL (c-NO-HDL) se utiliza para la estimación de la cantidad total de lipoproteínas aterogénicas en plasma, algunas de las cuales no son determinadas habitualmente en la práctica clínica diaria. El c-NO-HDL se calcula fácilmente a partir de la sustracción de la cifra de colesterol total plasmático el contenido de colesterol vehiculizado por las lipoproteínas de alta densidad (HDL).
c-NO-HDL=colesterol total – c-HDL
El c-NO-HDL puede determinarse si necesidad de que el paciente esté en ayunas pues la variación de su determinación entre el estado de ayuno y el posprandial es solo de un 8%7.
Valor predictivo del colesterol no HDLEstimar el riesgo de ECV empleando solo las concentraciones plasmáticas de c-LDL ignora el resto de partículas aterogénicas circulantes. Además, tanto la fórmula de Friedewald como las estimaciones directas de c-LDL tienen limitaciones en sujetos con hipertrigliceridemia y en sujetos con muy bajas concentraciones de c-LDL8. El c-NO-HDL permite obviar ambas contingencias, ya que se correlaciona bien con la concentración de apolipoproteína B, que es un buen indicador del número total de las lipoproteínas aterogénicas9, expresando la totalidad del colesterol vehiculizado por ellas. De acuerdo con esta relación, los primeros estudios poblacionales demostraron que el c-NO-HDL es un predictor del riesgo de ECV10,11 y de mortalidad12 más fuerte que el c-LDL. Un metaanálisis realizado en 302.430 participantes sin ECV previa, procedentes de 68 estudios, confirmó que el c-NO-HDL era un factor de riesgo para el desarrollo de cardiopatía isquémica (CI) tras haberse ajustado los resultados a las variables de edad, presión arterial sistólica, estado de fumador, antecedentes de diabetes mellitus e índice de masa corporal. En este estudio también los TG obtuvieron una asociación positiva con la CI, que desapareció al introducir como variable el colesterol HDL (c-HDL). Por el contrario, el c-NO-HDL permaneció significativamente relacionado con la CI y con los accidentes cerebrovasculares agudos tras considerar las concentraciones de c-HDL y de TG13. Esta superioridad predictora del c-NO-HDL y de la apoB sobre el c-LDL para estimar el riesgo de eventos cardiovasculares mayores (ECVM) en los estudios epidemiológicos ha quedado bien establecida14. Incluso en pacientes tratados con estatinas, otro metaanálisis demostró la superioridad del c-NO-HDL sobre el c-LDL y la apoB para predecir ECVM, especialmente en aquellas personas que alcanzan un objetivo c-LDL inferior a 100mg/dl pero mantienen sus concentraciones de c-NO-HDL por encima de los 130mg/dl15. Un último metaanálisis más reciente de los datos aportados por 448.732 casos provenientes de 9 estudios prospectivos realizados en población general, demostró un aumento aproximado del 79% en el riesgo de presentar una futura CI al comparar a los individuos con las concentraciones más altas de c-NO-HDL frente a los que presentaron los niveles séricos más bajos16.
Asociación del colesterol no HDL con la cardiopatía isquémica en los estudios genéticosLos estudios genéticos han dado un enorme impulso a la confirmación de que los niveles de TG, y de las partículas que los transportan, contribuyen en la génesis de las enfermedades derivadas de la arteriosclerosis. El hecho de que la hiperlipoproteinemia tipo iii —un trastorno monogénico del metabolismo de los TG— predisponga a quienes la padecen al desarrollo de la ECV ha incitado al estudio de los procesos genéticamente determinados que elevan los niveles de TG y de TRL, y a relacionarlos con el desarrollo de las manifestaciones arterioscleróticas.
Como se ha comentado previamente, el c-NO-HDL incluye a las lipoproteínas aterogénicas ricas en TG, por lo que los hallazgos genéticos que estableciesen a estas como factores causales de la aterogénesis pueden hacerse extensivos al propio c-NO-HDL.
Análisis de mutaciones por secuenciación del exomaMediante la secuenciación del exoma se encontró una mutación en el gen que codifica la apoproteína A-V (apoA5) —un activador de la lipoproteína lipasa (LPL), que es una enzima clave que cataboliza los TG— que se ha asociado con un aumento de los niveles de TG y, simultáneamente, se ha correlacionado la hipertrigliceridemia de los portadores con un mayor riesgo de cardiopatía coronaria y de infarto de miocardio17. Por el contrario, mediante esta misma técnica, una rara mutación de APOC3 que conlleva una pérdida de su función natural de inhibir la LPL, se asoció a una disminución de las concentraciones de TG y a una disminución del riesgo de cardiopatía coronaria18.
Estudios de asociación del genoma completoLos estudios de asociación del genoma completo están diseñados para buscar grandes cohortes de variantes genéticas comunes, tales como polimorfismos de un único nucleótido (SNP), que se producen con mayor frecuencia en pacientes con una determinada enfermedad en comparación con aquellos sin la enfermedad, y así identificar genes susceptibles que pueden contribuir a dicha enfermedad. Se han realizado estudios de asociación de genoma completo para identificar loci con susceptibilidad de generar enfermedades del corazón, así como rasgos de lípidos específicos asociados a ellas.
Un estudio demostró que los loci que presentan una fuerte asociación con los niveles altos de TG o de c-LDL, pero no con las concentraciones de c-HDL; también están relacionados con el desarrollo de CI, independientemente de los valores del resto de los lípidos19.
Estudios aleatorización mendelianaLos estudios de aleatorización mendeliana se basan en la segregación y la independencia de los genotipos (alelos) específicos de acuerdo con las leyes de la genética mendeliana. En estos estudios, las personas con determinados genotipos que predisponen a un efecto específico (p. ej., hipertrigliceridemia) se comparan con otras carentes de los mismos. Debido a que estos estudios no se ven afectados por los factores de confusión registrados en los estudios epidemiológicos observacionales, pueden proporcionar pruebas sólidas para la participación causal de un mecanismo específico en un estado de enfermedad. En genética humana, este tipo de estudios basados en la genética mendeliana tienen muchas similitudes con los ensayos de intervención aleatorizados, controlados y doble ciego (RCT), debido a la asignación de los alelos al azar por la naturaleza con la ventaja adicional sobre estos y sobre los estudios epidemiológicos clásicos de que el efecto producido por la mutación es de por vida y no por un tiempo limitado de seguimiento. Diversos trabajos analizan los efectos de la exposición a niveles altos de TG y su repercusión en la CI. Los basados en las cohorte danesas identificaron algunas variantes de APOA5 y de LPL que se asociaron tanto a los progresivos aumentos de los niveles de TG posprandiales y de colesterol remanente calculado como a los correspondientes incrementos en el riesgo de CI20,21. Un metaanálisis de 17 estudios que examinó todos los SNP asociados a c-LDL, TG y c-HDL concluyó que aquellos que aumentaban los TG y las LDL pero no las HDL, se asociaron significativamente a las coronariopatías22.
Tomados en conjunto, los datos genéticos sobre los TG y las TRL se alinean con los procedentes de estudios epidemiológicos y clínicos para apoyar el papel causal de estos lípidos en la ECV. Además, estos datos pueden compararse favorablemente con los que vinculan el c-LDL con el desarrollo de arteriosclerosis, en contraste con los del c-HDL del que descartan su implicación. Este último hallazgo es notablemente coincidente con los malos resultados cardiovasculares de los ensayos clínicos que mediante fármacos aumentaron las concentraciones de c-HDL.
Cierre del círculo causal: el colesterol no HDL en los estudios de intervenciónUna simplificación de la dinámica de sistemas nos permite construir un círculo causal entre el c-NO-HDL y la CI: si es cierto que el aumento de los niveles de c-NO-HDL origina un aumento de la CI, cualquier intervención que haga disminuir las concentraciones del primero debería hacer disminuir la cardiopatía arteriosclerótica. Esto ha sido perfectamente establecido por el metaanálisis de Robinson et al.23. Este estudio evaluó los datos de 132.021 pacientes procedentes de ensayos RCT en los que se emplearon para disminuir el c-NO-HDL fármacos como estatinas, resinas, fibratos o niacina, u otros que usaron solo dieta o cirugía de derivación ileal. El metaanálisis demuestra que existe una relación directa y consistente entre la magnitud de la reducción c-NO-HDL y la reducción del riesgo de CI, sea cual sea el método utilizado, en una proporción cercana a 1:1 (por cada 1% de disminución de c-NO-HDL se reduce un 1% la CI). Estos hallazgos mantienen la congruencia de la relación entre c-NO-HDL y CI probada en los estudios epidemiológicos y genéticos, apoyando su uso como un objetivo importante a conseguir de los tratamientos destinados a frenar o reducir las enfermedades arterioscleróticas.
Posicionamiento de las guías de práctica clínica sobre el colesterol no HDLLa guía conjunta de las sociedades europeas de Cardiología y Arteriosclerosis 2016 para el manejo de las dislipidemiasEl c-NO-HDL es recomendado dentro de los parámetros lipídicos a analizar en el cribado del RCV por la guía conjunta de las sociedades europeas de Cardiología y Arteriosclerosis (ESC/EAS)24. Esta guía lo reconoce como un factor de RCV independiente que debe considerarse especialmente en sujetos con niveles altos de TG. También aconseja su determinación antes de iniciar cualquier tratamiento para caracterizar correctamente la dislipidemia. No obstante, la guía, admitiendo que todos los ensayos de intervención terapéutica fijan su meta en la reducción del c-LDL, recomienda este parámetro como el principal objetivo de tratamiento. Por otra parte, no contempla el establecimiento de metas específicas a alcanzar en los niveles de TG ni de c-HDL. Para paliar esta circunstancia, contempla el c-NO-HDL como una diana terapéutica con una recomendación clase iia (debería realizarse), nivel B (datos de un único RCT o de varios no RCT), y fija su objetivo en menor de 100 o 130mg/dl para aquellos pacientes con muy alto riesgo o alto riesgo, respectivamente. Estos valores a lograr de c-NO-HDL se calculan fácilmente añadiendo 30mg/dl a los objetivos c-LDL. Con la misma categoría y nivel de evidencia recomienda un objetivo de apoB menor de 80 o 100mg/dl, respectivamente, para pacientes con muy alto riesgo o alto riesgo.
Otras guíasLa guía conjunta para reducir el RCV arteriosclerótico del Colegio Americano de Cardiología y de la Asociación Americana del Corazón (ACC/AHA) del 201325, tras analizar los estudios de intervención, no encontró evidencia suficiente para fijar un objetivo de c-LDL ni de c-NO-HDL porque los ensayos clínicos utilizaban dosis fijas de estatinas o aumentaban la dosis con la intención de maximizar el tratamiento. Por lo tanto, no consideraron que estas fueran pruebas realmente cualificadas para definir unos objetivos óptimos de c-LDL, ni de c-NO-HDL, en prevención primaria o secundaria. Por el contrario, las recomendaciones emitidas en el 2015 por la Asociación Nacional de Lipidólogos americanos reconoce que un nivel elevado de colesterol transportado por las lipoproteínas que contienen apoB (c-NO-HDL y c-LDL) es una causa raíz de la arteriosclerosis, el proceso subyacente clave que contribuye a la mayoría de los eventos clínicos de las ECV26, como ya lo había descrito expresamente el Programa de Educación Nacional sobre el Colesterol (NCEP/ATPIII) en el 200227. Pero además admite que, desde entonces, se ha acumulado una gran cantidad de evidencia para respaldar la opinión de que el c-NO-HDL está más fuertemente relacionado con el riesgo de ECV que el C-LDL y que esta relación es evidente en sujetos con y sin hipertrigliceridemia. De forma similar, pero aún más enfática, la guía británica para la evaluación del RCV y modificaciones lipídicas del Centro Nacional de Guías Clínicas (NICE) del 2014 recomienda el c-NO-HDL como el objetivo primario de tratamiento en todos los pacientes, debido a que representa la totalidad del colesterol aterogénico28. Para finalizar, la última guía de la Asociación Americana de Endocrinólogos Clínicos (AACE) del 2017, además de admitir el c-NO-HDL como un factor mayor de riesgo de ECV, establece una categoría de riesgo denominada «extremadamente alto» que abarca aquellas personas con: ECV progresiva pese a lograr concentraciones de c-LDL inferiores a70mg/dl; ECV en pacientes con diabetes mellitus tipo 2, insuficiencia renal crónica o hipercolesterolemia familiar; ECV prematura —definiendo unas edades inferiores a 55 y 65 años para hombres y mujeres, respectivamente, a los cuales les marca un objetivo de c-NO-HDL por debajo de los 80mg/dl29.
Así pues, la mayoría de las guías de práctica clínica identifican el c-NO-HDL como un factor causal de las ECV de origen arteriosclerótico, estimulan su determinación para la evaluación de la dislipidemia y del RCV, y establecen unos objetivos de concentraciones máximas de este lípido según el RCV (tabla 1).
Categorías de riesgo cardiovascular y niveles objetivos de c-NO-HDL
| Sociedad científica | Año | Categoría de riesgo | c-NO-HDL |
| ESC/EAS24 | 2016 | Muy alto | <100 mg/dl |
| Alto | <130 mg/dl | ||
| ACC/AHA25 | 2013 | No objetivos específicos (c-LDL y c-NO-HDL), tratamiento dependiendo de las características del paciente: niveles de c-LDL, prevención 1.ª o 2.ª, diabetes mellitus | |
| National Lipid Association26 | 2015 | Muy alto | <100 mg/dl |
| Resto de situaciones | <130 mg/dl | ||
| NICE28 | 2014 | Calculador del RCV (%). Considera que el c-NO-HDL es un mejor indicador de RCV que el c-LDL. Es más preciso, más práctico y rentable | |
| AACE29 | 2017 | Extremo | <80 mg/dl |
| Muy alto | <100 mg/dl | ||
| Alto | <130 mg/dl | ||
| Moderado | <130 mg/dl | ||
| Bajo | <160 mg/dl |
Los autores declaran no tener ningún conflicto de intereses.
Nota al suplementoEste artículo forma parte del suplemento «Actualidad de la dislipemia aterogénica en 2018», que cuenta con el patrocinio de laboratorios Mylan.







![Distribución de las lipoproteínas ricas en triglicéridos y las partículas que abarca el colesterol no HDL. apoB: apolipoproteína B; HDL: lipoproteínas de alta densidad; IDL lipoproteínas de densidad intermedia; LDL(b): subfracción de lipoproteínas LDL pequeñas y densas; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína (a); Quilomicron-R: quilomicrón residual; TG: triglicéridos; VLDL: lipoproteínas de muy baja densidad; VLDLr: lipoproteínas de muy baja densidad residuales. Adaptada con permiso de Hernández-Mijares A, Ascaso JF, Blasco M, Brea A, Díaz A, Mantilla T, et al.. Residual cardiovascular risk of lipid origin. Components and pathophysiological aspects. Clin Investig Arterioscler. 2018 Sep 24. [Epub ahead of print]. doi: 10.1016/j.arteri.2018.06.007. Distribución de las lipoproteínas ricas en triglicéridos y las partículas que abarca el colesterol no HDL. apoB: apolipoproteína B; HDL: lipoproteínas de alta densidad; IDL lipoproteínas de densidad intermedia; LDL(b): subfracción de lipoproteínas LDL pequeñas y densas; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína (a); Quilomicron-R: quilomicrón residual; TG: triglicéridos; VLDL: lipoproteínas de muy baja densidad; VLDLr: lipoproteínas de muy baja densidad residuales. Adaptada con permiso de Hernández-Mijares A, Ascaso JF, Blasco M, Brea A, Díaz A, Mantilla T, et al.. Residual cardiovascular risk of lipid origin. Components and pathophysiological aspects. Clin Investig Arterioscler. 2018 Sep 24. [Epub ahead of print]. doi: 10.1016/j.arteri.2018.06.007.](https://static.elsevier.es/multimedia/02149168/00000031000000S2/v1_202001062202/S021491681930124X/v1_202001062202/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)