El aneurisma de aorta abdominal (AAA) es una patología vascular con una elevada tasa de morbimortalidad y una prevalencia que, en varones de más de 65 años, puede alcanzar el 8%. En esta enfermedad, habitualmente asintomática, se produce una dilatación progresiva de la pared vascular que puede llevar a su rotura, un fenómeno mortal en más de un 80% de los casos. El tratamiento de los pacientes con aneurismas asintomáticos se limita al seguimiento periódico con pruebas de imagen, el control de los factores de riesgo cardiovascular y un tratamiento con terapia antiagregante y estatinas, si bien actualmente no existe ningún tratamiento farmacológico efectivo capaz de limitar su progresión o evitar su rotura. En la actualidad el diámetro aórtico es el único marcador de riesgo de rotura y determina la necesidad de reparación quirúrgica cuando alcanza valores superiores a 5,5cm. En esta revisión se tratan los principales aspectos relacionados con la epidemiología, los factores de riesgo, el diagnóstico y el manejo terapéutico del AAA, se exponen las dificultades para disponer de buenos biomarcadores de esta enfermedad y se describen las estrategias para la identificación de nuevas dianas terapéuticas y biomarcadores en el AAA.
Abdominal aortic aneurysm (AAA) is a vascular pathology with a high rate of morbidity and mortality and a prevalence that, in men over 65 years, can reach around 8%. In this disease, usually asymptomatic, there is a progressive dilatation of the vascular wall that can lead to its rupture, a fatal phenomenon in more than 80% of cases. The treatment of patients with asymptomatic aneurysms is limited to periodic monitoring with imaging tests, control of cardiovascular risk factors and treatment with statins and antiplatelet therapy. There is no effective pharmacological treatment capable of limiting AAA progression or avoiding their rupture. At present, the aortic diameter is the only marker of risk of rupture and determines the need for surgical repair when it reaches values greater than 5.5cm. This review addresses the main aspects related to epidemiology, risk factors, diagnosis and clinical management of AAA, exposes the difficulties to have good biomarkers of this pathology and describes the strategies for the identification of new therapeutic targets and biomarkers in AAA.
El aneurisma de aorta abdominal (AAA) es una patología vascular que consiste en una dilatación localizada y permanente de la aorta debido a un debilitamiento de la pared vascular. Generalmente se manifiesta en la porción infrarrenal de la aorta, región que está sometida a importantes fuerzas hemodinámicas. El aneurisma se define como una dilatación superior al 50% del diámetro normal del vaso en zonas adyacentes por lo que, a nivel de la aorta abdominal, se considera patológico un diámetro mayor o igual a 3cm. La evolución natural del AAA supone una dilatación progresiva, caracterizada por la proteólisis de los componentes estructurales de la pared vascular, la pérdida de células de músculo liso vascular (CMLV) y una respuesta inmunoinflamatoria crónica. La dilatación vascular en el AAA es progresiva pero no lineal, alternando fases de aceleración y periodos de estabilidad, lo que dificulta el seguimiento del paciente y, con ello, empeora el pronóstico de la enfermedad. La dilatación vascular puede culminar en la rotura de la pared vascular, la complicación más grave de esta enfermedad asociada a un 80% de mortalidad1,2. Investigaciones recientes sugieren que el AAA es una muestra local de una enfermedad vascular sistémica, existiendo en la mayor parte de los casos una afectación de todo el árbol vascular del paciente. Además, en pacientes con AAA se ha demostrado una importante asociación con enfermedad coronaria y con enfermedad arterial periférica. En esta revisión se recogen los principales aspectos relacionados con la epidemiología, el diagnóstico y manejo terapéutico, los factores de riesgo y las dificultades para disponer de buenos biomarcadores de esta enfermedad.
EpidemiologíaEl AAA tiene una afectación 6 veces superior en los hombres que en las mujeres, incidiendo en más de un 5-8% de la población masculina mayor de 65 años, y en un 2% de la población femenina en el mismo rango de edad1. La incidencia media anual de nuevos diagnósticos de AAA en poblaciones occidentales oscila entre el 0,4-0,67%3. En los últimos años, la incidencia de rotura aneurismática está en crecimiento, lo que supone el 1-2% del total de muertes4. Una posible explicación a este hecho es el aumento en la esperanza de vida poblacional, lo que permitiría en los pacientes con AAA, principalmente en aquellos no diagnosticados, el crecimiento progresivo del aneurisma hasta llegar a su rotura. En cualquier caso, la magnitud de la mortalidad relacionada con la rotura aneurismática de la aorta abdominal está infraestimada, especialmente si se tiene en cuenta el bajo número de casos en los que se realiza un examen post mortem1.
FisiopatologíaLa fisiopatología del AAA es un proceso complejo y dinámico que culmina con un remodelado irreversible del tejido conectivo5. Los principales procesos que tienen lugar en el AAA son cuatro: proteólisis, estrés oxidativo, respuesta inmune inflamatoria y apoptosis de las CMLV (fig. 1), procesos que provocan la pérdida de elasticidad y resistencia de la pared arterial e impiden la recuperación del diámetro arterial normal después de cada pulsación.
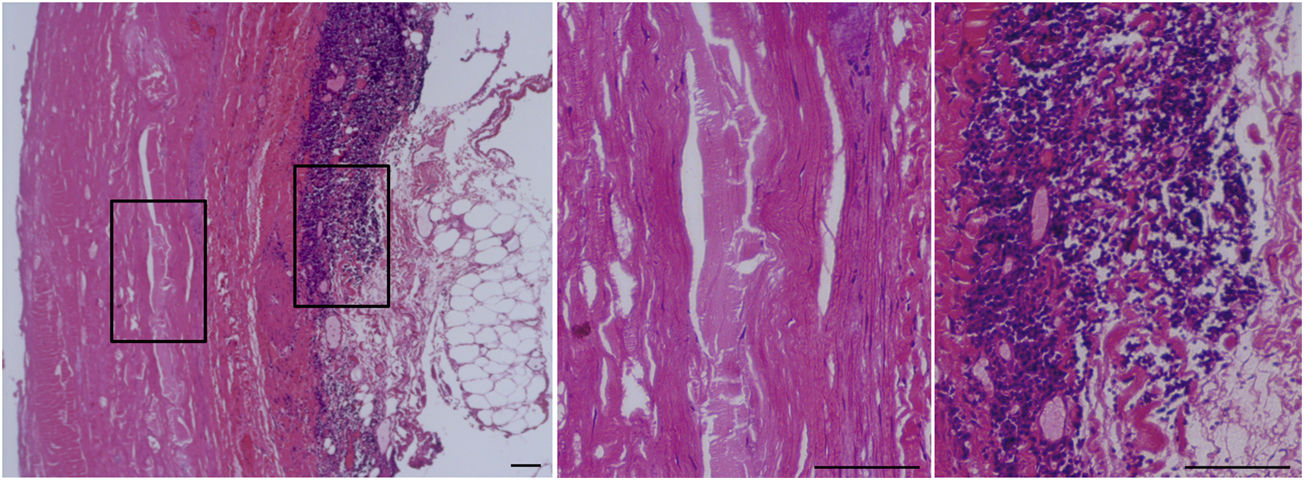
Características histopatológicas del aneurisma de aorta abdominal (AAA).
Tinción con hematoxilina-eosina de la aorta abdominal de un paciente con AAA. El área recuadrada se muestra a la derecha a mayor aumento. El panel central muestra la ausencia de celularidad (CMLV) en la capa media de la pared vascular de estos pacientes. En el panel de la derecha se observa el importante infiltrado inmunoinflamatorio característico de la adventicia del AAA. Barras: 150μm.
El AAA se caracteriza por una degradación del tejido conectivo, principalmente de las fibras de elastina, a través de la activación de diversas proteasas como la plasmina, la elastasa, las catepsinas y las metaloproteinasas de matriz (MMP), junto a una reducción en la expresión de proteínas elastogénicas como la fibulina-56,7. Todo ello provoca la pérdida de las propiedades elásticas de la pared arterial y la dilatación arterial y altera la homeostasis de las células vasculares. Además, la pared arterial presenta un importante infiltrado inflamatorio consistente en linfocitos T y B, neutrófilos y macrófagos8,9. Si bien se desconoce el mecanismo que desencadena este proceso inflamatorio, es probable que los péptidos solubles derivados de la degradación de los componentes de la matriz extracelular actúen como agentes quimiotácticos promoviendo la infiltración de macrófagos. El aumento de los niveles de interleucina (IL)-8, MCP-1 y RANTES facilitaría a su vez el reclutamiento de leucocitos.
Asimismo, el debilitamiento de la pared vascular está vinculado a la importante reducción en el contenido de CMLV que mueren por apoptosis. Como efecto compensatorio se produce una gran deposición de colágeno, cuyo contenido se incrementa con la progresión del AAA. La desestructuración de la capa media supone que la adventicia tenga que soportar fuerzas centrífugas inusuales, a las que responde generando respuestas inflamatorias, fibróticas y angiogénicas, lo que complica aún más el desarrollo de la patología10.
En los últimos años se ha prestado especial atención al trombo intraluminal (ILT), presente en el 75% de los AAA. El ILT es un tejido biológicamente activo formado en la zona luminal por una capa hemática fresca con fibras de fibrina, mientras que en la cara abluminal se produce una fibrinólisis activa. Además, la presencia de eritrocitos y neutrófilos en la zona luminal contribuye al estrés oxidativo mediante la liberación de hierro y mieloperoxidasa. El grosor de este trombo disminuye la biodisponibilidad de oxígeno en la pared arterial, lo que podría incrementar la reactividad de los neutrófilos y su producción de elastasa. La presencia del ILT se asocia a un menor grosor de la pared arterial, mayor elastólisis, menor contenido en CMLV en la media y un nivel más elevado de respuesta inmune inflamatoria en la adventicia10. Recientemente, los niveles de proteínas retenidas en el ILT se han asociado a un mayor crecimiento del AAA11.
Diagnóstico y manejoEl AAA cursa habitualmente de forma silente, de manera que el diagnóstico suele ocurrir como un hallazgo casual tras una prueba de imagen (ultrasonografía, tomografía axial computarizada [TAC] o resonancia magnética) realizada por una patología concomitante del paciente. En algunos países se realizan programas de screening dirigidos a ciertos grupos de riesgo mediante ecografía. Estos programas han demostrado ser eficaces y coste-efectivos12. Actualmente, el manejo del AAA cuando su diámetro se mantiene entre 3-5cm es conservador. Se basa en un seguimiento periódico con pruebas de imagen, un adecuado control de los factores de riesgo cardiovascular y un tratamiento médico con terapia antiagregante y estatinas, si bien en la actualidad no existe ningún tratamiento farmacológico efectivo capaz de limitar su progresión o evitar su rotura. Este tipo de manejo será el adecuado siempre que el AAA no alcance los 5,5cm de diámetro. En estas circunstancias, en las que el riesgo de rotura supera el riesgo de la intervención quirúrgica, la opción terapéutica suele ser la cirugía, decisión que puede precipitarse ante la presencia de síntomas o una elevada tasa de crecimiento del AAA (superior a 1cm/año). En función de las características del paciente, la morfología y la localización del AAA, la intervención quirúrgica podrá ser de tipo intravascular o consistirá en una cirugía abierta13. La indicación que determina si un paciente es candidato a un tipo u otro de tratamiento dependerá del diámetro aórtico, la tasa de crecimiento y el potencial riesgo quirúrgico del paciente. Durante años se ha sostenido que la intervención intravascular cuenta con una mejor supervivencia perioperatoria, si bien diversos estudios han mostrado que la supervivencia a largo plazo es similar para ambos tipos de intervenciones14,15. Sin embargo, la incidencia de roturas tardías es superior tras la intervención intravascular, lo que sigue siendo un motivo de preocupación que requerirá nuevos estudios y estrategias de mejora14,15.
Factores de riesgoLa patogénesis del AAA es compleja y multifactorial y, aunque la etiología es confusa, comparte varios factores de riesgo asociados con la enfermedad aterosclerótica, como son: edad, tabaquismo, sexo masculino, susceptibilidad genética, hipertensión arterial, obesidad centrípeta, niveles reducidos de colesterol asociado a la lipoproteína de alta densidad (HDL), enfermedad coronaria y claudicación intermitente. Cabe destacar el hecho de que la diabetes mellitus (DM), factor de riesgo para la aterosclerosis es, por el contrario, un factor protector para el AAA13.
EdadLa incidencia del AAA aumenta con el paso de los años. Las muertes por rotura aneurismática rara vez ocurren en pacientes por debajo de los 65 años y, a partir de este momento, el riesgo se incrementa un 40% cada 5 años16. El número de individuos de edad muy avanzada (octogenarios y nonagenarios) con AAA es cada vez más elevado y para ellos no existe una recomendación clara respecto a la indicación de intervención quirúrgica en el caso de que el diámetro supere los 5,5cm. La decisión deberá ser individualizada y variará en función de factores clínicos, éticos, económicos y del sistema sanitario del país en cuestión17.
SexoComo se ha comentado previamente, el riesgo en varones es muy superior al de las mujeres y en estas el aneurisma se desarrolla aproximadamente 10 años más tarde, lo que probablemente se deba a factores hormonales, genéticos y a la diferente exposición a factores de riesgo18,19. Se dispone de una gran información acerca de la prevalencia y los factores de riesgo para el AAA en hombres, pero pocos estudios se han centrado de manera específica en la patología aneurismática en la mujer20. En consecuencia, la información acerca de los factores de riesgo asociados, las indicaciones de tratamiento y los resultados tras la reparación del AAA en este grupo de pacientes es escasa. Se ha demostrado el beneficio del screening por ecografía para el AAA en varones de más de 65 años, un procedimiento que ha permitido reducir la mortalidad relacionada con el AAA. Por el contrario, este procedimiento no se recomienda en mujeres pese a que la enfermedad cursa de forma más severa: crecimiento más rápido, mayor riesgo de rotura con menores diámetros y mayor mortalidad hospitalaria asociada a la rotura y la intervención21. Sin embargo, existe un subgrupo de mujeres con un riesgo sustancialmente mayor de enfermedad aneurismática: aquellas de edad avanzada (>65 años), con una historia de tabaquismo y enfermedad cardíaca, que probablemente podrían beneficiarse del screening de AAA22.
Historia familiarExiste un aumento en la prevalencia de AAA entre familiares de primer grado con AAA, llegando al 15-19%23, lo que ha llevado a considerar que existe un componente genético en esta patología. La historia familiar positiva en primer grado de AAA aumenta hasta 10 veces el riesgo de que una persona lo padezca, y a edades más tempranas24. Asimismo, en los últimos años diversos estudios han puesto de manifiesto la importancia de la regulación epigenética en esta patología7,25.
Consumo de tabacoEl tabaco incrementa el riesgo relativo (RR) de AAA 7,6 veces26. Aquellos varones fumadores de más de 25 cigarrillos/día presentan un riesgo de AAA 15 veces superior al de los hombres que nunca han fumado27. El número de cigarrillos al día es importante, pero lo es más la duración del hábito tabáquico. Cada año de tabaquismo incrementa el RR de AAA un 4%26. Una vez cesado el consumo de tabaco, el riesgo de AAA se mantiene hasta 10 años. Los mecanismos a través de los cuales el tabaco desencadenaría la formación del AAA son aún desconocidos. Se baraja la implicación de la inhibición en la síntesis de colágeno, la alteración en la expresión de metaloproteinasas y la posible relación con el estrés oxidativo28; y estudios recientes en modelos de AAA asocian la exposición al tabaco con una alteración de la función de las células inflamatorias29.
Hipertensión arterialLa hipertensión arterial (HTA) se asocia con un incremento del riesgo de formación del AAA y su rotura. Sin embargo, el tratamiento antihipertensivo no ha demostrado eficacia limitando la progresión del AAA30.
Cardiopatía y enfermedad arterial periféricaLa incidencia de enfermedad coronaria y de enfermedad arterial periférica, ambas reflejo de la presencia de enfermedad aterosclerótica, es muy alta en pacientes con AAA y de hecho con frecuencia coexisten ambas patologías. Los eventos cardiovasculares son la principal causa de muerte en pacientes con AAA31. El riesgo de presentar un evento cardiovascular en pacientes con AAA es un 52% superior frente a aquellos pacientes sin patología aórtica aneurismática32.
Niveles de lípidosLa asociación entre los niveles de lípidos en plasma y el AAA no es sencilla. Hay resultados contradictorios respecto a si los niveles de colesterol sérico por encima de 240mg/dl se asocian con un mayor riesgo de AAA33,34. También se ha analizado el posible beneficio que las estatinas pudieran presentar en cuanto a la estabilización del AAA. Sin embargo, los estudios son poco concluyentes y se requieren ensayos de carácter prospectivo y con un mayor número de pacientes para poder establecer conclusiones sólidas. En los últimos años se ha puesto en evidencia que las HDL son las lipoproteinas más relevantes a la hora de predecir el riesgo de desarrollo del AAA. En un estudio dirigido por Golledge et al.35 se observó que las concentraciones séricas de HDL se asocian de manera independiente con una reducción del riesgo de AAA en varones que no se encuentran bajo tratamiento hipolipemiante. Por el contrario, en este estudio no se encontró asociación entre la presencia de AAA y los niveles de triglicéridos o los de colesterol LDL. Por tanto, estos resultados sugieren que la reducción en la concentración de HDL podría considerarse un factor de riesgo para el desarrollo de la enfermedad35. Otras líneas de investigación indican que las alteraciones lipídicas en el AAA podrían estar relacionadas con la presencia de LDL anormales, pequeñas y con un fenotipo que podemos denominar aterogénico36. Esto podría suponer que la determinación tradicional de colesterol y triglicéridos no sería suficiente para evaluar la contribución de la dislipidemia a la enfermedad.
Diabetes mellitusEn contraste con su papel como factor de riesgo de la enfermedad aterosclerótica, la DM se ha descrito como un factor protector frente al desarrollo de AAA37. La DM se asocia a una baja prevalencia de AAA y, si este existe, a un crecimiento más lento del mismo. El mecanismo que subyace a esta relación negativa es desconocido, pero podría estar relacionado, entre otros, con un aumento de la síntesis de matriz extracelular debido a la presencia de productos de glicosilación avanzada (AGE) en los pacientes diabéticos. Los AGE promueven la proliferación de las CMLV e incrementan el contenido de proteínas de matriz en la pared del vaso. Además, la DM suprime la plasmina, un activador de MMP, lo que reduciría los niveles y la actividad de las MMP 2 y 9 y aumentaría la resistencia a la proteólisis del colágeno38. En última instancia, la DM se asociaría con un aumento de la matriz extracelular de la pared aórtica aneurismática, lo que contrarrestaría la pérdida de matriz y la susceptibilidad a la formación del AAA.
Biomarcadores de aneurisma de aorta abdominalUn biomarcador es una característica biológica que puede medirse objetivamente y evaluarse como un indicador de un proceso biológico normal o patológico, o de una respuesta a una intervención terapéutica. Entre ellos se incluyen genes, proteínas, péptidos, variaciones genéticas, lípidos o productos metabólicos de diferente origen tales como fluidos corporales o tejidos39. Aunque el término biomarcador es relativamente reciente, los biomarcadores se han usado en investigación preclínica y en diagnóstico clínico desde hace ya un tiempo considerable40. El biomarcador ideal debe cumplir una serie de características como son: presentar una relación causal con la enfermedad, ser específico para esa enfermedad particular, estar implicado en las vías fisiopatológicas de dicha enfermedad y ser capaz de reflejar la gravedad y progresión de la enfermedad41. La investigación y el descubrimiento de nuevos biomarcadores contribuyen además a un mejor conocimiento y comprensión de la fisiopatología de la enfermedad.
La identificación de biomarcadores circulantes con valor diagnóstico y pronóstico en el AAA es un reto42,43. Actualmente no se conoce ningún marcador bioquímico para esta patología con suficiente especificidad y sensibilidad como para poder ser utilizado en la práctica clínica. Los únicos factores pronósticos en esta enfermedad se establecen a través de técnicas de imagen y se limitan al diámetro aórtico y a la velocidad de expansión del aneurisma. Por tanto, se requieren marcadores biológicos que permitan diagnosticar la enfermedad, valorar su progresión y el riesgo de rotura aórtica, y determinar la respuesta al tratamiento de los pacientes43. De acuerdo con la fisiopatología del AAA, los biomarcadores circulantes pueden ser clasificados en función de su relación con la actividad protrombótica, la degradación de la matriz extracelular de la pared vascular o la respuesta inmunoinflamatoria.
Marcadores relacionados con la degradación de la matriz extracelularLos primeros biomarcadores en estudio estaban relacionados de forma directa con la proteólisis de la matriz extracelular. Se ha demostrado que los péptidos de elastina y el propéptido aminoterminal del procolágeno tipo III están elevados en el suero de pacientes con AAA. Sin embargo, presentan una baja sensibilidad y especificidad. Se ha determinado también la utilidad de la medida directa de enzimas proteolíticas. Se han realizado diversos estudios dirigidos a evaluar el posible papel de los niveles circulantes de MMP-9 como marcador de la expansión del aneurisma. Sin embargo, el estudio de mayor tamaño muestral no encontró correlación entre los niveles de esta MMP y la expansión del AAA44. Otros autores han demostrado niveles elevados de MMP-1 y MMP-9 en pacientes con rotura aneurismática frente a pacientes que esperan cirugía de reparación, si bien estos resultados deberían ratificarse en estudios que incluyan un mayor número de pacientes45.
Marcadores relacionados con la respuesta inmunoinflamatoriaDado que los neutrófilos infiltran el ILT del AAA, podemos encontrar marcadores circulantes relacionados con su activación como son los complejos α1 antitripsina-elastasa, mieloperoxidasa o α-defensina. Los niveles de la proteína NGAL, liberada por polimorfonucleares circulantes y por el propio ILT, se correlacionan con la presencia de AAA46. Asimismo, los biomarcadores relacionados con la inflamación, concretamente con la respuesta inmunoadaptativa, también están elevados en pacientes con AAA, demostrando la evidencia de un proceso inflamatorio asociado al desarrollo de AAA. Entre ellos encontramos: citocinas, factor de necrosis tumoral alfa (TNF-α), IL-6 y proteína C reactiva (PCR). También hay una manifiesta elevación de IgG4 e IgE47. Los estudios proteómicos han sido útiles para la identificación de posibles nuevos biomarcadores candidatos. Entre ellos la quimiocina CCL20, cuyos niveles se incrementan en pacientes con AAA en comparación con individuos sanos48 y que recientemente se ha demostrado como un biomarcador de AAA de alta sensibilidad49.
Marcadores relacionados con la actividad protrombóticaEn el AAA se produce un aumento de la activación plaquetaria, como los complejos trombina-antitrombina circulantes en el plasma. La activación simultánea de marcadores relacionados con la coagulación y la fibrinólisis muestra la evidencia de la actividad biológica del ILT. Los complejos plasmina-antiplasmina tienen una moderada sensibilidad en el AAA, asociados o no con productos de degradación de la fibrina. Así, se ha demostrado que los complejos plasmina-antiplasmina y dímero D se correlacionan con el diámetro aórtico, con el grosor del ILT, con el crecimiento aneurismático y también con un empeoramiento de la función pulmonar en pacientes con AAA50.
Las evidencias más recientes, basadas en un estudio prospectivo de gran tamaño muestral, apoyan el hecho de que aquellos pacientes que combinan un mayor número de biomarcadores relacionados con el AAA se asocien de forma significativa, tras el ajuste por factores de riesgo, con un incremento en la incidencia de AAA. Así, las alteraciones en las concentraciones circulantes de varios biomarcadores relacionados con AAA son capaces de identificar a un grupo de pacientes con alto riesgo para el desarrollo de AAA51.
El conocimiento limitado de la fisiopatología del AAA, y la ausencia de biomarcadores fiables de expansión y rotura del mismo, hacen que la intervención invasiva sea la única opción terapéutica que se puede ofrecer hoy en día a los pacientes. Actualmente, los únicos parámetros determinantes de la necesidad de dicha intervención son el diámetro del AAA, su tasa de crecimiento y el riesgo quirúrgico del paciente. Por esto es fundamental poder profundizar y ampliar nuestros conocimientos acerca de la fisiopatología del AAA, así como identificar biomarcadores de la presencia de AAA, de su tamaño, crecimiento y eventual rotura. La identificación de un biomarcador útil en esta patología es complicada, dado su carácter multifactorial y su compleja fisiopatología. Se han identificado varias moléculas circulantes cuyos niveles están elevados en pacientes con AAA respecto a sujetos control, potenciales biomarcadores de la enfermedad, incluyendo lípidos, citocinas, elementos que conforman la matriz extracelular, factores de coagulación y proteasas, pero ninguno de ellos tiene una aplicación directa en la práctica clínica.
Tratamiento médico del aneurisma de aorta abdominalEl tratamiento médico actual en el AAA se basa en el adecuado control de los factores de riesgo, mediante el uso de antiagregantes y estatinas. Sin embargo, no existe un tratamiento médico capaz de modular el crecimiento aneurismático. Este es un tema de gran importancia, puesto que no permite ofrecer ningún tratamiento eficaz a aquellos pacientes con AAA inferior a 5,5cm. Incluso, se sugiere que la calidad de vida de pacientes con AAA inferior a 5,5cm se ve deteriorada durante el seguimiento con el crecimiento aneurismático52,53. Además, si un futuro tratamiento médico fuese capaz de posponer, o incluso evitar el tratamiento quirúrgico de estos pacientes, el coste médico se vería reducido sustancialmente.
Por todo ello, desde hace años se está trabajando en este campo, y se han intentado identificar fármacos capaces de modular la progresión aneurismática. También se han investigado terapias experimentales, basadas en la fisiopatología de la enfermedad, que en un futuro pudieran tener una aplicación clínica. En primer lugar, nos centraremos, por tanto, en fármacos ya comercializados con otros fines y, en una segunda parte, en posibles tratamientos en una fase preclínica.
Se presenta, a continuación, una relación de los fármacos empleados en la actualidad para el tratamiento de otras patologías, que han tenido una repercusión positiva en su traslación a la patología aneurismática.
AntihipertensivosBetabloqueantesLos bloqueantes de receptores beta adrenérgicos son los fármacos más estudiados. Se han realizado tanto estudios de tipo observacional, principalmente estudios de cohortes54,55, como ensayos clínicos56-58. En los estudios de cohortes se emplearon diferentes tipos de betabloqueantes que, en muchos casos, no fueron especificados. Estos trabajos demostraron diferencia en cuanto a la velocidad de crecimiento aneurismático entre los grupos en función de que recibiesen, o no, el tratamiento. Sin embargo, únicamente en menos de la mitad de los casos, esa diferencia resultó estadísticamente significativa55,59. Asimismo, los ensayos clínicos desarrollados con propranolol no presentaron resultados significativos en cuanto a la velocidad de crecimiento del AAA56,57.
Por su parte, el bisoprolol ha demostrado una reducción en la mortalidad por causa cardíaca tras la cirugía del AAA. No está confirmado que este efecto ocurra en el caso de otros betabloqueantes, pero las guías de la ACC/AHA otorgan una recomendación de clase I (nivel de evidencia A) durante el periodo perioperatorio del AAA en cuanto a la reducción del RR de morbilidad por eventos adversos cardíacos asociados a ese periodo60.
Es interesante señalar que, en un primer momento, se consideró que la utilidad de los betabloqueantes venía dada por su capacidad para reducir la presión arterial y la frecuencia cardíaca. Sin embargo, estudios más recientes han llevado a pensar que la efectividad de estos fármacos como terapia cardioprotectora no solo se relaciona con sus efectos como bloqueantes de los receptores beta adrenérgicos, sino por presentar un efecto directo antiaterosclerótico, tanto a nivel experimental como humano61. Además, la evidencia apoya la teoría de que la diana terapéutica del metoprolol como fármaco cardioprotector viene dada por su interacción con la respuesta inflamatoria y, de forma más concreta, por su implicación en la respuesta de macrófagos y neutrófilos62.
Inhibidores de la enzima convertidora de angiotensina (IECA)La activación del sistema renina-angiotensina se ha visto implicada en el desarrollo del AAA63. Estudios de cohortes han obtenido resultados favorables en el grupo tratado con inhibidores de la enzima convertidora de angiotensina (IECA), aunque no significativos30. Trabajos más recientes, con un reclutamiento de casi 10.000 pacientes, han demostrado que la administración de IECA se asocia con una reducción en la mortalidad y en el riesgo de intervención quirúrgica en pacientes con AAA64. Sin embargo, dos publicaciones del año 2010, no solo no obtuvieron resultados positivos, sino que observaron un incremento en la tasa de crecimiento así como en la mortalidad perioperatoria en aquellos pacientes que recibieron tratamiento con IECA65,66. Además, el primer y único ensayo clínico realizado hasta el momento con estos fármacos, en 2016, concretamente con perindopril, no ha obtenido resultados favorables67.
Bloqueantes del calcioEl papel potencial de los bloqueantes del calcio en el AAA es controvertido. Por una parte, se han mostrado efectos beneficiosos que no se relacionan de forma directa con su función hipotensora. Así, el nifedipino ha sido capaz de inhibir la progresión aneurismática mediante la supresión de la actividad de NF-kB y MMP-968, mientras que otros fármacos se han relacionado con un incremento en la rigidez de la pared aórtica69. Además, los estudios de cohortes realizados han demostrado diferencia a favor del grupo tratado, aunque esta diferencia nunca haya resultado estadísticamente significativa30. Por otra parte, los bloqueantes del calcio parecen promover la formación del AAA en sus estadios iniciales, lo que podría estar en relación con su papel en el metabolismo de la elastina. En el caso del amlodipino, se ha determinado que este fármaco potencia la actividad elastasa en un modelo animal54.
Tratamiento antiagreganteSabemos que el ILT juega un papel fundamental en la progresión y riesgo de rotura del AAA70. Los estudios experimentales realizados con terapia antiagregante sugirieron el efecto beneficioso de este tratamiento71. Varios estudios observacionales apoyaron estos resultados, mientras que otros estudios resultan contradictorios72. Quizá ensayos clínicos con otro tipo de antiagregantes como el ticagrelor, ya en marcha, puedan esclarecer todas estas dudas. En todo caso, pese a que no existe una evidencia concluyente, se recomienda que los pacientes con AAA reciban dosis bajas de aspirina60.
AntiinflamatoriosEs necesario destacar una serie de fármacos, como son las estatinas y ciertos antibióticos que, si bien no tienen como función principal sus efectos antiinflamatorios, sí son estos los que han permitido que sean utilizados en la enfermedad aneurismática.
La práctica totalidad de los estudios experimentales apoyan a las estatinas como capaces de reducir el crecimiento aneurismático73. Como hemos mencionado, a su capacidad para reducir el nivel de lípidos, se une su función antiinflamatoria. Dentro de los estudios observacionales, algunos han demostrado diferencia en cuanto a la tasa de crecimiento74, pero no todos75. En conjunto, los metaanálisis que existen al respecto apoyan la capacidad de las estatinas para modular el crecimiento del AAA, pero la evidencia es de baja calidad76. En cualquier caso, podemos afirmar que la información de que disponemos a día de hoy apoya que las estatinas sean recomendadas a pacientes con AAA.
Por otro lado, se propuso también que un agente infeccioso, la Chlamydia pneumoniae, podría estar relacionada como un agente iniciador o acelerador en el proceso de formación y expansión aneurismática77-79. La doxiciclina, un antibiótico capaz de inhibir las MMP, ha tenido resultados favorables en modelos experimentales80,81, así como en ensayos clínicos realizados hace ya algunos años70. Además, se ha observado que en pacientes con AAA tratados con doxiciclina, los niveles en plasma de MMP-9 así como el nivel de mRNA de esta MMP en aorta abdominal estaba reducido82,83. Sin embargo, ensayos clínicos más recientes han obtenido resultados contradictorios, opuestos a lo que la evidencia fisiopatológica nos indica84. En cuanto a la roxitromicina, se han realizado ensayos clínicos que han demostrado diferencia entre el grupo tratado y el grupo no tratado, pero esta diferencia tampoco resultó estadísticamente significativa79.
Respecto a los fármacos antiinflamatorios per se, también se han realizado estudios de cohortes para los antiinflamatorios no esteroideos (AINE). De igual forma que con las estatinas, en este caso hubo mejoría en el grupo tratado, pero esa diferencia no resultó estadísticamente significativa74.
Nuevas dianas terapéuticas para el tratamiento del aneurisma de aorta abdominalEl conocimiento de la patogénesis del AAA permitirá determinar nuevas dianas terapéuticas moleculares con el potencial de ser trasladadas a la práctica clínica habitual en el futuro.
Los trabajos realizados en este sentido son diversos, por eso nos centraremos en algunos de los más recientes que consideramos pueden ser representativos de cómo la fisiopatología puede ayudar a identificar nuevas dianas terapéuticas para el tratamiento del AAA. Específicamente, daremos ejemplos de la línea a la que posiblemente se han dedicado más esfuerzos, como es la modulación de la respuesta inmunoinflamatoria. Asimismo, esbozaremos otras posibles líneas de investigación más novedosas, pero de las que se tiene menos información, como son los reguladores postranscripcionales y la terapia celular.
Regulación de la respuesta inmunoinflamatoriaComo hemos comentado previamente, el AAA se caracteriza por la presencia de distintos tipos celulares implicados en la respuesta inmunoinflamatoria, como son los neutrófilos, los macrófagos y los linfocitos B y T, así como de mediadores proinflamatorios como las citocinas y el TNF-α. Distintas IL se han relacionado con la progresión del AAA. Tanto a nivel clínico como experimental, se ha observado una elevación de IL-1β en estos pacientes. Además, la ausencia experimental de IL-1β y del receptor de IL-1, así como el tratamiento con anakinra (un antagonista del receptor de IL-1), redujo la dilatación aneurismática, generando a su vez una reducción en la infiltración de macrófagos y neutrófilos, y manteniendo la integridad de la elastina85. En este sentido, resultados recientes con un anticuerpo bloqueante de IL-1β en el estudio CANTOS (Canakinumab Anti-inflammatory Thrombosis Outcome Study), realizado en pacientes con infarto de miocardio previo, han mostrado su capacidad para reducir eventos cardiovasculares86. En cambio, una publicación reciente demuestra que este tratamiento puede tener efectos deletéreos en lesiones ateroscleróticas avanzadas87, por lo que su posible aplicación a otras enfermedades como el AAA necesitará de estudios adicionales.
En cuanto al TNF-α, a nivel experimental se ha observado cómo el infliximab, un anticuerpo monoclonal que inhibe la actividad funcional de esta citocina, ha sido capaz de limitar la expansión aneurismática88. Una reciente publicación señala la contribución del TNF-α a la polarización de macrófagos, y concluye que su bloqueo en enfermedades como el AAA podría ser más efectivo que el bloqueo de la IL-1β89.
Otros miembros de la superfamilia del TNF-α también se han visto implicados en el desarrollo del AAA y en la respuesta inflamatoria subyacente. Así, tanto la proteína TWEAK (tumor necrosis factor-like weak inducer of apoptosis) como su receptor funcional Fn14 están presentes en la lesión aneurismática humana90. La deleción génica de estas proteínas en modelos experimentales de aneurisma en ratón disminuye la respuesta inflamatoria así como el tamaño y la progresión del AAA90. Cabe destacar que los niveles circulantes de TWEAK soluble se han asociado a la expansión del AAA en humanos91.
También se conoce la relación entre la prostaglandina E2 (PGE2) y los procesos inflamatorios vasculares en el AAA92,93. Entre los receptores de PGE2, el EP-4 parece tener un papel importante en el desarrollo aneurismático93. Así, la reducción de la expresión de EP-4 y/o la administración de antagonistas disminuye la dilatación aneurismática y los niveles de IL-6, IL-17, MIP-1α, MMP-2 y MMP-994.
El reclutamiento de las células inflamatorias a la pared arterial se ve favorecido por la síntesis y secreción de diversos mediadores como las quimiocinas. Entre ellas, hemos demostrado recientemente que la inhibición de la galectina-3, que es quimiotáctica para monocitos, disminuye el desarrollo del AAA experimental a través de la regulación del MCP-1, la principal quimiocina de macrófagos95. Respecto a los neutrófilos, la lipocalina-2 es una proteína que actúa como quimioatrayente de neutrófilos y cuyos niveles circulantes están significativamente incrementados en plasma de pacientes con AAA y se correlacionan con la actividad del AAA46. Recientemente, hemos observado cómo, a nivel experimental, la deficiencia de lipocalina-2 era capaz de limitar la expansión del AAA en el modelo de perfusión de elastasa en ratón96.
Finalmente, el sistema inmune mediante la regulación de la inflamación, pero también modulando la respuesta inmune innata, así como las inmunoglobulinas, puede alterar la evolución del AAA. La regulación de la polarización de las células T (ratio Th1/Th2) puede ser una línea de investigación en el tratamiento del AAA97. También se han implicado recientemente en el AAA las células B. Las publicaciones más recientes, basadas en estudios experimentales, avalan la posibilidad de que las células B en un ambiente de AAA puedan verse dañadas. Este motivo explicaría el paradójico resultado de cómo, por una parte, la eliminación de células B reduce la progresión aneurismática, mientras que, por otra parte, la inserción de células B procedentes de animales sanos genera los mismos efectos98.
Reguladores epigenéticosComo en la mayoría de las enfermedades complejas, en las enfermedades cardiovasculares se producen interacciones entre factores genéticos y ambientales en las que intervienen mecanismos epigenéticos. La regulación epigenética tiene importantes repercusiones en el repertorio de genes expresados a nivel celular. Los mecanismos epigenéticos controlados por histonas deacetilasas (HDAC) y microRNA (miRNA) modulan procesos como la inflamación, la trombosis, la proliferación, la apoptosis y el remodelado vascular implicados en el desarrollo de enfermedades complejas como el AAA.
Los miRNA son reguladores postranscripcionales de genes y están implicados en diversos procesos fisiopatológicos. Para no extendernos, se recomienda a los lectores una revisión en la que de forma exhaustiva se detallan los últimos avances sobre los miRNA, su papel en el AAA99 y su interés como dianas terapéuticas y/o biomarcadores en esta enfermedad. Sin embargo, su traslación a la práctica clínica probablemente iría acompañada de efectos colaterales severos. Asimismo, existe un reciente interés por los efectos de los RNA no codificantes de cadena larga (en inglés, LncRNAs) en procesos de remodelado vascular crónico como el AAA100,101.
En relación con las HDAC y su implicación en la patología aneurismática, estudios recientes han demostrado la alteración del patrón de expresión de las HDAC de clase I y IIa en el aneurisma humano y cómo el tratamiento con inhibidores de HDAC limita el desarrollo de AAA en un modelo experimental en ratón, lo que sugiere que estos fármacos podrían constituir una estrategia terapéutica eficaz para el tratamiento y la estabilización del AAA25.
Terapia celularLas células madre de tipo mesenquimal no solo tienen la capacidad de diferenciarse en distintos tipos celulares, sino que también presentan potentes acciones antiinflamatorias e inmunorreguladoras. De esta forma, la administración intravenosa de este tipo de células en modelos murinos de AAA mediante perfusión de angiotensina II retrasó el desarrollo del AAA102. Los eventos que se relacionan con este retraso en la progresión aneurismática son diversos, entre ellos: la reducción de MMP-2, MMP-9, IL-6 y MCP-1 y la elevación de TIMP-1103. Cabe destacar que estos tratamientos también se han analizado en modelos más traslacionales como el cerdo104. Actualmente, existe un ensayo clínico en marcha sobre el tratamiento del AAA (en AAA pequeños sin indicación quirúrgica) mediante células mesenquimales105.
La suma de la investigación preclínica y clínica es necesaria para desentrañar los mecanismos que subyacen al desarrollo del AAA y, de esta forma, validar los enfoques médicos. La evidencia actual del tratamiento médico disponible para el AAA es de baja calidad. Sin embargo, es importante señalar que los ensayos clínicos realizados hasta el momento son escasos. Además, se han desarrollado con un número pequeño de pacientes, una baja calidad del estudio y, por último, se ha analizado el crecimiento tomándolo como un marcador subrogado de rotura, pero sin ser este un marcador directo, por lo que podría resultar de interés analizar otros marcadores. Por otro lado, se han identificado algunas posibles dianas terapéuticas en modelos preclínicos, principalmente en ratón, los cuales necesitan validarse en modelos experimentales más traslacionales106 para potencialmente llegar a ser trasladados al paciente.
ConclusionesEn la actualidad, el conocimiento de la fisiopatología del AAA es todavía limitado. El estudio de los diferentes mecanismos celulares y moleculares que modulan el remodelado vascular patológico nos permitirá conocer con mayor exactitud los procesos que dan lugar a la formación, crecimiento y rotura del AAA. A su vez, la identificación de estos mecanismos nos permitirá identificar dianas terapéuticas potenciales para frenar el avance de esta patología. En la actualidad, se están llevando a cabo diferentes ensayos clínicos con fármacos antihipertensivos, antiagregantes y antiinflamatorios para dilucidar la conveniencia de este tipo de tratamientos en el paciente aneurismático. Finalmente, la búsqueda e identificación de biomarcadores circulantes de AAA es un reto importante ya que en la actualidad el diagnóstico del AAA suele ser casual y no causal. Estos nuevos biomarcadores nos deberían permitir un temprano y mejor tratamiento de esta patología.
FinanciaciónEl trabajo desarrollado en los laboratorios de JLMV y CR ha sido financiado por el Instituto de Salud Carlos III (ISCIII) (PI15/01016 y PI16/01419) y el Ministerio de Economía, Industria y Competitividad (SAF SAF2015-64767-R y SAF2016-80843-R), con cofinanciación por el Fondo Europeo de Desarrollo Regional (FEDER). El CIBER de Enfermedades Cardiovasculares es una iniciativa del ISCIII. LC recibió una ayuda del programa FI del AGAUR (2017FI_B_00175, Generalitat de Catalunya).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores piden disculpas a todos aquellos investigadores cuyo trabajo no ha podido ser citado debido a las limitaciones de espacio.