El objetivo de este estudio es conocer las tasas de resistencia antimicrobiana y la evolución de las mismas durante 2012-2017 en aislados de Pseudomonas aeruginosa causante de infección invasiva en el sur de España.
MétodosEstudio retrospectivo de recogida de datos microbiológicos en 20 centros hospitalarios (14 de Andalucía, 5 de Extremadura y 1 de Ceuta) durante 2012-2017. Las principales variables de estudio fueron: sistema de antibiograma usado, interpretación (CLSI o EUCAST) y tasa o porcentaje de aislados resistentes.
ResultadosEl sistema de antibiograma más utilizado fue MicroScan (58%). Los porcentajes de resistencia globales variaron entre el 25% (ciprofloxacino) y el 4% (colistina) usando EUCAST, y entre el 19% (ciprofloxacino e imipenem) y el 3% (amicacina) usando CLSI. Las tasas de resistencia se mantuvieron relativamente estables durante 2012-2017. El 14% de los aislados fueron MDR y el 7% XDR. Los aislados de muestras respiratorias presentaron mayores tasas de resistencia antimicrobiana, particularmente a ciprofloxacino y colistina, que los aislados de orina o sangre.
ConclusionesLas tasas de resistencia antimicrobiana en P. aeruginosa no son demasiado elevadas en el sur de España. Las tasas de resistencia más elevadas se observan para ciprofloxacino, piperacilina/tazobactam y meropenem, siendo los antimicrobianos de mayor actividad colistina, tobramicina y amicacina. Las mayores tasas de resistencia se observan en aislados de muestras respiratorias. En general las tasas de resistencia se mantienen estables durante el periodo de estudio para la mayoría de los antimicrobianos evaluados.
The aim of this study was to determine the antimicrobial resistance rates and their evolution in clinical isolates of Pseudomonas aeruginosa causing invasive infections in the south of Spain between 2012 and 2017.
MethodsRetrospective study consisting of the collection of microbiological data from 20 hospitals (14 from Andalucía, 5 from Extremadura and 1 from Ceuta) between 2012 and 2017. The main variables studied were the antimicrobial susceptibility testing system used, interpretation criteria (CLSI or EUCAST) and the rate or percentage of resistant isolates.
ResultsThe most widely used antimicrobial susceptibility testing system was MicroScan (58%). The global resistance rates varied between 25% (ciprofloxacin) and 4% (colistin) using EUCAST, and between 19% (ciprofloxacin and imipenem) and 3% (amikacin) using CLSI. The antimicrobial resistance rates were relatively stable throughout the period 2012-2017. 14% of isolates were MDR and 7% were XDR. Respiratory isolates were more resistant, particularly to ciprofloxacin and colistin, than isolates from urine or blood.
ConclusionsThe antimicrobial resistance rates in P. aeruginosa are not particularly high in the south of Spain. The highest resistance rates were observed with ciprofloxacin, piperacillin/tazobactam and meropenem, whereas the more active antimicrobials were colistin, tobramycin and amikacin. The highest resistance rates were seen in respiratory isolates. In general, the resistance rates remained stable during the study period for most of the antimicrobials studied.
Las infecciones nosocomiales constituyen un serio problema de salud mundial con importantes repercusiones económicas y sociales1,2. Pseudomonas aeruginosa es un patógeno oportunista capaz de producir un amplio espectro de infecciones, siendo las infecciones invasivas las de mayor relevancia clínica por asociarse con elevadas tasa de morbimortalidad3,4. Este patógeno se caracteriza por su elevada resistencia intrínseca a muchos anrtimicrobianos y por su capacidad para adquirir resistencia incluso a los de amplio espectro, como los carbapenémicos y las polimixinas5–8.
Entre las opciones terapéuticas en infecciones causadas por P. aeruginosa no multirresistente se incluyen betalactámicos (ej. piperacilina/tazobactam, ceftazidima, cefepima, imipenem, meropenem, aztreronam), fluoroquinolonas y aminoglucósidos. Sin embargo, en infecciones producidas por P. aeruginosa multirresistente las opciones terapéuticas pueden disminuir considerablemente, teniendo que utilizarse antimicrobianos que pueden presentar problemas de toxicidad, como colistina, o antimicrobianos más novedosos con los que existe menos experiencia, como ceftolozano/tazobactam y ceftazidima/avibactam9–13.
La elección de un tratamiento antimicrobiano empírico requiere conocer, entre otros factores, las tasas de sensibilidad o resistencias locales. Las tasas de resistencia antimicrobiana en esta especie son variables y dependen de factores geográficos (ej. tasas locales de resistencia) y microbiológicos (ej. clon y mecanismos de resistencia). En España existen muy pocos estudios que permitan conocer las tasas de resistencia a antimicrobianos en aislados de P. aeruginosa causante de infección invasiva14–18. El objetivo de este estudio es conocer i) las tasas de resistencia antimicrobiana global y por tipo de muestra en aislados de P. aeruginosa causante de infección invasiva en el sur de España, y ii) conocer cómo han evolucionado las tasas de resistencia antimicrobiana durante el período 2012-2017.
Material y métodosEstudio retrospectivo descriptivo de recogida de datos demográficos y microbiológicos durante 2012-2017 en 20 centros hospitalarios: 14 de Andalucía, 5 de Extremadura y 1 de Ceuta. Se recogieron datos de los primeros 3 aislados por cada año y tipo de infección (bacteriemia, infección intraabdominal, ITU nosocomial y neumonía nosocomial). En los pacientes en los que se obtuvo más de un aislado por tipo de infección y año se incluyó solo el primer aislado. Las variables de estudio fueron: servicio, origen de las muestras, sistema de antibiograma usado, interpretación (CLSI o EUCAST) y tasa o porcentaje de aislados resistentes. Tanto las pruebas de identificación bacteriana como las de sensibilidad a estos antimicrobianos se realizaron en cada centro. Los antimicrobianos analizados fueron piperacilina/tazobactam, ceftazidima, cefepima, imipenem, meropenem, aztreonam, tobramicina, amicacina, ciprofloxacino y colistina. Para cada antimicrobiano se determinó la correspondiente categoría clínica según los puntos de corte de EUCAST de 2019 y de CLSI de 201919,20.
El análisis estadístico de las discrepancias entre las variables cualitativas se realizó utilizando el test de la Chi cuadrado, o el test de Fisher, si procedía. Se consideraron estadísticamente significativas las diferencias con valores de p<=0,05.
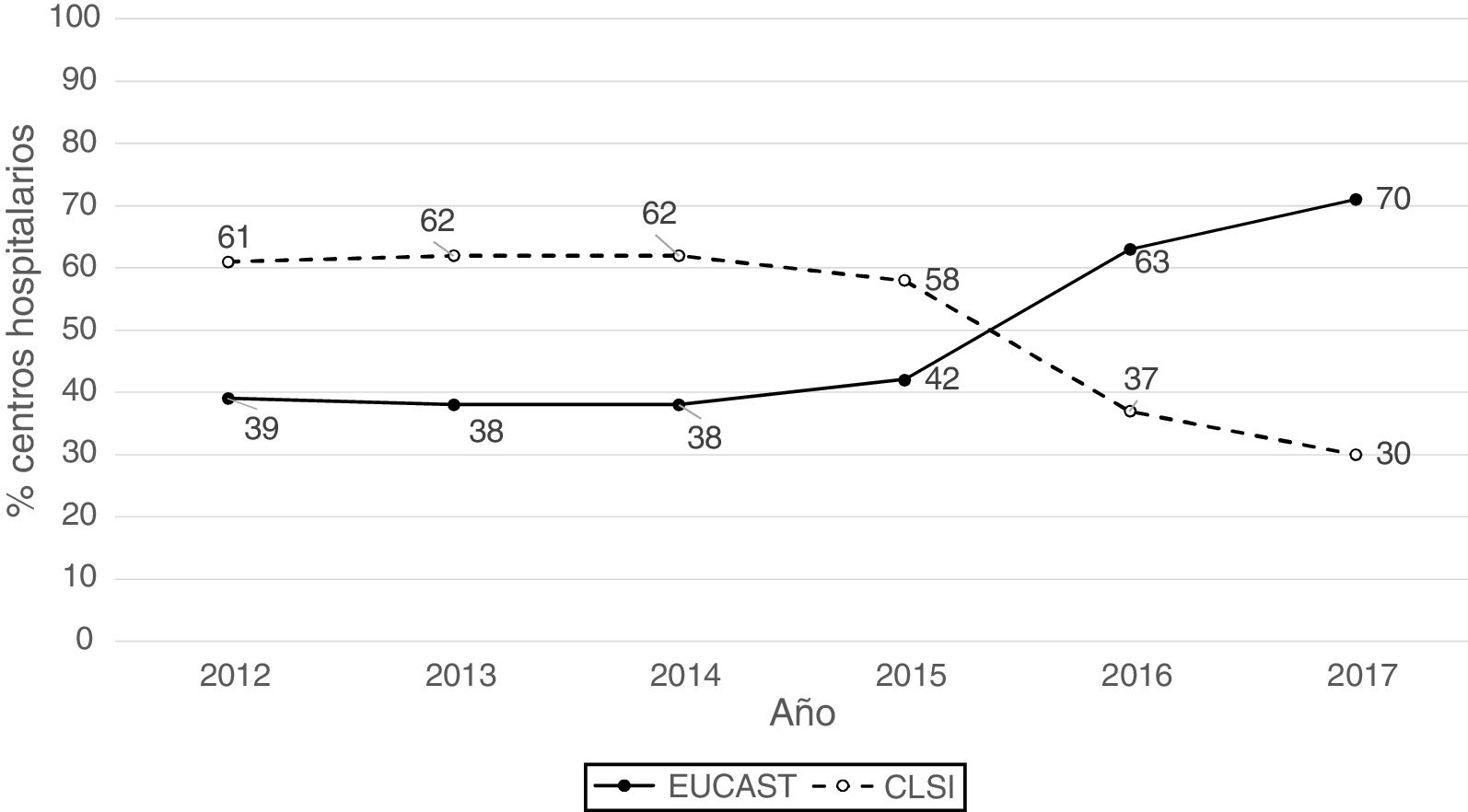
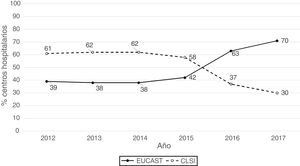
ResultadosLa procedencia por tipo de Unidad o Servicio de los 1341 datos analizables fue la siguiente: unidades médicas (47%), unidades quirúrgicas (26%), UCI (22%), Urgencias (4%) y otros servicios (1%). Los aislados se obtuvieron de muestras del tracto respiratorio (27%), orina (25%), sangre (24%), abdominal (23%), y otras muestras (1%). Los sistemas de antibiograma utilizados fueron: MicroScan (58%), Vitek 2 (24%), Wider I (15%), Phoenix (2%), difusión con discos (0,7%) y difusión con tiras de gradiente (0,3%). El 52% de los resultados de sensibilidad se obtuvieron usando los puntos de corte de CLSI de 2019 y el 48% usando los puntos de corte propuestos por EUCAST en 2019. En la figura 1 se representan los porcentajes de resultados de sensibilidad por año y por puntos de corte utilizados (CLSI o EUCAST de 2019) y como puede apreciarse, a partir de 2014 se produce un aumento progresivo del número de centros que utilizan los puntos de corte de EUCAST a costa de una disminución de centros que utilizan puntos de corte del CLSI.
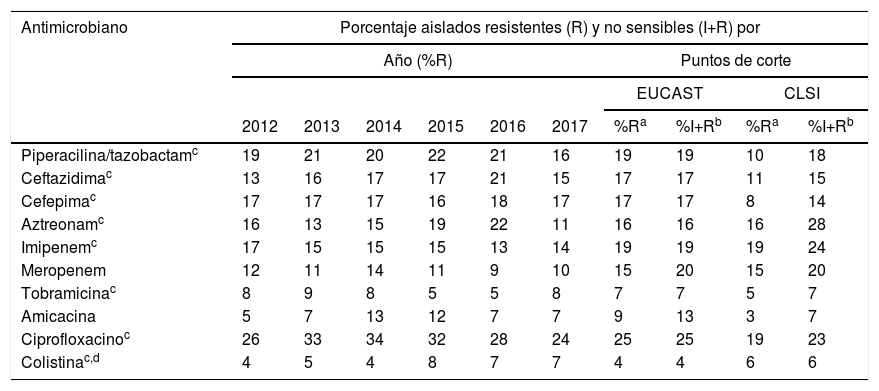
Para analizar los porcentajes de resistencia se consideraron 2 grupos de aislados: aislados no sensibles (incluye a los aislados resistentes y a los aislados con sensibilidad intermedia) y aislados resistentes (se incluyen aislados resistentes pero no aislados con sensibilidad intermedia). Como se aprecia en la tabla 1, los porcentajes de resistencia globales de los aislados resistentes varió entre el 25% (ciprofloxacino) y el 4% (colistina), utilizando los puntos de corte propuestos por EUCAST en 2019, y entre el 19% (ciprofloxacino e imipenem) y el 3% (amicacina), utilizando los puntos de corte del CLSI de 2019 (tabla 1). En los aislados no sensibles, las tasas globales de resistencia variaron entre el 25% (ciprofloxacino) y el 4% (colistina) usando los puntos de corte de EUCAST de 2019, y entre el 28% (aztreonam) y el 6% (colistina) usando puntos de corte del CLSI de 2019 (tabla 1).
Distribución de las tasas de resistencia por año utilizando puntos de corte de EUCAST de 2019 y de las tasas de resistencia globales en función de los puntos de corte utilizados (EUCAST o CLSI) y de la inclusión o no de los aislados con sensibilidad intermedia
| Antimicrobiano | Porcentaje aislados resistentes (R) y no sensibles (I+R) por | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Año (%R) | Puntos de corte | |||||||||
| EUCAST | CLSI | |||||||||
| 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | %Ra | %I+Rb | %Ra | %I+Rb | |
| Piperacilina/tazobactamc | 19 | 21 | 20 | 22 | 21 | 16 | 19 | 19 | 10 | 18 |
| Ceftazidimac | 13 | 16 | 17 | 17 | 21 | 15 | 17 | 17 | 11 | 15 |
| Cefepimac | 17 | 17 | 17 | 16 | 18 | 17 | 17 | 17 | 8 | 14 |
| Aztreonamc | 16 | 13 | 15 | 19 | 22 | 11 | 16 | 16 | 16 | 28 |
| Imipenemc | 17 | 15 | 15 | 15 | 13 | 14 | 19 | 19 | 19 | 24 |
| Meropenem | 12 | 11 | 14 | 11 | 9 | 10 | 15 | 20 | 15 | 20 |
| Tobramicinac | 8 | 9 | 8 | 5 | 5 | 8 | 7 | 7 | 5 | 7 |
| Amicacina | 5 | 7 | 13 | 12 | 7 | 7 | 9 | 13 | 3 | 7 |
| Ciprofloxacinoc | 26 | 33 | 34 | 32 | 28 | 24 | 25 | 25 | 19 | 23 |
| Colistinac,d | 4 | 5 | 4 | 8 | 7 | 7 | 4 | 4 | 6 | 6 |
De los antimicrobianos evaluados, los únicos con los que se observó diferencias estadísticamente significativas al comparar los porcentajes globales de aislados resistentes y los porcentajes globales de aislados no sensibles, considerando puntos de corte de EUCAST, fueron amicacina (9% aislados resistentes y 13% aislados no sensibles; p=0,004) y meropenem (15% aislados resistentes y 20% aislados no sensibles, p=0,004). Utilizando los puntos de corte del CLSI estos porcentajes fueron del 3% (aislados resistentes) y 7% (aislados no sensibles) para amicacina (p=0,004) y del 15% (aislados resistentes) y 20% (aislados no sensibles) para meropenem (p=0,004).
Como se aprecia en la tabla 2, durante el periodo 2012-2017 las tasas de resistencia se mantuvieron relativamente estables, excepto para aztreonam, que pasa de un 22% en 2016 a un 11% en 2017 (p=0,013), y en menor medida piperacilina/tazobactam (21% en 2016 y 16% en 2017; p=0,20) y ceftazidima (21% en 2016 y 15% en 2017; p=0,17).
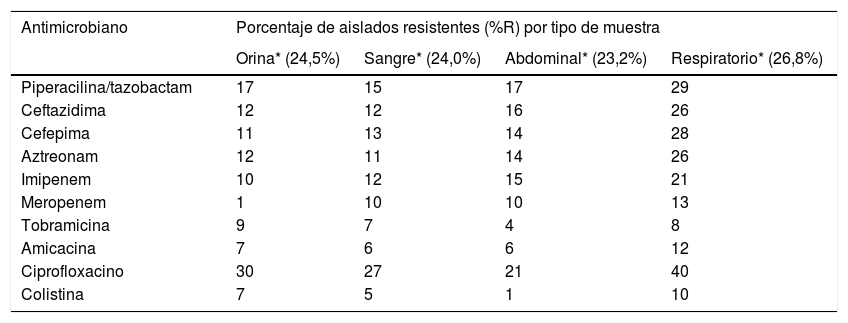
Distribución de las tasas de resistencia antimicrobiana por tipo de muestra
| Antimicrobiano | Porcentaje de aislados resistentes (%R) por tipo de muestra | |||
|---|---|---|---|---|
| Orina* (24,5%) | Sangre* (24,0%) | Abdominal* (23,2%) | Respiratorio* (26,8%) | |
| Piperacilina/tazobactam | 17 | 15 | 17 | 29 |
| Ceftazidima | 12 | 12 | 16 | 26 |
| Cefepima | 11 | 13 | 14 | 28 |
| Aztreonam | 12 | 11 | 14 | 26 |
| Imipenem | 10 | 12 | 15 | 21 |
| Meropenem | 1 | 10 | 10 | 13 |
| Tobramicina | 9 | 7 | 4 | 8 |
| Amicacina | 7 | 6 | 6 | 12 |
| Ciprofloxacino | 30 | 27 | 21 | 40 |
| Colistina | 7 | 5 | 1 | 10 |
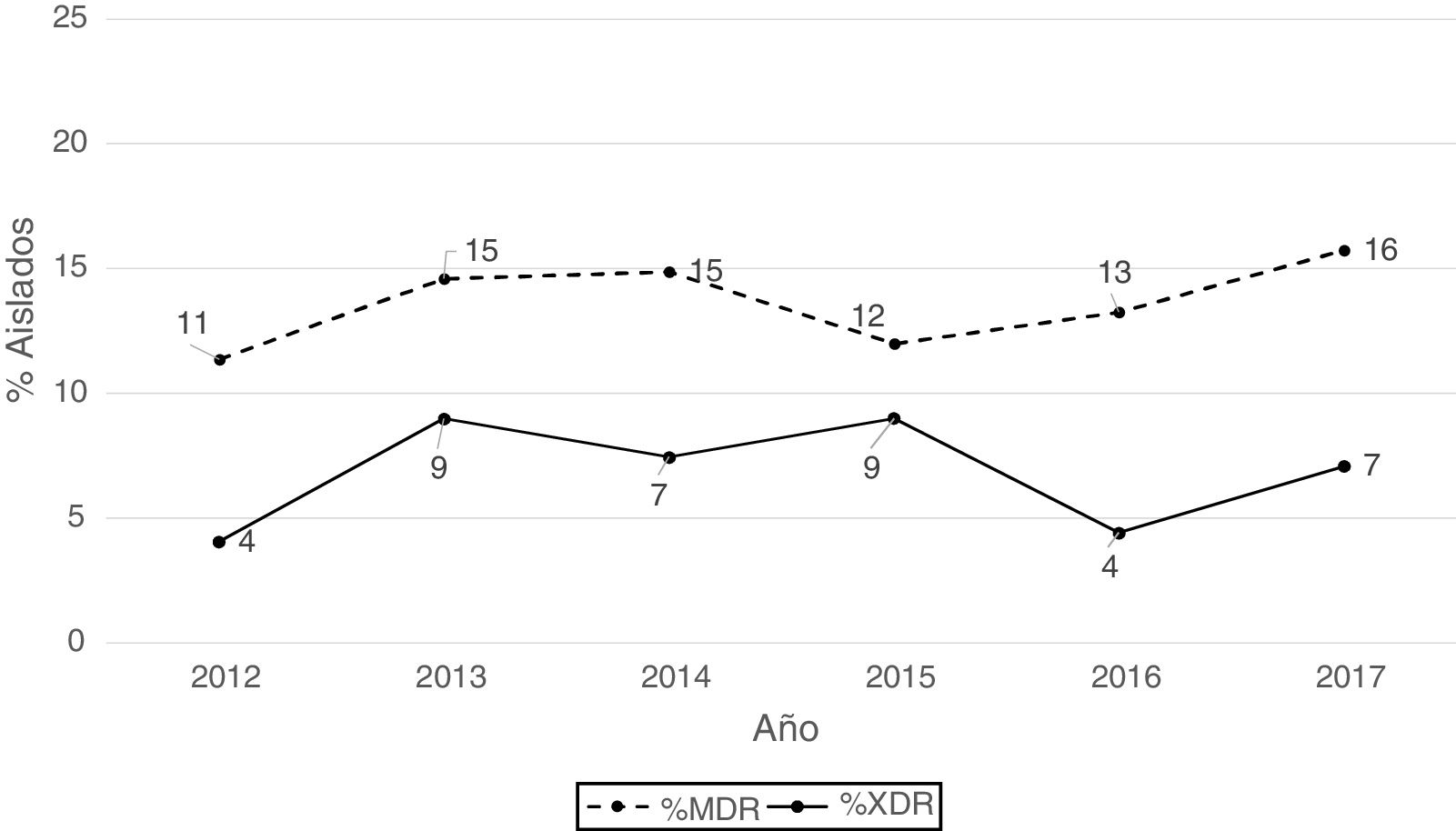
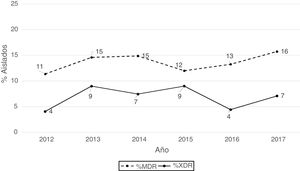
Según los criterios de Magiorakos et al.21 no se observaron aislados panresistentes, mientras que el 14% de los aislados fueron multirresistentes (MDR) y el 7% extremadamente resistentes (XDR). Como se aprecia en la figura 2, el porcentaje de aislados MDR se incrementó ligeramente a partir de 2012, pasando de un 11% en 2012 a un 16% en 2017. Respecto a los aislados XDR también se observa un incremento, pero menos acentuado que en los aislados MDR, pasando de un 4% en 2013 a un 7% en 2017.
Los aislados obtenidos de muestras respiratorias presentaron mayor resistencia a los antimicrobianos evaluados, particularmente ciprofloxacino (40%), amicacina (12%) y colistina (10%), que los aislados obtenidos de otras muestras, como por ejemplo orina o sangre.
DiscusiónSegún los resultados del estudio EPINE de 2017 P. aeruginosa fue el segundo patógeno nosocomial (9,6%), junto con Staphylococcus aureus, después de Escherichia coli (15,6%)22. En los últimos años se ha observado un aumento importante, aunque variable, en las tasas de resistencia antimicrobianas de P. aeruginosa. Este hecho justifica la necesidad de conocer las tasas de resistencias locales a los antimicrobianos así como las tendencias o evolución de las mismas en el tiempo, con el objeto de poder establecer o diseñar estrategias terapéuticas, sobre todo las empíricas, adecuadas.
Los datos obtenidos en este estudio indican que las tasas globales de resistencia antimicrobiana en P. aeruginosa en la zona sur de España (Andalucía, Extremadura y Ceuta) no son muy elevadas en comparación a la descrita en otros estudios nacionales14–16 y que estas varían dependiendo del punto de corte clínico utilizado (EUCAST o CLSI), de los criterios de inclusión de los aislados (aislados resistentes o aislados resistentes más aislados con sensibilidad intermedia) y del origen de los aislados.
En los últimos años se está produciendo, sobre todo en Europa, una clara tendencia en el uso creciente de puntos de corte EUCAST23,24. La razón es clara pues son los puntos de corte oficiales de la agencia Europea de Medicamentos. Adicionalmente, muchos países de Europa han tenido una «orden» de sus ministerios para ello.
El punto de corte utilizado (EUCAST o CLSI) tuvo un efecto importante en la mayoría de las tasas globales de resistencia antimicrobiana. Para algunos antimicrobianos, como piperacilina/tazobactam, cefepima, amicacina y ciprofloxacino se obtuvieron mayores tasas de resistencias usando EUCAST que con CLSI, por lo que el criterio o los puntos de corte utilizados para interpretar las categorías clínicas es de especial relevancia por la gran trascendencia o repercusión clínica que puede tener.
Con independencia del punto de corte utilizado, la tasa de resistencia más elevada se observó con ciprofloxacino (25% EUCAST y 19% CLSI), mientras que los antimicrobianos más activos fueron colistina, tobramicina y amicacina, con tasas de resistencia inferiores al 10%. Estos resultados concuerdan con los obtenidos en estudios previos, como los obtenidos en un estudio nacional español realizado con aislados obtenidos durante 1998-2003 en el que las mayores tasas de resistencia se observaron con ciprofloxacino (28%), aztreonam (23%) y cefepima (20%), mientras que los antimicrobianos más activos fueron tobramicina (11%), amicacina (8%) y piperacilina/tazobactam (7%)14. Los datos obtenidos en estudios más recientes realizados en España indican una tendencia similar o muy parecida. En un estudio realizado en Córdoba con aislados de 2005-2010 se observó que las mayores tasas de resistencia se correspondían con ciprofloxacino (20%), gentamicina (16%) y cefepima (12%), siendo los antimicrobianos de mayor actividad tobramicina (5%), meropenem (7%), piperacilina/tazobactam (7%) y ceftazidima (7%)16. Resultados similares se obtuvieron en otro estudio realizado en Castellón con aislados de 2004-2008, en el que la mayor tasa de resistencia se obtuvo con ciprofloxacino (17%), mientras que los antimicrobianos más activos fueron amicacina (2%), piperacilina/tazobactam (6%) y meropenem (6%)15.
El cálculo de las tasas de resistencia antimicrobiana puede realizase considerando aislados no sensibles (aislados con sensibilidad intermedia y aislados resistentes). En nuestro estudio esta consideración tuvo un gran impacto sobre las tasas de resistencia de algunos antimicrobianos, particularmente cuando se aplican puntos de corte EUCAST, como se ha visto anteriormente, como por ejemplo meropenem (15% aislados resistentes vs. 20% aislados no sensibles) y amicacina (9% aislados resistentes vs. 13% aislados no sensibles). Recientemente EUCAST ha realizado unas modificaciones o recomendaciones en relación con los aislados con sensibilidad intermedia en el sentido de que estos aislados pueden ser considerados como sensibles en función de ciertos factores como por ejemplo la dosis de antimicrobiano o el foco de la infección, entre otros25. Este cambio implicará una disminución muy significativa en las tasas de resistencia de muchos antimicrobianos.
De forma global, durante el periodo de estudio (2012-2017) no se han observado cambios o tendencias importantes en las tasas de resistencia de la mayoría de los antimicrobianos evaluados, excepto para aztreonam, cuya tasa de resistencia en 2017 se reduce a la mitad (11%) respecto a 2016 (22%). Estos resultados sugieren que en los hospitales del sur de España no se están produciendo cambios importantes a nivel de diseminación de determinantes de resistencia o de clones resistentes. Esta tendencia parece que se mantiene desde principios de 2000 según muestran los resultados de algunos estudios previos realizados en España14.
En nuestro estudio no se observaron aislados panresistentes, mientras que la prevalencia global de aislados MDR (14%) y XDR (7%) fue relativamente baja. Estos porcentajes de resistencia combinada son relativamente parecidos a los descritos en algunos países de centro y sur de Europa, según datos del ECDC de 201726; no obstante estos porcentajes estuvieron muy por debajo de las tasas descritas recientemente en un estudio multicéntrico realizado en España, Grecia e Italia en el que estos porcentajes fueron del 4% para aislados panresistentes, 30% para aislados MDR y 36% para aislados XDR27.
Los aislados obtenidos de muestras respiratorias presentaron mayor resistencia a los antimicrobianos evaluados, particularmente ciprofloxacino y colistina, que los aislados obtenidos de otras muestras, como por ejemplo orina o sangre. Estos resultados son similares a los observados en otros estudios y podrían estar relacionados con un mayor uso de antimicrobianos para el tratamiento de las infecciones respiratorias por P. aeruginosa15.
Este trabajo tiene algunas limitaciones. Los datos de sensibilidad son los comunicados por los centros utilizando diferente metodología, sin que los datos se hayan comprobado en un laboratorio de referencia, pero consideramos que el número de centros participantes y los años y tipo de muestra incluidos nos dan una imagen bastante real de la situación de la sensibilidad a P. aeruginosa en el sur de nuestro país. Mientras no existan bases de datos normalizadas nacionales, este tipo de estudio es necesario para adquirir este tipo de información. Otra limitación que presenta este trabajo es la ausencia de estudios de epidemiología molecular (ej. PFGE, MLST) que podrían ayudar a entender si las prevalencias de las resistencias observadas se pueden ver afectadas (o no) en parte por determinadas situaciones endémicas (ej. clones resistentes o bien de diseminación de determinantes de resistencia horizontales) en alguno(s) de los centros participantes.
En conclusión, la resistencia antimicrobiana en P. aeruginosa en el sur de España no es demasiado elevada en comparación con la descrita en otros estudios14–16,26. Las tasas de resistencia más elevadas se observan con ciprofloxacino, piperacilina/tazobactam y meropenem, siendo los antimicrobianos de mayor actividad colistina, tobramicina y amicacina. Las mayores tasas de resistencia se observan en aislados de muestras respiratorias. En general las tasas de resistencia se mantienen estables durante el periodo de estudio para la mayoría de los antimicrobianos evaluados.
FinanciaciónLas reuniones del Grupo GRAM fueron parcialmente financiadas por laboratorios MSD.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores de este trabajo manifiestan su agradecimiento a todos los centros que han participado desinteresadamente en este estudio.
Eugenio Garduño (H. Infanta Cristina, Badajoz), Purificación Hernández Pérez (H. San Pedro de Alcántara, Cáceres), José Román Muñoz Sanz (H. Virgen del Puerto, Plasencia, Cáceres), Carmen González Velasco (H. General de Mérida, Mérida, Badajoz), Saray Rodríguez (H. Don Benito, Badajoz), José M. Navarro Marí y María Dolores Rojo Martín (H. Virgen de las Nieves, Granada), Marta Álvarez Estévez y Alejandro Peña Monje (H. Universitario San Cecilio, Granada), Waldo Sánchez Yebra (H. Torrecárdenas, Almería), Carolina Roldán Fontana y Lina Martín Hita (Complejo Hospitalario Jaén, Jaén), Encarnación Clavijo Frutos y María Gracia Ortega (H. Virgen de la Victoria, Málaga), Begoña Palop Borrás y Pilar Bermúdez Ruiz (H. Regional de Málaga, Málaga), José Antonio Lepe y Javier Aznar (H. Virgen del Rocío, Sevilla), M. Carmen Domínguez (H. La Merced, Osuna, Sevilla), Irene Gracia Ahufinger y Fernando Rodríguez (H. Reina Sofía, Córdoba), Ana Domínguez Castaño (H. Juan Ramón Jiménez (Huelva), Manuel Rodríguez Iglesias y Fátima Galán Sánchez (H. Puerta del Mar, Cádiz), M. Dolores López Prieto y Juan Manuel Sánchez Calvo (H. de Jerez, Cádiz), José Luis López Barba (H. de Ceuta, Ceuta), Carmen Martínez Rubio (H. Puerto Real, Cádiz)