El objetivo de este estudio es valorar si la RM en contraste de fase es una herramienta útil en el diagnóstico de la hidrocefalia a presión normal (HPN), así como su diferenciación con otras afecciones neurológicas muy similares clínicamente.
MétodosSe incluyó a un total de 108 sujetos, de los cuales 61 eran sujetos sanos control, y 47 pacientes; 19 de ellos fueron clasificados en el grupo de pacientes con enfermedad cerebrovascular isquémica (ECI) y 28 pacientes dentro del grupo de HPN. A todos los pacientes se les realizó una RM en contraste de fase con cuantificación de parámetros de flujo y velocidad de LCR en el acueducto de Silvio. Se evaluó la capacidad de clasificación de los parámetros individualmente y combinándolos mediante análisis discriminantes.
ResultadosLos parámetros de velocidad máxima diastólica, flujo promedio y volumen por ciclo mostraron diferencias estadísticamente significativas para separar a los pacientes con HPN y con ECI (p<0,001). El volumen por ciclo y el flujo promedio no presentaron falsos positivos, con tasas de acierto del 86% y 79%, respectivamente. El resto de parámetros y la combinación de todos ellos no mejoraron los resultados.
ConclusionesLa RM en contraste de fase es una herramienta muy útil para el diagnóstico precoz de los pacientes con HPN. La cuantificación de parámetros de flujo de LCR junto con la valoración del estudio morfológico de la RM convencional permite diferenciar a los pacientes con HPN de los pacientes con ECI.
The aim of this study is to evaluate the use of phase-contrast MR imaging to diagnose normal pressure hydrocephalus (NPH) and differentiate it from other neurological disorders with similar clinical symptoms.
MethodsThe study included 108 subjects, of whom 61 were healthy controls and 47, patients; in the patient group, 19 had cerebrovascular disease (CVD) and 28 had NPH. All patients underwent a phase-contrast MRI study and several CSF flow and velocity parameters were measured at the aqueduct of Sylvius. Discriminant analyses were performed to evaluate the classification capacity of both individual parameters and the combination of different parameters.
ResultsMaximum diastolic velocity, mean flow, and stroke volume showed statistically significant differences that could be used to distinguish between NPH and CVD patients (P<.001). Stroke volume and mean flow showed no false positive results and successful classification rates of 86% and 79%, respectively. No other parameters or combination produced better results.
ConclusionsPhase-contrast MR imaging is a useful tool for the early diagnosis of patients with NPH. CSF flow quantitative parameters, along with morphological features in a conventional MR study, enable us to differentiate between NPH and CVD patients.
La teoría más aceptada sobre el mecanismo fisiopatológico de la hidrocefalia a presión normal (HPN) o también llamada hidrocefalia crónica del adulto es la alteración de los mecanismos de reabsorción del LCR1,2. Hay que tener en cuenta que el objetivo de la derivación ventricular no es reducir la presión intraventricular, sino disminuir el pulso de LCR.
Durante la sístole, la entrada de sangre arterial en el cerebro normal produce un aumento del volumen intracraneal que se compensa con el desplazamiento de LCR a través del conducto espinal y, por tanto, un movimiento craneocaudal de líquido y en sentido centrífugo a los senos venosos. Durante la diástole, la salida de sangre reduce el volumen intracraneal y el LCR se mueve en dirección contraria. El desplazamiento de líquido depende de la elasticidad intracraneal relativa.
En los pacientes con HPN existe una disminución de la elasticidad intracraneal y la fuerza de la sístole no puede transmitirse de igual manera en sentido centrífugo, por lo que tiende a transmitirse centrípetamente, comprimiendo los ventrículos laterales y aumentando el flujo de LCR a través del acueducto de Silvio3-6.
La HPN se caracteriza por el cuadro clínico de demencia, inestabilidad en la marcha e incontinencia urinaria (tríada de Hakim)7. Aunque esta es la forma más típica de presentación, algunas series han demostrado que hasta el 30% de los pacientes solo presentan uno de los síntomas. El diagnóstico de la HPN es difícil en muchos casos, ya que otras enfermedades neurológicas pueden presentar estos síntomas, muchas veces inespecíficos8,9. En la mayor parte de los casos, el síntoma de presentación es la inestabilidad en la marcha, que también puede estar asociada a discretas alteraciones cognitivas10. Estas alteraciones son de predominio subcortical, siendo a menudo difícil establecer diferencias clínicas frente a otros tipos de demencia, como las de origen vascular o la asociada a la enfermedad de Parkinson11,12.
El diagnóstico radiológico clásico de la HPN se basaba en la dilatación desproporcionada del sistema ventricular respecto al espacio subaracnoideo, observado en el estudio de tomografía computarizada (TC). La disminución del espacio subaracnoideo suele ser más marcada en la convexidad. Sin embargo, este signo considerado aisladamente es altamente inespecífico, ya que puede aparecer tanto en la hidrocefalia comunicante secundaria como en la atrofia cerebral.
Con el uso de la resonancia magnética (RM), se pueden observar otros signos característicos, aunque no diagnósticos, de la HPN. El primero es el aumento del vacío de flujo en el tercer ventrículo, que se produce por un aumento de la velocidad del LCR y se puede ver como una marcada hipointensidad de señal en las secuencias T2. Las hiperintensidades de señal periventriculares y en la sustancia blanca profunda, que también se suelen observar en las secuencias T2, están asociadas a alteraciones de la microcirculación13, pero tampoco son específicas. Aunque estas aparecen más frecuentemente en pacientes con HPN14,15, también se pueden encontrar en otros pacientes con alteraciones cognitivas de origen vascular e, incluso, entre el 30 y 80% de las personas sanas mayores13.
Existen otros métodos para el diagnóstico de los pacientes con HPN, entre ellos destaca la medida de presión abierta de LCR16, la medida de la resistencia de salida de LCR17 y estudios dinámicos como el tap test18. El tap test consiste en la extracción de 40 o 50ml de LCR mediante una punción lumbar, tiene un valor predictivo positivo muy alto (de hasta el 90%) y, sin embargo, escasa sensibilidad (26-61%). El test de infusión salina, con medida de la resistencia de salida de LCR, presenta mayor sensibilidad (57%-95%), con un alto valor predictivo positivo (75-92%)19. Por tanto, distintos estudios demuestran amplios resultados y, además, todos ellos son invasivos.
La HPN es la única demencia que puede ser tratada mediante derivación ventricular. Sin embargo, no existe acuerdo sobre los pacientes que deben someterse a cirugía, ya que aunque se han publicado algunas guías diagnósticas20, no existen parámetros establecidos para diagnosticar la HPN de manera precisa21,22. Para algunos estudios, la única evidencia diagnóstica de HPN es la buena respuesta a la derivación ventricular23. Sin embargo, se sabe que esta depende de la técnica quirúrgica y de las complicaciones postoperatorias, que ocurren hasta en un 28% de los casos24,25, por lo que la respuesta a la derivación ventricular no puede considerarse como una prueba de referencia reproducible.
En este contexto, la RM con contraste de fase (RM-PC) abre una nueva puerta en el diagnóstico de la HPN, ya que permite calcular parámetros cuantitativos de flujo de LCR a lo largo del ciclo cardiaco25. Utilizando esta técnica no invasiva, algunos estudios han demostrado la presencia de un flujo hiperdinámico en el acueducto de Silvio en pacientes con HPN3,4,6,24-26.
El objetivo de este estudio es evaluar si la RM-PC puede ayudar a separar a los pacientes con HPN de los pacientes con ECI, ya que los 2 pueden tener los mismos hallazgos de RM convencional.
Pacientes y métodosPacientesRealizamos una RM-PC a un total de 124 pacientes durante un periodo de 5 años (desde enero del 2005 hasta diciembre del 2011), de los que se incluyó finalmente a 108 en el estudio (42 hombres, 66 mujeres), con un rango de edad de entre 20 y 91 años (56±21 años). Todos los pacientes dieron su consentimiento para la anonimización y la inclusión de sus imágenes en el estudio. No se requirió ninguna autorización especial por parte del Comité de Ética, ya que el estudio de RM se realiza en la rutina clínica habitual.
Los sujetos se clasificaron en sanos, HPN y ECI sobre la base de los siguientes criterios:
- 1.
Sujetos sanos (61 sujetos): 43 hombres y 18 mujeres, con una media de edad de 46 años. Los sujetos seleccionados como población control fueron voluntarios y pacientes remitidos para la realización de RM por cefaleas y vértigos. No presentaban alteraciones neurológicas (como ataxia o demencia) ni incontinencia. No habían presentado nunca un cuadro de hipertensión intracraneal ni habían tenido un traumatismo craneoencefálico.
- 2.
Pacientes con diagnóstico de HPN (28 pacientes): 23 hombres y 5 mujeres, con una media de edad de 71 años. Se emplearon los siguientes criterios de inclusión:
- –
Dilatación ventricular con índice de Evans > 0,3 (medido como la relación entre la distancia entre las astas frontales y las tablas internas del cráneo en parietal posterior), que presentaban además inestabilidad en la marcha con inicio insidioso.
- –
Dilatación ventricular y deterioro cognitivo leve.
- –
Dilatación ventricular e incontinencia urinaria.
- –
No presentar factores de riesgo cardiovascular, diabetes, hipertensión o arteriosclerosis.
- –
No presentar historia de traumatismo craneal, hipertensión intracraneal o hemorragia subaracnoidea.
- –
Realización de una derivación ventricular con mejoría clínica evaluada al menos 6 meses después de la cirugía.
- 3.
Pacientes con ECI (19 pacientes): 10 hombres y 9 mujeres, con media de edad de 70 años. Presentaban deterioro cognitivo moderado de inicio reciente y curso progresivo y al menos uno de los siguientes:
- –
Más del 25% de aumento de intensidad de señal de la sustancia blanca en secuencias T2 de RM por leucoaraiosis y presencia de arteriosclerosis en otras localizaciones.
- –
Presencia de factores de riesgo cardiovascular (hipertensión, diabetes o tabaquismo).
- –
Se excluyó a 16 pacientes tras la realización de la resonancia y la cuantificación de flujo por los siguientes motivos: pacientes con hidrocefalia obstructiva (2), específicamente los pacientes con estenosis del acueducto de Silvio con hidrocefalia supratentorial y acueducto ausente o disminuido de tamaño y ausencia de señal de flujo en el acueducto en la RM con contraste de fase; pacientes diagnosticados de malformación de Chiari tipo i (1); pacientes con antecedentes de hemorragia subaracnoidea y sospecha de hidrocefalia comunicante arreabsortiva (1); pacientes con tumoraciones intraxiales (1); pacientes con infarto cortical parietal (1); pacientes sin seguimiento clínico de al menos 6 meses (8); pacientes con arritmias continuas y persistentes (1) y pacientes menores de 20 años (1).
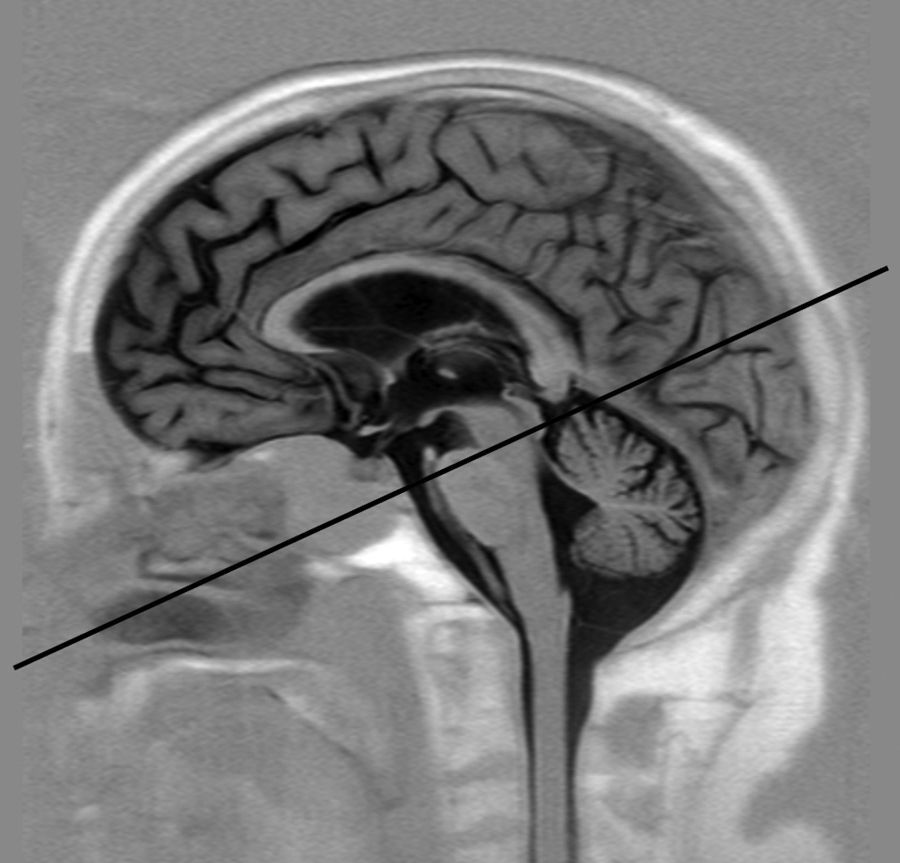
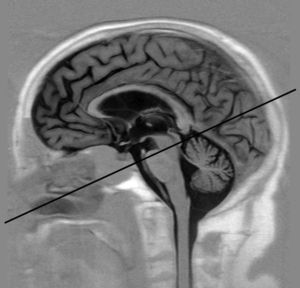
Adquisición de imágenesEl estudio de RM-PC se realizó con un plano oblicuo transversal al acueducto de Silvio (fig. 1). Se empleó un equipo de RM de 3 T (Archieva r3.2, Philips, Holanda), con los siguientes parámetros de adquisición: TR=16ms, TE=8ms, ángulo de inclinación=10°, 25 imágenes/ciclo, matriz de adquisición=324×324, grosor de corte=5mm, tamaño de píxel=0,330,33mm, velocidad de codificación=15cm/s, sincronización cardiaca retrospectiva. Las velocidades caudocraneales se codificaron como valores positivos, mientras que las velocidades craneocaudales se codificaron como valores negativos. Para prevenir las variaciones de flujo asociadas al ritmo circadiano se adquirieron todos los estudios en la misma franja horaria (de 11 a 18 horas)27.
El estudio de RM incluyó además las siguientes secuencias: turbo espín eco transversal potenciada en T2, turbo espín eco FLAIR coronal, turbo espín eco sagital potenciada en T1 con inversión inicial de la magnetización y difusión.
Análisis cuantitativoEl análisis cuantitativo de las imágenes de RM-PC comprendió 4 pasos: a) segmentación del acueducto de Silvio; b) extracción de las curvas temporales de flujo de LCR; c) corrección del aliasing, y d) cálculo de los parámetros cuantitativos de LCR.
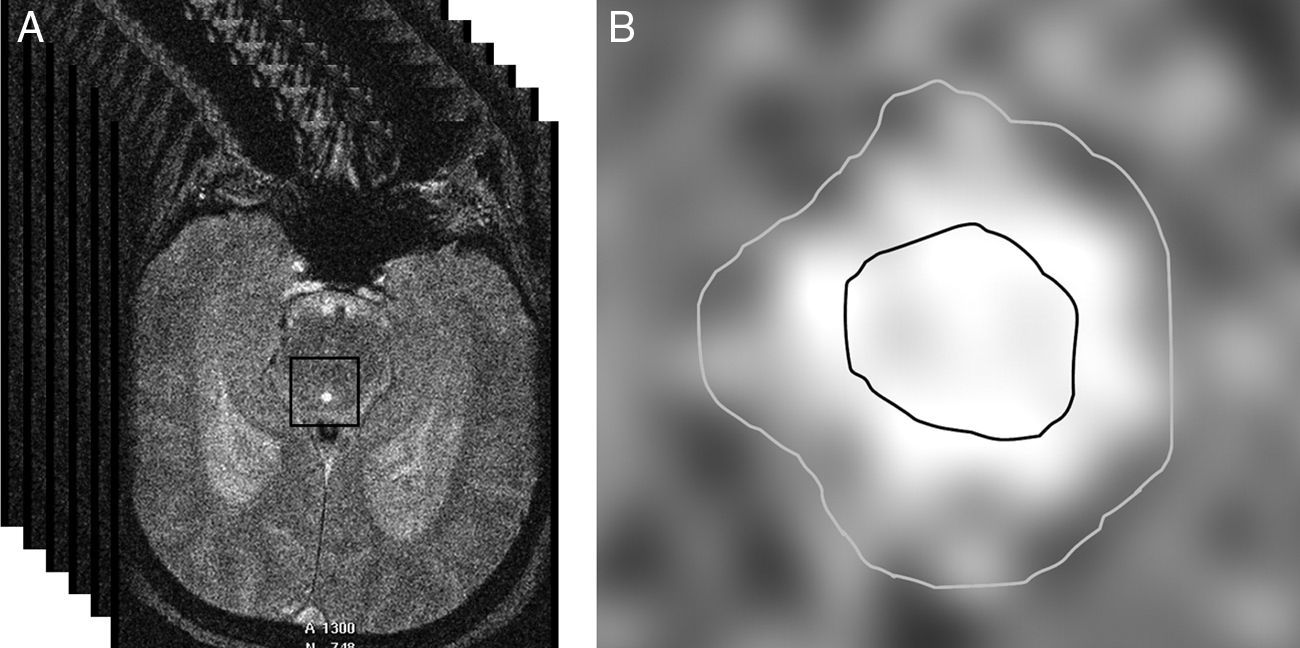
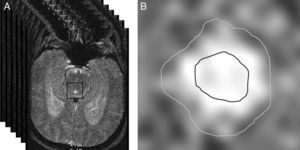
Para segmentar el acueducto, se seleccionó manualmente un punto dentro del mismo y se aplicó de forma automática un método de umbralización. Básicamente, este método convierte una imagen en escala de grises en una imagen binaria con 2 valores posibles, 0 o 1 (negro o blanco), dependiendo de si la intensidad del píxel es menor o mayor que el umbral establecido, respectivamente28. El resultado de la segmentación son 2 regiones de interés (ROI): un área interna al acueducto, que permite calcular la velocidad del LCR, y un área que comprende todo el acueducto, utilizada para obtener valores de flujo (fig. 2). Es necesario emplear 2 ROI para prevenir que los efectos del flujo laminar (flujo más rápido en el centro del acueducto que cerca de las paredes) contaminen las medidas de velocidad29.
a) Selección automática de una matriz cuadrada alrededor del acueducto de Silvio a partir de un punto marcado manualmente en su interior. En esta matriz se aplicarán los umbrales de intensidad para obtener la segmentación. b) Segmentación del acueducto de Silvio mediante umbralización. La región de interés interior se utiliza para medir solo las velocidades, mientras que la región exterior comprende todo el acueducto y se emplea para las medidas de flujo.
A continuación, se extraen las curvas temporales de flujo mediante la propagación de las 2 ROI al resto de las 25 imágenes de la secuencia de RM adquiridas a lo largo del ciclo cardiaco. Esta curva puede presentar aliasing, es decir, píxeles cuyo valor de velocidad se ha codificado erróneamente debido a que la velocidad del flujo en ese punto es más alta que el rango especificado en la secuencia de RM (15cm/s en este estudio). El efecto del aliasing sobre la curva temporal se traduce en cambios muy abruptos, que se pueden detectar y corregir automáticamente28.
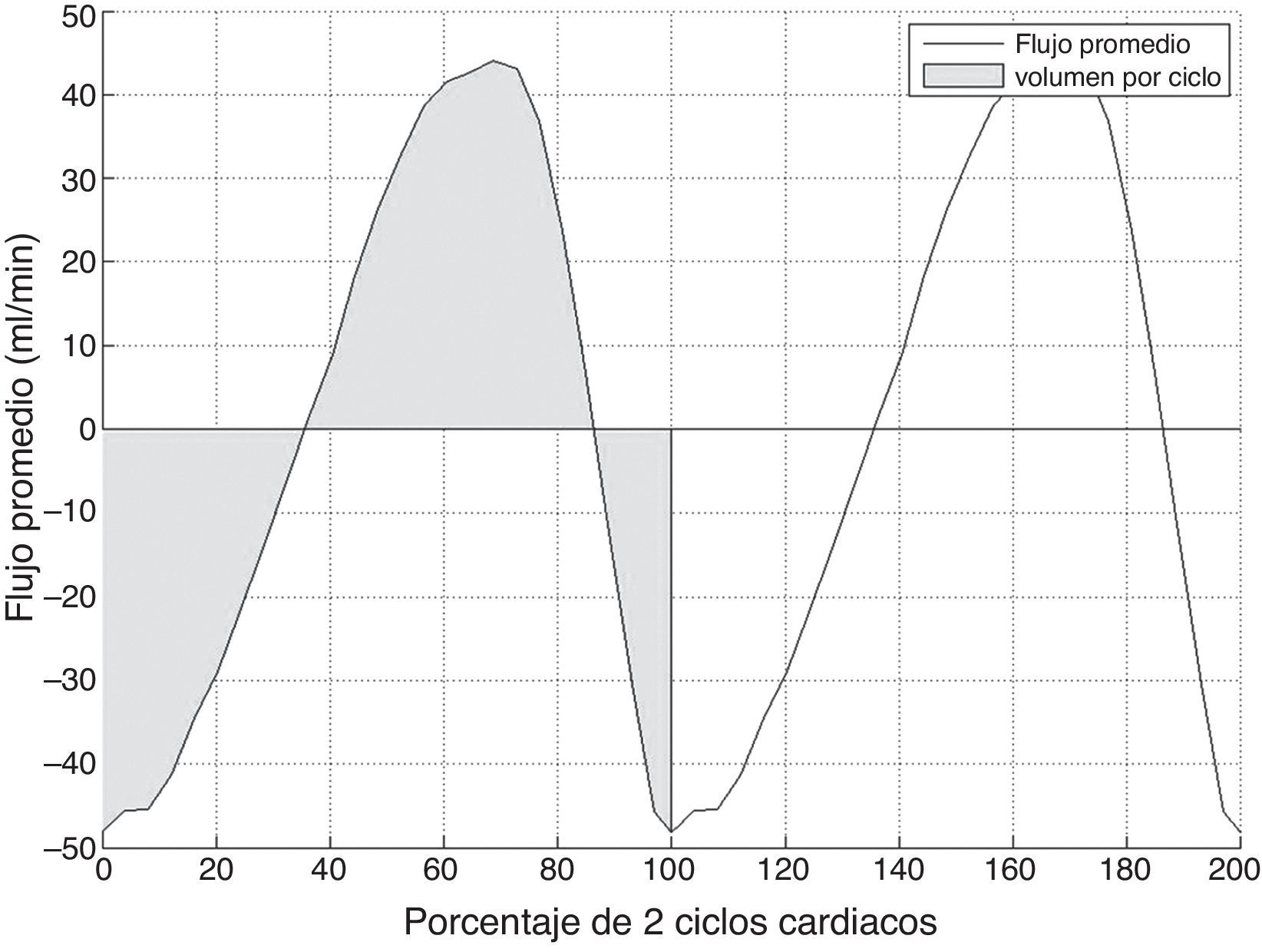
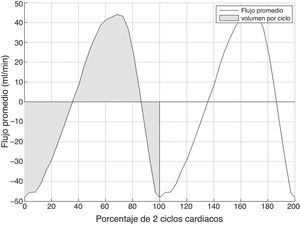
Finalmente, se obtiene una curva temporal de flujo libre de aliasing (fig. 3), a partir de la cual se pueden obtener varios parámetros cuantitativos:
- –
Velocidad máxima diastólica.
- –
Velocidad máxima sistólica.
- –
Amplitud de velocidad, obtenida como la variación de velocidad entre las velocidades máximas diastólica y sistólica.
- –
Flujo en cada píxel, calculado para cada instante temporal como la multiplicación del área del píxel por su velocidad.
- –
Flujo promedio, calculado como la media del flujo de todos los píxeles del acueducto para cada instante temporal.
- –
Volumen por ciclo, calculado como el valor absoluto del área bajo la curva de flujo promedio durante un ciclo cardiaco.
Se realizaron pruebas ANOVA con test post hoc para estudiar las diferencias entre sujetos sanos, pacientes con ECI y pacientes con HPN. La homogeneidad de las variancias se estudió con test de Levene. En caso de homocedasticidad, se utilizó el test post hoc de Student-Newmann-Keuls. En caso contrario, se utilizó el test T2 de Tamhane. Se consideró como estadísticamente significativo un valor de p<0,05. Adicionalmente, se realizó un análisis discriminante para estudiar si alguna combinación lineal de los parámetros cuantitativos calculados permitía establecer una mejor clasificación de los pacientes. Todos los análisis se realizaron en SPSS (versión 13.0, IBM, EE. UU.).
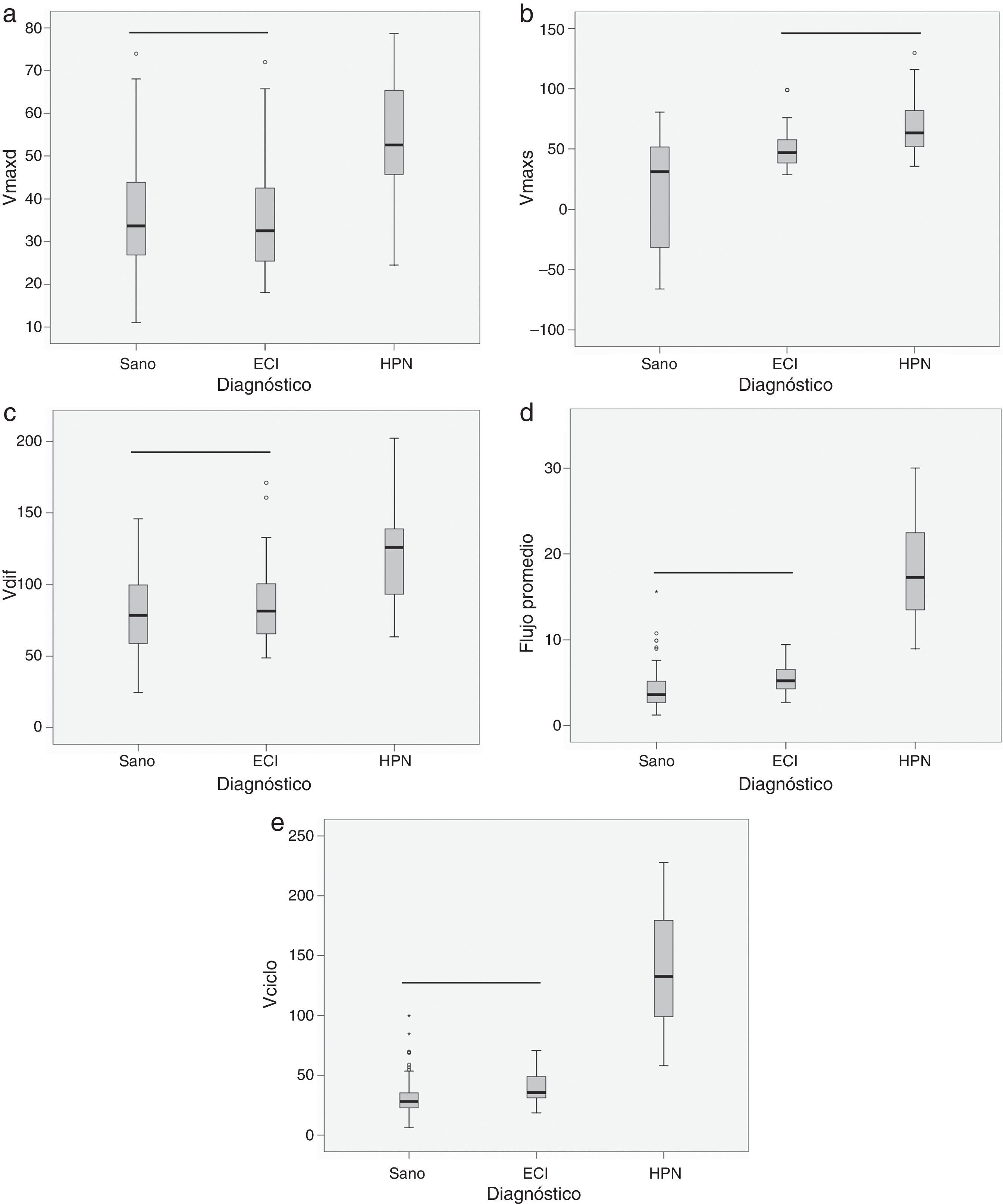
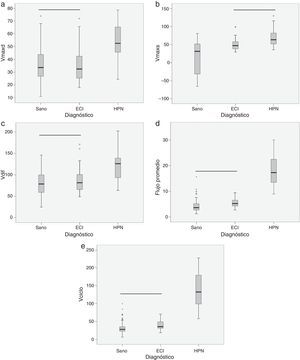
ResultadosEl volumen por ciclo, el flujo promedio, la velocidad máxima diastólica y la amplitud de velocidad presentaron diferencias estadísticamente significativas entre pacientes con ECI y pacientes con HPN (tabla 1). Cabe destacar que la velocidad máxima sistólica no permitió separar entre ambos grupos, pero sí mostro diferencias significativas para diferenciar entre pacientes con ECI y sujetos sanos (tabla 1). En la figura 4 se pueden observar la distribución de casos y los distintos grados de solapamiento entre grupos para cada una de las variables.
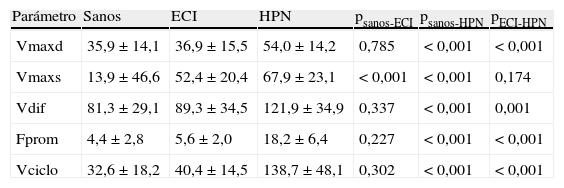
Media±desviación típica y significación estadística de los parámetros cuantitativos de LCR para sujetos sanos y pacientes con enfermedad cerebrovascular isquémica e hidrocefalia a presión normal
| Parámetro | Sanos | ECI | HPN | psanos-ECI | psanos-HPN | pECI-HPN |
| Vmaxd | 35,9±14,1 | 36,9±15,5 | 54,0±14,2 | 0,785 | < 0,001 | < 0,001 |
| Vmaxs | 13,9±46,6 | 52,4±20,4 | 67,9±23,1 | < 0,001 | < 0,001 | 0,174 |
| Vdif | 81,3±29,1 | 89,3±34,5 | 121,9±34,9 | 0,337 | < 0,001 | 0,001 |
| Fprom | 4,4±2,8 | 5,6±2,0 | 18,2±6,4 | 0,227 | < 0,001 | < 0,001 |
| Vciclo | 32,6±18,2 | 40,4±14,5 | 138,7±48,1 | 0,302 | < 0,001 | < 0,001 |
Unidades: Vmaxd, Vmaxs, Vdif en mm/s; Fprom en ml/min; Vciclo en μl.
ECI: enfermedad cerebrovascular isquémica; Fprom: flujo promedio; HPN: hidrocefalia a presión normal; Vciclo: volumen por ciclo; Vdif: amplitud de velocidad; Vmaxd: velocidad máxima diastólica; Vmaxs: velocidad máxima sistólica.
Diagramas de caja donde se presentan los estadísticos de mediana (línea negra central), percentiles 25 y 75 (área del rectángulo), máximo y mínimo, para la velocidad máxima diastólica (Vmaxd) (a), la velocidad máxima sistólica (Vmaxs) (b), la amplitud de velocidad (Vdif) (c), el flujo promedio (d) y el volumen por ciclo (Vciclo) (e), en sujetos sanos, pacientes con enfermedad cerebrovascular isquémica (ECI) y pacientes con hidrocefalia a presión normal (HPN). La línea negra horizontal indica que no existen diferencias estadísticamente significativas entre los grupos. Unidades: Vmaxd, Vmaxs, Vdif en mm/s; flujo promedio en ml/min; Vciclo en μl.
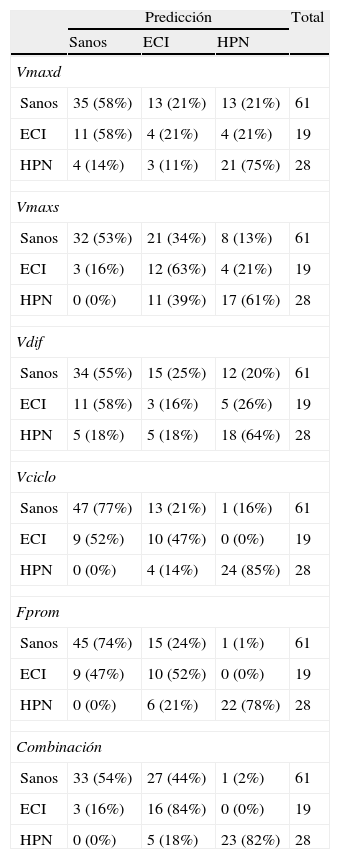
La clasificación obtenida mediante el análisis discriminante mostró que el volumen por ciclo y el flujo promedio presentaban las menores tasas de error para clasificar correctamente ECI e HPN, con errores de un 14% (4 pacientes con HPN clasificados como ECI) y un 21% (6 pacientes con HPN clasificados como ECI), respectivamente (tabla 2). Ambos parámetros clasificaron correctamente a todos los pacientes con ECI. El siguiente parámetro que mejores resultados proporcionó fue la velocidad máxima diastólica, con un error de un 32% (4 pacientes con ECI clasificados como HPN y 3 pacientes con HPN clasificados como ECI). La combinación de parámetros cuantitativos en una función discriminante no mejoró los resultados de la clasificación individual. Cabe destacar que ni el volumen por ciclo ni el flujo promedio presentaron falsos positivos, siendo por tanto el volumen por ciclo el parámetro con mejor rentabilidad diagnóstica.
Resultados de la clasificación obtenida de la validación cruzada del análisis discriminante para los parámetros estudiados y su combinación
| Predicción | Total | |||
| Sanos | ECI | HPN | ||
| Vmaxd | ||||
| Sanos | 35 (58%) | 13 (21%) | 13 (21%) | 61 |
| ECI | 11 (58%) | 4 (21%) | 4 (21%) | 19 |
| HPN | 4 (14%) | 3 (11%) | 21 (75%) | 28 |
| Vmaxs | ||||
| Sanos | 32 (53%) | 21 (34%) | 8 (13%) | 61 |
| ECI | 3 (16%) | 12 (63%) | 4 (21%) | 19 |
| HPN | 0 (0%) | 11 (39%) | 17 (61%) | 28 |
| Vdif | ||||
| Sanos | 34 (55%) | 15 (25%) | 12 (20%) | 61 |
| ECI | 11 (58%) | 3 (16%) | 5 (26%) | 19 |
| HPN | 5 (18%) | 5 (18%) | 18 (64%) | 28 |
| Vciclo | ||||
| Sanos | 47 (77%) | 13 (21%) | 1 (16%) | 61 |
| ECI | 9 (52%) | 10 (47%) | 0 (0%) | 19 |
| HPN | 0 (0%) | 4 (14%) | 24 (85%) | 28 |
| Fprom | ||||
| Sanos | 45 (74%) | 15 (24%) | 1 (1%) | 61 |
| ECI | 9 (47%) | 10 (52%) | 0 (0%) | 19 |
| HPN | 0 (0%) | 6 (21%) | 22 (78%) | 28 |
| Combinación | ||||
| Sanos | 33 (54%) | 27 (44%) | 1 (2%) | 61 |
| ECI | 3 (16%) | 16 (84%) | 0 (0%) | 19 |
| HPN | 0 (0%) | 5 (18%) | 23 (82%) | 28 |
Unidades: Vmaxd Vmaxs Vdif en mm/s; Fprom en ml/min; Vciclo en μl.
ECI: enfermedad cerebrovascular isquémica; Fprom: flujo promedio; HPN: hidrocefalia a presión normal; Vciclo: volumen por ciclo; Vdif: amplitud de velocidad; Vmaxd: velocidad máxima diastólica; Vmaxs: velocidad máxima sistólica.
La hidrocefalia a presión normal es una afección difícil de diagnosticar clínicamente, y en muchas ocasiones con gran similitud clínica y por imagen de RM, respecto de otras enfermedades, entre ellas la ECI30.
Esta clara asociación entre los cambios de sustancia blanca e hidrocefalia es la que nos llevó a intentar diferenciar a los pacientes con HPN y aquellos con ECI, ya que ambos procesos guardan similitudes clínicas y de imagen por RM.
Distintas guías diagnósticas han sido publicadas para intentar ayudar al diagnóstico de esta afección20, y más recientemente por el grupo de Mori et al.31-33, pero en ninguna de ellas se realiza un análisis en profundidad de utilidad de la RM en contraste de fase.
Conociendo las dificultades de diagnóstico de la HPN y de la gradación de sus síntomas, hemos desarrollado una metodología, elaborando una técnica de posproceso que minimiza los efectos de volumen parcial y aliasing, sin necesidad de repetir la exploración, como en estudios anteriores34.
Nuestro estudio confirma un flujo hiperdinámico en el acueducto, ya observado en estudios anteriores3,4. El volumen por ciclo es el parámetro que de manera aislada separó mejor a los pacientes con ECI y HPN. Nuestros valores de volumen por ciclo fueron mayores que los reportados por Bradley. La media del volumen por ciclo fue de 138μl, mientras Bradley obtuvo una media de 42μl para pacientes con HPN35. En su caso, no utilizaron segmentación automática ni corrección de aliasing. Nuestros valores de normalidad son similares a los presentados por El Sankari et al.36, que establece el punto de corte de la normalidad en 71μl (media de los valores normales más 2 desviaciones estándar). Sin embargo, la media de sus pacientes con HPN fue de 175±71, más elevado que la nuestra.
El segundo parámetro que proporcionó una mejor diferenciación entre los pacientes con HPN y ECI fue el flujo promedio. Existen varios estudios que han utilizado este parámetro para el diagnóstico de la HPN. Entre ellos destaca Luetmer et al.34, que concluyó que los pacientes con HPN muestran un flujo promedio mayor de 18ml/min. Estos resultados son similares a los nuestros; sin embargo, en el caso de Luetmer la corrección de aliasing se realiza repitiendo adquisiciones.
Ni el volumen por ciclo ni el flujo promedio presentaron falsos positivos, por lo que con este criterio no se derivaría ningún paciente innecesariamente, dado el riesgo que estos pacientes mayores pueden tener en una intervención quirúrgica. En los casos dudosos, proponemos realizar un control de imagen a los 6 meses y valorar los cambios producidos en la dinámica del flujo. En el caso de la velocidad máxima diastólica, sí se obtuvieron 4 falsos positivos, con lo que este parámetro utilizado de forma aislada llevaría a la intervención de pacientes que no mejorarían con la derivación. El análisis discriminante utilizando todos los parámetros tampoco mejoró los resultados de clasificación, probablemente porque exista cierta correlación estadística entre las variables estudiadas.
Aunque hay estudios que valoran toda la dinámica de flujo de LCR, tanto en acueducto de Silvio como en espacio cervical, en general, no encuentran diferencias en el flujo de LCR en el espacio cervical, por lo que consideran el flujo únicamente en el acueducto37.
La principal limitación de este estudio es la selección de los pacientes. En primer lugar, el número de pacientes con HPN no es muy alto (28 pacientes), a pesar del largo periodo de estudio (5 años). Esto se debe a que la HPN no es una entidad frecuente. Pr otro lado, la selección se ha realizado combinando criterios clínicos, radiológicos y de respuesta al tratamiento, ya que hasta el momento no existe prueba de referencia20.
Nuestros parámetros de adquisición fueron similares a los utilizados por Luetmer et al.34 y Lee et al.38. La velocidad de codificación debe estar por encima de la esperada, para evitar el aliasing pero la menor posible, ya que es inversamente proporcional al índice señal-ruido (ISR); por ello durante el transcurso del estudio la modificamos39. Con la selección de la velocidad de codificación, y la realización de cortes más finos y perpendiculares al acueducto conseguimos minimizar los errores de cuantificación, el más frecuente es el volumen parcial producido por los tejidos adyacentes al acueducto; el error de fondo, producido por el movimiento cerebral, lo minimizamos mediante la técnica de segmentación y posproceso desarrollada por nuestro grupo de trabajo. De esta manera, la cuantificación realizada es altamente reproducible y objetiva.
En conclusión, la RM-PC es una técnica muy útil para identificar a pacientes con HPN y para diferenciarla de pacientes con cambios vasculares. Los parámetros cuantitativos obtenidos a partir de la RM-PC, principalmente el volumen por ciclo y el flujo promedio, pueden separar a los pacientes con HPN inicial y establecida de los pacientes con ECI.
FinanciaciónParte de este trabajo ha sido financiado por una beca de la Sociedad Española de Radiología (SERAM_Industria_2008).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.