La inmunodepresión infantil es una condición que se ha incrementado en los últimos años. Los niños con cáncer, enfermedades hematológicas no malignas (como las inmunodeficiencias primarias), los receptores de trasplante de progenitores hematopoyéticos, los prematuros extremos y aquellos ingresados en Unidades de Cuidados Intensivos Pediátricos (UCIP) pueden sufrir, en mayor medida, infecciones fúngicas invasivas (IFI). El uso de las terapias oncológicas, incluidas la inmunoterapia o los anticuerpos monoclonales, para el tratamiento de las enfermedades de base en estos pacientes ha ido acompañado de un aumento de las IFI y de la mortalidad asociada.
La enfermedad de base y su manejo, las comorbilidades, las pruebas diagnósticas empleadas, tanto moleculares como de imagen, así como los tratamientos utilizados pueden ser significativamente diferentes entre los pacientes adultos y los niños ingresados en UCIP o con cáncer. En pediatría, el tratamiento de la IFI se basa, fundamentalmente, en los estudios farmacocinéticos realizados en adultos. En los pacientes de mayor riesgo debe considerarse la profilaxis y, en el caso de un diagnóstico de IFI, el tratamiento antifúngico debe administrarse lo más precozmente posible, apoyado en la corrección de la disfunción inmune y la cirugía en los casos en que esta esté indicada.
In recent years, immunodeficiency condition has experienced a rise among children, who are at risk of invasive fungal infections (IFI) due to their health condition. Cancer, non-malignant hematological diseases, as primary immunodeficiencies, hematopoietic stem cell transplantation (HSCT), extreme prematurity, or critically ill condition in Pediatric Intensive Care Unit (PICU) are some immunosuppressive situations in children. The use of oncologic therapies, including immunotherapy and monoclonal antibodies, for the treatment of the aforementioned health conditions has led to an increase in morbidity and mortality rates of IFI in children.
The underlying diseases and their management, comorbidities, the diagnostic tests used (both molecular and imaging), as well as the treatment used can be significantly different between adult patients and children admitted to PICU or with cancer. In pediatrics, the treatment of IFI is based primarily on pharmacokinetic studies performed in adults. In higher risk patients prophylaxis should be considered and, in the case of an IFI diagnosis, an antifungal treatment should be administered as early as possible, supported by the reversion of the immune dysfunction and surgery when appropriate.
La infección fúngica invasiva (IFI) se considera una infección oportunista que acontece casi exclusivamente en el paciente inmunodeprimido y el crítico, y que comporta una elevada morbimortalidad. La población de pacientes de riesgo de IFI va en aumento en pediatría e incluye a recién nacidos extremadamente prematuros, niños que requieren ingresos prolongados en unidades pediátricas de cuidados intensivos (UCIP), pacientes oncohematológicos, sobre todo los receptores de trasplantes de precursores hematopoyéticos (TPH), así como niños que sufren alguna inmunodeficiencia primaria (IP) o que reciben nuevas terapias, como CAR (chimeric antigen receptor)33.
Los niños oncohematológicos, incluidos los receptores de TPH, presentan un aumento del riesgo de IFI que varía según el grado de inmunosupresión48. La incidencia de IFI en niños oncohematológicos es difícil de definir debido a las diferencias entre instituciones en la profilaxis antifúngica y el manejo de los pacientes, así como a los distintos criterios usados para el diagnóstico de IFI. La incidencia de IFI puede presentar variaciones tanto geográficas como en el tiempo que pueden explicarse por la aparición de nuevos fármacos antifúngicos en los últimos años41.
EpidemiologíaCandida sigue siendo la causa más frecuente de IFI en pacientes pediátricos y la cuarta causa de infecciones hematológicas adquiridas en el hospital41. Aunque en la última década se ha experimentado un descenso en la incidencia de la candidiasis invasiva (CI) en neonatos y niños, a diferencia de los adultos, aún continúan siendo elevadas su incidencia y morbimortalidad56. Cinco especies de Candida (Candida albicans, Candida parapsilosis, Candida glabrata, Candida tropicalis y Candida krusei) causan la mayoría de los episodios de CI en niños. En niños inmunodeprimidos la segunda en frecuencia es C. parapsilosis, muy presente en la candidemia asociada a catéter, más recurrente en niños de UCIP56. Aunque C. albicans es la especie aislada con más frecuencia hay una tendencia hacia el aumento en la incidencia de CI causada por otras especies del género, sobre todo por C. parapsilosis y C. tropicalis59.
Algunas especies de Aspergillus y de mucorales son la causa más recurrente de micosis por hongos filamentosos41, si bien en los últimos años se han registrado más casos de infección por otros hongos emergentes. Aspergillus fumigatus es el más frecuente en niños con enfermedades hematológicas, seguido de Aspergillus flavus y Aspergillus terreus17. En niños de UCIP, son mucho menos recurrentes las infecciones por hongos filamentosos y son excepcionales en los grandes prematuros, en quienes los casos de infección de Aspergillus y mucorales descritos son, habitualmente, de afectación cutánea28.
Los niños con IP tienen un riesgo muy variable de contraer una IFI, que dependerá del tipo de IP y del grado de inmunodeficiencia. Aquellos con enfermedad granulomatosa crónica (EGC) tienen un riesgo de IFI muy elevado, sobre todo de aspergilosis invasiva (AI)29. Una particularidad de estos niños es su susceptibilidad de padecer infecciones por Aspergillus nidulans, que es excepcional en otros pacientes. En niños con EGC, además, la infección por A. nidulans es más agresiva y la resistencia de esta especie a los fármacos antifúngicos suele ser mayor en comparación con otras especies de Aspergillus21.
La repercusión de las IFI en el infante inmunodeprimido es muy importante, con un aumento de la estancia hospitalaria, así como de la mortalidad, tanto en candidiasis como aspergilosis60,61. Así, la mortalidad de las CI en el niño oncohematológico es del 10 al 25%, pero aumenta al 50% en los pacientes que ingresan en la UCIP19. En el caso de las infecciones por hongos filamentosos, la mortalidad es del 20 al 50% y se incrementa al 80% en aquellos sometidos a TPH alogénico19. En prematuros extremos, la mortalidad asociada a CI es muy elevada, con valores del 17 al 44%3,47, al igual que en pacientes de UCIP en quienes se estima en el 27 al 44%59,62, próxima a la de los adultos de la Unidad de Cuidados Intensivos (UCI). En prematuros extremos, la CI se asocia a un elevado riesgo de diseminación, sobre todo al sistema nervioso central (SNC), de ahí que más de la mitad de los supervivientes con CI presenten secuelas neurocognitivas3.
Factores de riesgoA) Paciente oncohematológico. Las IFI son infecciones oportunistas y, por tanto, muy raras en el paciente sin inmunodeficiencia. La actividad fagocitaria y el desarrollo de los linfocitos T son factores determinantes en la respuesta contra la infección fúngica. Aquellos sujetos en los que el riesgo de IFI es alto (la incidencia es superior al 10%) se benefician de la profilaxis antifúngica. Un metaanálisis reciente que ha incluido 22 estudios, ocho en TPH, diez en pacientes con cáncer y cuatro que recogían ambas situaciones clínicas, ha revisado los factores de riesgo de IFI en niños con cáncer y TPH. Dieciocho de los estudios evaluaban la presencia de IFI durante el período de quimioterapia o postrasplante y el resto (cuatro estudios) valoraban la IFI en los pacientes con neutropenia febril15. Los factores de riesgo encontrados en estos individuos han sido los que se detallan a continuación.
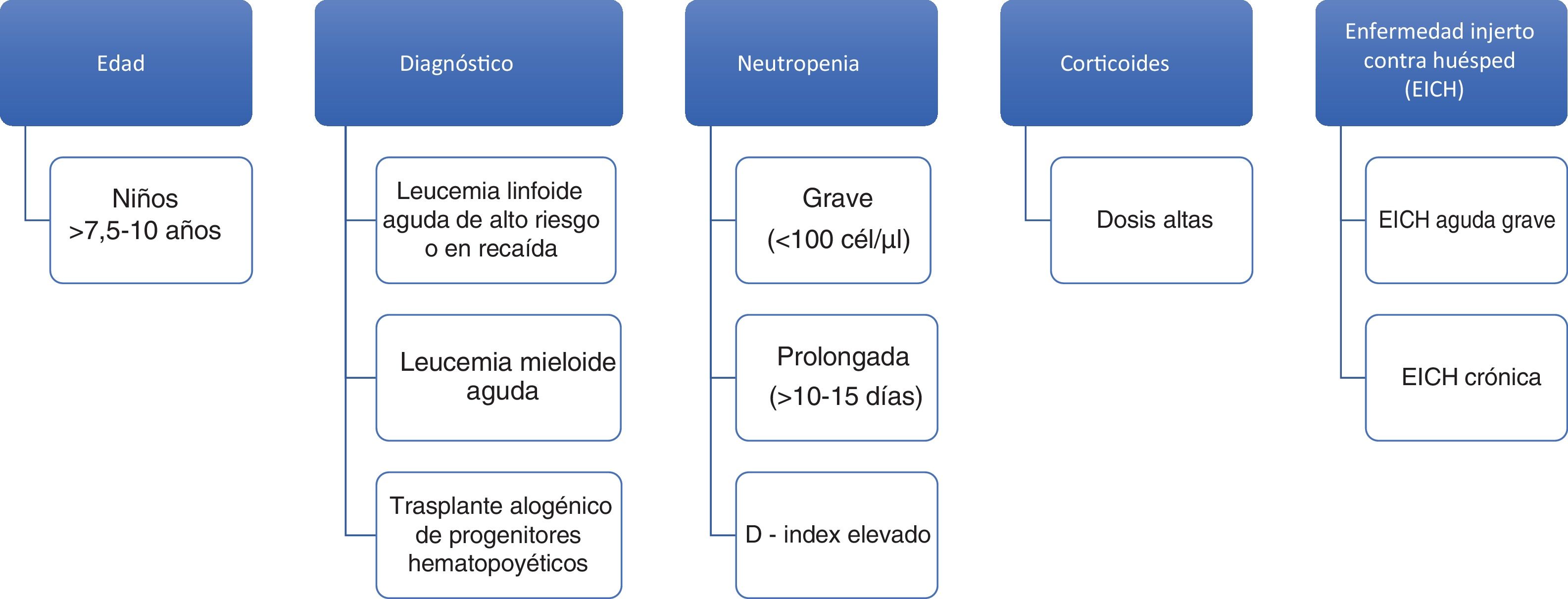
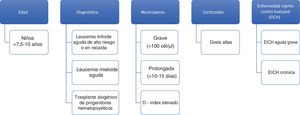
Edad: La mayor edad se ha identificado como factor de riesgo de IFI en población infantil con TPH y con cáncer en general. El punto de corte a partir del cual aumenta el riesgo de IFI varía entre los 7,5 y los 10 años22. No está claro si el incremento de edad supone un riesgo en sí o lo es su asociación con determinados tratamientos quimioterápicos, diferencias en la farmacocinética de los fármacos empleados, obesidad o ciertas comorbilidades.
Enfermedad de base: Los niños diagnosticados de leucemia linfoide aguda (LLA) tienen una incidencia baja de IFI, por debajo del 1%25, aunque supone el 70% de la mortalidad por causas infecciosas durante el tratamiento de inducción de la LLA49. Los regímenes de tratamiento que se asocian con un incremento de la IFI en niños con LLA son los de inducción intensiva frente a la estándar y la terapia en la recaída frente a la administrada en primera línea. La incidencia de IFI es más elevada en pacientes con leucemia mieloide aguda (LMA) que varía según la profilaxis antifúngica empleada y su espectro contra hongos filamentosos, que es diferente según los centros y protocolos31. Así, en los niños con LMA tratados con el protocolo BFM-2004, que incluye profilaxis antifúngica en el 70% de los casos, la mayoría con cobertura contra hongos filamentosos, la incidencia es del 3%4 vs. 14 a 21% en los pacientes tratados en EE. UU. con el protocolo CCG2961, en el que la cobertura frente a hongos filamentosos es solo del 14,4%51. Las IFI causan un 60% de la mortalidad infecciosa en población infantil con LMA51. En cuanto al TPH alogénico, la incidencia de IFI es aproximadamente del 12%22, con la mitad de los casos en el período de neutropenia preinjerto y la otra mitad entre los que desarrollan enfermedad injerto contra huésped (EICH) y reciben tratamiento inmunosupresor9. Dentro de los pacientes receptores de TPH, aquellos con aplasia medular idiopática y anemia de Fanconi son los que mayor riesgo de contraer IFI presentan13. La mortalidad en el TPH alogénico es muy elevada y más de la mitad de los pacientes (52%) fallecen por causas tóxicas asociadas al tratamiento en el período postrasplante22. La incidencia de IFI en el TPH autólogo es muy baja, por debajo del 1%9.
Neutropenia: El estado de neutropenia se ha definido de varias maneras, en función de su gravedad (<500 neutrófilos/μl) o en función de su duración (>10 a 15 días)13. Teniendo en cuenta de forma conjunta el grado y la duración de la neutropenia, se ha descrito el D-index, medida que combina ambas y que se calcula como la diferencia entre el área observada bajo la curva y el área esperada si el paciente no desarrolla neutropenia44. Dicho índice permite conocer el riesgo de padecer IFI. La neutropenia se ha asociado a IFI en seis estudios prospectivos, tres en niños con leucemia, dos en niños receptores de TPH y uno que incluía ambos tipos15. En estos pacientes, la fiebre, un valor de proteína C reactiva ≥9 mg/dl y un recuento de monocitos inferior a 100 células/μl el cuarto día de la neutropenia son factores de riesgo54.
Corticoides: La exposición a corticoides (>0,3 mg/kg/día) se ha correlacionado con el aumento del riesgo de IFI en niños receptores de TPH22. También, la duración prolongada del tratamiento con corticoides se asocia con IFI en el grupo de pacientes con LMA y tumores sólidos.
Enfermedad injerto contra huésped: La EICH, tanto aguda como crónica, se ha identificado como factor de riesgo de IFI en niños trasplantados debido a la disfunción de los linfocitos T y al uso de fármacos inmunosupresores7. Los factores de alto riesgo de IFI en niños con cáncer aparecen resumidos en la figura 1.
B) Otros pacientes pediátricos inmunodeprimidos. En los niños prematuros extremos, especialmente en aquellos con un peso inferior a 1.000 g, la incidencia de IFI es variable, siendo inversamente proporcional a la edad gestacional y presenta grandes variaciones en función de la complejidad del centro y de la existencia de factores de riesgo. Se estima que la incidencia de CI está en el 4 al 16% en niños prematuros extremos y en el 2 al 5% en los nacidos con un peso de 1.500 g o menos29. Entre los factores de riesgo de CI en los neonatos, se incluye la presencia de un catéter venoso central (CVC), la intubación, la nutrición parenteral con lípidos, los días de tratamiento con antibióticos de amplio espectro56 y el grado de colonización por Candida. Las tasas de colonización son muy elevadas en los prematuros extremos y oscilan entre el 18 y el 26%. También se consideran factores de riesgo la presencia de trombocitopenia e hiperglucemia, que pueden ser evidencias clave en el diagnóstico de CI en estos pacientes. El origen de la candidemia varía según la especie de Candida implicada. Así, la colonización por C. parapsilosis tiene lugar habitualmente por transmisión horizontal y después del séptimo día de ingreso, mientras C. albicans se adquiere con más frecuencia por transmisión vertical en el período perinatal, siendo más común en partos vaginales y cuando existe corioamnionitis28.
En UCIP, aunque el mismo ingreso es per se un factor de riesgo de IFI y de mortalidad asociada57, la mayoría de los niños tienen, además, otros factores de riesgo28 como la presencia de CVC, las neoplasias, la cirugía abdominal, los antibióticos de amplio espectro, los esteroides, la nutrición parenteral, la insuficiencia renal y la ventilación mecánica4,26,42,62. En un estudio multicéntrico español realizado en 24 UCIP26 se identificaron como factores de riesgo independientes de candidemia la nutrición parenteral, la estancia en UCIP superior a 15 días, la fiebre al ingreso en UCIP y la trombocitopenia.
En la IP, la alteración de la inmunidad celular es el mayor factor predisponente para sufrir IFI, incluida la neumonía por Pneumocystis jiroveci. Además, con frecuencia se acompañan de infecciones fúngicas mucocutáneas. Entre las IP asociadas a IFI destacan la inmunodeficiencia combinada grave, el síndrome de HiperIgM y el síndrome de Job (HiperIgE)47. Por otro lado, las IP que cursan con alteración en la función de los granulocitos se relacionan con un mayor riesgo de IFI, en particular la EGC, donde la incidencia de aspergilosis es incluso mayor que en pacientes oncohematológicos de alto riesgo21.
DiagnósticoA) Paciente oncohematológico. En el año 2014, en el marco de la cuarta edición de la European Conference on Infections in Leukaemia, se publicaron las guías ECIL-4 de diagnóstico, prevención y tratamiento de infecciones fúngicas en niños con cáncer o receptores de TPH alogénico19. Recientemente se ha publicado también una actualización del manejo de la neutropenia febril en el infante con cáncer y TPH, donde la principal modificación se refiere al tratamiento antifúngico empírico30. Así, hay una mejor estratificación del riesgo para definir pacientes con alto riesgo de IFI, hay cambios en los biomarcadores y pruebas de diagnóstico de imagen recomendadas para la evaluación de IFI en niños y se incluye una recomendación débil para suspender el tratamiento empírico en los pacientes con neutropenia febril de bajo riesgo. El gold standard del diagnóstico de IFI son la histología y los hemocultivos40. Sin embargo, realizar estas pruebas diagnósticas conlleva dificultades: es complejo obtener tejido para el análisis histológico y los hemocultivos solo son positivos en el caso de las levaduras y algunos hongos filamentosos, como Fusarium. Por estos motivos, se utilizan biomarcadores y pruebas de imagen que ayudan al diagnóstico.
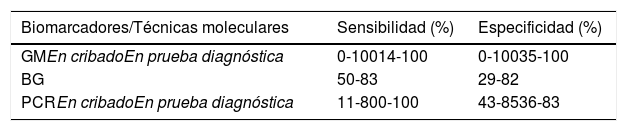
Los biomarcadores son una promesa para el armamento diagnóstico de las IFI, pero su rendimiento aún tiene que mejorar, especialmente en el diagnóstico de IFI en pacientes pediátricos24. Los más utilizados son el 1,3-β-D-glucano (BG) y el galactomanano (GM). La reacción en cadena de la polimerasa (PCR) es una técnica que también puede ser útil al amplificar algunos genes de los hongos en la misma muestra. En la tabla 1 aparecen los valores de sensibilidad y especificidad de cada prueba diagnóstica32. El BG es un polisacárido de la pared celular que se encuentra en la mayoría de los hongos. Se puede detectar en infecciones por Aspergillus, Candida, Fusarium, Trichosporon o Pneumocystis. Sin embargo, también se detecta en infecciones bacterianas, como las producidas por Streptococcus pneumoniae y en la población sana. Además, algunos antibióticos, como la cefepima o el meropenem, pueden dar falsos positivos. Los resultados son más difíciles de evaluar en niños que en adultos porque los valores medios normales en niños sanos, sin inmunodeficiencias, son mayores que en los adultos, lo que dificulta establecer el punto de corte.
Biomarcadores de IFI en niños24,32
| Biomarcadores/Técnicas moleculares | Sensibilidad (%) | Especificidad (%) |
|---|---|---|
| GMEn cribadoEn prueba diagnóstica | 0-10014-100 | 0-10035-100 |
| BG | 50-83 | 29-82 |
| PCREn cribadoEn prueba diagnóstica | 11-800-100 | 43-8536-83 |
BG: 1,3-β-D -glucano; GM: galactomanano; PCR: reacción en cadena de la polimerasa.
El GM es un componente de la pared celular de algunos hongos, como Aspergillus, y se libera durante su crecimiento. La detección de GM en sangre se lleva a cabo por medio de una técnica de Enzyme-Linked ImmunoSorbent Assay (ELISA). Se han revisado 18 estudios, que incluyen un total de 1.421 pacientes pediátricos con cáncer y TPH, en los que se evalúa la presencia de GM en sangre32. Diez de estos estudios examinaron el GM como técnica de cribado en pacientes asintomáticos durante períodos de neutropenia o de EICH, mientras que los otros ocho lo hicieron en niños con síntomas sugerentes de IFI o con neutropenia febril. La prevalencia de IFI varió entre 0 y 30,8%. El punto de corte empleado del valor de densidad óptica fue 0,5 con dos muestras positivas en la mayoría de los casos, de acuerdo con el trabajo de Maertens et al.35 o de 0,7 en una sola muestra. La incidencia de falsos positivos es elevada. Las causas son variadas, como la administración de algunos antibióticos, reacción cruzada con Penicillium o Cryptococcus, o la ingesta de algunos productos lácteos o Bifidobacterium. Recibir una profilaxis antifúngica con actividad contra hongos filamentosos también disminuye la sensibilidad del test de GM en sangre. El único estudio que evaluaba la presencia de GM en el lavado broncoalveolar en la aspergilosis pulmonar arrojaba un valor de especificidad del 88% y una sensibilidad del 82%. El valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) eran del 82 y 87%, respectivamente, y el punto de corte de 0,537. No se han encontrado estudios que valoren la presencia de GM en el líquido cefalorraquídeo en población pediátrica. El punto de corte para el GM considerado en la aspergilosis del SNC, extrapolado de estudios de pacientes adultos, es de 0,5. La utilidad de la PCR para el diagnóstico de IFI no está clara. Su sensibilidad es elevada pero la especificidad es muy variable y la técnica no está estandarizada24.
Las pruebas diagnósticas descritas tienen una sensibilidad y especificidad muy variables en los pacientes pediátricos, lo que las hace poco robustas, tanto si se usan en el cribado de individuos asintomáticos como en aquellos con neutropenia febril. Para que estos parámetros puedan ser válidos clínicamente deben tener un elevado VPP como herramienta diagnóstica y un alto VPN como cribado. Todos estos parámetros cuentan con un VPP muy variable, bajo en general y poco útil. La única variable con un VPN elevado es el GM en sangre, pero su presencia se asocia principalmente con Aspergillus, por lo que un resultado negativo no descarta la presencia de otros hongos filamentosos. En cuanto a la PCR, se trata de una técnica poco estandarizada, lo que dificulta su empleo en el ámbito clínico. Por todo ello, resultaría útil determinar nuevos biomarcadores para el diagnóstico de la IFI en niños que permitieran la instauración de un tratamiento anticipado.
Las técnicas de imagen pueden resultar útiles en el diagnóstico de IFI en algunos casos. Hay estudios que evalúan la tomografía computarizada (TC) pulmonar como herramienta para el diagnóstico de IFI cuando los pulmones, el órgano afectado con más frecuencia, están dañados. Suelen observarse hallazgos radiológicos característicos de los niños, como los nódulos múltiples o los infiltrados con apariencia de masas6. Se ha descrito un aumento en la afectación del SNC en los niños con afectación pulmonar por IFI, por lo que se recomienda también la realización de una resonancia magnética nuclear (RMN) craneal. La TC de senos no ha mostrado utilidad diagnóstica en niños asintomáticos, por lo que la recomendación para efectuarla en estos casos es muy débil. En muchos pacientes pediátricos con IFI y sin síntomas digestivos las pruebas de imagen de abdomen han mostrado hallazgos que pueden ayudar en el diagnóstico30. La técnica de imagen ideal en este caso es la ecografía porque, a diferencia de la TC, no produce radiación y, además, no requiere sedación, que sí es necesaria en la RMN en los niños más pequeños.
Por último, las guías de manejo de los pacientes pediátricos con neutropenia febril y cáncer o receptores de TPH han actualizado recientemente las recomendaciones para el diagnóstico y seguimiento de estos individuos30 (tabla 3).
Recomendaciones para el diagnóstico y seguimiento de la infección fúngica invasiva en el paciente pediátrico
| Biomarcadores/Técnicas moleculares | Considerar no realizar la detección de galactomanano (evidencia moderada, recomendación débil).No analizar la presencia de 1,3-β-D-glucano (evidencia baja, recomendación fuerte).No realizar PCR de sangre (evidencia moderada, recomendación fuerte). |
| Técnicas de imagen | Realizar TC pulmonar (evidencia baja, recomendación fuerte).Considerar realizar una prueba de imagen abdominal en los pacientes sin síntomas o signos localizados (evidencia baja, recomendación débil).Considerar no realizar de forma rutinaria TC de los senos en pacientes sin síntomas de sinusitis (evidencia baja, recomendación débil). |
PCR: reacción en cadena de la polimerasa; TC: tomografía axial computarizada.
B) Otros pacientes pediátricos inmunodeprimidos. El diagnóstico de una IFI en el neonato y el niño de UCIP, según las manifestaciones clínicas, es un difícil reto porque la sintomatología y la analítica son inespecíficas y, con frecuencia, indistinguibles de una sepsis bacteriana, de ahí la necesidad de mantener siempre un alto grado de sospecha. En el neonato, la clínica puede ser muy sutil. Son hallazgos de sospecha la trombocitopenia y la hiperglucemia3,28. Con frecuencia, la fiebre en niños de UCIP que no responde al tratamiento con antibióticos es el primer signo de alarma28. La trombocitopenia prolongada puede ser también un signo revelador en estos pacientes, incluidos los tratados con cirugía cardiaca26,28. Las concentraciones de algunos reactantes (aunque variables y con valores que pueden solaparse), como la procalcitonina, son en general menos elevadas que en las infecciones bacterianas42. En las IP también es fundamental un alto grado de sospecha, pues los síntomas pueden ser inespecíficos o con frecuencia estar ausentes signos cardinales como la fiebre, tal cual ocurre en niños con EGC y AI. De igual manera, el diagnóstico de IFI en un niño sin aparentes factores de riesgo, debe alertar sobre la posibilidad de una IP.
La información sobre la rentabilidad de los biomarcadores en neonatología y niños de UCIP es escasa. Es importante resaltar que no se pueden extrapolar los datos de la población adulta a la infantil por numerosas razones24. El biomarcador más estudiado ha sido el BG, especialmente en las infecciones por Candida. El mayor problema del BG es la falta de especificidad y que no están establecidos los puntos de corte en neonatología o niños de UCIP. Se han descrito valores más elevados en los pacientes pediátricos, por lo que el punto de corte podría ser superior al umbral de 80 pg/ml establecido en los adultos. Además, la colonización por Candida puede dar lugar a resultados falsos positivos en prematuros extremos18,38. Por otro lado, en el prematuro de riesgo y niño de UCIP hay múltiples factores presentes que pueden generar también resultados falsos positivos, como la infección bacteriana, las gasas empleadas en cirugía, los derivados sanguíneos, como la seroalbúmina o las inmunoglobulinas, o los antibióticos, como la amoxicilina-ácido clavulánico o la piperacilina-tazobactam. Con frecuencia hay valores que no permiten discriminar entre la CI y otras situaciones clínicas, como una infección bacteriana46. No obstante, las determinaciones negativas pueden ser de utilidad por su alto VPN.
La PCR de Candida podría ser de gran utilidad, pero adolece de falta de estandarización. Taira et al., en un estudio publicado con 54 niños en estado crítico (24 neonatos) con CI, mostró la utilidad de la PCR por el aumento franco de la sensibilidad diagnóstica en comparación con aquella de los hemocultivos52. Aunque la PCR de Candida parece aumentar la sensibilidad del diagnóstico de la CI en recién nacidos pretérmino, su implementación podría tener implicaciones terapéuticas por su mayor rapidez en la obtención de resultados y por su alto VPN, que permitiría la retirada precoz del tratamiento antifúngico46.
En UCIP, aunque la información también es mínima y las limitaciones son similares a las encontradas en neonatos, es posible que el BG sea de mayor utilidad con un punto de corte más próximo al del adulto, si bien su uso en la población pediátrica no está aún recomendado36. Un resultado positivo, una vez descartadas las múltiples causas de falsos positivos, apoya el diagnóstico de CI y, por su mayor precocidad respecto al hemocultivo, podría ser de utilidad en la monitorización de la respuesta terapéutica. El VPN es alto, sobre todo cuando se combina con otros biomarcadores, lo que puede ser un gran beneficio para decidir la retirada de un tratamiento antifúngico instaurado empíricamente5. La PCR es muy específica, aunque tampoco está estandarizada en niños mayores. Aparte de la rapidez diagnóstica que proporciona, permite identificar la especie de Candida52. Además, si al igual que lo observado en los adultos se confirma el alto VPN en la población pediátrica, esta técnica podría tener gran utilidad para establecer el tratamiento antifúngico en programas de optimización del uso de antimicrobianos en los hospitales (PROA)16.
La experiencia con GM es mucho menor en otros niños inmunodeprimidos en comparación con los que sufren neutropenia por la menor incidencia de AI. Aunque en neonatos y UCIP la AI es excepcional y no hay estudios que analicen la utilidad del GM, esta parece menor por el hecho de que la microbiota fecal del neonato y del lactante contiene un alto contenido de bifidobacterias que puede arrojar una alta tasa de falsos positivos24. Además, puesto que la neutropenia favorece la disrupción tisular y la invasión vascular por parte de Aspergillus, con la consiguiente liberación de GM en el torrente sanguíneo, la sensibilidad de la detección de GM es menor en niños sin neutropenia que en aquellos con neutropenia y así sucede en pacientes con IP. En un estudio de 16 niños con IP (10 con EGC y seis con síndrome de Job) diagnosticados de AI, la sensibilidad del GM en el diagnóstico de la AI fue solo del 25%55. Además, al igual que en el niño con neutropenia, en estos pacientes, la profilaxis contra los hongos filamentosos disminuye aún más su rentabilidad, siendo baja la sensibilidad y el VPP24. En lo que se refiere a la PCR de Aspergillus, y a diferencia del paciente oncohematológico, la experiencia en población infantil sin neutropenia es mínima.
Una herramienta muy prometedora para el diagnóstico de CI en niños es la técnica T2 de visualización en resonancia magnética (T2MR). Al igual que en los pacientes adultos, los resultados preliminares obtenidos en niños, tanto con neutropenia como con otra inmunodeficiencia, muestran que puede mejorar la sensibilidad del hemocultivo. Dicha técnica utiliza unos cartuchos automatizados en los que se introduce un pequeño volumen de sangre y mediante una combinación de tecnología de resonancia magnética en T2 y amplificación de ADN puede identificar las cinco especies más frecuentes de Candida; mejora la rapidez y la sensibilidad de los hemocultivos tanto en la candidemia como en la CI profunda8.
Las pruebas de imagen son fundamentales en la población infantil con IFI tanto en la evaluación diagnóstica como en la respuesta terapéutica. El estudio de extensión es obligado en el manejo de la IFI en niños27. En neonatos es fundamental completarlo con una ecografía cerebral y abdominal, observación del fondo de ojo y una punción lumbar por la alta frecuencia de diseminación43. En otros pacientes inmunodeprimidos hay que individualizar, pero la ecografía abdominal y la observación del fondo de ojo suelen completar el estudio. En la AI, la radiografía de tórax es la prueba inicial, a la que debe seguir siempre una TC torácica. Los resultados de estas pruebas de imagen son aún más inespecíficos que en los pacientes adultos6,58. La sensibilidad de la radiografía de tórax es mayor en otras situaciones de inmunodepresión, incluidas las IP, que en el paciente pediátrico con neutropenia. Además de las imágenes de tórax, puede ser necesaria la evaluación de otras localizaciones como los senos paranasales, el abdomen y el SNC.
TratamientoA) Paciente oncohematológico. El tratamiento empírico está indicado en pacientes de alto riesgo de IFI con neutropenia febril prolongada (≥96 h) que no responden a la terapia con antibióticos de amplio espectro. En cuanto a la duración, el tratamiento antifúngico empírico deberá continuarse hasta 72 h después de la resolución de la neutropenia. Respecto a la elección de la terapia, dependerá de la profilaxis antifúngica que se esté realizando. Si se recibe profilaxis antifúngica con actividad contra hongos filamentosos, lo razonable es cambiar a otra clase de fármaco antifúngico, aunque no hay estudios comparativos aleatorizados. Los fármacos con indicación de tratamiento empírico de IFI en niños son la caspofungina y la anfotericina B liposomal (AmB-L). Hay pocos estudios aleatorizados en esta población sobre el tratamiento antifúngico empírico. El primero lo publicaron Prentice et al.45 hace dos décadas y en él comparaban la anfotericina B desoxicolato (AmB-D) con la AmB-L. La AmB-L resultó más eficaz, aunque las diferencias no eran significativas, y menos tóxica. Posteriormente, Maertens et al.34 realizaron un estudio prospectivo aleatorizado en niños, la mayoría con leucemia aguda o TPH, en el que comparaban la AmB-L en dosis de 3 mg/kg/día con la caspofungina (70 mg/m2/día el primer día y después 50 mg/m2/día). La eficacia del tratamiento fue del 32 y el 46%, respectivamente, pero las diferencias no fueron significativas. Sin embargo, hay que destacar el aumento de infecciones de brecha que se ha descrito con el uso de la caspofungina en niños con cáncer y receptores de TPH39.
El tratamiento antifúngico empírico conlleva el sobretratamiento de algunos pacientes que no lo necesitarían, con el consiguiente aumento de la toxicidad y la posibilidad de aparición de resistencias. Se ha intentado extrapolar el modelo de tratamiento anticipado empleado en la infección por citomegalovirus a la infección fúngica. La experiencia del tratamiento anticipado en adultos basado en la detección de GM en sangre y la realización de una TC pulmonar muestra que la supervivencia es similar a la registrada con la terapia empírica, pero aumentan las infecciones de brecha con el tratamiento anticipado11.
En un estudio aleatorizado con 149 niños con neutropenia febril de alto riesgo (73 con tratamiento empírico y 76 con anticipado), en el que 32 (42%) en el grupo de tratamiento anticipado recibieron terapia antifúngica, la mortalidad relacionada con IFI fue la misma en ambos grupos (3%, p = 0,97), así como el porcentaje dy niños con IFI (12%, p = 0,92) y el número de días de fiebre (nueve días, p = 0,76)50. Sin embargo, aunque la terapia antifúngica anticipada fue tan eficaz como la empírica en este grupo de niños con cáncer y neutropenia febril, no se incluyeron pacientes de muy alto riesgo, como los receptores de TPH alogénico, por lo que hay que ser precavido a la hora de adoptar de forma universal el tratamiento anticipado para IFI en población pediátrica.
En el tratamiento dirigido de la IFI la complejidad es aún mayor en el niño que en el adulto por la menor información disponible y las limitaciones en el uso de pruebas diagnósticas y de fármacos antifúngicos en la edad pediátrica. La elección de la estrategia antifúngica más apropiada depende de la edad del paciente, su situación inmunitaria, la disfunción de órganos diana (riñón, hígado o SNC), la administración de otros fármacos con potenciales interacciones, la especie fúngica causal y el perfil de sensibilidad a los medicamentos antifúngicos de esta.
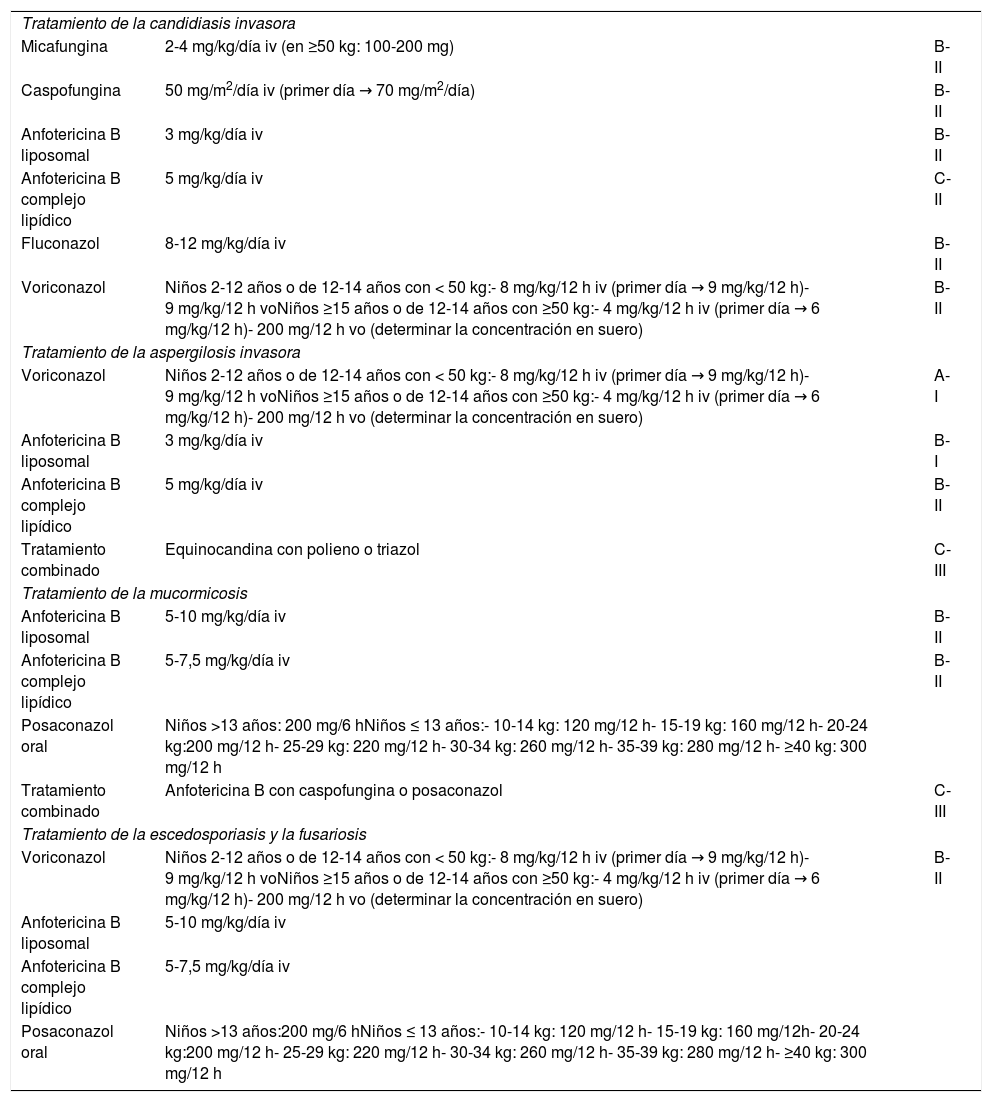
La información sobre las propiedades farmacocinéticas de los fármacos antifúngicos en pediatría es limitada, aunque está aumentando en los últimos años. Así, el medicamento antifúngico del que se tiene la mayor experiencia es la AmB-L, de la que hay información en todos los grupos de edad pediátrica, y sus propiedades farmacocinéticas resultan similares a aquellas descritas en el paciente adulto. La AmB-L tiene un amplio espectro de actividad antifúngica y una acción fungicida. Al no ser metabolizada por el hígado carece de interacciones farmacológicas importantes20, lo que la convierte en una parte esencial del arsenal terapéutico antifúngico. Además, el hecho de que la AmB-L tiene efectos inmunomoduladores que pueden tener cierto papel en la lucha contra la IFI, que cursa con un importante componente inflamatorio que no toleran los pacientes, supone un motivo más para su uso1. En la tabla 2 aparecen los tratamientos de primera línea indicados en las IFI más habituales (adaptada del trabajo de Groll19).
Infecciones fúngicas en pediatría: recomendaciones para el tratamiento y grado de evidencia
| Tratamiento de la candidiasis invasora | ||
| Micafungina | 2-4 mg/kg/día iv (en ≥50 kg: 100-200 mg) | B-II |
| Caspofungina | 50 mg/m2/día iv (primer día → 70 mg/m2/día) | B-II |
| Anfotericina B liposomal | 3 mg/kg/día iv | B-II |
| Anfotericina B complejo lipídico | 5 mg/kg/día iv | C-II |
| Fluconazol | 8-12 mg/kg/día iv | B-II |
| Voriconazol | Niños 2-12 años o de 12-14 años con < 50 kg:- 8 mg/kg/12 h iv (primer día → 9 mg/kg/12 h)- 9 mg/kg/12 h voNiños ≥15 años o de 12-14 años con ≥50 kg:- 4 mg/kg/12 h iv (primer día → 6 mg/kg/12 h)- 200 mg/12 h vo (determinar la concentración en suero) | B-II |
| Tratamiento de la aspergilosis invasora | ||
| Voriconazol | Niños 2-12 años o de 12-14 años con < 50 kg:- 8 mg/kg/12 h iv (primer día → 9 mg/kg/12 h)- 9 mg/kg/12 h voNiños ≥15 años o de 12-14 años con ≥50 kg:- 4 mg/kg/12 h iv (primer día → 6 mg/kg/12 h)- 200 mg/12 h vo (determinar la concentración en suero) | A-I |
| Anfotericina B liposomal | 3 mg/kg/día iv | B-I |
| Anfotericina B complejo lipídico | 5 mg/kg/día iv | B-II |
| Tratamiento combinado | Equinocandina con polieno o triazol | C-III |
| Tratamiento de la mucormicosis | ||
| Anfotericina B liposomal | 5-10 mg/kg/día iv | B-II |
| Anfotericina B complejo lipídico | 5-7,5 mg/kg/día iv | B-II |
| Posaconazol oral | Niños >13 años: 200 mg/6 hNiños ≤ 13 años:- 10-14 kg: 120 mg/12 h- 15-19 kg: 160 mg/12 h- 20-24 kg:200 mg/12 h- 25-29 kg: 220 mg/12 h- 30-34 kg: 260 mg/12 h- 35-39 kg: 280 mg/12 h- ≥40 kg: 300 mg/12 h | |
| Tratamiento combinado | Anfotericina B con caspofungina o posaconazol | C-III |
| Tratamiento de la escedosporiasis y la fusariosis | ||
| Voriconazol | Niños 2-12 años o de 12-14 años con < 50 kg:- 8 mg/kg/12 h iv (primer día → 9 mg/kg/12 h)- 9 mg/kg/12 h voNiños ≥15 años o de 12-14 años con ≥50 kg:- 4 mg/kg/12 h iv (primer día → 6 mg/kg/12 h)- 200 mg/12 h vo (determinar la concentración en suero) | B-II |
| Anfotericina B liposomal | 5-10 mg/kg/día iv | |
| Anfotericina B complejo lipídico | 5-7,5 mg/kg/día iv | |
| Posaconazol oral | Niños >13 años:200 mg/6 hNiños ≤ 13 años:- 10-14 kg: 120 mg/12 h- 15-19 kg: 160 mg/12h- 20-24 kg:200 mg/12 h- 25-29 kg: 220 mg/12 h- 30-34 kg: 260 mg/12 h- 35-39 kg: 280 mg/12 h- ≥40 kg: 300 mg/12 h | |
Fuente: adaptada de Groll et al.19
iv: intravenosa; vo: vía oral.
B) Otros pacientes pediátricos inmunodeprimidos. En otros pacientes de riesgo hay mucha menos información de manejo y tratamiento de la IFI que en el niño con neutropenia, de ahí la gran variabilidad en la práctica clínica entre centros14. Aunque hay varias guías de tratamiento de CI53 en adultos, niños de UCIP y neonatos, solamente la de la European Society of Clinical Microbiology and Infectious Diseases (ESCMID) se refiere específicamente al paciente pediátrico23. Las guías de la Infectious Diseases Society of America (IDSA), centradas básicamente en adultos, recomiendan la misma aproximación terapéutica en el paciente pediátrico según los datos existentes respecto a los diferentes fármacos, sus dosis y farmacocinética a diferentes edades43.
El tratamiento empírico se considera la mejor opción en el paciente pediátrico crítico con factores de riesgo de CI. Aunque el tratamiento empírico está bien establecido en el niño con neutropenia, existe muy poca información en niños de UCIP. Las guías IDSA recomiendan comenzar el tratamiento antifúngico empírico en los pacientes de UCIP cuando el estado es crítico, con signos clínicos de shock y causa no identificada de fiebre43. Las guías ESCMID reconocen la falta de datos en pediatría, por lo que no establecen recomendación alguna23. La administración de una equinocandina se considera la opción terapéutica de elección y, como alternativa, puede administrarse 3-5 mg/kg/día de AmB-L43, o fluconazol a dosis de carga de 12 mg/kg, seguido de 6 mg/kg/día53.
El tratamiento dirigido del niño con CI en UCIP debe seguir los mismos principios que para el resto de los pacientes, con un diagnóstico temprano y retirada de la posible fuente de la infección. Como en la mayoría de los casos, el CVC es el foco más probable y su retirada debe hacerse lo antes posible. Todas las guías coinciden, además de en el control de los factores de riesgo subyacentes, en la evaluación de la extensión y manejo de la infección profunda, así como en el tratamiento de la candidemia hasta al menos 14 días después de la negativización del hemocultivo23,43,53. Si hay afectación específica de un órgano, el tratamiento se prolongará durante un mínimo de cuatro semanas o hasta que pueda asegurarse una resolución completa del foco de la infección por pruebas de imagen o por resección quirúrgica43.
En los niños de UCIP, las equinocandinas son de primera elección en el tratamiento de la CI, tanto en el paciente sin inmunodeficiencias como en el inmunodeprimido. La caspofungina y la micafungina están aprobadas por la European Medicines Agency (EMA) y la Food and Drug Administration (FDA) en población infantil. La dosis recomendada de caspofungina es de 70 mg/m2, como dosis de carga, seguida de 50 mg/m2/día, mientras que la de micafungina es de 2 a 4 mg/kg/día. Se conoce la farmacocinética de la anidulafungina a diferentes edades y la dosis recomendada es 0,75 a 1,5 mg/kg/día, con la que se alcanzan concentraciones comparables a las dosis de 50 y 100 mg, respectivamente, de los pacientes adultos12. La AmB-L se considera una alternativa terapéutica a dosis de 3 a 5 mg/kg/día43. El fluconazol es también una alternativa, pero solo en infecciones con aislamientos sensibles en el paciente pediátrico sin neutropenia, no en estado crítico y sin la administración previa de azoles. En los pacientes estables con aislamientos de Candida sensibles el fluconazol se emplea con frecuencia para la desescalada del tratamiento de CI tras cinco a siete días53.
No hay evidencia del beneficio del tratamiento empírico en los estudios controlados de neonatos de riesgo, si bien es una práctica común en las unidades pediátricas donde no se hace profilaxis con fluconazol en prematuros extremos. Algunos estudios observacionales han documentado una mejoría en la supervivencia en los neonatos de riesgo tratados empíricamente con AmB-D, mientras que otros no han encontrado diferencias en la mortalidad o el desarrollo neurocognitivo2. En ausencia de profilaxis sistémica puede plantearse el tratamiento empírico en el prematuro extremo de riesgo cuando hay sospecha de infección que justifique la realización de un hemocultivo, si la edad gestacional es de 25 semanas o inferior y existe trombocitopenia, o si la edad gestacional es de 25 a 27 semanas y se han administrado antibióticos de amplio espectro, como cefalosporinas de tercera generación o un carbapenem2.
Respecto al tratamiento dirigido en neonatos, aunque las guías IDSA contemplan el uso de 1 mg/kg/día de AmB-D por su mejor tolerancia en niños y amplia experiencia43, en Europa, se considera de elección la AmB-L a dosis altas (2,5 a 7 mg/kg) por la frecuente afectación meníngea23, junto a la experiencia clínica y efectividad demostrada12. En general, el tratamiento de elección de la meningitis por Candida en niños de cualquier edad es la AmB-L por su mejor penetración en el SNC y su acumulación en el parénquima cerebral12. En ausencia de una profilaxis previa con azoles, el fluconazol se considera una alternativa en el tratamiento de la CI en los neonatos. La dosis recomendada es de 12 mg/kg/día de fluconazol tras una dosis de carga de 25 mg/kg53. La única equinocandina con aprobación en neonatología y experiencia en prematuros es la micafungina, que es bien tolerada, si bien su menor penetración en el SNC supone una desventaja. Para tratar adecuadamente la CI en neonatos, incluidos los prematuros, se requieren dosis mucho más elevadas que las equivalentes en niños mayores y adultos, debiendo llegar hasta 4 a 10 mg/kg, con aumento a 10 a 15/mg/kg si hay afectación del SNC12.
El fármaco antifúngico de elección en el tratamiento de la AI en el paciente pediátrico mayor de dos años continúa siendo el voriconazol, salvo en aquellos que desarrollan AI durante la profilaxis con azoles, en quienes es de elección la AmB-L, al igual que en el menor de dos años58. Las recomendaciones de tratamiento se basan sobre todo en la experiencia en el infante oncohematológico, como se muestra en la tabla 2. En niños con EGC se debe intentar llegar al diagnóstico etiológico y determinar la sensibilidad antifúngica. El posaconazol podría ser efectivo en niños con AI refractaria porque muestra actividad también contra A. nidulans, que puede ser resistente al voriconazol58.
ProfilaxisTanto en niños oncohematológicos como en aquellos sin neutropenia con alto riesgo de IFI debe considerarse la profilaxis primaria. Habitualmente está indicada en niños oncohematológicos tratados con quimioterapia o receptores de TPH con neutropenia prolongada, con la recomendación de que incluya actividad contra los hongos filamentosos en situaciones de alto riesgo.
En prematuros extremos, aunque controvertido, se recomienda la profilaxis en aquellos con un peso inferior a 1.000 g que se encuentren en unidades con una prevalencia de infección por Candida por encima del 5%23,43. En unidades con valores de prevalencia inferiores al 5% la profilaxis debería individualizarse y considerarse solo en aquellos con un peso inferior a los 1.000 g que requieran CVC y un tratamiento antibiótico prolongado47. La profilaxis con fluconazol reduce la incidencia de colonización y CI, si bien no se han observado diferencias en la mortalidad y el neurodesarrollo10. Se recomienda una dosis baja (intravenosa u oral) de 3 a 6 mg/kg de fluconazol dos veces por semana durante las seis primeras semanas. Es una estrategia segura y bien tolerada. Aunque se han descrito aislamientos de Candida con una sensibilidad disminuida al fluconazol, su uso en profilaxis no se ha asociado de forma consistente con el desarrollo de resistencias a los azoles tras su administración prolongada, si bien se requiere una vigilancia continua47. En niños de UCIP, por el contrario, la profilaxis frente a IFI no está habitualmente indicada. A diferencia de lo que ocurre con los pacientes adultos, no hay scores de predicción de IFI validados para estos individuos, lo que dificulta la recomendación sobre el tipo de pacientes que se beneficiarían de la profilaxis, debiendo considerarse si coexisten varios factores de riesgo asociados47. En pacientes con IP, la profilaxis antifúngica dependerá del tipo de IP y del grado de inmunosupresión. La inmunodeficiencia combinada grave y la EGC requieren siempre profilaxis contra hongos filamentosos.
ConclusionesAnte la dificultad de encontrar biomarcadores fiables en la población pediátrica con alto riesgo de IFI, el tratamiento anticipado no resulta seguro y supone un aumento del riesgo de IFI. Sería importante describir nuevos marcadores en niños que permitieran predecir, de manera segura, el riesgo de padecer una IFI. Los fármacos indicados para el tratamiento antifúngico empírico de la IFI en niños son la AmB-L y la caspofungina. La elección dependerá de la profilaxis antifúngica empleada y de la toxicidad, sin olvidar que la caspofungina está asociada a más infecciones de brecha.
La creación reciente del Pediatric Fungal Network (PFN) (http://pfn.pediatrics.duke.edu)57 tiene el objetivo de resolver las dificultades diagnósticas de la IFI en población infantil. Su primera meta es mejorar el conocimiento de la IFI en estos pacientes e identificar las peculiaridades específicas de este grupo de edad a través de una red coordinada de investigación científica.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.