El Síndrome de Apnea Hipoapnea Obstructiva del Sueño (SAHOS) es un trastorno frecuente, crónico y evolución progresiva. Se asocia a mayor morbilidad cardiovascular, neurocognitiva y metabólica, riesgo de accidentes, mala calidad de vida y mortalidad aumentada. Afecta al 5% de la población adulta y al 2% de niños entre 4 y 5 años. Tiene tratamiento eficaz y rentable, por lo cual es imperativo su diagnóstico y tratamiento. Se caracteriza por episodios repetidos de obstrucción parcial o completa de la faringe durante el sueño, que provocan hipoxia seguida de re-oxigenación y despertares transitorios, responsable de las alteraciones fisiopatológicas y síntomas, que aunque inespecíficos, son muy sugerentes. El paciente tipo de SAHOS, es un hombre obeso, de cuello corto, roncador de larga data, que acusa somnolencia diurna, sueño poco reparador, cansancio, nocturia y leve deterioro cognitivo. Su pareja observa la aparición progresiva de pausas respiratorias. Sin embargo, la presentación es heterogénea y se distinguen diferentes fenotipos clínicos. El diagnóstico se basa en la sospecha y la evaluación conjunta del cuadro clínico con estudios nocturnos confirmatorios adecuados, siguiendo algoritmos propuestos, usando desde PSG convencional hasta equipos simplificados.
Obstructive Sleep Apnoea Syndrome (OSAS) is a common chronic and progressive disorder. It has cardiovascular, neurocognitive and metabolic consequences. Also has increased risk of accident, poor quality of life and higher mortality. About 5% of adult population and 2% of children aged 4 to 5 year are affected. OSAS therapy is efficient and cost effective, so early diagnosis and treatment are important. The hallmark feature is the recurrent episodes of partial or complete upper airway collapse during sleep, which is associated with hypopxia-reoxygenation and microarousal which contributes to the pathophysiology and symptoms which are not specific but quite suggestive of the disease. The typical presentation of OSAS is represented by an overweight, gross neck male patient complaining of loud snoring, nocturia, excessive daytime sleepiness and mild cognitive impairment, with a history of witnessed apnoeas during sleep. Obstructive apnoea has a quite heterogeneous presentation form and different clinical phenotypes have been recognized. OSAS diagnosis is based on a high level of disease suspicion, complete clinical assessment and the adequate sleep study by using diagnostic algorithms.
Podemos decir que desde siempre ha existido la idea o concepto que un buen dormir es pre requisito básico de una buena salud. También la asociación inversa de enfermedad y muerte con alteración del sueño es antigua y se remonta a la mitología griega donde Hymnos, la personificación del Sueño era hermana melliza de Thanatos, personificación de la Muerte. Sin embargo, solo en las últimas décadas se ha producido el reconocimiento científico y estudio de la relación entre diferentes enfermedades y trastornos que ocurren durante el sueño, especialmente los trastornos respiratorios, destacando entre ellos la Apnea del Sueño, no solo por su alta frecuencia, sino por el gran impacto en salud.
La apnea obstructiva del sueño históricamente fue observada por primera vez en 1877, en forma magistral por Broadbent (1), en un paciente con daño cerebral y posteriormente comunicado por Mackenzie en el año1880 (2). No fue sino hasta un siglo más tarde, cuando en 1976 Guillerminault y colaboradores (3) lo reconocen como una entidad clínica de importancia y frecuente. Además, le dan el nombre de “Síndrome de Apnea del Sueño”.
Actualmente el concepto es más amplio y la Clasificación Internacional de los Trastornos del Sueño (ISCD-2 de la sigla en inglés) (4) distingue a los Desórdenes Respiratorios durante el Sueño, por un lado y al grupo de los Desordenes No Respiratorios del Sueño por otro. A su vez, en el primer grupo establece tres categorías principales:
- 1.
Síndrome de Apnea Hipoapnea Obstructiva del Sueño (SAHOS).
- 2.
Síndrome de Apnea Central del Sueño (SACS).
- 3.
Síndrome de Hiperventilación Alveolar durante el sueño (SH). Además, una 4ª categoría denominada “Otras “, que como su nombre lo indica, incluye a otras afecciones respiratorias que ocurren durante el sueño como el asma nocturna, las alteraciones del EPOC del sueño, etc. (Figura 2).
El presente artículo está enfocado al SAHOS y se harán referencia a los otros trastornos por razones comparativos, aspectos fisiopatológicos o de diagnóstico diferencial.
En los años que siguieron a la comunicación de Guillerminault y colaboradores en 1976, se publicaron contados y esporádicos estudios sobre apnea del sueño, situación que en la última década se ha incrementado en forma exponencial, contándose por miles al año las publicaciones sobre este tema.
Lo anterior, no solo ha facilitado el conocimiento médico y aumentando su sospecha clínica, sino que ha trascendido a la población general, permitiendo al público en general y a los pacientes en particular, encontrar respuestas a muchas de sus molestias derivadas de esta afección.
EpidemiologíaEl SAHOS es un trastorno altamente frecuente que afecta del 2% al 4% en mujeres y a los hombres entre el 4% al 6% de la población adulta de edad media (5, 6). Hay evidencia de que su prevalencia aumenta con la edad (7) y también de que el riesgo de desarrollar SAHOS está estrechamente relacionado con la obesidad y el género masculino.(6). En las mujeres el SAHOS se presenta principalmente en la edad post menopáusica.
En niños es de común ocurrencia, siendo su prevalencia de alrededor de 2% entre los 4 y los 5 años (8), con consecuencias similares a las descritas en adultos (9, 10).
Constituye la tercera enfermedad respiratoria más frecuente después del asma bronquial y la enfermedad pulmonar obstructiva crónica (EPOC), es la alteración más frecuente que ocurre durante el sueño y también la principal causa de hipoxia crónica en seres humanos, debido a la hipoxia intermitente.
Esto significa que en Chile alrededor de 660.000 adultos y 77.200 menores de 15 años lo padecen.
En relación con morbilidad, la evidencia ha mostrado que el SAHOS está asociado a trastornos cognitivos y a deterioro de la calidad de vida y en niños afecta el aprendizaje y la conducta. El 35% de estos pacientes presenta hipertensión arterial sistémica, tiene 2 veces más hipertensión pulmonar, 4 veces más enfermedad vascular cerebral que la población general y la tasa de accidentes aumenta en 7 veces.
También la mayor mortalidad de la apnea del sueño moderada a severa sin tratamiento ha sido documentada desde hace mas de 20 años por los trabajos de He y colaboradores, publicados en 1988. Este mayor riesgo, que ha sido corroborado por trabajos posteriores, aumenta con los años de observación, es más marcado en los sujetos más jóvenes (30 - 50 años) y se debe principalmente a complicaciones cardiovasculares y accidentes caseros, del tránsito, laborales e industriales. También se ha establecido que su tratamiento con presión positiva continua de la vía aérea (CPAP), es eficaz y revierte esta mayor mortalidad.
FisiopatologíaEl síndrome de apnea del sueño es una enfermedad crónica, caracterizada por la obstrucción repetitiva de la vía aérea superior (VAS) a nivel faríngeo durante el sueño con el cese completo del flujo aéreo (apnea) o parcial (hipoapnea). Esto se produce por alteración anatómica y funcional de la vía aérea superior que hacen que esta sea más colapsable que en los sujetos normales.
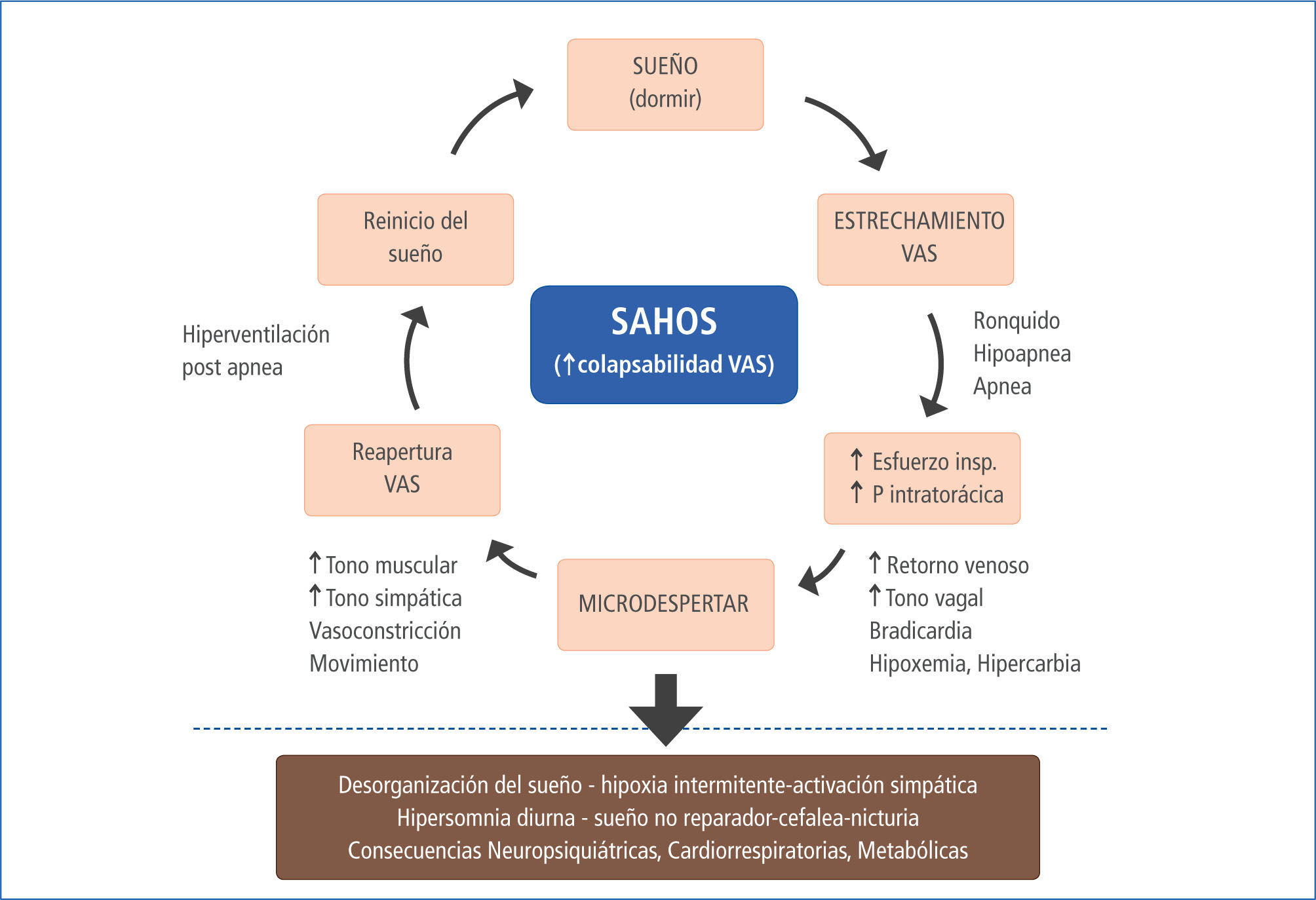
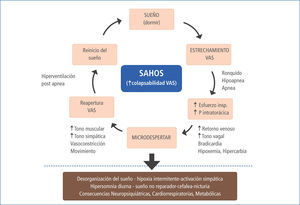
Las apneas e hipoapneas recurrentes conducen a desaturaciones repetidas de la oxihemoglobina, determinando hipoxia intermitente, microdespertares con fragmentación del sueño y oscilaciones significativas de la presión intratorácica por aumento del esfuerzo inspiratorio en cada evento apneico. Esto determina incrementos súbitos del tono simpático, de la frecuencia cardiaca y la presión arterial (11), responsables de la activación simpática y la disfunción endotelial. Todo lo anterior, es responsable de los efectos mórbidos del SAHOS a nivel neurocognitivo (10, 12), cardiovascular, (13, 16) y metabólica (17). También son la causa del mayor riesgo de mortalidad general que presentan estos pacientes (18,19). El cuadro clínico del SAHOS y sus consecuencias, son el resultado directo de los trastornos provocados por la obstrucción cíclica de la VAS durante el sueño, siendo este hecho clave en la génesis de la enfermedad (Figura 1).
Como se dijo anteriormente, el aumento de la colapsabilidad de la faringe se debe a factores anatómicos, como cargas mecánicas y VAS de menor calibre, a la alteración de reflejos de compensación durante el sueño y a la pérdida excesiva del tono muscular (20). Se ha determinado que para cada paciente existe una presión crítica que determina el colapso de la vía aérea durante el sueño, existiendo todo un espectro de colapsabilidad desde los sujetos normales y aquellos con apneas obstructivas, pasando por los roncadores simples o en los que predominan las hipoapneas. El rango de presiones se extiende desde <-10 cms H2O, - > 0 cm. H2O (21).
En la figura n°1 se esquematiza que la mayor presión negativa pleural, producida por el aumento del esfuerzo inspiratorio, determina bradicardia, aumento del retorno venoso y del gasto cardiaco, vía reflejo vagal, con el consiguiente aumento de la precarga (22). Por otro lado, el mayor esfuerzo inspiratorio unido a la hipoxia e hipercapnia, determinan microdespertares no conscientes mediante la estimulación de receptores específicos, los que producen tanto fragmentación y desorganización de la estructura del sueño, como activación del sistema simpático e hiperventilación responsable de la taquicardia, aumento del gasto cardiaco y de la resistencia vascular periférica, lo que unido a la vasoconstricción hipóxica, producen aumento de la postcarga (22-24).
La hipoxia intermitente descrita más arriba, es la responsable del stress oxidativo, mediante la activación simpática, del sistema renina-angiotensina-aldosterona y la liberación de citoquinas vasoactivas y proinflamatorias (23). Esto produce en el corto plazo los trastornos fisiopatológicos ya descritos como taquicardia, vasoconstricción, aumento de la resistencia vascular periférica y disfunción endotelial. En el mediano y largo plazo, se manifiestan clínicamente como hipertensión arterial, arritmias, coronariopatías, complicaciones cerebrovasculares y/o metabólicas (Figura 2 y tabla 2).
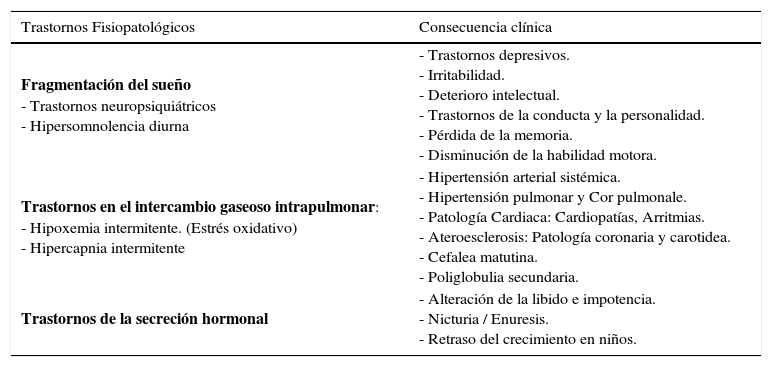
Trastornos fisiopatológicos característicos del sahs y consecuencias clínicas
| Trastornos Fisiopatológicos | Consecuencia clínica |
|---|---|
| Fragmentación del sueño - Trastornos neuropsiquiátricos - Hipersomnolencia diurna | - Trastornos depresivos. - Irritabilidad. - Deterioro intelectual. - Trastornos de la conducta y la personalidad. - Pérdida de la memoria. - Disminución de la habilidad motora. |
| Trastornos en el intercambio gaseoso intrapulmonar: - Hipoxemia intermitente. (Estrés oxidativo) - Hipercapnia intermitente | - Hipertensión arterial sistémica. - Hipertensión pulmonar y Cor pulmonale. - Patología Cardiaca: Cardiopatías, Arritmias. - Ateroesclerosis: Patología coronaria y carotidea. - Cefalea matutina. - Poliglobulia secundaria. |
| Trastornos de la secreción hormonal | - Alteración de la libido e impotencia. - Nicturia / Enuresis. - Retraso del crecimiento en niños. |
Como se dijo anteriormente, la apnea del sueño es una enfermedad heterogénea por el lento y progresivo desarrollo de los síntomas, que tiene un amplio espectro de formas de manifestación clínica, siendo la forma típica de presentación la de un hombre de edad media, con sobrepeso u obeso, con ronquidos progresivos de larga data, cada vez más intensos y molestos. A esto se agregan pausas respiratorias nocturnas, observadas por sus parejas o compañeros de dormitorio.
El paciente puede referir cansancio, sueño no reparador o presentar excesiva somnolencia durante el día, con mayor o menor interferencia de sus actividades habituales. Puede referir nocturia, síntomas de reflujo, cefalea matinal o algún grado de deterioro cognitivo.
El paciente “típico” de SAHOS es un hombre de 40 años, obeso, de cuello corto, roncador de larga data, en el que su pareja observa la aparición progresiva de pausas respiratorias asociado a síntomas como somnolencia diurna, sueño poco reparador, cansancio y cada vez más pasivo. Puede o no acompañarse de disminución de la Íibido, nocturia, cefalea matinal y otras molestias.
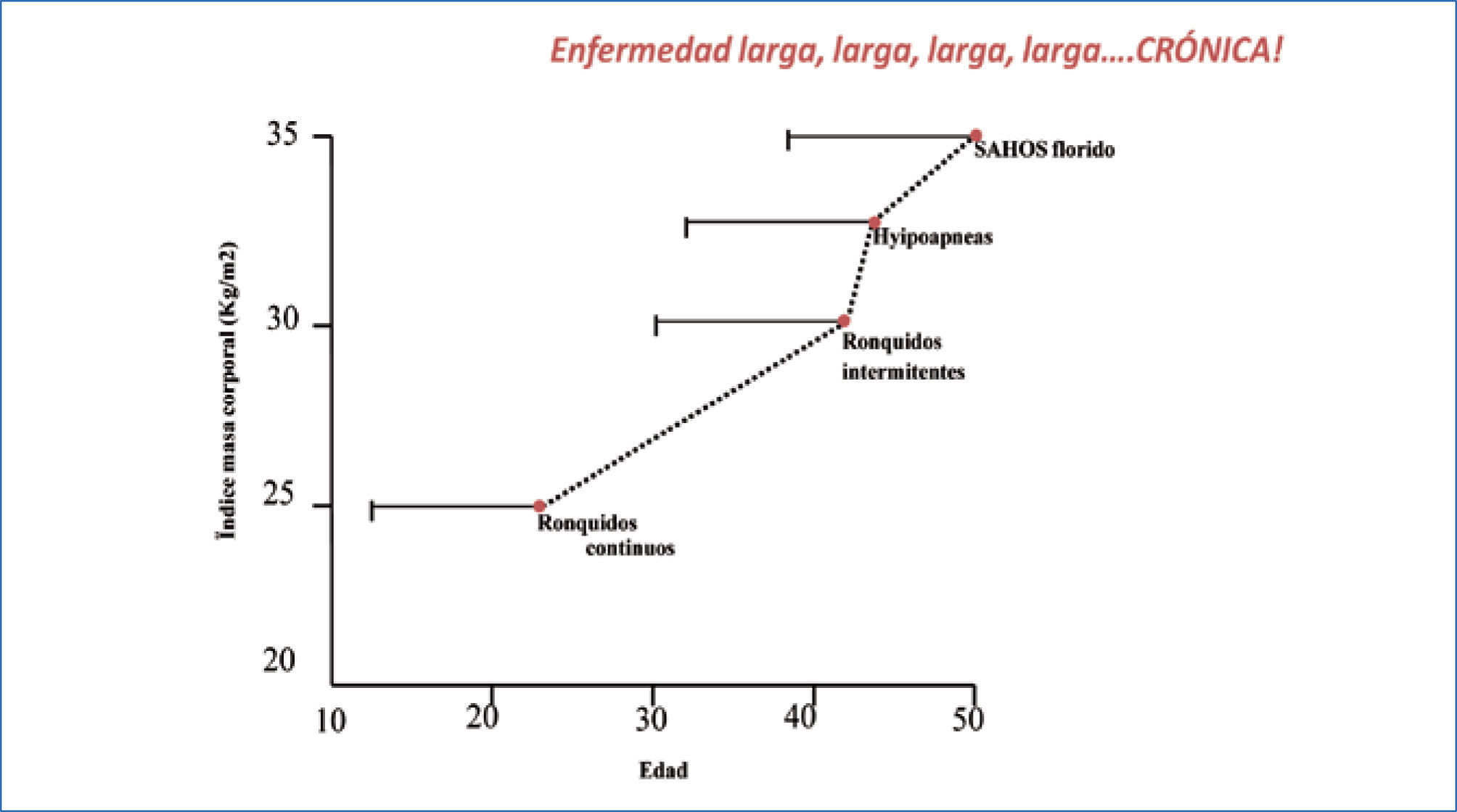
El examen físico puede evidenciar además del sobrepeso, la edad y género, otros factores de riesgo, ya sea de origen alérgico respiratorio (obstrucción nasal por rinitis alérgica, adenoides o asma), cardiovascular (HTA, arritmias), neurológico (déficit cognitivo), metabólico (diabetes mellitus), endocrino (bocio) u otorrinológico destacando la existencia de hipertrofia amigdaliana obstructiva, frecuente en apnea de niños y adolescentes. Este hecho es de importancia, ya que su corrección quirúrgica soluciona el cuadro. También es relevante detectar los antecedentes familiares de ronquidos y apneas en abuelos, padres o hermanos que traducen la predisposición genética familiar de estos pacientes. En la historia natural de esta enfermedad, los síntomas se hacen evidentes o se acentúan marcadamente en relación al aumento de peso de 5 - 10 o más kilos, con un punto de inflexión entre los 30 y 40 años (25).
SintomatologíaLos síntomas de la apnea del sueño se pueden agrupar en diurnos y nocturnos, de acuerdo al momento de su presentación, los que se detallan en la Tabla 1.
Síntomas y signos del síndrome de apnea hipoapnea durante el sueño
| Síntomas Nocturnos | Síntomas Diurnos |
|---|---|
| Apneas observadas. Ronquidos. | Somnolencia excesiva |
| Asfixias. | Sueño poco reparador. |
| Movimientos anormales. | Cansancio o Fatiga crónica. |
| Nocturia (adultos), enuresis (niños). | Cefalea matutina. |
| Insomnio. | Irritabilidad. |
| Reflujo gastroesofágico. | Apatía. |
| Polidipsia durante la noche. | Depresión. |
| Diaforesis nocturna. | Dificultad para concentrarse. |
| Congestión nasal. | Pérdida de memoria. |
| Salivación excesiva. | Alteración de la libido e impotencia. |
| Pesadillas. | Sequedad faríngea y bucal matutina. |
Los síntomas nocturnos principales son los ronquidos y apneas o pausas presenciadas por testigos, mientras que en los síntomas diurnos se destacan la somnolencia diurna excesiva y el cansancio o sueño no reparador, ambos muy sugerentes de enfermedad, aunque menos específicos que los nocturnos (26). Estos cuatro se consideran los síntomas mayores o principales y la existencia de dos o más de ellos obligan a plantear un cuadro clínico de SAHOS y la necesidad de descartarlo. Por la relativa alta sensibilidad de estos síntomas mayores, se deben buscar dirigidamente en todo paciente que se sospeche SAHOS.
La anamnesis detallada de los sujetos con sospecha de SAHOS es vital para la sospecha diagnóstica, teniendo en cuenta que la edad, el incremento de peso, especialmente en hombres, la menopausia en las mujeres, el uso de medicamentos tranquilizantes o relajantes, son factores que favorecen la inestabilidad de la vía aérea superior, la instalación de la enfermedad y la aparición de los síntomas. En la obtención de estos datos, la información dada por las parejas de los pacientes es generalmente muy importante (27, 28).
El Ronquido es el ruido producido por la vibración de los pilares anteriores y las partes blandas del paladar por el paso de aire a través de un área estrechada de la faringe, producto del flujo turbulento que genera este estrechamiento. Es el síntoma más frecuente y llamativo del SAHOS y su ausencia disminuye la sospecha diagnóstica; sin embargo, su valor predictivo positivo es bajo por su alta prevalencia en la población general (49% de los hombres y 25% de las mujeres), cifra que aumenta progresivamente con la edad. En niños es el síntoma principal y se presenta hasta el 27% de los SAHOS (29-32). Puede ser crónico o de inicio reciente, continuo o intermitente y estas interrupciones sugieren apneas. La intensidad varía con la posición al dormir y la etapa del sueño, aumentando en posición supina y etapa REM (33). Tiene valor práctico cuando se presenta más de dos noches por semana y asociado a los otros síntomas mayores, alcanza una especificidad para la existencia de SAHOS clínico de hasta un 90%. También se ha demostrado su asociación con hipertensión arterial y ateroesclerosis carotidea en roncadores no apneicos, lo que remarca su importancia tanto en el diagnóstico, como en las complicaciones cardiovasculares del SAHS (34, 35).
Las pausas respiratorias o apneas observadas, son episodios repetidos durante el sueño, seguidos por hiperventilación post apnea y a veces movimientos corporales que generalmente son inadvertidos para el paciente, pero llama la atención de la pareja, que es la que la reporta tanto al paciente, como al médico. Junto con el ronquido, son la causa más frecuente de consulta y es un buen predictor de apnea del sueño confirmada por Polisomnografía, aunque no se correlaciona con la severidad (5, 36).
La hipersomnolencia diurna o somnolencia excesiva durante el día (SED), definida como la sensación de déficit de sueño en los pacientes con SAHS, es el resultado directo de la fragmentación del sueño con disminución o ausencia de las etapas reparadoras del sueño, debido a los microdespertares post apneas o hipoapneas. Es un síntoma inespecífico y siendo la apnea obstructiva del sueño la causa más frecuente y existen otros trastornos que lo producen y que deben ser descartados (Tabla 3).
Diagnóstico diferencial de somnolencia diurna de la academia americana de medicina del sueño (AAMS)
| FISIOLÓGICA | - Relacionada con la edad o un estado: periodo premenstrual, embarazo, ejercicio físico intenso, postprandial. |
| PATOLÓGICA | - Pueden deberse a un défcit de sueño por hábitos incorrectos, cambios de horario de trabajo, alteraciones del ritmo circadiano o la ingesta de ciertos medicamentos o drogas. Se clasifican en primarias y secundarias. |
| Primarias - Narcolepsia. - Hipersomnia diurna idiopática. - Hipersomnias recurrentes. - Síndrome de piernas inquietas. (aunque su mayor síntoma es el insomnio) | |
| Secundarias - Trastornos respiratorios del Sueño. - Enfermedades psiquiátricas, frecuentemente en depresión. - Enfermedades neurológicas. - Enfermedades metabólicas. - Enfermedades infecciosas. - Secundaria a trastornos del ritmo circadiano. |
La evaluación de la SED, se dificulta por su alto grado de subjetividad y muchas veces los pacientes lo refieren como cansancio durante el día, sueño no reparador, baja de la concentración, sensación de déficit de sueño, párpados pesados o deseos de dormir (26, 36, 37). Como ayuda en su medición se han validado dos herramientas semi objetivas, la escala de somnolencia Epworth (ESE), descrita en 1991 (38, 39) y la escala de somnolencia de Stanford (SSS) en 1972, (40). La primera es la más simple, difundida y utilizada. Fácil de realizar, pero sin estrecha relación con la severidad del desorden respiratorio de sueño (41).
Entre los exámenes objetivos de somnolencia, hay que mencionar la pupilometría, el test de latencia múltiple del sueño (TLMS), el test de mantención de la vigilia (TMV) y el test de latencia. El TLMS, constituye el patrón oro para medir la hipersomnolencia diurna y se ha estandarizado como normal cuando es mayor a 10 minutos, indeterminado entre 5 y 10 minutos y anormal inferior a 5 minutos, pero en la práctica clínica de los pacientes con SAHOS, un test inferior a 8 minutos implica un grado de somnolencia leve. No se efectúa de rutina por ser un examen complejo, prolongado, caro, no fácil de implementar y se reserva para pacientes con somnolencia residual post tratamiento, ante sospecha de narcolepsia, o por razones médico legales. El TLMS, no se asocia significativamente con el ESE, ya que miden difierentes aspectos de la somnolencia.
En la práctica habitual del SAHOS, la evaluación, control y seguimiento de la ESE, se realiza mediante la historia clínica, la evaluación en conjunto de los síntomas y la medición del índice de Epworth (42, 43). (Tabla 4).
Índice de somnolencia de epworth
| SITUACIÓN | PUNTUACIÓN |
|---|---|
| • Sentado y leyendo un libro por más de ½ hora. | |
| • Viendo TV, tranquilo por más de ½ hora. | |
| • Sentado, inactivo en un espectáculo (teatro, cine, conferencia) | |
| • Como pasajero en tren, bus, auto, durante 1 hora sin detención. | |
| • Recostado a media tarde (no siesta) | |
| • Sentado y conversando con alguien | |
| • Sentado después de la comida (sin tomar alcohol) | |
| • En su vehículo, cuando se para durante algunos minutos debido al tráfico | |
| PUNTUACIÓN TOTAL (MAX. 24) |
Corresponde a una autoevaluación que permite objetivar el grado de somnolencia durante actividades diurnas, de no haberlas realizados debe imaginar cómo le afectaría. Paciente contesta ¿Con qué frecuencia siente Ud. somnolencia o cabeceo en las siguientes situaciones? Le otorga a cada pregunta uno de los siguientes puntuaciones: 0 = nula posibilidad, 1 = escasa posibilidad, 2 = moderada posibilidad, 3 = Elevada posibilidad. Se consideran las puntuaciones totales como normal 1 – 9, hipersomnolencia leve 10 – 14, moderada 15 – 19 y severa 20 – 24 puntos.
Por último, es importante destacar que la somnolencia diurna no solo deteriora la calidad de vida y menor rendimiento en las actividades diurnas, sino además representa un mayor riesgo de accidentes, tanto laborales como de vehículos motorizados. En la literatura no hay consenso si esta asociación se relaciona o no directamente con la severidad del índice de apnea/hipoapnea (44-48).
En cuanto a los síntomas menores descritos en la tabla I, interesa destacar que los pacientes con apnea se caracterizan por una latencia de sueño acortada, sin embargo, algunos presentan insomnio principalmente de conciliación y más raro de mantención o despertar precoz. En estos pacientes se ha demostrado la asociación con trastornos sicológicos, la existencia de mayor número de “microdespertares completos”, así denominados cuando el paciente tiene percepción de los microdespertares recurrentes que siguen a las apneas (49, 50).
Los ahogos nocturnos que refieren algunos pacientes con SAHOS, pueden corresponderse con apneas prolongadas que despiertan completamente al paciente, con sensación de angustia y asfixia, aunque más frecuentemente son causados por episodios de reflujos gastroesofágicos con o sin espasmo glótico. Los ahogos nocturnos pueden ser concurrentes en un corto periodo o con intervalos de varios meses, lo que dificulta que el paciente lo asocie con su roncopatía. Hay que considerar que debe hacerse el diagnóstico diferencial de estos episodios, con asma de predominio nocturno, disnea paroxística nocturna propia de la insuficiencia cardiaca congestiva y con parasomnias. Otros síntomas menos frecuentes, pero no raros son la cefalea matinal, la nocturia sin causa obstructiva prostática, la disminución de la libido y la sequedad faríngea. También la salivación excesiva, congestión nasal nocturna, diaforesis, síntomas cuya relación causal con la apnea se demuestra por la mejoría que tienen cuando se realiza un tratamiento efectico con CPAP (27, 51).
Factores de riesgoEn el proceso de diagnóstico del SAHS, también es muy relevante considerar los factores de riesgo más importantes para esta enfermedad, que se enumeran en la tabla 5, destacando los antecedentes familiares de ronquidos y apneas que representan el riesgo genético de desarrollar SAHOS. También se ha demostrado que la edad es un factor de riesgo para el SAHOS, cuya prevalencia aumenta en los grupos etáreos mayores y un punto de quiebre a partir de los 35 años en los hombres (3). El peso constituye un factor de riesgo no solamente por su valor absoluto (IMC) y su efecto mecánico por depósito a nivel cervical y viceral, sino que importan también la evolución en el tiempo y su relación con la aparición de los síntomas (25). En relación con comorbilidad en el SAHOS, destaca la hipertensión arterial no sólo por su asociación con la apnea obstructiva, sino que se ha demostrado una relación de causa y efecto. Debe descartarse la existencia de apnea, especialmente ante la presencia de hipertensión arterial refractaria al tratamiento o de aparición de reciente sin dip nocturno (52-54). Lo mismo es válido para los sujetos con AC x FA o accidente cerebro vascular (55). Conocida es la mayor prevalencia de desorden respiratorio del sueño en pacientes con insuficiencia cardiaca congestiva, caracterizado no sólo por la existencia de apneas obstructivas, sino también de apneas centrales, cuyos mecanismos fisiopatológicos son distintos. Interesante es señalar que en estos pacientes el tratamiento con CPAP, no solo corrige la apnea obstructiva, sino que mejora la función ventricular izquierda (56, 57).
Factores de riesgo de sahos y comorbilidad asociada
| Pacientes con alto riesgo de SAHOS |
|---|
| 1. Genética: Antecedentes familiares de SAHOS. |
| 2. Edad: Mayor a 30 – 40 años. |
| 3. Sexo masculino y menopausia en la mujer. |
| 4. Obesidad centrípeta con IMC >35 kg/m2 |
| 5. Factores que estrechen la vía aérea superior a. Obesidad. b. Malformaciones congénitas. c. Obstrucción nasal (rinitis alérgica, poliposis). d. Hipertrofia amigdalina. e. Macroglosia. |
| 6. Comorbilidad a. Hipertensión arterial. b. Insuficiencia cardiaca congestiva. c. Diabetes mellitus tipo 2. d. Arritmias cardiacas. e. Accidente cerebrovascular. f. Hipertensión pulmonar. g. Disfunción tiroidea. h. Insuficiencia renal avanzada. i. Asma bronquial. |
Por último, en el estudio del paciente con apnea, es importante detectar la presencia de atopía, rinitis y/o asma, que por su característica acentuación nocturna con obstrucción de la vía aérea favorecen o agravan los riesgos de apnea obstructiva.
Examen físicoAunque el examen físico en sí, no es concluyente para el diagnóstico de SAHOS, tiene dos objetivos fundamentales: detectar los factores anatómicos predisponentes riesgo (Tabla 5) y por otro lado, excluir otras etiologías. Se debe incluir la anatomía cráneo–facial y el estado funcional de los sistemas respiratorios, cardiovascular y neurológico. El examen visual debe evaluar la morfología cráneo–facial, del cuello y partes blandas, como también determinar la permeabilidad de las fosas nasales y el estado bucofaríngeo. Por ser un importante factor de riesgo, debe registrarse el peso, calcular el IMC y evaluar la distribución del tejido adiposo, midiendo la circunferencia del cuello y el perímetro abdominal. También es esencial, medir la presión arterial, descartar arritmias y obstrucción bronquial. Los puntos esenciales a evaluar en el examen físico de un paciente con sospecha de apnea de seño, se resumen en la Tabla 6.
Puntos esenciales a evaluar en examen físico de un paciente con sospecha de apnea
| Lo que no podemos dejar de mirar o medir ante la sospecha de SAHOS: |
|---|
| • Peso corporal, cálculo de IMC y su evolución en el tiempo. Alrededor del 50 % de los SAHOS son obesos (IMC > 30 Kg / m²). |
| • Medición del perímetro cervical: En los pacientes con apnea obstructiva, a menudo es mayor a 43 cm. |
| • Inspección de cuello y cráneo buscando masas, engrosamientos, infiltrados, micro o retrognatia, y evaluación la mordida y oclusión |
| • Evaluar la permeabilidad nasal. |
| • En la boca, inspección del tamaño, movilidad y desplazamiento de la lengua (en decúbito). |
| • Evaluar dentición y ausencia de dientes. |
| • Evaluar el espacio faríngeo tamaño tonsilar, aspecto de la úvula y paladar blando. |
| • Medir presión arterial repetidamente |
| • Efectuar examen respiratorio, cardiovascular y neurológico habitual para descartar enfermedad coexistente. |
Normalmente las fosas nasales aportan la mitad de la resistencia de la VAS, por lo que cualquier alteración anatómico o funcional a ese nivel determinará un significativo aumento de esa resistencia. Esto puede ser muy relevante en la génesis o acentuación del SAHOS y explica la importancia de descartar rinitis, disfunción valvular nasal, alteración septal o alteraciones obstructivas de cornetes, pólipos o tumores. A nivel bucofaríngeo es crucial establecer cualquier desbalance de la interrelación entre el continente determinado por reducción del paladar duro y la estructura óseo máxilo-mandibular por un lado o el aumento del contenido, dado por el crecimiento de partes blandas como amígdalas, lengua y paladar blando.
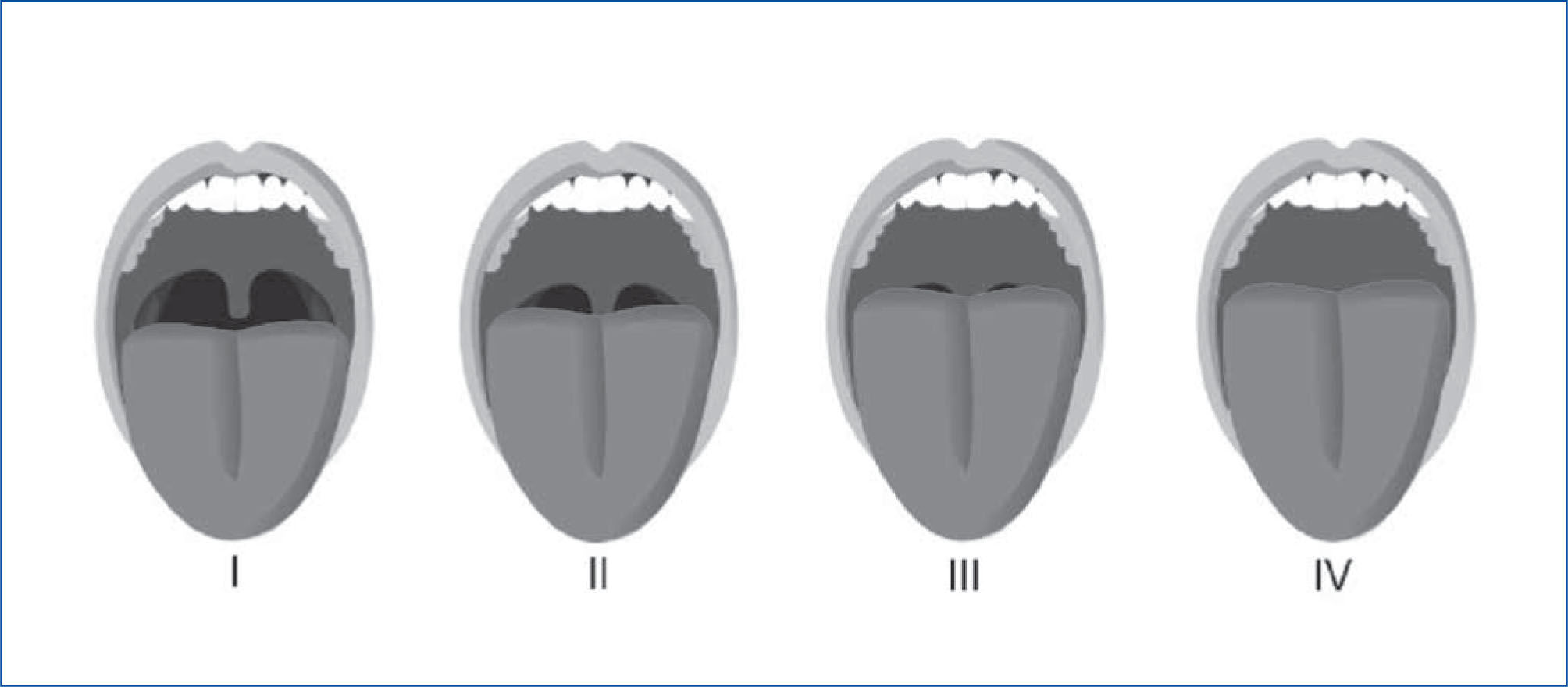
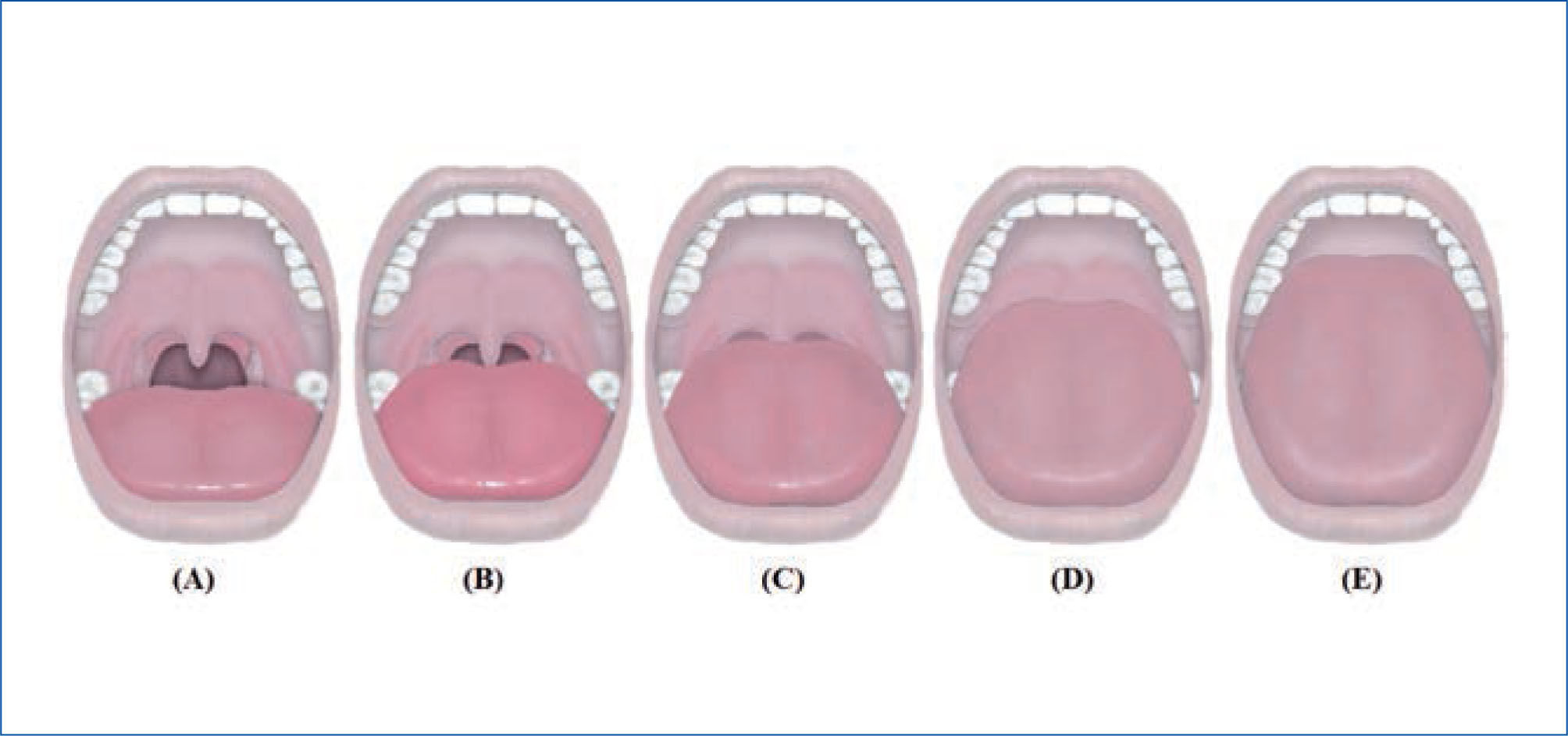
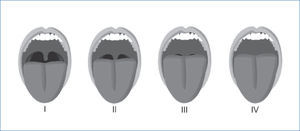
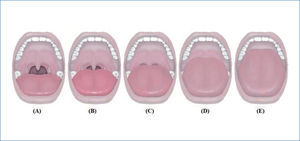
La clasificación de predicción de intubación oro-traqueal de Mallampatí (58), y la posterior modificación propuesta por Friedman en su nueva clasificación anatómica en cinco categorías, exploran la anatomía de la cavidad oral, relacionándose directamente con el riesgo de desarrollar apnea e hipoapnea y tienen buena concordancia inter-examinador, (59). (Figura 3a y 3b).
Clasificación de mallampati, en 4 grados, para la visualización de estructuras anatómicas faríngeas a traves de la cavidad bucal
Grado I: Se visualiza úvula completa, paladar blando con sus pilares y las amígdalas.
Grado II: Se visualiza solo base de la úvula, pero no las amígdalas, ni los pilares.
Grado III: Se visualiza solo el paladar blando.
Grado IV: Se visualiza solo el paladar duro.
Clasificación de friedman
Valora las estructuras anatómicas faríngeas con el paciente en posición sentada y la boca completamente abierta, la lengua dentro de la cavidad oral y sin depresor.
A: normal y E: máximo grado de obstrucción y en consecuencia de predicción de SAHOS
(A) Se visualiza úvula completa, amígdalas y pilares. (B) Se visualiza gran parte de la úvula, pero no las amígdalas y los pilares. (C) Se visualiza el paladar blando y base de la úvula. (D) se visualiza parte del paladar blando, pero no las estructuras más distales. (E) se visualiza solo el paladar duro.
La apnea obstructiva del sueño es una enfermedad crónica y progresiva, se caracteriza por ser heterogénea, por lo que es interesante considerar algunas formas especiales de presentación.
En ancianos, no sólo es más frecuente, sino que hasta un 20% de los individuos entre 80 y 89 años presenta un SAHOS moderado a severo. En este grupo etario desaparece la diferencia de género por los cambios hormonales en las mujeres y la sintomatología puede ser más difícil de reconocer al estar interferida por diferentes comorbilidad que abundan a esta edad. Asimismo, el SAHOS agrava enfermedades preexistentes como el Alzheimer y el Parkinson y se asocia con varias oftalmopatías (60, 61). Por lo anterior y por la mejoría clínica que se consigue con adecuado tratamiento con CPAP, la sospecha de apnea debe hacerse sistemáticamente en los ancianos.
Históricamente la sospecha de SAHOS es más tardía en las mujeres, las que a su vez refieren síntomas más vagos, menos específicos y menos sensibles para percibir somnolencia que los hombres.
Las embarazadas presentan SAHOS en al menos un 10%, atribuido a varios factores como aumento de peso, cambios hormonales, alteración espacial del diafragma y congestión nasal. La somnolencia propia de esta afección es interferida por el déficit de sueño fisiológico habitual del embarazo (62-64). Como se dijo anteriormente los pacientes con insuficiencia cardiaca congestiva, tienen una alta prevalencia de trastornos respiratorios durante el sueño con apneas obstructivas, pero también centrales, los que se asocian a un riesgo aumentado de arritmias. Esto y la respiración de Cheyne Stokes propia de esta cardiopatía son factores de mal pronóstico, lo que se corrige significativamente con adecuado tratamiento de apnea (56, 65). Por la alta prevalencia del SAHOS y la Enfermedad Pulmonar Obstructiva Crónica (EPOC), la coexistencia de ambas no es infrecuente, lo que determina una mayor fraccionamiento y desorganización el sueño por un lado y mayor riesgo de saturación bajo 90% y por lo tanto a desarrollar Hipertensión Pulmonar, taquiarritmias nocturnas y muertes durante la noche (66, 67). La Insuficiencia Renal Crónica Avanzada (IRC), representa un fenotipo especial de SAHOS, caracterizado por sobrecarga de volumen a nivel faríngeo como causa etiopatogénica de su estrechamiento y del desarrollo de SAHOS, determinando una alta prevalencia en estos pacientes, que habitualmente no son obesos, ni presentan síntomas típicos, lo que dificulta su diagnóstico. A su vez, se ha mostrado que el SAHOS deteriora la progresión de la IRC y su tratamiento lo revierte y además mejora la calidad de vida (68-71).
Diagnóstico y evaluación del sahos en el laboratorioLa sospecha clínica es fundamental en el diagnóstico del SAHOS, por lo que una historia detallada y el examen físico, constituyen la piedra angular de la evaluación inicial para cualquier paciente que se presente con síntomas de desorden respiratorio u otro trastorno del sueño.
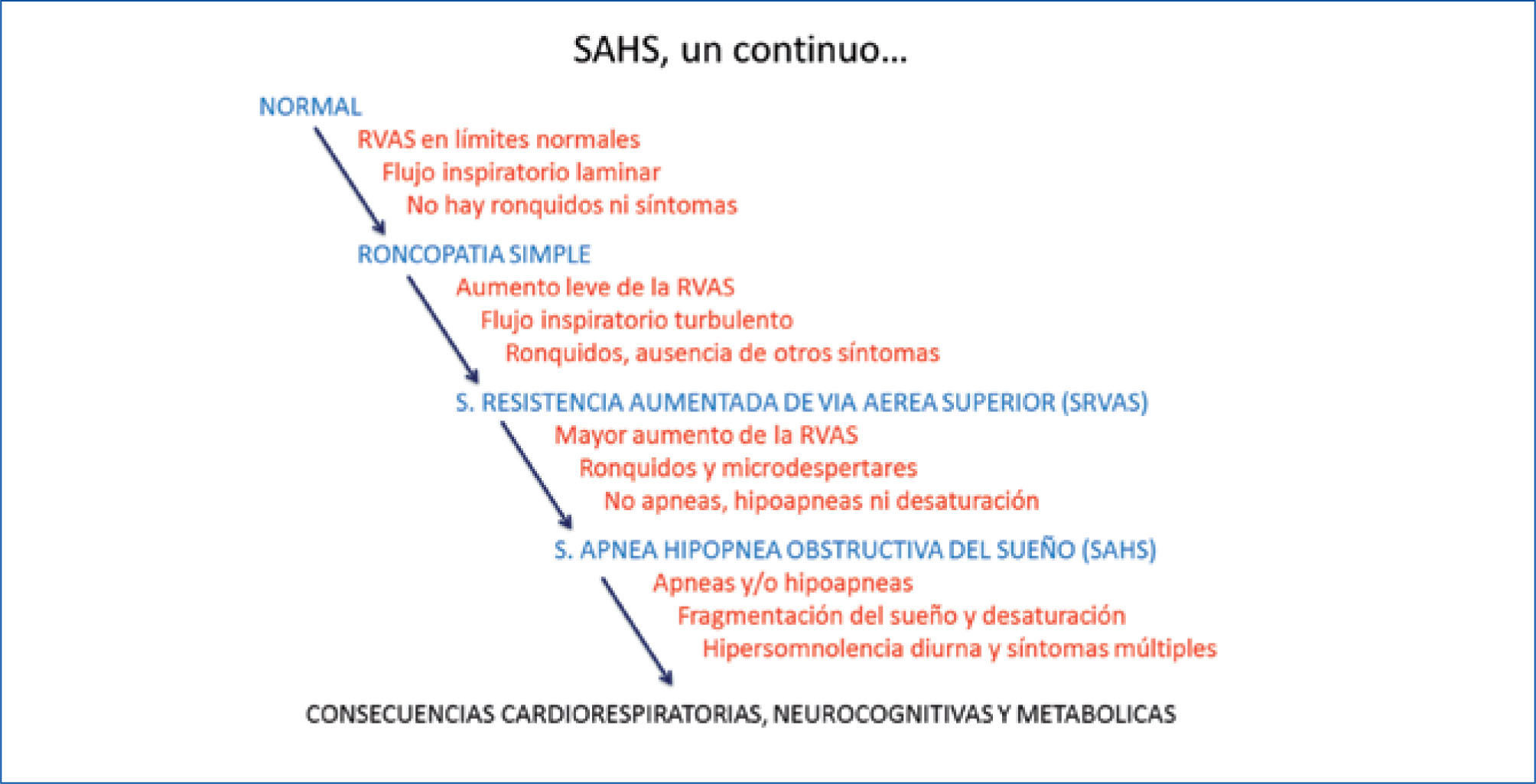
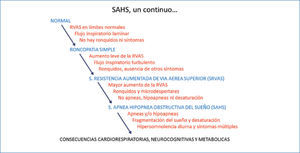
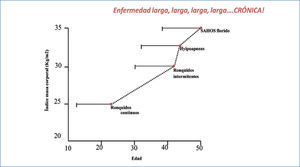
El síndrome de apnea hipoapnea obstructiva del sueño es un continuo, que se presenta desde el roncador simple (ronquido sin apnea, ni síntomas significativos) hasta el extremo opuesto, del paciente con apneas severas, síntomas floridos e insuficiencia cardiaca congestiva Figuras 2a y 2b.
La recomendación para evaluar y diagnosticar los desordenes respiratorios del sueño han cambiado, en los últimos años y se pueden resumir en dos grupos de pacientes: a) Aquellos pacientes sintomáticos en los que el objetivo principal es el tratamiento de los síntomas y b) Aquellos con factores de riesgos para SAHOS, en los cuales el objetivo es tratar esos factores de riesgos, a pesar de la ausencia de síntomas claros, con la idea de disminuir la morbilidad y mortalidad.
El efecto del beneficio del tratamiento para aquellos pacientes con riesgo cardiovascular está bien documentado (72), no así para el síndrome metabólico en el que se necesitan estudios de más largo plazo (73, 74). La Polisomnografía (PSG) convencional en el laboratorio sigue siendo el patrón oro para la confirmación diagnóstica y determinación de la severidad de estas afecciones. Sin embargo, es un examen caro que consume recursos tanto de tiempo como de personal y logra diagnosticar solo una minoría de pacientes. Además, es difícil de implementar en el nivel primario de salud.
Lo anterior, unido a la alta prevalencia del SAHOS, su morbilidad y mortalidad, así como la mayor conciencia a nivel médico y de la población general, ha provocado un notable aumento en la demanda de atención, que a su vez ha generado un formidable incremento de los métodos simplificados y domiciliarios, que se han desarrollado tanto para el diagnóstico, como para el tratamiento de la apnea fuera del laboratorio.
Desde la descripción oficial de la Polisomnografía hecha en 1974 por Holland y colaboradores (75) el progreso tecnológico ha sido enorme, con amplia aplicación en diferentes campos clínicos y de investigación. En la actualidad su foco principal son los trastornos del sueño (76). Desde el año 2005 la indicación de la PSG ha sido enmarcada por las guías de la Asociación Americana del Sueño (AASM) las que se resumen en la Tabla 7.
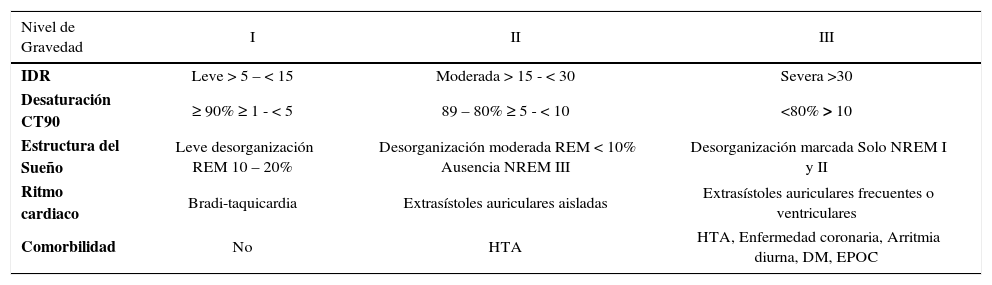
Gravedad del SAHOS
| Nivel de Gravedad | I | II | III |
|---|---|---|---|
| IDR | Leve > 5 – < 15 | Moderada > 15 - < 30 | Severa >30 |
| Desaturación CT90 | ≥ 90% ≥ 1 - < 5 | 89 – 80% ≥ 5 - < 10 | <80% > 10 |
| Estructura del Sueño | Leve desorganización REM 10 – 20% | Desorganización moderada REM < 10% Ausencia NREM III | Desorganización marcada Solo NREM I y II |
| Ritmo cardiaco | Bradi-taquicardia | Extrasístoles auriculares aisladas | Extrasístoles auriculares frecuentes o ventriculares |
| Comorbilidad | No | HTA | HTA, Enfermedad coronaria, Arritmia diurna, DM, EPOC |
Diferentes aspectos que se deben a considerar para establecer la gravedad del SAHOS clínico. IDR: Índice de Desorden Respiratorio. CT90: Porcentaje de tiempo con SatO2<90%. REM: Movimiento Rápido de los Ojos. HTA: Hipertensión Arterial. DM: Diabetes Mellitus. EPOC: Enfermedad Pulmonar Obstructiva Crónica. Olivi, H.
La PSG convencional en laboratorio, incluye registro de EEC, EOG, EMG mentón, EKG frecuencia cardiaca, flujo aéreo, esfuerzo respiratorio y saturación de O2, con al menos siete canales y cuenta con la asistencia y supervisión de un técnico especializado, durante toda la noche.
Los canales de sueño de este examen registran los estados de vigilia y sueño, sus diferentes etapas y las proporciones de cada una de ellas. Los microdespertares y movimientos de extremidades (piernas). Los canales o variables respiratorias registran el flujo de aire nasal y bucal, el esfuerzo inspiratorio, la saturación de O2 arterial, los ronquidos, además el pulso y la posición corporal. Esto permite detectar y cuantificar los eventos respiratorios principales, apneas e hipoapneas.
Apnea se define como el cese del flujo por más de 10 segundos. Hipoapnea es la disminución del flujo entre 30% y 90%, por más de 10 segundos, asociadas a desaturación ≥ 3 % y/o a un microdespertar. Además, permite diferenciar las apneas obstructivas, de las de tipo central, caracterizadas por ausencia del esfuerzo inspiratorio.
La suma de apneas, e hipoapneas dividido por el número de horas de sueño da el índice de Apnea- Hipoapnea/hora de sueño (IAH). Se considera anormal un IAH >5/hora de sueño. Un valor de IAH >5 a 20 se considera alteración leve, IAH>20 y <30 moderado y un IAH> 30 severo. La sola existencia de un IAH anormal no es sinónimo de SAHOS, sino que debe coexistir con síntomas y la gravedad clínica del SAHOS debe considerar varios aspectos, además del IAH (Tabla 8).
Recomendaciones de la aasm para indicaciones de polisomnografía convencional
| 1. Diagnostico de los desórdenes respiratorios del sueño. |
| 2. Titulación de presión positiva en la vía aérea (PPA) en los pacientes con SDRS. |
| 3. Evaluación preoperatoria de cirugía VAS por ronquidos o AOS. |
| 4. Evaluación de tratamiento en AOS moderado a severo: después de buena respuesta clínica o recurrencia de síntomas a pacientes tratados con DIO o cirugía. |
| 5. Seguimiento clínico después de: respuesta incompleta o recurrencia a- PPA- baja significativa de peso- aumento significativo de peso. |
| 6. Evaluación de pacientes con sospecha de apnea del sueño y comorbilidad relacionada- ICS o ICD con síntomas de apnea—ICC con síntomas persistentes pese a tratamiento óptimo –enfermedades neuromusculares con síntomas de apnea. |
| 7. Diagnóstico y evaluación de narcolepsia (seguido de TLMS). |
| 8. Diagnóstico y evaluación de pacientes con sospecha de MPP y trastornos del sueño. |
Recomendación de la Academia Americana de Medicina del Sueño para la indicación de polisonnografia (PSG) convencional asistida. PPA: presión positiva de la vía aérea. SDRS: síndrome de desorden respiratorio del sueño. VAS: vía aérea superior. AOS: apnea obstructiva el sueño. ICS, ICD, ICC: insuficiencia cardíaca sistólica, diastólica y congestiva.
Como se dijo previamente, el uso de equipos portátiles se ha hecho cada vez más frecuente tanto en el laboratorio, como en domicilio. Estos se pueden agrupar en tres tipos. Equipos PSG convencionales portátiles (Tipo I) que incluyen las mismas variables de una PSG convencional, con un mínimo de siete canales. Equipos portátiles modificados o de poligrafía respiratoria, con un número de 4 canales, que incluye variables respiratorias (flujo, esfuerzo respiratorio, frecuencia cardiaca y saturación de O2) sin EEG (Tipo II) y equipos continuos simples o de canal dual que incluyen flujo aéreo y saturación de O2 con 2 o 2 canales (Tipo III) (77). En resumen podemos decir que en el presente los estudios portátiles y especialmente simplificados, están indicados en los pacientes con una alta probabilidad pre test de tener SAHOS moderado –severo aunque no tengan comorbilidad significativa (78). Un resultado negativo discordante, obliga a una PSG convencional.
Para decidir el método de estudio disponible más adecuado, es necesario tener en cuenta el diagnóstico diferencial de los diferentes trastornos respiratorios del sueño, como alteración la higiene de sueño, privación o restricción de horas de sueño, narcolepsia, SPI, insomnio, depresión, somnolencia inducida por fármacos y diferentes enfermedades neurológicas.
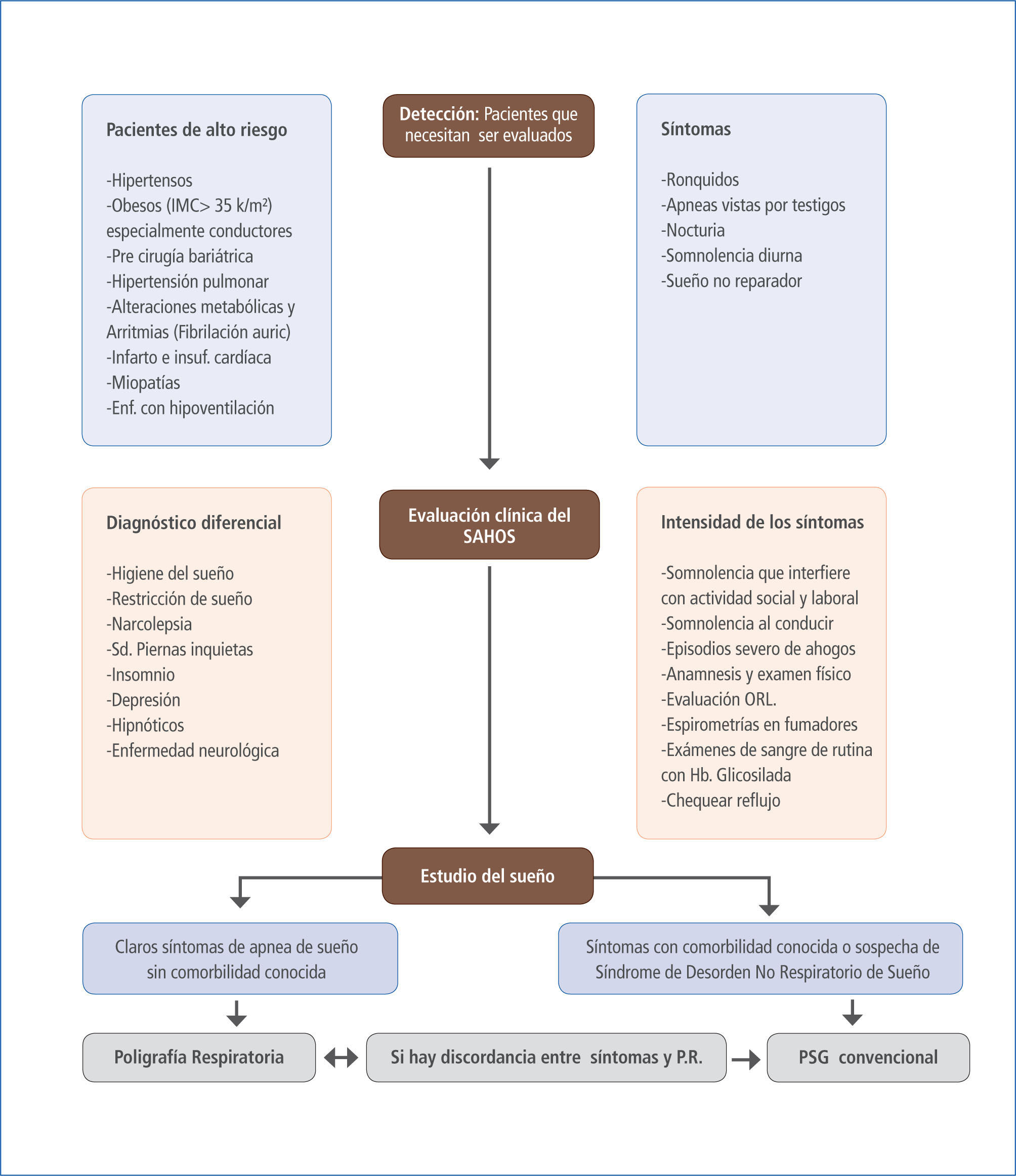
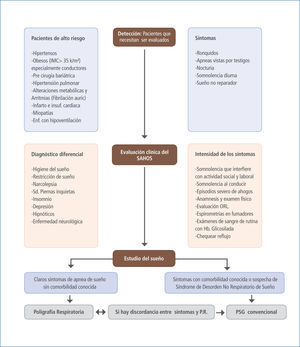
Un algoritmo de estudio diagnóstico se muestra en la figura 4, donde se establecen los pasos a seguir de acuerdo con lo expuesto precedente mente para estudiar y diagnosticar a cada paciente en que se sospecha apnea del sueño.
Algoritmo de estudio diagnostico de SAHOS
Los tres pasos que siempre deben seguirse cuando se sospecha de apnea de sueño:- detección (pacientes susceptibles);- evaluación clínica para determinar la severidad de la enfermedad y el diagnóstico diferencial; finalmente, - el estudio de sueño, debería efectuarse de acuerdo con la posibilidad pre test de apnea de sueño y la presencia de comorbilidad conocida.
Finalmente, es necesario decir que para establecer una adecuada estrategia de estudio diagnóstico de estos pacientes, tanto a nivel nacional (sistema de salud) como local (institucional), lo más recomendable es tener un sistema de red con los diferentes niveles de especialistas, equipos y tecnología de estudio interconectado. Esta es la manera más eficiente de utilizar los recursos y dar la más amplia cobertura a la alta y creciente demanda.
El autor declara no tener conflictos de interés, con relación a este artículo.