El síndrome de apneas-hipopneas del sueño (SAHS) es un problema mayor de salud pública que, en sus formas más graves, afecta al 3-6% de los hombres y al 2-5% de las mujeres. El SAHS causa hipertensión arterial y produce un aumento del riesgo de enfermedades cardiovasculares, deterioro de la calidad de vida, accidentes y exceso de mortalidad.
El tratamiento más costo-efectivo en los casos graves es la presión positiva continua en la vía aérea superior (CPAP) que es seguida por decenas de millones de personas en todo el mundo. Sin embargo, apenas se ha diagnosticado y tratado al 10% de la población afectada.
El tratamiento con CPAP, aunque bien aceptado por la mayoría de los pacientes con cumplimientos superiores al 70% no está exento de incomodidades. El 50% de los pacientes presenta algún tipo de efectos secundarios, generalmente leves y transitorios. La utilización de las escuelas de CPAP para el inicio del tratamiento y el seguimiento de los pacientes con CPAP por personal entrenado se ha mostrado muy eficaz. Es imprescindible la formación y la colaboración entre todas las partes implicadas en el proceso. En este sentido, se considera esencial una mayor participación de los médicos de asistencia primaria en el control y seguimiento de los pacientes en tratamiento con CPAP.
Obstructive sleep apnea-hypopnea syndrome (OSAHS) is a major public health problem. Severe OSAHS affects 3-6%of men and 2-5% of women. OSAHS causes hypertension, increase the risk of cardiovascular disease and accidents, impairs quality of life and produces an excess of mortality.
The most cost-effective treatment for severe OSAHS is continuous positive airway pressure (CPAP) which is received by tens of millions of people worldwide. However, less than 10% of the affected polulation has been diagnosed and treated.
CPAP treatment, although well accepted by most patients, with a complicance of over 70%, is not free from inconveniences. Around 50% of patients have some kind of side effects, albeit usually mild and transient. The use of CPAP schools that involve trained personnel in starting the treatment and the monitoring of has proven very effective. Training and collaboration among all sleep specialists, primary phisicians and CPAP suppliers is a key point. Greater participation from primary phisicians in the control and monotoring of patients treated with CPAP is also essential.
El Documento Español de Consenso definió al SAHS como “un cuadro de somnolencia excesiva, trastornos cognitivo-conductuales, respiratorios, cardíacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía aérea superior durante el sueño” (1). Estos episodios se miden con el Índice de Apneas-hipopneas de sueño (IAH) definido como el número de apneas (obstrucciones totales) + el número de hipopneas (obstrucciones parciales) divididos por las horas de sueño (Tabla 1). Un IAH > 5 es considerado como anormal y un IAH > 30 es sinónimo de SAHS grave (1). Los estudios epidemiológicos (2,3) han evidenciado que el SAHS es una enfermedad muy prevalente que deteriora la calidad de vida (4), causa hipertensión arterial (5-15) y potencia el desarrollo de enfermedades cardiovasculares (16-21) y cerebrovasculares (22-27). Además, está asociado con los accidentes de tráfico (28-30) y se relaciona con un exceso de mortalidad (31-35). Por ello se ha afirmado que esta enfermedad es un problema mayor de salud pública que obliga al médico a identificar los pacientes subsidiarios de tratamiento (36). Por otra parte, se ha mostrado que los pacientes no diagnosticados duplican el consumo de recursos sanitarios comparándolos cuando el diagnóstico se ha establecido y se ha instaurado el tratamiento (37, 38). Finalmente, disponemos de un tratamiento efectivo a través de la presión positiva en la vía aérea superior (CPAP) que ha mostrado ser eficaz y costo-efectivo (39-42).
Definiciones aceptadas en el SAHS
| Apnea Obstructiva | Ausencia o reducción > 90% de la señal respiratoria (termistores, cánula nasal o neumotacógrafo) de > 10 segundos de duración en presencia de esfuerzo respiratorio detectado por las bandas tóraco-abdominales. |
| Apnea Central | Ídem en ausencia de esfuerzo respiratorio detectado por las bandas tóraco-abdominales. |
| Apnea Mixta | Es un evento respiratorio que, habitualmente, comienza con un componente central y termina en un componente obstructivo. |
| Hipopnea | Reducción discernible (> 30% y < 90%) de la amplitud de la señal respiratoria de > 10 segundos de duración (termistores, cánula nasal o neumotacógrafo) que se acompaña de unas desaturación (> 3%) y/o un microdespertar en el EEG.. La obstrucción es con frecuencia deducida de la respiración paradójica en las bandas de esfuerzo tóraco-abdominal, la morfología del flujo o el incremento del ronquido durante el evento respiratorio. Sin embargo, la tipificación precisa de las hipopneas como obstructivas o centrales sólo puede llevarse a cabo si se mide presión esofágica. |
| Esfuerzos Respiratorios Asociados a Microdespertares (ERAM) | Período > 10 segundos de incremento progresivo del esfuerzo respiratorio (habitualmente detectado mediante medición de presión esofágica) que acaba, con un microdespertar. Opcionalmente, también puede detectarse el esfuerzo mediante el empleo de una cánula nasal y/o el sumatorio de las bandas tóraco-abdominales cuando hay un período de limitación al flujo > 10 segundos y < de 2 minutos, sin reducción marcada de la amplitud del flujo y que termina con un microdespertar. |
| Índice de Alteración Respiratoria (IAR) | Consiste en la suma del número de apneas + el número de hipopneas por hora de sueño (o por hora de registro si se usa una poligrafía respiratoria) – IAH sumado al número de ERAM por hora. El IAR se corresponde con el Respiratory Disturbance Index (RDI) de la literatura. |
Definiciones aceptadas de los principales eventos respiratorios según el Documento Español de Consenso sobre el SAHS del 2005 y actualizado en 2011 (1, 48).
La tendencia actual en todas las UTS es a considerar los ERAM como hipopneas por lo que el IAR es, en esencia, equivalente al IAH.
Aún a pesar de las limitaciones que tiene el IAH en donde no se ha establecido con claridad el umbral de anormalidad en diferentes poblaciones (hombre, mujeres, anciano, comorbilidad asociada, etc.) Se acepta clasificar la severidad del SAHS en: leve (IAH 5-14,9); Moderado (IAH 15-29,9) y severo o grave (IAH > 30).
El límite umbral de las caídas de la SaO2 del 3% no es aceptado por todos los grupos y algunas sociedades recomiendan utilizar el 4%.
Estudios realizados en España por nuestro grupo, objetivaron que presentan un IAH patológico el 16-19% de los hombres y el 10-17% de las mujeres (1, 2, 43). Además, padecen un SAHS grave el 3-6% de los hombres y el 2-5% de las mujeres (43). Estas cifras se duplican en las edades medias y se triplican en los ancianos (43). Por otra parte, el análisis realizado en el año 2003 por este grupo, sobre los recursos existentes en España para el diagnóstico del SAHS en un total de 449 hospitales generales, evidenció que en el 46% se realizaban estudios de sueño y el 50% disponían de polisomnografía convencional (PSG) (43). Comparativamente con los estudios realizados en años anteriores (44, 45) había una mejoría relevante del nivel de equipamiento. Sin embargo, los recursos disponibles seguían siendo insuficientes para establecer el diagnóstico del SAHS y apenas se había diagnosticado al 10% de la población con SAHS grave por lo que estábamos muy lejos de haber conseguido una situación óptima (43). El último estudio realizado en España sobre este aspecto fue en 2007 y, aunque con notables mejorías, continuaban existiendo importantes demoras para el diagnóstico del SAHS (46, 47). Por ello es mandatorio la identificación precoz, el tratamiento adecuado y el seguimiento preciso de todos los pacientes con un SAHS relevante (1, 48).
Pruebas de sueño, diagnóstico y clasificación del SAHSCualquier planteamiento terapéutico del SAHS precisa de un diagnóstico correcto y una adecuada clasificación del paciente (Tabla 1). El clínico, generalmente el médico de asistencia primaria, es quien hace la primera valoración del paciente por lo que es muy importante que tenga claros los criterios de derivación a una unidad de trastornos del sueño (UTS) expresados en la tabla 2 (1). Sin embargo, dado que no existe ningún síntoma o signo clínico que sea específico del SAHS, para establecer el diagnóstico, es preciso la realización de una prueba de sueño. Hasta muy recientemente, la polisomnografía convencional (PSG) era el único método recomendado para el diagnóstico de los pacientes con sospecha de SAHS (1).
Criterios para derivar un paciente a evaluación por una unidad de sueño por presentar sospecha DE SAHS*
| 1 | Roncador habitual (roncar al menos cinco días por semana, generalmente entrecortados y ruidosos). |
| 2 | Excesiva somnolencia diurna (ESD) definida como una anormal tendencia al sueño o a quedarse dormido en situaciones inapropiadas no explicada por otras causas. |
| 3 | Apneas observadas por la pareja, familiar o acompañante (generalmente de manera repetitiva). |
| 4 | Cansancio no explicado por otras causas. |
| 5 | Presencia de HTA y/o Enfermedad cardio o cerebrovascular. |
La PSG consiste en el registro simultáneo de variables neurofisiológicas y respiratorias que permiten evaluar la cantidad y calidad del sueño, así como la identificación de los diferentes eventos respiratorios y su repercusión respiratoria y neurofisiológica. Aunque la PSG es el método más preciso, su limitada disponibilidad, la enorme población diana, los costes, y su complejidad hacen de esta técnica un mal "gold standard". La poligrafía respiratoria (PR), consiste en el análisis de variables respiratorias sin evaluar las neurofisiológicas, y es una técnica aceptada como abordaje diagnóstico del SAHS (1, 48). Sobre la validez de la PR en el diagnóstico del SAHS y su aplicación, el Grupo Español de Sueño viene realizado múltiples aportaciones desde hace muchos años (49-56) con excelentes resultados. Por otra parte, en los últimos años la PR se ha ido incorporando al proceso diagnóstico del SAHS en la mayoría de las sociedades científicas relacionadas con el sueño (1, 48, 57-62) y la PR es considerada una alternativa y complemento a la PSG que puede ser utilizada tanto en el laboratorio de sueño como en el domicilio del paciente.
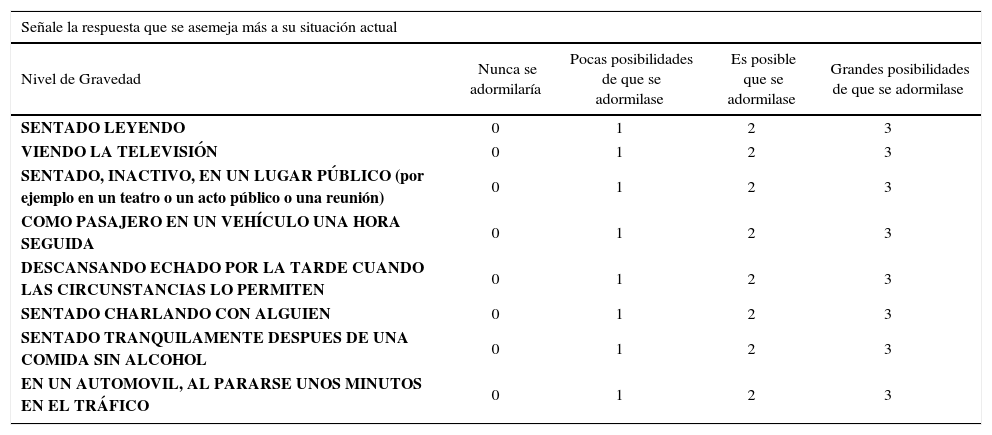
Hay que reseñar la presencia o no de excesiva somnolencia diurna (ESD) y su clasificación y hacer un diagnóstico diferencial de la misma (1). Para ello se suele utilizar la escala de Epworth (63), que está validada en español (64, 65) y otras relacionadas (66) según se describen en las tablas 3 y 4. Los fenotipos del SAHS están cambiando y ni todos los pacientes con SAHS son obesos, ni mucho menos varones. Se evaluará la asociación de co-morbilidad y/o factores de riesgo así como a las profesiones donde se manejan vehículos o se manipulan sustancias peligrosas (Tabla 5). Además, en todo SAHS deberán aplicarse medidas higiénico dietéticas (Tabla 6) y medidas generales de sueño (Tabla 7).
Escala de somnolencia de epworth
| Señale la respuesta que se asemeja más a su situación actual | ||||
|---|---|---|---|---|
| Nivel de Gravedad | Nunca se adormilaría | Pocas posibilidades de que se adormilase | Es posible que se adormilase | Grandes posibilidades de que se adormilase |
| SENTADO LEYENDO | 0 | 1 | 2 | 3 |
| VIENDO LA TELEVISIÓN | 0 | 1 | 2 | 3 |
| SENTADO, INACTIVO, EN UN LUGAR PÚBLICO (por ejemplo en un teatro o un acto público o una reunión) | 0 | 1 | 2 | 3 |
| COMO PASAJERO EN UN VEHÍCULO UNA HORA SEGUIDA | 0 | 1 | 2 | 3 |
| DESCANSANDO ECHADO POR LA TARDE CUANDO LAS CIRCUNSTANCIAS LO PERMITEN | 0 | 1 | 2 | 3 |
| SENTADO CHARLANDO CON ALGUIEN | 0 | 1 | 2 | 3 |
| SENTADO TRANQUILAMENTE DESPUES DE UNA COMIDA SIN ALCOHOL | 0 | 1 | 2 | 3 |
| EN UN AUTOMOVIL, AL PARARSE UNOS MINUTOS EN EL TRÁFICO | 0 | 1 | 2 | 3 |
Escala de Epworth. Se trata de una auto-escala que el paciente debe rellenar. Se considera cuando la puntuación final es igual o mayor que 12 (63-65).
Grado de excesiva somnolencia durante el día (ESD)
| 1 | No hay ESD. |
| 2 | LEVE: Episodios infrecuentes de ESD que ocurren en situaciones pasivas (viendo TV, leyendo, viajando como pasajero). Producen poca repercusión sobre las actividades de la vida diaria. |
| 3 | MODERADA: Episodios de ESD que ocurren regularmente en situaciones que requieren cierto grado de atención (conciertos, teatros reuniones). Producen cierto impacto en las actividades de la vida diaria. |
| 4 | GRAVE: Episodios de ESD diarios en situaciones francamente activas (hablando, comiendo, paseando), altera de forma importante las actividades habituales. |
Gradación de la excesiva somnolencia diurna (66).
Aspectos generales del SAHS a tener en cuenta
| 1 | El estereotipo de SAHS como hombre obeso, de mediana edad, con cuello corto y sintomatología florida, aunque existe, representa un fenotipo de la enfermedad aplicable sólo a un subgrupo de pacientes con SAHS. Aunque la obesidad es el factor de riesgo más importante, casi el 50% de los pacientes que vemos en las unidades de Trastornos del Sueño (UTS) no son obesos, por lo que hay que pensar en SAHS también en pacientes delgados. |
| 2 | La Excesiva somnolencia diurna (ESD) es una manifestación de algunos pacientes con SAHS pero que en muchos puede faltar bien porque el paciente no es consciente de ella, porque la minimiza, o porque en ese paciente concreto no se ha manifestado. La ausencia de ESD no elimina la gravedad del SAHS y, mucho menos, lo descarta. Así mismo, la ausencia de ESD no minimiza las consecuencias clínicas del SAHS. |
| 3 | Aunque la relación hombre / mujer en los estudios epidemiológicos es de 2:3/1, la realidad es que en las consultas de las UTS esta relación es 7-9/1. Esto es debido a que tanto las parejas y familiares, como los médicos, tienden a pensar poco en el SAHS entre las mujeres. De hecho, las mujeres que son enviadas a las UTS, comparadas con los hombres, son más obesas, con peor estado de salud y mayor comorbilidad. Es decir, aunque las mujeres están más protegidas que los hombres ante las consecuencia del SAHS, llegan a las UTS en peor estado clínico, lo que tiene implicaciones pronósticas. Por lo tanto, no dejar de sospechar un SAHS en presencia de una mujer (el SAHS en la mujer también existe). |
| 4 | La prevalencia de SAHS en pacientes con hipertensión arterial, si son roncadores, es superior al 75%, por lo que todo paciente hipertenso que ronca debería ser evaluado por la UTS. |
| 5 | Los pacientes con enfermedades cardiovasculares o cerebrovasculares representan una población con un riesgo superior al 50% de padecer un SAHS. Además, la mayoría de estos pacientes no tienen ESD. Por ello, deberán evaluarse con cuidado y enviarlos a la UTS si se considera necesario. |
| 6 | Los conductores profesionales y personal que manejan maquinaria peligrosa, son personas en los que es necesario pensar cuidadosamente en la presencia de un SAHS porque tienen un mayor riesgo de sufrir accidentes ellos mismos o causarlos en otros. |
| 7 | Entre el 1-3% de los niños padece SAHS. La sintomatología es diferente a la de los adultos y hay que sospechar SAHS, especialmente, entre los 3 y 6 años, en niños roncadores (8-12% de los niños roncan habitualmente), con respiración ruidosa o esforzada (la respiración de un niño mientras duerme debe ser tranquila) y si hay apneas observadas por los padres. |
| 8 | En el seguimiento de los pacientes con SAHS, tanto los tratados como no tratados si la evolución no es satisfactoria por la reaparición de síntomas, la presencia de efectos secundarios derivados del tratamiento o la aparición de complicaciones asociadas, deberán ser enviados de nuevo a la UTS para su evaluación, diagnóstico y tratamiento si procede. |
Medidas higiénico dietéticas
| 1 | El factor de riesgo más importante para el SAHS es la obesidad. Deberá reducirse el peso (en personas con sobrepeso) o evitar su ganancia en sujetos normales. |
| 2 | Evitar el decúbito supino al dormir (la mayoría de los SAHS empeoran en decúbito supino) y, especialmente, cuando se cumple el criterio de SAHS posicional (IAH al menos el doble en decúbito supino que en el resto de posiciones). |
| 3 | Evitar el tabaco si se es fumador. El tabaco es un irritante de la vía aérea superior y se ha visto que, por sí mismo, favorece la aparición del ronquido y también aumenta las severidad del SAHS. |
| 4 | Evitar el alcohol, especialmente en horario vespertino (a partir de las 20 horas). El alcohol genera un sueño de mala calidad y, además, inhibe parcialmente la actividad de los músculos dilatadores de la faringe favoreciendo / agravando la aparición de ronquido y del SAHS. |
| 5 | Evitar el uso, salvo prescripción facultativa, de hipnóticos, especialmente benzodiacepinas, dado que se ha demostrado que aumentan la severidad y la duración de las apneas e hipopneas agravando un SAHS pre-existente. |
Medidas generales de sueño
| 1 | Procure dormir en posición lateral, evite dormir boca arriba. |
| 2 | Procure dormir el tiempo suficiente. Cada persona necesita un determinado número de horas para estar descansado, probablemente usted ya sabe cuantas necesita. |
| 3 | Conserve un horario de sueño regular, acostarse y levantarse a la misma hora. |
| 4 | Evite pasar mucho tiempo en la cama, con 8 horas suele ser suficiente. |
| 5 | No hacer cambios bruscos de horario los fines de semana, ni duerma menos horas de las necesarias, o más de lo habitual. |
| 6 | Vaya a la cama solo si tiene sueño, no a ver la TV o a leer. Evitar especialmente lecturas atractivas o excitantes que favorezcan la activación de su cerebro y dificulten la conciliación del sueño. |
| 7 | Procurar que el ambiente en el dormitorio sea confortable: evitar ruidos, estímulos luminosos o temperaturas extremas. |
| 8 | Evite las siestas largas. Es suficiente con 20 o 30 minutos. |
| 9 | Evite la ingesta nocturna de alcohol. El alcohol aunque favorece el inicio del sueño, posteriormente produce un sueño de mala calidad y poco eficaz para producir descanso. |
| 10 | Si tiene el mal hábito de fumar, piense en dejarlo, ¡ya es hora! Prohibido fumar en su habitación. |
| 11 | Evitar la ingesta de bebidas con cafeína sobre todo en horas previas a ir a la cama (café, té, refrescos de cola, etc.). |
| 12 | No cenar ni beber en exceso antes de dormir. |
| 13 | Evitar la toma de tranquilizantes. Las “pastillas” para dormir sólo deben utilizarse bajo prescripción médica y, salvo excepciones, rara vez están indicadas por más de 2-3 semanas. Si tiene insomnio (dificultad para iniciar o mantener el sueño) consúltelo a su médico pero no se medique por su cuenta. |
| 14 | Hacer ejercicio de forma regular sin cansarse en exceso, pero evite realizarlo al caer la tarde o al comienzo de la noche. Practicar sexo, aunque es una actividad física, genera la producción se sustancias favorecedoras del sueño por lo que es una actividad muy recomendable antes de dormir. |
Recomendables para todo paciente con SAHS y para la población en general.
La CPAP, es el tratamiento de elección en el SAHS grave y la evidencia científica es incuestionable (1, 39-42, 48, 67, 68) (Evidencia A). La CPAP fue descrita por primera por Collin Sullivan (67). Consiste en un compresor médico que trasmite una presión predeterminada a través de una mascarilla nasal adaptada a la cara del sujeto y fijada con un arnés (Figura 1). De esta forma se produce una auténtica “férula neumática” que trasmite la presión positiva a toda la vía aérea superior impidiendo su colapso durante el sueño.
La CPAP corrige las apneas obstructivas, las mixtas y, en algunos casos, las centrales. Elimina las hipopneas y suprime el ronquido. Evita las caídas de la SaO2 y los despertares electroencefalográficos (arousals) secundarios a los eventos respiratorios y normaliza la arquitectura del sueño (39-42). La CPAP produce remisión de los síntomas del SAHS, disminución y/o eliminación de la ESD medida por escalas clínicas y por test de latencia múltiple del dueño, recuperación de la capacidad de atención y otras variables cognitivas y mejora la calidad de vida (1). El tratamiento con CPAP disminuye el riesgo de accidentes de tráfico (1) y parece reducir las cifras de tensión arterial en un porcentaje relevante de sujetos hipertensos (6-9, 11-13, 14, 20). Múltiples estudios han sugerido el papel de la CPAP en la disminución de las consecuencias cardiovasculares del SAHS (10, 18, 33, 69, 70) y cerebrovasculares (15, 33, 69, 70) y en la reducción de la mortalidad (31-35).
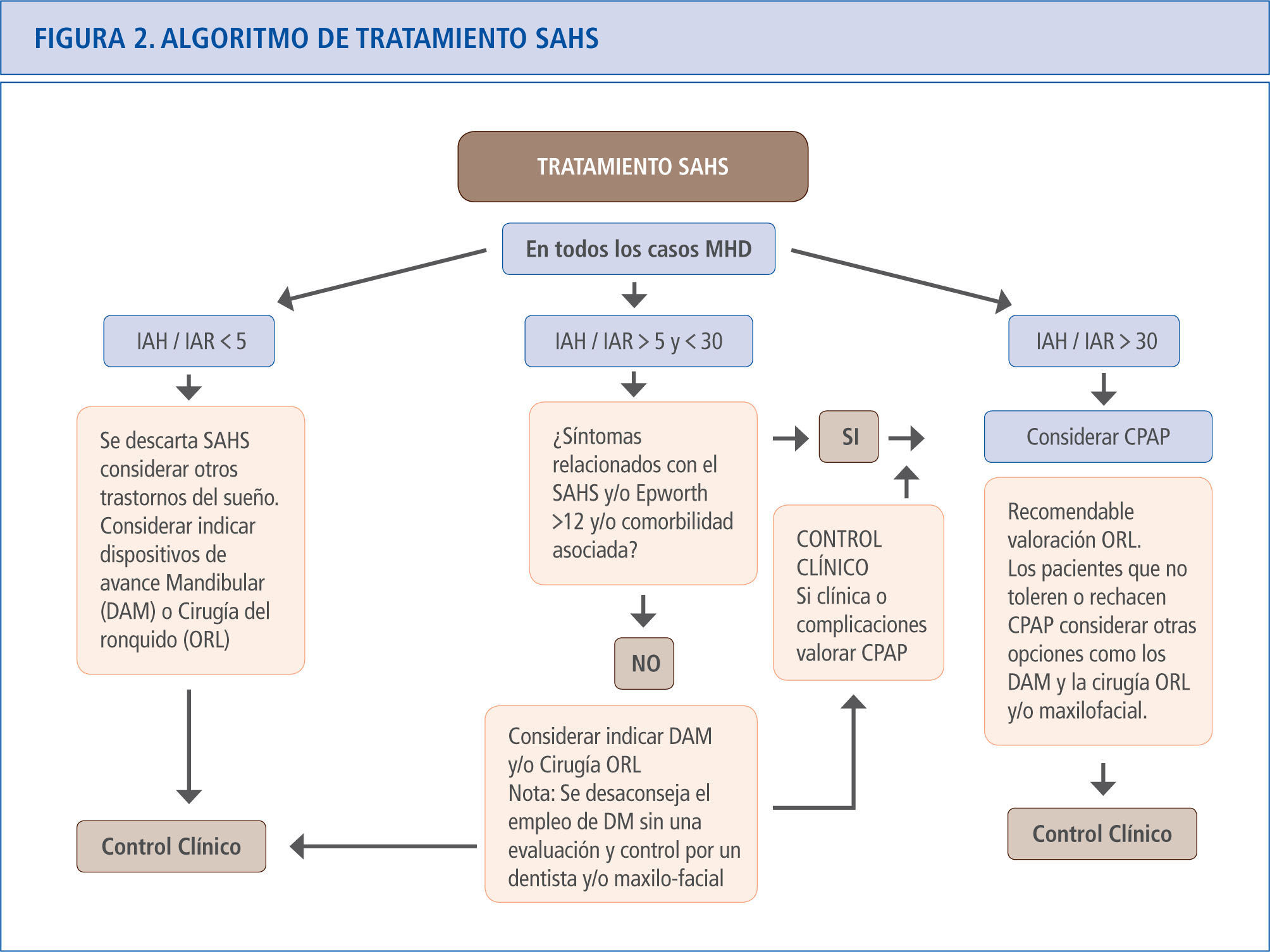
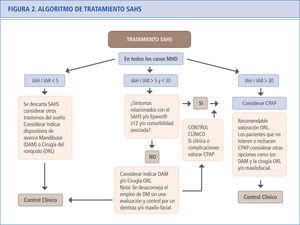
Las sociedades científicas han establecido las indicaciones para la prescripción de la CPAP (71). En 1998 la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) (72) estableció la indicación de CPAP para pacientes con un IAH > 30 y la existencia de síntomas relevantes, enfermedades cardiovasculares o cerebrovasculares graves y/o insuficiencia respiratoria. Este documento fue pionero y se adelantó en muchos años a las evidencias actuales que establecen el umbral de tratamiento en un IAH > 30. Sin embargo, a la luz de los datos que hoy se conocen, estas indicaciones pueden considerarse restrictivas (1). Actualmente, algunas normativas consideran que hay indicación de tratamiento con CPAP en algunos casos de SAHS leves-moderados (59, 73). De hecho, las recientes evidencias sobre mortalidad y SAHS sugieren que el tratamiento con CPAP debería considerarse ante todo paciente con un IAH elevado, independientemente de la presencia o no de síntomas. En la figura 2 se presenta el algoritmo de recomendación de tratamiento realizado por el Grupo Español de Sueño en 2005 (1) y actualizado en 2011 (48).
Algoritmo de tratamiento en el SAHS. Aunque la evidencia aún no es contundente. El Documento de consenso Nacional sobre el SAHS recomienda considerar la prescripción de CPAP en pacientes con IAH > 30, teniendo en cuenta las premisas del algoritmo (1,48).
MHD = Medidas Higiénico-Dietéticas.
IAH = Índice de apneas-hipopneas por hora de sueño.
IAR = Índice de alteración respiratoria (IAH + número de esfuerzos respiratorios asociados a microdespertares por hora de sueño).
DAM = Dispositivos de avance mandibular.
ORL = Otorrinolaringología.
No es operativo que haya que explicar el tratamiento con CPAP a cada paciente. Experiencias realizadas por nuestro grupo en 1998 y confirmadas posteriormente en otras unidades de sueño en España demuestran que la creación de Escuelas de CPAP, además de ser bien aceptadas por los pacientes resultan costo-efectivas (68). Se trata de citar al paciente y a su pareja en grupos de no más de 8-10 personas a cargo de una enfermera/fisioterapeuta entrenada y les explique en qué consiste la CPAP y cómo funciona. De esta manera, la instalación de la CPAP se lleva a cabo en el propio centro o unidad de sueño y se deja que el paciente “juegue” con el sistema, formule preguntas y se le solucione cualquier duda. Este sistema tiene ventajas de todo tipo:
- a)
El paciente comprueba que su enfermedad no es algo que “sólo le pase a él” y que hay “otros afectados”, lo que le transfiere tranquilidad paciente y acompañante.
- b)
En el proceso de enseñanza del sistema se interesa mucho más y, junto con su pareja, se obtiene un mayor compromiso lo que contribuye a una mejor formación de los pacientes y parejas (ambos tienen que convivir con la CPAP). Además, se fomenta la co-responsabilidad del paciente en su propia enfermedad y en el manejo y cuidado del equipo.
- c)
Se le deja un espacio y un tiempo para que el paciente pueda probar el sistema en un lugar seguro, como el hospital o el centro de asistencia o unidad de sueño.
- d)
Es coste-efectivo, dado que en unas 2 horas se puede completar la prescripción, instalación y formación de unos 5 pacientes con CPAP, mientras que si el proceso se lleva a cabo en cada domicilio, se necesitarían cerca de cuatro horas (teniendo en cuenta los desplazamientos). Por lo tanto este sistema es más eficiente tanto para la empresa adjudicataria como para los organismos contratantes suministradores de CPAP.
- e)
Facilita una mejor selección de los pacientes para la indicación de la titulación mediante auto-CPAP. Hoy día sabemos que la auto-CPAP permite titular adecuadamente la presión óptima en el 90% de los pacientes (1). Por lo tanto, es en la escuela de CPAP donde se puede hacer una selección adecuada, en colaboración con la Unidad de Sueño correspondiente, para detectar a los pacientes que se podrán titular con Auto-CPAP y establecer las prioridades.
En la ESCUELA DE CPAP se resolverán las siguientes cuestiones (68):
- a)
Información verbal y escrita a los pacientes sobre las instrucciones de manejo, seguridad e higiene, insistiendo en el método de limpieza periódico de los accesorios y se verificará que el paciente y/o familiares han comprendido dichas instrucciones.
- b)
El paciente y/o familiares dejarán constancia firmada de su conformidad con las instalaciones realizadas.
- c)
Se dejará al paciente tiempo suficiente para que pruebe el sistema e intercambie opiniones con el técnico sobre el funcionamiento, percepción de comodidad o incomodidad y posibles efectos secundarios así como la puesta en común de problemas y soluciones.
- d)
Se fijarán los parámetros de presión de CPAP indicados en la prescripción y se suministrará al paciente la mascarilla más adecuada a su anatomía facial y/o características, arnés u otros elementos necesarios poniéndose especial atención en la correcta fijación de todos los elementos (interfases, arnés y mascarilla), asegurándose la adecuada pro-tección de todos los elementos anatómicos faciales del paciente. Los accesorios nuevos se suministrarán en bolsa cerrada y precintada. Se comprobará el correcto funcionamiento del equipo y de los sistemas conexión con el paciente. En el momento de instalar la CPAP, se anotará en el albarán de entrega del aparato, el número de horas que el contador del mismo registre y se insistirá al paciente sobre la importancia del adecuado cumplimiento del tratamiento.
La CPAP sólo es efectiva mientras se utiliza, por ello obtener un adecuado cumplimiento es clave. En Europa, donde la CPAP está financiada por un sistema nacional de salud, con un buen control sobre los pacientes, el cumplimiento es superior al obtenido en publicaciones norteamericanas (1, 48, 74). De hecho, se puede afirmar que no existe ningún tratamiento crónico que con un perfil de incomodidad del tipo de la CPAP, arroje cumplimientos tan elevados, donde más del 70% de los pacientes la utiliza al menos 4 horas por noche (1, 48, 74). No hay forma precisa de establecer a priori que pacientes cumplirán adecuadamente el tratamiento. Las variables edad, sexo, nivel de instrucción, grado de hipersomnia, gravedad (definida por el IAH) desaturación nocturna o presión de CPAP, no son indicadores precisos de la predicción de un buen cumplimiento. Sin embargo, se ha comprobado que los pacientes que mejoran más con la CPAP y tienen un buen control de los efectos secundarios, son también quienes mejor cumplen el tratamiento (1, 48). Así mismo, también se ha visto que el índice de desaturaciones por hora podría ser una variable predictora del cumplimiento con CPAP (74). Una revisión sistemática de 17 estudios publicados sobre diferentes intervenciones conductuales para mejorar el cumplimiento concluyó que la intervención conductual mejoraba la adherencia al tratamiento de CPAP (75). Por lo tanto, resulta imprescindible que una vez indicado el tratamiento con CPAP se ofrezca al paciente un adecuado seguimiento que en el documento español de consenso se define como al primer mes, cada tres meses durante el primer año seguido de una periodicidad de cada seis meses los dos primeros años y luego continuar anualmente y cada 2-3 años, así como un sistema de atención inmediata de efectos secundarios y solución de problemas (1, 48).
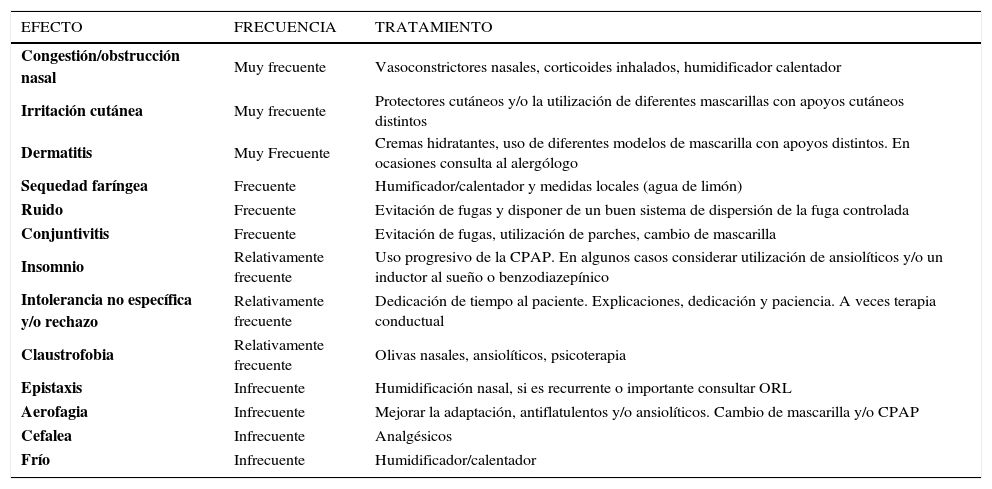
Efectos secundarios de la CPAPLa CPAP no tiene contraindicaciones absolutas, salvo la fractura de base del cráneo o un neumotórax activo (1, 48). Sin embargo, es un tratamiento incómodo sobre todo las primeras semanas. Cerca del 50% de los pacientes tienen algún efecto secundario, habitualmente en grado leve y de carácter transitorio en la fase inicial del tratamiento (1, 48, 76). Una parte considerable de los efectos secundarios se debe al uso inadecuado de la CPAP y de sus complementos por lo que es imprescindible dedicar tiempo a explicar a los pacientes qué es la CPAP, cómo funciona y cómo debe emplearse, así como qué cosas no son aconsejables. Este tiempo es fundamental para evitar y prevenir muchos de los efectos secundarios. Los efectos secundarios más frecuentes y sus consejos para su solución son los siguientes (1) (Tabla 8):
Efectos secundarios más frecuentes con cpap y su tratamiento
| EFECTO | FRECUENCIA | TRATAMIENTO |
|---|---|---|
| Congestión/obstrucción nasal | Muy frecuente | Vasoconstrictores nasales, corticoides inhalados, humidificador calentador |
| Irritación cutánea | Muy frecuente | Protectores cutáneos y/o la utilización de diferentes mascarillas con apoyos cutáneos distintos |
| Dermatitis | Muy Frecuente | Cremas hidratantes, uso de diferentes modelos de mascarilla con apoyos distintos. En ocasiones consulta al alergólogo |
| Sequedad faríngea | Frecuente | Humificador/calentador y medidas locales (agua de limón) |
| Ruido | Frecuente | Evitación de fugas y disponer de un buen sistema de dispersión de la fuga controlada |
| Conjuntivitis | Frecuente | Evitación de fugas, utilización de parches, cambio de mascarilla |
| Insomnio | Relativamente frecuente | Uso progresivo de la CPAP. En algunos casos considerar utilización de ansiolíticos y/o un inductor al sueño o benzodiazepínico |
| Intolerancia no específica y/o rechazo | Relativamente frecuente | Dedicación de tiempo al paciente. Explicaciones, dedicación y paciencia. A veces terapia conductual |
| Claustrofobia | Relativamente frecuente | Olivas nasales, ansiolíticos, psicoterapia |
| Epistaxis | Infrecuente | Humidificación nasal, si es recurrente o importante consultar ORL |
| Aerofagia | Infrecuente | Mejorar la adaptación, antiflatulentos y/o ansiolíticos. Cambio de mascarilla y/o CPAP |
| Cefalea | Infrecuente | Analgésicos |
| Frío | Infrecuente | Humidificador/calentador |
Son los más frecuentes y pueden aparecer con la CPAP o agravarse con ella y condicionar el cumplimiento. El tratamiento depende de la causa que la provoca. Se suele producir por edema e inflamación de la mucosa nasal y con frecuencia cede espontáneamente. Se trata con instilaciones locales o el empleo de corticoides en solución acuosa por vía nasal. El uso de vasoconstrictores nasales no debería utilizarse por más de 72 horas por el riesgo de producir una rinitis seca por lo que son preferibles los corticoides (1-2 instilaciones en cada coana 1-2 veces por día) o medidas locales.
La evaluación previa a la aplicación del tratamiento con CPAP por parte del ORL, puede prever su aparición y aplicar medidas que reduzcan su aparición e incrementen las tasas de cumplimiento. Los síntomas pueden producirse por un cuadro de rinitis aguda dentro de un cuadro catarral y el tratamiento de éste de forma sintomática puede conseguir su erradicación. Un problema mayor es la aparición de obstrucción nasal dentro de un cuadro de rinitis crónica, agravado o desencadenado por la aplicación de la CPAP. Una obstrucción nasal importante puede suponer una reducción significativa o incluso el abandono del tratamiento por lo que en esos casos podrían administrarse corticoides nasales durante largos periodos de tiempo si se considera necesario. Aunque no es infrecuente que la aplicación de la CPAP pueda conseguir una mejora en la obstrucción nasal preexistente, lo más común es lo contrario y que la propia presión de CPAP estimule la producción de vasodilatación y obstrucción nasal secundaria, especialmente, en las primeras semanas del tratamiento. La aplicación tópica de corticoides nasales puede resolver de forma muy satisfactoria una obstrucción nasal o la presencia rinorrea mucosa o acuosa. Sin embargo, es altamente recomendable que si el problema persiste estos pacientes sean remitidos al especialista en ORL para valorar su tratamiento. Debe descartarse, si no se hizo previamente, la presencia de dismorfias septales, poliposis nasales, rinitis crónica y otras patologías que requieran tratamientos más específicos. Es también importante esta evaluación en los casos que precisen tratamientos tópicos nasales con corticoides para resolver su problema ya que en determinados casos puede aparecer sequedad nasal secundaria a dicho tratamiento e incluso epistaxis que compliquen aún más el problema.
Debe tenerse en cuenta que si el paciente presenta una congestión nasal secundaria a un cuadro infeccioso de vías respiratorias altas, lo más probable es que no tolere la CPAP. Con la CPAP el paciente debe inspirar y espirar por vía nasal; si esto no es posible porque el paciente sufre una obstrucción nasal, lo intentará por la boca. Sin embargo, es muy frecuente que la propia presión de la CPAP empuje el paladar blando contra la base de lengua con lo que el paciente se verá impedido para hacer respiración bucal y tendrá que quitarse la CPAP para poder respirar. Por ello, en estos casos deberá administrarse tratamiento local y, en ocasiones, el paciente suspende el tratamiento durante el período de obstrucción nasal aguda. Desconocemos el efecto que puede tener en un paciente en tratamiento con CPAP la suspensión brusca de ésta. Todos los mecanismos compensadores que la presencia de un SAHS genera el organismo se desactivan una vez que se comienza el tratamiento con CPAP. Por lo tanto, la supresión brusca del tratamiento podría tener un efecto deletéreo que no somos capaces de precisar en el momento actual. También, en ocasiones es la propia estimulación de los mecanoreceptores por la CPAP lo que provoca congestión nasal aunque este suele ser un efecto transitorio y sobre todo en las primeras semanas.
Se deben evitar fugas de presión en la máscara y eventualmente el paciente puede usar una mentonera para evitar la abertura de la boca o una mascarilla oro-facial. También se pueden emplear, transitoriamente, vasoconstrictores nasales, antihistamínicos, solución salina, esteroides tópicos y bromuro de ipratropio en aerosol; otros pacientes requieren humidificador-calentador (el aire si no se calienta no se humidifica). Según la experiencia del Grupo Español de Sueño, en torno al 10% de los pacientes requieren la administración de CPAP a través de un humidificador-calentador (1, 48, 74).
Las personas con alteraciones nasales crónicas que impiden o dificultan un adecuado tratamiento con la CPAP deberán ser evaluadas por ORL y es una causa frecuente de indicación de cirugía nasal.
Irritación cutáneaSe produce en la zona de contacto con la mascarilla de CPAP. Con las modernas mascarillas es, en general, de escasa importancia y suele ceder con el tiempo al endurecerse la piel con el contacto progresivo con la mascarilla. En pieles sensibles se puede proteger con aditamentos como gasas, y otros protectores disponibles en el mercado. En este sentido el uso de los sistemas de prevención de las úlceras de decúbito puede ser aplicable a la CPAP. Así, sistemas como el “config” para proteger la zona de contacto y el empleo de geles con clorexidrina (dexidentR), pueden ser de utilidad. En caso de alergia puede requerir el cambio a otro tipo de mascarilla y medidas locales. Una opción alternativa para pieles sensibles es usar de manera secuencial dos o tres tipos de mascarillas que tengan apoyos en zonas diferentes. De esa manera se va rotando la zona de contacto con la piel y es más tolerable. En todo caso, con el paso del tiempo la piel se va adaptando. Sin embargo, en algunas ocasiones puede ser necesaria la consulta al dermatólogo y/o alergólogo.
Sequedad faríngeaSuele ceder espontáneamente. Con frecuencia suele ser una queja que tienen los pacientes con SAHS antes de ser tratados y es debida a la pérdida de agua del paladar blando como consecuencia de los ronquidos y las apneas. En estos casos, la sequedad desaparecerá con CPAP. Sin embargo, a veces es el propio flujo aéreo de la CPAP quien la provoca. Si persiste más allá de cuatro semanas es necesario ponerse en contacto con la empresa suministradora de CPAP para la instalación de un humidificador-calentador conectado a la CPAP. Aunque algunos estudios han evidenciado un mejor cumplimiento del tratamiento con CPAP cuando se emplea un humidificador-calentador (77), en general no es necesario salvo que el paciente tenga síntomas de sequedad, frío u obstrucción nasal. Algunas medidas locales como la ingestión de agua con limón estimulan, a través de la acidez, la salivación y podrían ser una medida útil en algunos casos para evitar y/o reducir la sequedad.
RuidoEspecialmente en las primeras semanas de tratamiento. En sentido estricto más que el ruido de la CPAP, los pacientes y acompañantes se quejan del cambio de tonalidad entre la inspiración y espiración que se produce a nivel de la mascarilla. No tiene un tratamiento especial y precisa de la adaptación por el paciente y acompañante. Los modernos equipos de CPAP son muy silenciosos y las actuales mascarillas, bien aisladas, no deberían producir un sonido molesto. Otro punto de ruido es la fuga controlada que genera, especialmente a presiones elevadas, uno sonido relevante que puede ser molesto para el paciente y/o compañero-a de cama. La fuga controlada, en algunos equipos es un simple orificio que genera ruido con armónicos muy altos y desagradables. Los actuales sistemas tienen la fuga dispersa bien con varios orificios, modulables en dirección, o mediante multiporo. Controlar el tipo y dirección de fuga es importante, no sólo para el paciente, sino también para su compañero-a de cama evitándole la llegada de “chorros” de aire sobre su rostro o espalda.
ConjuntivitisEn general se produce como consecuencia de la fuga de aire a través de la mascarilla que impacta sobre la conjuntiva produciendo cierto grado de irritación. Suele indicar que la mascarilla está mal ajustada. Desaparece con el adecuado ajuste de la mascarilla por parte del paciente. En las primeras semanas se podrían proteger los ojos con parches oculares de fabricación casera o el simple cierre de los mismos con esparadrapo de papel (al igual que hacen los anestesistas cuando anestesian a los pacientes). Si una mascarilla específica tiende a producir conjuntivitis esta debería cambiarse por otra con un mejor ajuste.
DermatitisLa instalación de una mascarilla que contacta con diferentes puntos de la cara está sujeta a la potencial aparición de fenómenos irritativos simple y dermatitis con o sin componente alérgico asociado. Aún a pesar de que los modernos sistemas son hipoalérgicos y utilizan componentes de silicona y/o látex de elevada calidad, es inevitable que en algunas personas haya fenómenos de dermatitis:
a)Irritaciones simplesEn general son leves y pasajeras y tienen que ver con la presión sobre la cara de la mascarilla o los arneses de sujeción. En estos casos no hay que hacer nada salvo esperar a que la piel de la zona se adapte al sistema y las irritaciones desaparezcan. Suele ser útil el empleo de cremas hidratantes y un adecuado cuidado de la piel de la cara.
b)DermatitisEn ocasiones por mecanismos no esencialmente alérgicos, condiciona una dermatitis en el paciente. En esos casos recomendamos, además de las medidas especificadas en “a”, el empleo de dos mascarillas con diferentes puntos de apoyo cutáneo para darle tiempo a que la piel se recupere. En ocasiones puede ser necesario el tratamiento tópico, a veces con corticoides o la consulta a dermatología.
c)Dermatitis por alergia al látex, silicona y otros componentesSi se sospecha esta situación, además de las acciones recomendadas en los apartados “a” y “b” siempre se deberá consultar a dermatología y/o alergología y seguir sus indicaciones.
CefaleaNo es frecuente. Su origen no está claro y, en general, suele desaparecer con el tiempo. De hecho, la cefalea ocurre a veces en pacientes con SAHS sin tratar y desparece con el tratamiento con CPAP. Si el dolor es importante pueden pautarse analgésicos tipo paracetamol antes de acostarse durante los primeros días de tratamiento.
EpistaxisAunque no es muy frecuente, su aparición puede ser muy condicionante y, en determinadas circunstancias, dificultar la entorpecer la aplicación de CPAP. La mayoría de las veces se origina en la parte anterior de las fosas nasales y su causa más frecuente es la sequedad nasal. El mejor tratamiento es evitar su aparición, por ello es muy recomendable mantener un ambiente adecuado de humidificación de la mucosa nasal. Puede conseguirse mediante un incremento en la ingesta de líquidos, la instilación nasal cuidadosa de suero fisiológico o agua marina, humidificadores ambientales o directos en la CPAP y evitando calefacciones que resequen el ambiente. Puede ser muy útil la aplicación de pomadas nasales en los casos de sequedad nasal. La epistaxis puede ser un problema previsible gracias a la evaluación del ORL previa a la aplicación de CPAP, ya que, por ejemplo. determinadas alteraciones de las fosas nasales y tabique, como por ejemplo una dismorfia del mismo puede ser favorecedores de su aparición cuando se aplique la presión positiva.
En los casos de epistaxis suficientemente importante por cantidad o frecuencia, es necesaria la evaluación por el especialista ORL. El especialista realizará el tratamiento más adecuado que consiga anular la epistaxis y reducir al máximo los períodos de imposibilidad de aplicar el tratamiento con CPAP. Con relativa frecuencia se requiere la cauterización de un pequeño vaso. De no hacerlo ésta puede recidivar y llegar a ser una epistaxis importante.
FríoImportante en zonas frías y en casas sin calefacción donde el aire de la CPAP en invierno puede entrar en la vía aérea superior a 15ºC o menos (la temperatura de sueño recomendable está en torno a los 18-19º C). La solución es aumentar la temperatura de la habitación y/o usar un humidificador-calentador. Como medida “casera” se puede añadir un tubo corrugado al tubo de la CPAP (2 metros) y hacerlo pasar por el interior de la ropa de cama para que actúe a modo de calentador del aire antes de llegar a la vía aérea superior.
InsomnioEn general se produce en algunos pacientes durante la fase de adaptación. En esos casos se recomienda introducir la CPAP de forma progresiva y favorecer la adaptación. No es imprescindible que el paciente cumpla todas las horas de la noche nada más empezar el tratamiento. Se puede explicar al paciente que vaya aumentando de forma progresiva el número de horas de uso. De todas formas, en pacientes especialmente ansiosos o que se preocupen mucho por el uso de la CPAP se considera aceptable usar, durante unos días, un ansiolítico o un hipnótico no benzodiacepínico como el zolpiden.
AerofagiaEs poco frecuente, pero muy molesta. Se produce por la deglución de aire por el paciente al no estar bien adaptado. En general se reduce con la adaptación del paciente y la desaparición de la ansiedad. Sin embargo, en algunos pacientes persiste generando meteorismo y molestias digestivas que producen insomnio. En esos casos se puede utilizar medicación antiflatulencia, pero no suele ser muy eficaz. También se pueden utilizar ansiolíticos e incluso que el paciente duerma con la cama levantada, para reducir la deglución aérea. Sin embargo, a veces la única solución es cambiar el tipo de CPAP o mascarilla.
Otros síntomasLa CPAP puede provocar claustrofobia y favorecer la aparición de insomnio o ansiedad. En ocasiones el paciente percibe la espiración como laboriosa con incomodidad torácica. En estos casos se podrán utilizar algunos sistemas del mercado que reducen la presión en el momento de la espiración, recuperándola después y/o ansiolíticos. También pueden ser útiles las modernas olivas nasales que son muy poco invasivas sobre la cara del paciente dejando mucho espacio anatómico libre. En algunas ocasiones es útil la psicoterapia.
Intolerancia no específica y rechazoAlgunos pacientes refieren una intolerancia inespecífica al tratamiento con CPAP. No son capaces de dar un síntoma concreto sino más bien una sensación de incomodidad general que les hace percibir la CPAP como muy molesta. Suele ser una mezcla de incomodidad, aire, ruido, irritación, etc., en diversos grados. La pauta con estos pacientes es ser progresivo con el tratamiento y tener paciencia. Reforzar el cumplimiento y hacer que se vayan adaptando de forma progresiva al sistema. También hay que tener en cuenta la diferencia entre rechazo e intolerancia. Arbitrariamente podemos definir como rechazo cuando el paciente rehúsa el tratamiento sin utilizarlo o, no lo tolera dentro del primer mes de indicación. Intolerancia es un paciente que tras utilizarlo más de un mes, continúa con problemas del tipo que sean que le impiden el empleo de CPAP.
Ocasionalmente se han descrito casos aislados de barotrauma y ruptura timpánica en relación a la CPAP. También se ha visto ocasionalmente enfisema subcutáneo, neumomediastino, por lo que debe tenerse especial cuidado en pacientes con antecedentes de neumotórax. Finalmente, y de manera excepcional, se ha descrito algún caso de neumoencéfalo. Por ello deberá prestarse mucha atención en casos con antecedente de trauma facial o craneal recientes, especialmente si ha habido antecedentes de fractura de la base del cráneo. El manejo adecuado de los efectos secundarios es imprescindible y en su mayor parte, basta un buen seguimiento por parte del médico/enfermera especializada con la utilización de medidas locales. Sólo ocasionalmente será necesaria medicación o la consulta a otros especialistas.
También hay algunos aspectos relevantes que deberemos tener en cuenta y que tiene influencia clara en los efectos secundarios:
RampasLa mayoría de los equipos de CPAP disponen de ella y es un sistema mediante el cual el usuario regula el tiempo, hasta un máximo de 30 minutos, durante el cual el equipo se mantendrá a una presión mínima de 4cm de H2O (evitando el re-breathing) sin alcanzar la presión prefijada. Su objetivo es aumentar la adaptabilidad del paciente a la CPAP y permitir que se acomode antes de quedarse dormido. A partir del tiempo máximo de 30 minutos, la CPAP aumentará progresivamente su presión hasta alcanzar el nivel óptimo prefijado a partir de la cual no se producen eventos respiratorios obstructivos. La rampa, por tanto, es en alguna medida un retraso en el tiempo hasta alcanzar la presión eficaz. Su utilización en ocasiones en vez de facilitar disminuye el cumplimiento dado que muchos pacientes con SAHS severos tienen latencias de sueño muy cortas y una rampa larga les va a someter a sufrir apneas durante todo ese tiempo y, además, no suele ser útil en pacientes bien adaptados. Por tanto, y sobre todo en pacientes graves, no es recomendable el empleo de rampas fijas superiores a 10 minutos. Lo ideal sería que pasado un periodo corto de adaptación los pacientes no utilizaran la rampa. Es aconsejable, especialmente en los pacientes graves, rampas inferiores a 5 minutos. Lo óptimo sería calcular la rampa en función del tiempo de latencia al sueño.
AncianosUn tema importante, sobre el que hay mucha menos experiencia, es el referente a qué ocurrirá con la CPAP después de ser usada durante 20-30 o más años. La experiencia con CPAP se limita, para las unidades de sueño más antiguas, a unos 20-30 años. Este tiempo, aunque relevante, no es suficiente a la hora de evaluar los efectos secundarios de un tratamiento a largo plazo. La vía aérea superior fue diseñada para estar sometida a presión negativa y la CPAP cambia ese principio fisiopatológico introduciendo presión positiva. Desconocemos los efectos a muy largo plazo que esto pueda causar y si habrá una potencial influencia en producir alteraciones en los senos nasales y paranasales que pudieran causar fenómenos de sinusitis crónica o facilitar la aparición de fenómenos inflamatorios o, incluso, tumorales. Por otra parte, la presión de la mascarilla sobre la cara y la zona periodontal podría tener alguna influencia en generar problemas dentales. También desconocemos que debemos hacer con la CPAP ante un paciente que lleva usándola muchos años y se ha vuelto anciano (más de 75-80 años). ¿Deberá modificarse la presión de CPAP? ¿Habrá que suspender ésta? No tenemos una respuesta adecuada, pero las experiencias empíricas sugieren que mientras el paciente tolere y acepte deberá seguir con el tratamiento con CPAP pero debemos tener en cuenta que a partir de los 80 años todo debe ser relativizado con estos pacientes y su tratamiento individualizado. En todo caso, los estudios realizados por el Grupo Español de Sueño sugieren que los ancianos también están sometidos a riesgos similares a las edades medias (78-80) y que, por tanto, la edad, considerada aisladamente, no debería ser un criterio para no prescribir el tratamiento con CPAP.
Como conclusión, el manejo adecuado de los efectos secundarios es imprescindible y con una buena relación médico-paciente y medidas locales se solucionan en su gran mayoría. Sin embargo, la CPAP es un tratamiento que tiene sus problemas. Unos son bien conocidos y fácilmente solventables. Sin embargo desconocemos los efectos reales de la CPAP a largo plazo. Por ello, la indicación siempre debe ser precisa.
Titulación de la CPAPAunque se considera que la titulación de la CPAP mediante PSG es el estándar de oro (1, 48, 78, 81) la PSG, como ocurre con el diagnóstico, resulta ser un estándar de oro problemático. No está al alcance de todos los centros y no permite una accesibilidad razonable por su laboriosidad y coste.
Actualmente está demostrado que se puede titular la CPAP con equipos autoajustables en el domicilio del paciente con auto-CPAP (Automatic Positive Airway Pressure –APAP-) (82-88). Aunque existen varios sistemas, los más aceptados son los que modifican la presión en función de la medición de la onda de flujo inspiratorio. La hipótesis inicial fue que la presión de CPAP fija, obtenida por ajuste convencional, no representa las necesidades reales del sujeto a lo largo de la noche, todas las noches y en todas las posiciones al dormir. Incluso, algunos trabajos han demostrado que la presión de CPAP requerida, se reduce a lo largo del tiempo de tal forma que a los tres meses de haber iniciado el tratamiento con CPAP, la presión necesaria se reduce en torno a 1,5-2 cm. menos que la prescrita por PSG convencional al inicio del tratamiento (89, 90). Estos sistemas proporcionan una presión individualizada, dentro de ciertos márgenes, que se adapta a las necesidades del sujeto con la finalidad de suprimir los eventos respiratorios. Las auto-CPAP disponen en su interior de un neumotacógrafo y un transductor de presión que permiten registrar la presión, flujo, volumen y fugas del sistema. Además, tienen una capacidad de memorización de hasta 500 noches para comparación, evaluación y control.
En general, se considera que se puede titular adecuadamente con auto-CPAP en torno al 90% de los pacientes con SAHS (1, 82) y estudios recientes confirman la utilidad de las auto-CPAP en la titulación de la presión de CPAP (88). Sin embargo, aquellos pacientes que no obtengan una titulación adecuada con auto-CPAP o cuando está no esté indicada precisarán la titulación con PSG siguiendo las recomendaciones establecidas (81). En la Tabla 9 se describe un resumen de las recomendaciones para realizar la titulación con CPAP mediante PSG.
Recomendaciones para la titulación de la cpap mediante la PSG
| 1 | El paciente se le habrá entrenado previamente en la utilización de los equipos de CPAP y mascarillas (escuela de CPAP) |
| 2 | Antes de empezar la titulación configurar el montaje con las entradas de flujo, presión y fuga del dispositivo. Si es posible, incluir un registro de muestra (1 minuto) de presión nasal sin la mascarilla para verificar la señal de presión nasal. Indicar las entradas de presión de las calibraciones y las entradas de tasas de fuga utilizadas |
| 3 | Es importante comprobar la existencia de fuga a altas presiones y asegurar un correcto control de estas. Aplicar la presión positiva del dispositivo y mientras se observa en el registro de PSG las señales de presión, fuga y flujo, hacer mover la cabeza del paciente de lado a lado y comprobar la fuga a altas presiones para asegurar un correcto control de las mismas |
| 4 | Debe tenerse en cuenta que las reglas de titulación se basan en diferentes niveles de evidencia y la respuesta individual a los distintos niveles de presión |
| 5 | Se recomienda comenzar con una presión inicial de 4 cm. de agua y se espera que aparezcan eventos claros y que el enfermo esté durmiendo de un modo estable. Se incrementa la presión por tramos de al menos 1 cm de agua en periodos de tiempo iguales o mayores a 5 minutos, hasta que desaparezcan durante ese periodo los eventos respiratorios < 2 apneas obstructivas; < 2 hipopneas; < 5 Esfuerzos respiratorios asociados con microdespertares (ERAM), ó 5 minutos de ronquido |
| 6 | Cuando aparecen elementos más sutiles como hipopneas leves o periodos prolongados de limitación al flujo leves es importante saber “confirmar” los eventos y esperar unos 15-20 minutos antes de subir la presión de CPAP |
| 7 | Se recomienda mantener durante periodos largos una misma presión (mínimo 30 minutos) e ir retocando con incrementos de presión si hace eventos. Es aconsejable obtener al menos 15 minutos de REM en supino sin presentar eventos |
| 8 | Aunque es opcional, es aconsejable, por el fenómeno de la “histéresis” de la VAS, intentar reducir la presión una vez conseguida la ausencia de eventos pudiendo disminuirse las presiones centímetro a centímetro en periodos de 10 minutos, hasta estabilizar de nuevo la presión. En general, el nivel de presión con el que la limitación de flujo desaparece suele ser 2-5 cm. de agua mayor que el nivel en el cual reaparece durante la bajada de presión. Se debe realizar cuando haya trascurrido al menos 30 minutos sin eventos respiratorios obstructivos |
| 9 | Las fugas importantes que no se auto-resuelven en unos minutos o que despiertan al paciente obligan a entrar en la habitación y ajustar la mascarilla |
| 10 | Las desaturaciones-resaturaciones no acompañadas de eventos respiratorios, no deben de ser tomadas en cuenta a la hora de tomar la decisión de variar la presión |
| 11 | Si durante la titulación el paciente se despierta y se queja de que la presión es demasiado alta, se deberá volver a una presión más baja, eligiendo aquella en la que el paciente se sienta cómodo y que le permita volver a dormirse |
| 12 | La conducta a seguir si aparecen apneas centrales no está definida y la actitud es un intentarlo mediante “prueba-error trial”. Probablemente lo recomendable es seguir incrementado la presión y valorar si desaparecen los eventos centrales sino lo mejor es volver a la presión que se tenía antes de las apneas centrales mantenerla 1-2 h y de un modo lento cada 30-40 minutos intentar incrementar la presión si existen eventos obstructivos. En caso de duda es mejor dejar la presión inicial antes de las apneas centrales durante toda la noche |
A pesar de los buenos resultados de las auto-CPAP para realizar el ajuste de la presión de CPAP óptima, éstos sistemas tienen algunas limitaciones. Así, su empleo no es recomendable, al menos por ahora, en pacientes con comorbilidad importante (enfermedades neurológicas, cardiacas, respiratorias, etc.). Debe tenerse en cuenta que las auto-CPAP responden fundamentalmente a la limitación al flujo y al ronquido. En pacientes con co-morbilidad severa puede haber episodios de hipoventilación, apneas centrales y otros hallazgos de solapamiento que podrían condicionar una respuesta de la auto-CPAP no totalmente predecible. Por lo tanto en esos casos es mejor realizar el ajuste con PSG. De la misma manera, pacientes con problemas nasales o intolerancia flagrante al equipo de auto-CPAP, deberían ser ajustados con PSG. Lo mismo sucede en aquellos casos en que tras varios intentos de ajuste con auto-CPAP, esta no haya podido llevarse a cabo de una manera adecuada por fugas o imposibilidad de lectura adecuada de la gráfica de presión.
Situaciones especialesAuto-CPAPHemos visto que las auto-CPAP son útiles para la titulación de la presión de CPAP necesaria en la mayoría de los pacientes con SAHS. Sin embargo, aún a pesar de su base teórica y fisiopatológica, no se ha demostrado con claridad su indicación como tratamiento a largo plazo para los pacientes (1). Por otra parte su mayor inconveniente radica en que, por ahora, tienen un precio más elevado que la CPAP convencional, sin ser claramente superiores al tratamiento con presión fija. Estos equipos deberían ser capaces de demostrar que los pacientes que los emplean a medio-largo plazo, cumplen mejor el tratamiento, con menores efectos secundarios, son preferidos por los pacientes y son coste-efectivos. Sin embargo, los estudios llevados a cabo muestran que, comparadas con la presión fija, tienen un efecto similar con escasas ventajas marginales para las auto-CPAP (88, 91).
Una potencial indicación de las auto-CPAP como tratamiento son los pacientes que presentan efectos secundarios con la CPAP a presión fija que no han podido ser corregidos (1). En estos pacientes, parece justificado ensayar el empleo de las auto-CPAP. Por otra parte, también existirían algunas indicaciones potenciales en relación con los pacientes que están en programas de pérdida de peso efectivos como es la cirugía bariátrica y también en los niños en fase de crecimiento. De esta forma podrían evitarse la realización de titulaciones periódicas que, en todo caso, serían continuas con el uso de las modernas auto-CPAP. Sin embargo, y hasta no disponer de criterios más claros, la utilización de las auto-CPAP debe ser individualizada, indicada por los especialistas y con un seguimiento controlado.
Bi-PAPEn la década de los noventa se sugirió que, en algunos pacientes que requerían presiones de CPAP especialmente altas, se podría alcanzar una mejor tolerancia con el empleo de sistemas de bipresión (92). Estos sistemas alcanzarían la presión necesaria para suprimir los eventos respiratorios en inspiración (presión inspiratoria), que es donde habitualmente ocurren las apneas e hipopneas, y esta presión se reduciría durante la espiración (presión espiratoria), en la que, por lo general, no hay eventos respiratorios. Sin embargo, en estudios posteriores no se consiguió demostrar que el empleo de sistemas de bipresión condicionara un mejor cumplimiento o tolerancia por parte de los pacientes (93, 94). Hoy día, los sistemas de bipresión, salvo excepciones, desempeñan un papel muy importante en la ventilación mecánica no invasiva, pero prácticamente han desaparecido como indicación en el SAHS. No obstante, en pacientes con síndrome de hipoventilación asociado en quienes está indicado el tratamiento con ventilación mecánica no invasiva, el tratamiento con bipresión que pueda asegurar una presión de soporte adecuada o con diferentes modalidades de ventilación podrían ser útiles y sustituir a la CPAP. Para la titulación de la presión con los sistemas de bi-presión recomendamos consultar las guías especializadas al respecto (81).
De manera complementaria algunos equipos modernos de CPAP disponen de un mecanismos de reducción automática de la presión de CPAP al inicio de la espiración con objeto de generar un confort espiratorio que pueda facilitar el cumplimiento del tratamiento. Algunos estudios sugieren que podría ser beneficioso su utilización en determinados casos (95).
ServoventilaciónSe estima que, aproximadamente, el 50% de los pacientes con fallo cardíaco tienen apneas durante el sueño, tanto obstructivas como centrales (96-98). Por otra parte, se ha observado que la presencia de apneas en pacientes con falla cardiaca aumenta la mortalidad, independientemente de otros factores de riesgo (99-101). Algunos estudios han sugerido que el tratamiento con CPAP podría mejorar algunas variables clínicas de los pacientes con fallo cardíaco y SAHS (102-104). Las apneas centrales del sueño son causadas por reducciones del impulso ventilatorio central durante el sueño producidas cuando la PaCO2 baja por debajo del umbral apneico. La repetición cíclica de apneas centrales genera el síndrome de apnea-hipopnea central del sueño (SAHCS). El SAHCS se observa en pacientes con falla cardíaca debido a una tendencia a la hiperventilación que conduce al descenso rápido de la PaCO2 alcanzando niveles por debajo del umbral de la apnea (105, 106). El hallazgo más importante del SAHCS en estos pacientes es su asociación independiente con un aumento de la mortalidad (102-104, 107). El estudio CANPAP (108) encontró que los pacientes con SAHCS y falla cardíaca en tratamiento con CPAP durante 2 años mejoró la oxigenación nocturna, la fracción de eyección y la prueba de la marcha de 6 minutos y bajó los niveles de norepinefrina, pero no afectó la supervivencia (108). Sin embargo, un estudio post hoc de este mismo grupo mostró que en grupo de pacientes tratados con CPAP en quienes se redujo el IAH por debajo de 15 y sin SAHCS la supervivencia aumentó significativamente en comparación con el grupo que continuó con SAHCS (109).
A partir del año 2001 comenzaron a desarrollarse sistemas, denominados servoventiladores (Adaptative Servo Ventilator –ASV-), que son capaces, mediante un algoritmo de regulación automática, suprimir eficazmente tanto las apneas obstructivas como las apneas centrales (110-112). El ASV proporciona presión espiratoria positiva de fondo (EPAP) para reducir las apneas obstructivas y, cuando es necesario, genera presión inspiratoria positiva de las vías respiratorias (IPAP) para eliminar las apneas centrales (Figura 3A y 3B). Se ha observado en pacientes con falla cardíaca que la apnea del sueño se puede convertir de central a obstructiva, o viceversa, durante el curso de una noche (112) o a lo largo de varias semanas o varios meses (113). Por lo tanto, el ASV tiene ventajas significativas sobre la CPAP por su capacidad de eliminar ambos trastornos en el mismo paciente. Aunque el ASV está aún en fase experimental hay en marcha actualmente dos grandes proyectos internaciones en el que participan países de todo el mundo para comprobar su eficacia. Los primeros datos sugieren unos resultados muy prometedores en pacientes con fallo cardíaco y SAHS, con o sin componente de SAHC añadido (114, 115). Por otra parte, es posible que otros pacientes que sufren SAHCS generado por mecanismos diferentes del fallo cardíaco, como pueda ser aquellas originadas en el contexto de enfermedades neurológicas o de causa idiopática también puedan beneficiarse del tratamiento con ASV (116, 117). Incluso, en el caso del llamado SAHS “complex” definido como un SAHCS que aparece, característicamente, después de haber iniciado el tratamiento con CPAP en un SAHS de origen obstructivo, también podría verse beneficiado del tratamiento con ASV (118).
La CPAP es un tratamiento altamente eficaz en el SAHS grave que previene sus complicaciones. El SAHS se muestra como una enfermedad sistémica y no sólo circunscrita a la vía aérea superior. Recientemente se ha visto que estas consecuencias van más allá de la esfera cardiovascular y se ha relacionado el SAHS con otras patologías como el cáncer (119, 120) y aún aparecerán otras muchas en el futuro. Desde el inicio del tratamiento con CPAP se ha venido diciendo que este tratamiento sería “transitorio” y que, lo mismo que ocurrió con el neumotórax terapéutico en los inicios de la tuberculosis, la CPAP sería superada por otros tratamientos. Sin embargo, la realidad es que la CPAP es hoy día un tratamiento seguido por decenas de millones de pacientes en todo el mundo y el sistema se ha ido sofisticando para hacer más fácil y cómodo tanto su utilización como la información sobre el mismo que reciben los especialistas del sueño. Un estudio llevado a cabo por nuestro grupo hace ya algunos años (48) evidenció que en el año 2004 había en España 110.000 CPAP que equivalía a unas 269 CPAP por 100.000 habitantes, cuando las cifras aconsejables para tratar los SAHS graves (IAH > 30), teniendo en cuenta la prevalencia en todos los sectores de población en España, eran de 1483 CPAP por 100.000 habitantes. Actualmente con más de 350.000 CPAP prescritas en España las cifras alcanzan unas 754 CPAP por 100.000 habitantes por lo que, aunque los datos han mejorado espectacularmente, aún estamos al 51% del objetivo propuesto de tratar a todos los pacientes con SAHS grave. Es esencial que seamos capaces de desarrollar indicadores que nos permitan saber qué pacientes cumplirán adecuadamente la CPAP y quiénes tendrán problemas con objeto de asegurar el máximo cumplimiento de este eficaz tratamiento (121, 122).
Por lo tanto, aunque es probable que otros tratamientos puedan convertirse en alternativas y, desde luego, en complemento de la CPAP, es muy posible que los pacientes más graves continúen precisando tratamiento con CPAP por muchos años. Para asegurar un adecuado control y tratamiento de estos pacientes hay cuatro aspectos que son imprescindibles para conseguir tratar a la mayoría de los pacientes graves:
Facilitar el diagnósticoDebemos favorecer la accesibilidad diagnóstica con técnicas sencillas, rápidas y de bajo coste (57). Esto nos permitiría identificar a los pacientes más graves y asegurar un tratamiento precoz. Los pacientes con SAHS severo no precisan una gran complejidad diagnóstica y, el Grupo Español de Sueño ha demostrado que esto es factible (47-56). Por otra parte, es muy posible que el diagnóstico de los casos más severos pudiera hacerse con estudios muy simplificados (2-5 canales de información). Por lo tanto, idealmente, precisaríamos de un “sistema experto para ser aplicado por personal no experto” simple y barato que permitiera identificar de forma automatizada aquellos sujetos con SAHS severo y, aquellos otros, sin SAHS o en grado leve. Esta aproximación debería poder ser abordada por los médicos de asistencia primaria. En los últimos años el Grupo Español de Sueño puso en marcha algunos estudios para validar los equipos supersimplificados en el diagnóstico del SAHS y los resultados han sido muy favorables, estando actualmente pendientes de publicación (comunicación personal). La utilización de estos equipos no sólo abaratará los costes de los estudios de sueño, sino que favorecerá enormemente la accesibilidad diagnóstica a grandes masas de población para las que ahora no es posible.
Tratamientos complementarios y alternativosLa utilización de los otros tratamientos como los dispositivos de avance mandibular (DAM) han resultado eficaces (123). Los DAM están indicados en los SAHS leves-moderados, en la roncopatía y en los pacientes con SAHS grave que no toleran o rechazan la CPAP. Sin embargo otras indicaciones son, teóricamente, posibles como su utilización combinada con la CPAP para reducir la presión de requerida y hacer más tolerable la CPAP e, incluso, tratamientos secuenciales donde el paciente usa la CPAP, digamos, de lunes a jueves y durante el fin de semana emplea el DAM o bien durante viajes y estancias cortas. Estas aplicaciones de los DAM aún están bajo estudio pero podrían constituirse en una buena alternativa y/o complemento de los SAHS. La cirugía no ha sido capaz de mostrarse como una alternativa y las evidencias de su eficacia son insuficientes (124). De manera complementaria hay en marcha estudios que tratan de utilizar dispositivos anti-decúbito supino con moderada eficacia para los SAHS postural con resultados prometedores y fácil aplicabilidad (125). Por otra parte, aún no disponemos de un tratamiento farmacológico para el SAHS y todos los ensayos clínicos realizados hasta el momento no permiten ser concluyentes (126). La posibilidad de investigar sobre fármacos estimulantes selectivos de las motoneuronas que regulan el tono de la vía aérea superior está abierta a la investigación. Así mismo, algunos grupos han investigado sobre la posibilidad de tratamiento rehabilitador de la VAS en el SAHS (127) pero los datos son aún muy preliminares y no permiten ser concluyentes. También, en los últimos años, diferentes grupos están investigando el efecto de la activación de la musculatura dilatadora de la VAS mediante estímulo nervioso como tratamiento del SAHS que podrían arrojar resultados interesantes en los próximos años (128-130). Por lo tanto, son muchos los caminos que se están abriendo con una gran esperanza de futuro. Sin embargo, todos ellos deberán ser complementados con medidas generales, que son siempre beneficiosas, como una adecuada higiene de sueño y una pérdida de peso en los pacientes obesos.
Médicos de atención primaria (MAP)El control del tratamiento y el seguimiento de los pacientes con CPAP no puede articularse, exclusivamente, a través de las unidades de trastornos del sueño (UTS) y sus especialistas. Es imprescindible que los MAP formen parte de ese proceso. No es posible el control de una enfermedad tan prevalente como el SAHS, sin la participación de todos los niveles asistenciales. Sin embargo, en el momento actual la MAP ha recibido escasa o nula formación sobre los trastornos del sueño en general y el SAHS en particular y lo mismo podemos afirmar sobre el personal de enfermería. Por ello su incorporación al sistema deberá basarse en tres pilares fundamentales: la formación, la coordinación y la utilización de las nuevas tecnologías (TV, internet, telemedicina, etc.). El papel del MAP en este proceso es fundamental por varias razones:
- a)
El MAP, como responsable directo del paciente, está en una situación óptima de accesibilidad y visibilidad para conocer y recibir información sobre su paciente e interactuar con el de manera directa.
- b)
La actual y progresiva informatización de las consultas, así como la historia clínica electrónica permitirá al MAP tener una información directa y de primera mano sobre toda la información referente al paciente con SAHS reseñada por la UTS (cumplimiento del tratamiento, seguimiento y control) así como la utilización de herramientas de telemedicina (telesueño) tanto para comunicarse con los profesionales y con sus pacientes.
- c)
Existe un creciente interés de incorporar al personal de enfermería, a través de consultas especializadas, en el proceso de los pacientes de manera que puedan participar en la estrategia del abordaje del paciente crónico generando una atención médica costo-efectiva y sostenible.
Una vez prescrito el tratamiento, la empresa suministradora, en colaboración con la UTS, instala el equipo y adiestra al paciente y sus familiares sobre su funcionamiento y manejo (Escuelas de CPAP). Así mismo, crea una ficha de seguimiento clínico que implica la recogida de datos sobre el cumplimiento medio de horas de uso de CPAP en los diferentes controles, incidencias, efectos secundarios, etc.
Las UTS, MAP y empresas suministradoras han tenido muy poco contacto entre ellos: La UTS diagnóstica, prescribe y sigue a los pacientes con CPAP, la empresa suministradora instala la CPAP y participa en el seguimiento y el MAP, habitualmente, está excluido y apenas ha participado en la derivación del paciente a la UTS. Por otra parte, aunque el paciente está en el centro del proceso, la relación entre las partes es muy mejorable. Es obvio que estos estamentos, junto a las autoridades sanitarias, debemos trabajar juntos y de forma coordinada. Esto favorece sinergias, evita consultas repetidas y descoordinaciones en los tratamientos y facilita una mejor atención del paciente y evitación de efectos secundarios y complicaciones. Actualmente se está generalizando el conocimiento del SAHS por la comunidad que reclama su derecho a ser atendida con rapidez, obtener un diagnóstico preciso y recibir un tratamiento y control adecuado. Esto sólo será posible con la formación, la coordinación y la colaboración entre todas las partes implicadas.
Los autores declaran no tener conflictos de interés, con relación a este artículo.