La apnea obstructiva del sueño (AOS) es una enfermedad frecuente que produce síntomas diurnos, deterioro en la calidad de vida, mayor riesgo de morbi-mortalidad cardio y cerebrovascular, deterioro neuro cognitivo y mayor accidentabilidad de tránsito. La terapia con presión positiva continua en la vía aérea (CPAP) es altamente eficaz y ha sido el tratamiento de elección en los pacientes con enfermedad grave y aquellos con enfermedad moderada con síntomas diurnos y/o comorbilidad cardiovascular, sin embargo, la CPAP tiene limitaciones en términos de aceptación y adherencia al tratamiento. Existen diversas opciones de tratamiento, como la pérdida de peso, el uso de dispositivos orales, medidas posturales, cirugía y la terapia miofuncional. Estos tratamientos personalizados han demostrado buenos resultados, especialmente en pacientes con AOS leve a moderada o en aquellos que buscan alternativas efectivas al tratamiento convencional. Se reconoce cada vez más que la AOS es un trastorno multifactorial con diversas presentaciones clínicas, fisiopatología y comorbilidades. Una mejor comprensión de la heterogeneidad de los pacientes permitirá enfoques de tratamiento más personalizados y garantizará la efectividad de las intervenciones mediante una medicina avanzada y de precisión. Esta revisión proporciona una descripción de los enfoques actuales para el tratamiento no quirúrgico de la AOS leve a moderada en pacientes sin indicación de tratamiento con CPAP o que rechazan dicha opción, además de proponer un algoritmo terapéutico para orientar el manejo de estos pacientes.
Obstructive sleep apnea (OSA) is a common disease that causes daytime symptoms, decreased quality of life, increased risk of cardio and cerebrovascular morbidity and mortality, neurocognitive impairments, and higher traffic accident rates. Continuous positive airway pressure therapy (CPAP) is highly effective and has been the treatment of choice for patients with severe disease and those with moderate disease accompanied by daytime symptoms and/or cardiovascular comorbidity. However, CPAP has limitations in terms of acceptance and treatment adherence. There are various treatment options available, such as weight loss, the use of oral devices, positional devices, surgery and emerging therapies like myofunctional therapy. These personalized treatments have shown promising results, particularly in patients with mild to moderate OSA or those seeking an effective alternative to standard treatment. It is increasingly recognized that OSA is a disorder with diverse risk factors, clinical presentations, pathophysiology, and comorbidities. A better understanding of patient heterogeneity will allow for more personalized treatment approaches and ensure the effectiveness of interventions through advanced and precision medicine. This review provides an overview of current approaches to non-surgical treatment of mild to moderate OSA in patients without an indication for CPAP treatment or who reject that option. Additionally, it proposes a therapeutic algorithm to guide the management of these patients.
La apnea obstructiva del sueño (AOS) es una enfermedad frecuente que afecta entre el 5% y el 15% de la población adulta1–3 siendo más prevalente en hombres, personas mayores y aquellas con obesidad4. Estudios epidemiológicos indican que la prevalencia de la AOS ha aumentado en las últimas dos décadas5, principalmente debido al incremento del peso corporal en la población. La AOS se caracteriza por la presencia de síntomas como la somnolencia diurna excesiva y ha sido asociada a un mayor riesgo de deterioro neurocognitivo6, cáncer7, hipertensión arterial8–11, accidentes de tránsito12,13, problemas laborales, así como una mayor morbimortalidad cardiovascular y cerebrovascular14–17. Además, los pacientes no diagnosticados aumentan el consumo de recursos en salud en comparación con aquellos que reciben un diagnóstico y un tratamiento adecuado. En Chile, la AOS está subdiagnosticada y la prevalencia estimada utilizando el cuestionario STOP-BANG18,19 es de un 8,9% (STOP-BANG≥5). La prevalencia es más alta en hombres, en personas de mayor edad, con mayor peso corporal y en aquellas con un nivel socioeconómico más bajo20. Según las guías de práctica clínica21, el diagnóstico y la clasificación de la gravedad de la AOS se basa en el Índice de Apnea-Hipopnea (IAH). Los pacientes con un IAH de 5–15 se consideran tener una apnea leve, de 15-30 es moderada y una AOS grave si el IAH es≥30 eventos por hora.
El tratamiento de elección de la AOS sigue siendo la terapia de presión positiva continua en la vía aérea (CPAP, por sus siglas en inglés), la cual está recomendada para pacientes con enfermedad grave y aquellos con enfermedad moderada y síntomas diurnos intensos y/o enfermedad cardiovascular. La CPAP, cuando se utiliza correctamente todas las noches y durante toda la noche, es capaz de mejorar la calidad de vida, reducir la somnolencia diurna, disminuir el riesgo de accidentes, mejorar el perfil metabólico, y el control de la presión arterial y disminuir el riesgo cardiovascular, sin importar los mecanismos subyacentes, la ubicación del colapso de las vías respiratorias superiores o el fenotipo del paciente. Sin embargo, una de las principales dificultades en el manejo de los pacientes con AOS es la baja adherencia y aceptación de la CPAP, por lo que es necesario disponer de otras medidas terapéuticas eficaces22,23. Resulta crucial, por tanto, personalizar el tratamiento teniendo en cuenta las preferencias de los pacientes, especialmente en aquellos con AOS leve a moderada, donde la CPAP puede no ser la primera opción de tratamiento. La utilización del análisis de conglomerados clínicos24–28 permite una mejor caracterización de la heterogeneidad de los pacientes, lo que a su vez facilita la implementación de enfoques más personalizados, garantizando la eficacia del tratamiento a través de la medicina personalizada.
En este sentido, esta revisión proporciona una descripción de los enfoques actuales de tratamiento no quirúrgico para pacientes con apnea del sueño leve a moderada que no requieren de CPAP, además de proponer un algoritmo terapéutico.
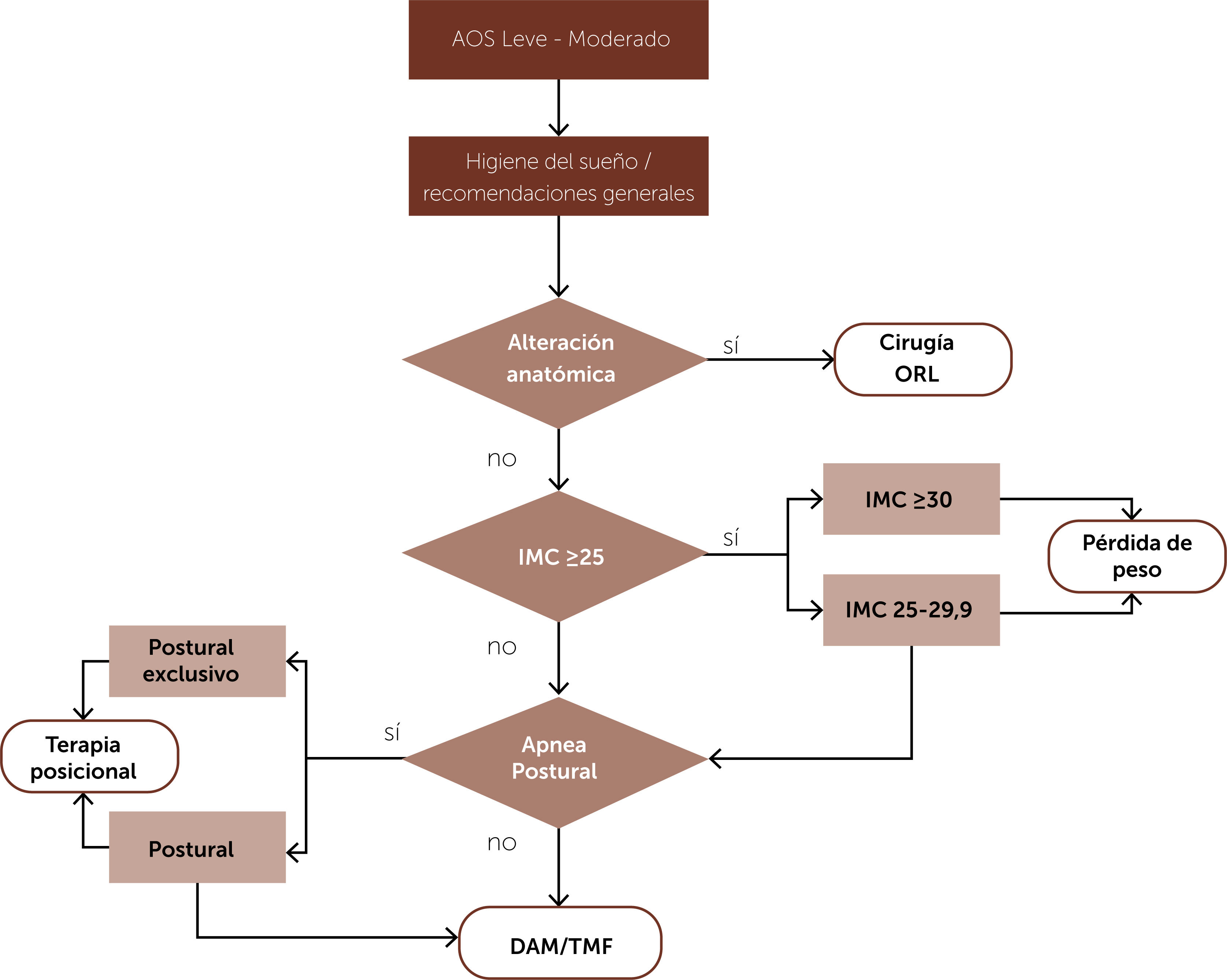
Terapias sin CPAPLa mayoría de las estrategias actuales no quirúrgicas, que prescinden del uso de CPAP, requieren un enfoque personalizado basado en la comprensión del fenotipo específico de cada paciente. Es importante tener en cuenta que estas estrategias no son universalmente efectivas para todos los pacientes, pueden combinarse y complementarse entre sí para aumentar su eficacia29,30. Para facilitar la comprensión y aplicación de estas terapias en los pacientes con apnea del sueño leve a moderada, como grupo de estudio de trastorno respiratorios del sueño (GETRS) proponemos en la figura 1 un algoritmo terapéutico que guía el proceso de tratamiento.
Algoritmo de tratamiento propuesto para los pacientes con AOS leve a moderada. Todos los pacientes que presenten AOS deben recibir educación sobre higiene de sueño. Quienes presenten alteraciones anatómicas sensibles de cirugía deberán ser evaluados por equipo de otorrinolaringología para definir tratamiento quirúrgico. A los pacientes con obesidad (IMC ≥ 30) la pérdida de peso podría ser la medida única de tratamiento, los que presentan sobrepeso (IMC 25-29,9) debe ser una medida complementaria a otras opciones terapéuticas como la terapia posicional que se diseñara especialmente en los pacientes con apneas postural exclusivo. Los DAM y TMF podrá ser el tratamiento de primera línea en pacientes que cumplan criterios específicos (ver texto). Abreviaturas: AOS: apnea obstructiva del sueño; ORL: otorrinolaringología; IMC: índice de masa corporal; DAM: dispositivos de avance mandibular; TMF: terapia miofuncional.
La presentación clínica estereotípica clásica de un paciente con AOS incluye dentro de sus síntomas excesiva somnolencia diurna, sin embargo, existe también un perfil no somnoliento y que presenta insomnio. Este grupo de pacientes se describe con el acrónimo COMISA que proviene del inglés “comorbid insomnia and sleep apnea”31. La prevalencia de COMISA se ha descrito a alcanzar el 38-59% de los pacientes con AOS32.
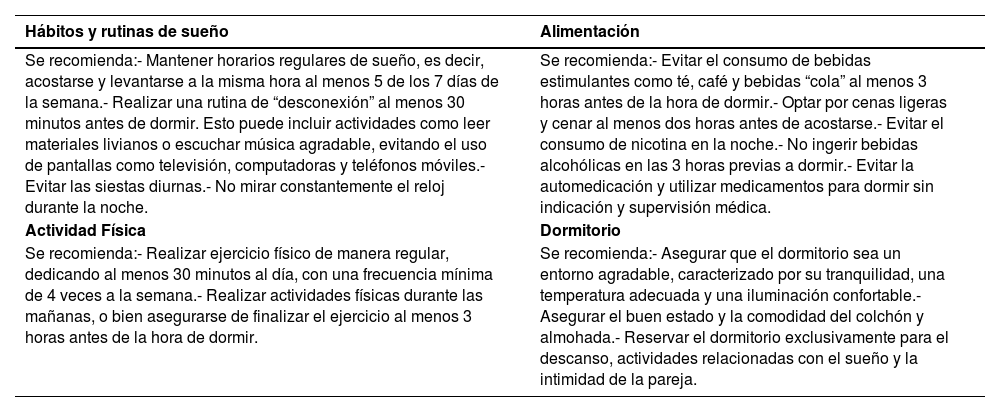
Como la presentación de la AOS tiene un alto impacto en la calidad de sueño es que resulta fundamental brindar educación sobre la higiene del sueño a todos los pacientes, sin importar la gravedad de la enfermedad. Estas medidas abarcan diversas acciones que garantizan una buena calidad y cantidad de sueño nocturno, incluyendo la adopción de hábitos y rutinas adecuadas, la atención a la alimentación, la creación de un entorno propicio en el dormitorio, la práctica de ejercicio físico y la realización de actividades apropiadas antes de acostarse33. En particular, es importante destacar la recomendación de evitar el consumo de tabaco34, ya que se ha observado una relación entre el tabaquismo y la alteración en la calidad del sueño, además de un aumento en la somnolencia y la gravedad de la AOS, debido a las alteraciones en la función neuromuscular y la inflamación de la vía aérea superior (VAS). Por su parte, el reflujo gastroesofágico (RGE) también puede generar inflamación de las VAS, resultando en una mayor prevalencia de ronquidos y, en ocasiones, apneas35. Por lo tanto, es esencial abordar el RGE a través de cambios en la dieta y, si es necesario, el uso de medicamentos, ya que a pesar que ha sido difícil establecer una relación causal entre ambas afecciones, debido a que comparten factores de riesgo comunes, el tratamiento adecuado de la AOS disminuye los síntomas asociados al RGE y viceversa. En la tabla 1 se presentan las recomendaciones para promover una buena higiene del sueño según los lineamientos propuestos por la Academia Americana de Medicina del Sueño (AASM)36.
Medidas y recomendaciones de higiene de sueño
| Hábitos y rutinas de sueño | Alimentación |
|---|---|
| Se recomienda:- Mantener horarios regulares de sueño, es decir, acostarse y levantarse a la misma hora al menos 5 de los 7 días de la semana.- Realizar una rutina de “desconexión” al menos 30 minutos antes de dormir. Esto puede incluir actividades como leer materiales livianos o escuchar música agradable, evitando el uso de pantallas como televisión, computadoras y teléfonos móviles.- Evitar las siestas diurnas.- No mirar constantemente el reloj durante la noche. | Se recomienda:- Evitar el consumo de bebidas estimulantes como té, café y bebidas “cola” al menos 3 horas antes de la hora de dormir.- Optar por cenas ligeras y cenar al menos dos horas antes de acostarse.- Evitar el consumo de nicotina en la noche.- No ingerir bebidas alcohólicas en las 3 horas previas a dormir.- Evitar la automedicación y utilizar medicamentos para dormir sin indicación y supervisión médica. |
| Actividad Física | Dormitorio |
| Se recomienda:- Realizar ejercicio físico de manera regular, dedicando al menos 30 minutos al día, con una frecuencia mínima de 4 veces a la semana.- Realizar actividades físicas durante las mañanas, o bien asegurarse de finalizar el ejercicio al menos 3 horas antes de la hora de dormir. | Se recomienda:- Asegurar que el dormitorio sea un entorno agradable, caracterizado por su tranquilidad, una temperatura adecuada y una iluminación confortable.- Asegurar el buen estado y la comodidad del colchón y almohada.- Reservar el dormitorio exclusivamente para el descanso, actividades relacionadas con el sueño y la intimidad de la pareja. |
Actualmente, no se ha encontrado evidencia que respalde la eficacia de una intervención farmacológica única para reducir la gravedad de la AOS. Además, la información disponible no es suficiente para hacer recomendaciones con respecto a alguna terapia farmacológica específica para esta condición37. Para lograr mejores resultados en el tratamiento de la AOS, es importante enfocarse en una mejor caracterización de los mecanismos predominantes de la enfermedad, especialmente con relación a la disminución del umbral de los microdespertares y/o un aumento en la ganancia del feedback positivo, ya que esto podría brindar nuevas perspectivas para abordar esta condición de manera más efectiva.
Pérdida de pesoLa obesidad se considera el principal factor de riesgo para el desarrollo de la AOS, por lo que se recomienda a todos los pacientes con sobrepeso u obesidad que intenten alcanzar un peso óptimo. Además, grandes estudios epidemiológicos han demostrado una sólida relación entre el aumento de peso y el desarrollo de la AOS38–42. En los sujetos obesos, la acumulación de grasa en los tejidos circundantes de la VAS y en el tórax, así como el aumento de la grasa visceral, junto con factores neurales como el deterioro en el control neuromuscular de la VAS, provocan una disminución en la presión de cierre crítica43 promoviendo las apneas. Dada esta fuerte asociación, mantener un peso saludable o reducir el exceso de peso se considera una recomendación clínica fundamental43. Los cambios de peso en torno al 10% han demostrado producir alteraciones significativas en el IAH. Un aumento del 10% en el peso se asocia con un incremento del 32% en la severidad de la AOS, mientras que una pérdida de peso (PdeP) en dicho rango se relaciona con una disminución en torno del 26% en el IAH45–47. La PdeP no solo ha demostrado ser efectiva para reducir el IAH, sino también para mejorar la calidad de vida y disminuir el riesgo de enfermedades cardiometabólicas44. Además, cuando se utiliza de manera complementaria al tratamiento con CPAP, se observa una sinergia beneficiosa48. El impacto de la PdeP en el IAH dependerá de la gravedad inicial de la apnea y del grado de obesidad. Por ejemplo, un paciente con AOS leve a moderada y un IMC muy elevado tendrá una alta probabilidad de controlar su enfermedad si se planifica una PdeP sustancial, ya sea mediante enfoques médicos o quirúrgicos. Sin embargo, el impacto en la reducción del IAH será limitado en caso de que solo exista sobrepeso ya que la PdeP será menor.
Terapia posicionalLa AOS postural se caracteriza por una reducción del 50% o más en el IAH al cambiar de la posición supina a la lateral. Dentro de esta condición, existe un subgrupo de pacientes que experimenta exclusivamente apneas en posición supina, conocido como apnea postural exclusiva (PE), en estos casos, el IAH en posición lateral se mantiene en valores normales, es decir, menor a 5 eventos por hora49. La prevalencia depende de la gravedad de la enfermedad y afecta aproximadamente al 75% de los casos leves, al 62% de los moderados y al 34% de los graves49,50. El subtipo PE da cuenta de alrededor del 30% de los casos de AOS49. Este tipo de apnea se asocia más frecuentemente con pacientes más delgados, circunferencia cervical menor, con menor prevalencia de hipertensión y preferentemente mujeres49. Desafortunadamente, no es posible evaluar adecuadamente las apneas posturales durante los estudios de polisomnografía nocturna dividida, ya que los registros en posición lateral son escasos y a menudo insuficientes para realizar un diagnóstico49,51,52, por lo que se prefiere realizar estudios de poligrafía respiratoria o una polisomnografía basal. La terapia posicional tiene como objetivo evitar el sueño en posición supina, y para lograrlo se han desarrollado una serie de dispositivos diseñados con este propósito. Estos dispositivos van desde una pelota de tenis colocada en la parte posterior del pijama hasta dispositivos electrónicos de última generación (DEUG) que se colocan en el cuello o en el pecho y emiten vibraciones cuando se adopta la posición supina, promoviendo así el cambio de posición. Los estudios han demostrado una mejoría en el IAH, aunque hasta el momento se limitan a pequeños ensayos y series de casos. No se han encontrado diferencias significativas en términos de reducción del tiempo en posición supina o del IAH entre los DEUG y soluciones más simples, como la pelota de tenis, en el corto plazo (aproximadamente 12 semanas). Sin embargo, los DEUG han mostrado mejorar la calidad del sueño29. En un metaanálisis reciente que analizó los efectos de los DEUG, se observó una reducción del 50% en el IAH total y una reducción del tiempo de sueño en posición supina del 80% o más53. Estos dispositivos, que presentan la capacidad de monitoreo objetivo del cumplimiento, su uso durante el primer mes llega a un 75,9%53. No obstante, el uso subjetivo de estos dispositivos al año se reduce significativamente, llegando solo al 35% a pesar del buen cumplimiento inicial54.
Se sabe poco acerca del impacto a largo plazo que tiene esta terapia en distintos resultados de salud (sobrevida, accidentabilidad, consecuencias metabólicas), sin embargo, existe un grupo de pacientes en los cuales la terapia posicional podría ser considerada como el tratamiento primario. Esto resulta especialmente razonable en pacientes con enfermedad leve a moderada sin enfermedades cardiovasculares y aquellos que presentan AOS PE. Además, en aquellos pacientes sometidos a cirugía o que se encuentran en tratamiento con aparatos orales, la terapia postural podría considerarse como un complemento beneficioso para reducir el IAH55.
Obstrucción nasalLa congestión nasal es un factor de riesgo independiente para los ronquidos y se asocia con un aumento de 3 veces en la probabilidad de ronquido habitual independientemente de factores confundentes. Esta relación puede ser particularmente importante porque la congestión nasal puede controlarse farmacológicamente y reducir significativamente la prevalencia de los ronquidos, aun cuando, en adultos no existen datos concluyentes que evalúen la eficacia específica de esta intervención farmacológica56. No obstante, debido a que se trata de una medida sencilla, se recomienda su tratamiento y es esencial para optimizar la tolerancia al uso del CPAP. En el caso de los niños, cuando presentan rinitis y/o obstrucción de la vía aérea superior debido a hipertrofia adenotonsilar, el uso de corticoesteroides intranasales ha demostrado ser efectivo en la reducción del IAH57.
Aparatos oralesLos aparatos orales (AO) se han consolidado como una alternativa a la CPAP en el tratamiento de la AOS. El objetivo de esta terapia es reposicionar las estructuras craneofaciales e intraorales para aumentar el espacio de la VAS y mejorar la tensión de los músculos dilatadores de la faringe, evitando su colapso durante el sueño58. Los AO abarcan diferentes tipos de dispositivos, incluyendo aquellos diseñados para retener la lengua en una posición más anterior59. Sin embargo, la evidencia y las directrices clínicas más sólidas se centran en los dispositivos de avance mandibular (DAM). Estos dispositivos se colocan en los arcos dentales superiores e inferiores con el propósito de adelantar la mandíbula y los tejidos circundantes, lo que resulta en la ampliación del espacio velofaríngeo. Existen diversos diseños de DAM disponibles en el mercado, los cuales varían en cuanto al material de fabricación, si están compuestos por una sola placa (monobloque) o por dos placas separadas, los movimientos laterales permitidos, la apertura vertical que se permite, el mecanismo de avance y la posibilidad de ajustar el grado de avance (titulación)57. Son limitados los estudios que comparan directamente diferentes diseños de DAM, no obstante, las guías clínicas recomiendan el uso de dispositivos personalizados, los cuales deben ser prescritos por un odontólogo calificado60. Este punto es de suma importancia debido a que esta terapia debe ser supervisada para evaluar y controlar posibles efectos secundarios, como la sensación de boca seca, exceso de salivación, presión excesiva en las encías o dolor dental, trastornos temporomandibulares y cambios en la oclusión dental. Además, se recomienda realizar un estudio de sueño de seguimiento para confirmar la eficacia del tratamiento57. Los DAM han demostrado reducir significativamente el IAH, la caída en los niveles de saturación de oxígeno y los ronquidos61. Son capaces de reducir en alrededor del 50% el IAH y entre el 30% al 70% de los usuarios logrará una respuesta completa (IAH <5 eventos/hora)60. Eso sí, aproximadamente un tercio de los pacientes no experimentan ningún beneficio terapéutico. Los ensayos clínicos han demostrado que la terapia con CPAP es superior a los DAM en la reducción del IAH independiente de la severidad de la enfermedad29, sin embargo esta mayor eficacia no necesariamente se traduce en mejores resultados de salud en la práctica clínica. Una revisión sistemática indica que tanto la terapia CPAP como los DAM reducen en rango similar la presión arterial62. Algunas características de los pacientes que se asocian con una respuesta efectiva incluyen tener AOS leve o moderada, apneas de predominio postural, menor IMC, ser jóvenes, tener una circunferencia del cuello más pequeña y menor desarrollo mandibular, sin embargo, es importante tener en cuenta que estas características solo proporcionan una guía general y no existen parámetros precisos para asegurar la eficacia de esta terapia63. Se han propuesto varios métodos de predicción para seleccionar pacientes para la terapia con DAM; como el uso de estudios de imagen volumétricos de la VAS, cefalometría, nasofibroscopía con maniobra de Müller60,63, titulación del avance mandibular instrumental durante un estudio de sueño64 o el aumento de la resistencia de la vía aérea superior durante la endoscopia del sueño inducida por drogas (DISE, por sus siglas en inglés)65. Sin embargo, ninguno de estos métodos ha demostrado predecir con precisión qué pacientes se beneficiarán de la terapia. Si bien se ha observado que los pacientes que utilizan DAM reportan una buena adherencia clínica a estos dispositivos61, la incorporación de micrograbadores en los DAM representa un avance importante que permitirá evaluar la adherencia de manera objetiva66. En resumen, los DAM se han demostrado como una alternativa terapéutica útil y efectiva. Pueden ser utilizados como primera línea de tratamiento en pacientes con AOS leve o moderada sin enfermedades cardiovasculares. También están indicados en pacientes con AOS severa que no toleran la terapia de CPAP o que buscan una alternativa a esta, así como en pacientes con AOS y bruxismo67 y en roncadores primarios (sin AOS), y siempre supervisado por un odontólogo calificado.
Terapia miofuncionalLos músculos dilatadores de la VAS juegan un papel crítico en el mantenimiento de la permeabilidad de la orofaringe durante el sueño. Se han investigado los ejercicios dirigidos a la musculatura de la cavidad oral y las estructuras orofaríngeas como un método para el tratamiento de la AOS, incluso a través del canto y el uso de instrumentos musicales de viento68–70. La terapia miofuncional (TMF) consiste en ejercicios isotónicos e isométricos dirigidos a las estructuras orales (labio, lengua) y orofaríngeas (paladar blando, pared faríngea lateral)70. Los ejercicios son supervisados por fonoaudiólogos y tienen como objetivo aumentar el tono muscular. Una revisión sistemática reciente71 ha demostrado que la TMF reduce el IAH en aproximadamente un 50% (de 24,5±14,3 eventos por hora a 12,3±11,8 eventos por hora [IC 95% -20,98 a -7,54], p<0,0001). Además, se ha observado mejoría en la saturación de oxígeno con un aumento del 4,2% [IC 95% 1,85 a 6,54], reducción del ronquido y disminución de la somnolencia medida mediante la escala de somnolencia de Epworth. Estos cambios han sido consistentes, independiente de la heterogeneidad en los ejercicios realizados.
Nuestro equipo utiliza un esquema modificado del utilizado por Guimaraes70 y consiste en 6 sesiones fonoaudiológicas donde se enseñan y supervisan ejercicios específicos enfocados en potenciar la nutrición del tejido oro y faringolaríngeo y tonificar la musculatura involucrada en el colapso de la vía aérea durante el sueño. El plan de trabajo se distribuye generalmente en 2 sesiones el primer mes y luego se distancian hasta completar 6 sesiones en un periodo de 6 meses de tratamiento. Los ejercicios aprendidos se incorporan a la rutina diaria del paciente, quien debe practicarlos en casa. Hasta el momento, hemos observado mejorías en la calidad del sueño, reducción de la somnolencia y disminución de la intensidad del ronquido en nuestros pacientes (datos no presentados).
En resumen, TMF puede desempeñar un papel importante como complemento a otros tratamientos de la AOS y también como una opción viable en pacientes con enfermedad leve a moderada sin enfermedades cardiovasculares, así como en aquellos que son roncadores primarios71.
ConclusionesLa medicina del sueño está experimentando avances significativos hacia una medicina personalizada. Un aspecto clave en este enfoque es adaptar la terapia específica a las necesidades de cada paciente con apnea del sueño. Actualmente, contamos con terapias innovadoras que pueden complementar los enfoques convencionales y en algunos casos, representar la opción terapéutica con resultados clínicos satisfactorios, siempre y cuando sean seleccionadas adecuadamente para cada paciente. Si bien la terapia con CPAP es claramente efectiva en los casos de AOS grave, los pacientes con enfermedad leve a moderada plantean un desafío mayor, ya que requieren un enfoque más individualizado para determinar el tratamiento más adecuado, considerando los diferentes fenotipos clínicos que puedan presentar.
Conflicto de interésLos autores declaran no tener conflictos de interés.