La Roncopatía Primaria es un trastorno respiratorio del sueño que se caracteriza por no presentar apneas, desaturaciones ni microdespertares. Se presenta en más del 50% de la población adulta y se traduce en una obstrucción parcial de la vía aérea superior. Durante mucho tiempo se consideró sólo como un síntoma benigno, sin embargo, constituye una entidad patológica en sí misma y determina importantes repercusiones a nivel de funciones neurocognitivas, metabólicas y cardiovasculares. La polisomnografía constituye hoy el gold estándar en su estudio, sin embargo, análisis acústicos del ronquido presentan una relevancia creciente. Su manejo incorpora medidas médicas, quirúrgicas e instrumentales, debiendo siempre adecuarse en forma personalizada a cada individuo. El estudio etiológico y de los mecanismos histopatológicos y bioquímicos que determinan las repercusiones clínicas de la roncopatía, aportará nuevas herramientas que nos permitan profundizar y optimizar tanto su estudio como su tratamiento.
Primary snoring is a respiratory disorder of the sleep, characterized by the abscence of apneas, desaturations or arousals. It is present in 50% of the adult population and refects a partial obstruction of the upper airway. For a long time it was considered only as a benign symptom, however, it is a disease itself and determines important repercussions in neurocognitive, metabolic and cardiovascular functions. Polysomnography is now the gold standard in its study, however, acoustic analysis of snoring have shown an increasing relevance. Its management incorporates medical, surgical and instrumental measurements, and should always be tailored to fit each individual. The etiological study and histopathological and biochemical mechanisms that determine the clinical implications of snoring, will provide us with new tools that allow us to deepen and optimize both study and treatment.
Si bien el ronquido es una manifestación muy frecuente, no constituye un evento fisiológico, por el contrario, su presencia evidencia algún grado de obstrucción parcial de la vía aérea superior (VAS). Esto genera turbulencias en la columna aérea y vibración de algunas estructuras anatómicas, originando el clásico sonido del ronquido, el que a su vez puede tener múltiples variaciones en tonos e intensidad.
La Roncopatía Primaria (RP) es un Trastorno Respiratorio del Sueño (TRS), que por definición no se acompaña de apneas, hipopneas, desaturaciones ni microdespertares electroencefalográficos (1).
El ronquido, como síntoma, constituye el principal motivo de consulta entre los pacientes portadores de un Síndrome de Apnea Obstructiva del Sueño (SAOS) (2). Hasta hace apenas un par de décadas se pensaba que en aquellas ocasiones en que el ronquido se presentaba en forma aislada, esto es, sin acompañarse de apneas o hipopneas, no generaba repercusión alguna en el estado de salud del paciente, constituyendo tan solo un problema social para su acompañante en la cama. En 1976, Guilleminault (3) describió el Síndrome de Resistencia de la Vía Aérea Superior (SRVAS) en pacientes roncadores que si bien no presentan apneas ni hipopneas, generan altas presiones negativas a nivel de vía aérea y esófago, lo que induce microdespertares con la consiguiente fragmentación del sueño, originando la hipersomnia diurna que aqueja a estos pacientes.
En los últimos años se ha publicado una serie de investigaciones que sustentan un nuevo enfoque, según el cual la RP no sería tan “benigna” como se creía hasta hace algunos años, sino por el contrario, produciría un significativo deterioro de las funciones cognitivas y académicas de quienes la presentan, generando además alteraciones conductuales e incluso desordenes metabólicos, especialmente en los niños (4-10).
EpidemiologíaGran parte de la literatura que aborda la patología obstructiva del sueño ha dado poca importancia clínica al ronquido, el que se ha tendido a considerar sólo un síntoma dentro del SAOS, o bien un síntoma que a futuro podría conducir a la aparición del SAOS.
En población adulta, Xiang describe una prevalencia de 59% en hombres y 47,9% en mujeres para el grupo etario entre 50 y 85 años en un estudio que incluyó a 8217 habitantes de Hong Kong (11). Por su parte, Nagayoshi refiere una prevalencia de 72,6% en hombres y 54,1% en mujeres para el grupo entre 40 y 69 años según datos de un estudio multicéntrico Japonés (12).
La prevalencia de Ronquido Habitual (RH) en niños va desde cifras de 7,2% según el estudio de Li en niños de 5 a 14 años en Hong Kong (13), hasta un 34,5% en el estudio de Castronovo de prevalencia de RH en 595 niños de 2 a 8 años de una comunidad del norte de Italia (14), siendo en este grupo, mayor la incidencia de RH en niños pequeños respecto a los mayores. La prevalencia de 34,5% citada fue obtenida mediante un cuestionario realizado a los padres, y se redujo hasta un 23,4% en los 241 niños cuyos padres aceptaron completar el estudio mediante la realización de un monitoreo nocturno.
Respecto a la realidad local, Brockmann describe una prevalencia de RH en niños chilenos de 7 a 17 años del 18% para una población urbana de nivel socioeconómico bajo (15).
En general, para la población pediátrica se describe, al igual que en entre los adultos, una mayor prevalencia de RH en niños que en niñas (13-15). De igual manera, factores tales como obesidad, malformaciones craneofaciales y enfermedades neuromusculares se asocian también a una mayor prevalencia, alcanzando cifras que superan el 50% (16).
La obstrucción nasal favorece la aparición de ronquido. Sabemos que la obstrucción nasal secundaria a procesos infecciosos o inflamatorios es frecuente en la población, especialmente durante la edad pediátrica, sin embargo, su naturaleza transitoria y su extensión temporalmente limitada, determinan que su presencia no revista mayor implicancia clínica. Así pues, es necesario avocarse a la detección del roncador habitual, cuyo ronquido puede evidenciar la presencia de una RP o bien constituir una manifestación más en el contexto de un SRVAS o un SAOS. En relación a éste último, se acepta que su prevalencia es 3,2 veces más alta en pacientes roncadores (17).
FisiopatologíaEl ronquido podría definirse como la emisión de respiración ruidosa durante el sueño, con una intensidad mayor a 50 dB cuando es medida cerca del sitio de salida, esto es, a nivel del labio superior (18).
El ronquido se origina producto del colapso parcial de ciertas regiones anatómicas que componen parte de la arquitectura de la VAS. Este colapso se ve favorecido por el estrechamiento luminal de la vía aérea, producto de variaciones anatómicas que condicionan un mayor volumen de determinadas estructuras tales como hiperplasia adenoidea y/o amigdalina, hipertrofia de base de lengua, elongación y engrosamiento del paladar blando, entre otros. El aumento de velocidad y turbulencias producidas en la columna área, favorecen la vibración de algunas estructuras. La disminución del tono muscular durante el sueño también juega un rol importante y es así que los TRS aumentan su incidencia durante la etapa de sueño REM (1). La intensidad del ronquido dependería del grado de obstrucción y la diferencia de presiones que se generen (19).
La obstrucción nasal, ya sea por inflamación, hipertrofia de cornetes, poliposis nasal o desviaciones septales, condiciona un aumento en la presión negativa inspiratoria, lo que favorece la aparición de ronquidos y la acentuación de un cuadro de RP o SAOS.
La conformación cráneo facial y del cuello de los individuos, influye en la posibilidad de presentar ronquido o SAOS, es así que estudios cefalométricos en grupos de pacientes sanos, con RP y con SAOS, presentan medidas significativamente distintas en sus diferentes estructuras (20). El sólo hecho de tener un perímetro cervical mayor a 43 cm. ha mostrado por sí solo, ser un factor de riesgo para roncar y presentar SAOS (21).
Clásicamente, se ha considerado que la obstrucción de la VAS tiende a producirse de manera casi exclusiva durante la inspiración, ya que durante esa fase respiratoria se genera una presión negativa intraluminal que permitiría un fácil colapso de las estructuras no rígidas de la VAS, tales como paladar blando, base de lengua y supraglotis. No obstante este precepto, algunos estudios experimentales han mostrado la producción de colapsos espiratorios con relevancia clínica significativa en pacientes con RP y SAOS (1).
RepercusionesAmpliamente conocidas son las repercusiones metabólicas, sociales y neurocognitivas en pacientes portadores de SAOS, no así las producidas en pacientes portadores de R P. En los últimos años, un número creciente de literatura abarca y profundiza el entendimiento de estos aspectos, especialmente en población pediátrica.
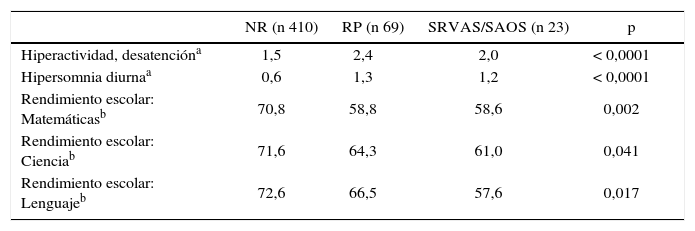
Brockmann (4) estudió el deterioro neurocognitivo en 1114 escolares; a los roncadores se les realizó una Polisomnografia (PSG) a fin de identificar y discriminar entre quienes presentaban R P, SAOS y SRVAS. Mostró que el grupo de RP tuvo un deterioro similar a los grupos con SAOS y SRVAS en cuanto a hiperactividad, déficit atencional, hipersomnia diurna, rendimiento académico en matemáticas, ciencias y lenguaje (ver tabla 1).
Síntomas diurnos y rendimiento escolar: estratificación según trastorno respiratorio del sueño
| NR (n 410) | RP (n 69) | SRVAS/SAOS (n 23) | p | |
|---|---|---|---|---|
| Hiperactividad, desatencióna | 1,5 | 2,4 | 2,0 | < 0,0001 |
| Hipersomnia diurnaa | 0,6 | 1,3 | 1,2 | < 0,0001 |
| Rendimiento escolar: Matemáticasb | 70,8 | 58,8 | 58,6 | 0,002 |
| Rendimiento escolar: Cienciab | 71,6 | 64,3 | 61,0 | 0,041 |
| Rendimiento escolar: Lenguajeb | 72,6 | 66,5 | 57,6 | 0,017 |
El mismo autor, en un estudio en niños chilenos de 7 a 17 años en población urbana de nivel socioeconómico bajo, encontró una alta tasa de Trastornos Respiratorios del Sueño (TRS), que se asociaron en forma significativa a comportamiento hiperactivo y un bajo rendimiento académico (15).
En escolares, la incidencia de RP es alrededor de un 12%, mientras que un 1 a 2% presentaría un SAOS. Gozal (5) estudió a 297 escolares de primer año que se encontraban en el 10 percentil de menor rendimiento académico, encontrando una alta incidencia (18,1%) de probable SAOS, de acuerdo a la aplicación de una encuesta a los padres y mediciones de oximetría y capnografía nocturna.
Bourke, en dos estudios (6, 10), realizó PSG a niños de 7 a 12 años con desórdenes obstructivos del sueño, y a un grupo control de niños sanos. Demostró que los niños con R P, SAOS leve y SAOS moderado/severo presentan un deterioro significativo en las funciones cognitivas (habilidades ejecutivas e intelectuales) y académicas, en relación al grupo control, independiente de la severidad del cuadro, teniendo los portadores de R P, sin hipoxias ni fragmentación del sueño, similar deterioro que aquellos con SAOS.
Algunos estudios que abarcan de manera específica las alteraciones de memoria de trabajo en niños, muestran resultados contradictorios; cuando se emplean evaluaciones subjetivas como la apreciación de los padres (Behaviour Rating Inventory of Executive Function, BRIEF), los resultados son peores para los portadores de SAOS y R P, sin embargo, al usar métodos de medición más objetivos, como el reconocimiento por computador de cartas de juego (CogHealth), no se aprecian diferencias significativas con respecto a los grupos control (8).
A la luz de estas experiencias, podemos concluir que el RP sin desaturaciones, apneas ni hipopneas, no es tan inocente como hasta hace algunos años se aceptaba y por el contrario, produce un impacto en el comportamiento, así como en el desarrollo cognitivo y emocional del niño.
Se estudió la relación entre RP, SAOS, Síndrome Metabólico (SM) y niveles sanguíneos de PCR ultrasensible (usPCR), un marcador indirecto de alto riesgo cardiovascular (22). Se analizaron 309 pacientes con TRS. En general, niveles elevados de usPCR se asociaron a alteraciones metabólicas y a un mayor riesgo cardiovascular, independiente de la severidad del TRS, esto es, sin diferencias significativas entre RP y SAOS.
En esta misma línea, Kazman (23) estudió a 248 adultos afroamericanos de Maryland, describiendo una correlación estadísticamente significativa entre la presencia de ronquido y el diagnóstico de SM, así como también con alteraciones específicas en factores de riesgo cardiovascular tales como glicemia en ayunas, IMC, porcentaje de grasa corporal y circunferencia de cintura.
El SAOS produce disfunción endotelial en adultos y niños (24-26). Li estudió 201 niños de 6 a 18 años para determinar el grado de función endotelial, utilizando ultrasonografía de vasodilatación mediada por el flujo de la arteria braquial, método considerado el gold standard para esta medición (9). Mostró que los niños con RP presentan una disfunción endotelial significativa en relación a los no roncadores, independiente de si presentan un peso normal o sobrepeso (9). La disfunción endotelial constituye el indicador más precoz de patología cardiovascular y su presencia es altamente predictiva de eventos cardiovasculares en personas durante las primeras etapas de la enfermedad, independiente de los factores de riesgo convencionales (27, 28).
Respecto a la etiología de estas alteraciones, se postula que periodos repetidos de hipoxia y reoxigenacion, excitación del sistema nervioso central y fluctuaciones de la presión intratorácica son los principales mecanismos responsables de la comorbilidad cardiovascular en los TRS. Estos fenómenos conducen a un aumento del estrés oxidativo, inflamación sistémica crónica, trastorno de la función vasomotora, incremento de la actividad simpática y desarrollo de arteriosclerosis (29).
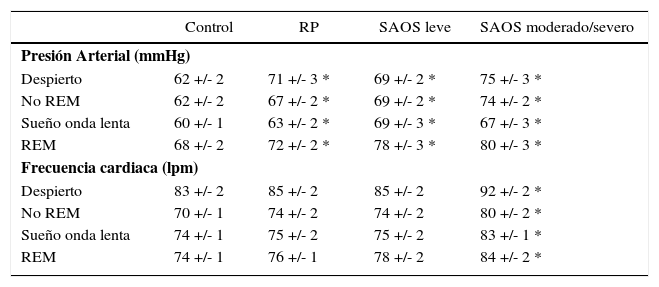
Conocida es la afectación de la autoregulación autómica en pacientes con TRS, lo que condiciona el aumento de la presión arterial y la frecuencia cardiaca en adultos (29), fenómeno que se repite en población infantojuvenil (7). En la tabla 2 se puede apreciar además, que si bien quienes presentan RP no tienen alteraciones hemodinámicas significativamente mayores respecto al grupo control, sí existe una tendencia en este sentido.
Presión arterial y frecuencia cardiaca en niños sanos, con RP y SAOS, durante periodos de vigilia y en las distintas etapas del sueño
| Control | RP | SAOS leve | SAOS moderado/severo | |
|---|---|---|---|---|
| Presión Arterial (mmHg) | ||||
| Despierto | 62 +/- 2 | 71 +/- 3 * | 69 +/- 2 * | 75 +/- 3 * |
| No REM | 62 +/- 2 | 67 +/- 2 * | 69 +/- 2 * | 74 +/- 2 * |
| Sueño onda lenta | 60 +/- 1 | 63 +/- 2 * | 69 +/- 3 * | 67 +/- 3 * |
| REM | 68 +/- 2 | 72 +/- 2 * | 78 +/- 3 * | 80 +/- 3 * |
| Frecuencia cardiaca (lpm) | ||||
| Despierto | 83 +/- 2 | 85 +/- 2 | 85 +/- 2 | 92 +/- 2 * |
| No REM | 70 +/- 1 | 74 +/- 2 | 74 +/- 2 | 80 +/- 2 * |
| Sueño onda lenta | 74 +/- 1 | 75 +/- 2 | 75 +/- 2 | 83 +/- 1 * |
| REM | 74 +/- 1 | 76 +/- 1 | 78 +/- 2 | 84 +/- 2 * |
Hunsaker realizó una evaluación domiciliaria de TRS, incorporando a los métodos de estudio convencionales, la medición de la intensidad del ronquido. Sus resultados sugieren que el RP puede ser un factor independiente de disrupción del sueño (18); existe un subgrupo de pacientes en quienes el Índice de Apnea e Hipopnea (IAH) es normal, no obstante, roncan y presentan síntomas de hipersomnia diurna (18). Según Hunsaker, la intensidad del ronquido estaría relacionada con el nivel de disrupción del sueño y la afectación del acompañante en la cama, por lo que esta medición debiera ser incorporada en los estudios del sueño de manera habitual.
Estudio y diagnósticoLa observación por un testigo de las características del ronquido, asociado a un sueño reparador y la ausencia de hipersomnia diurna, deberían en conjunto constituir elementos suficientes por si mismos para diagnosticar una R P. Sin embargo, la práctica clínica nos ha enseñado, especialmente en sujetos jóvenes, que el paciente puede ya estar desarrollando un SAOS o un SRVAS, sin dar manifestaciones evidentes.
En un intento por implementar un método de screening entre pacientes roncadores que podrían presentar un TRS de mayor complejidad, encubierto o aún no develado, permitiendo seleccionar aquellos con un riesgo elevado de SAOS, hay autores que han propuesto realizar un análisis acústico del ronquido, empleando para esto un Programa Multidimensional de la Voz, que analiza variadas características del ronquido, logrando así demostrar diferencias significativas en los peaks de intensidad y el espectro frecuencial entre RP y SAOS, llegando incluso a poder clasificar a los pacientes en grupos dependiendo del valor esperado del IAH (2, 17, 30). Estos estudios, si bien son prometedores, aún necesitan una mayor validación para ser aplicados en la práctica clínica diaria.
Los métodos de screaning automáticos mencionados, tienen a su favor el hecho de ser bastante más sencillos y económicos que la realización de una PSG, por lo que su implementación podría permitirnos seleccionar aquellos pacientes de mayor riesgo, en quienes finalmente realizar una PSG, examen costoso y cuya realización resulta compleja para el paciente, tanto más en edad pediátrica.
Darrel (18) en un estudio domiciliario y midiendo la intensidad del ronquido, mostró una asociación significativa entre la duración del ronquido, su intensidad promedio y el peak de intensidad, respecto al IMC y el IAH; de igual manera, describió una asociación entre la intensidad promedio y la escala de Epworth (ESDE). Respecto a la intensidad, según Darrel, existe una progresión lineal de 20 dB entre RP y SAOS severo; por su parte, la duración del ronquido aumenta desde 73% en RP a 98% en SAOS severo. Por lo anterior, cuando el ronquido tiende a ser frecuente y con cierto nivel de intensidad, se recomienda realizar un estudio de sueño. De no existir otras comorbilidades del sueño, se podría realizar una Polisomnografia (PSG) o Poligrafía Ambulatoria del Sueño (PAS).
Akpinar estudió las características cefalométricas en pacientes adultos de sexo masculino, no obesos (20). Reportó que el área retropalatal, la distancia entre la mandíbula y el hioides, así como la longitud y el espesor del paladar blando, presentan diferencias significativas entre individuos sanos y aquellos con diagnóstico de RP y SAOS. Se plantea que los datos cefalométricos seleccionados pueden ser útiles al momento determinar el sitio anatómico de obstrucción de la VAS, constituyendo un complemento importante a los estudios endoscópicos y la PSG.
La necesidad del estudio polisomnográfico en niños con SAOS es controversial, ya que la mayoría de las veces esta patología se origina por una hiperplasia adenoamigdaliana y se resuelve fácil y exitosamente mediante una adenoamigdalectomia. Por lo complejo y costoso que resulta la realización de una PSG en niños, se prefiere realizarla sólo en aquellos casos especiales seleccionados, tales como malformaciones cráneo faciales, síndromes hipotónicos o en quienes el examen físico no arroja hallazgos consistentes con el diagnóstico. Si habría acuerdo de realizar una PSG en niños que fueron intervenidos, pese a lo cual las apneas continúan. En la RP con examen acorde a la sintomatología no se justificaría una PSG.
TratamientoEl uso de aparatos de Presión Positiva de Vía Aérea (PAP), ha demostrado ser muy eficiente en inhibir la aparición del ronquido. No obstante, pacientes que presentan solo R P, sin SAOS, especialmente sujetos jóvenes, tienen una baja tasa de adherencia a su uso. Por otra parte, muchos autores consideran excesiva la indicación de PAP en R P, en condiciones en las que esta patología puede muchas veces manejarse satisfactoriamente de forma conservadora mediante la optimización del estado ponderal, mediadas de higiene del sueño y manejo posicional.
Aarts (31) revisó la respuesta al uso de Dispositivos Orales (DO) en el manejo de la R P, encontrando un 38% de reducción en la sonoridad del ronquido y un 54% de mejoría en los trastornos del sueño del compañero de cama. Por su parte, Maguire (32) describió una mejoría significativa mediante el uso tanto de dispositivos de avance mandibular, como de dispositivos de elevación de la mordida.
El rol de la obstrucción nasal en la fisiopatología del ronquido y el SAOS no está totalmente aclarado, sin embargo, pacientes portadores de SAOS tienen una alta frecuencia de anormalidades obstructivas nasales, por lo que debería existir alguna influencia en su etiopatogenia (33). El efecto de la cirugía nasal para mejorar su permeabilidad en SAOS, es controversial, ya que si bien la cirugía nasal (septoplastía, turbinoplastía, polipectomías, entre otros), disminuye la sintomatología en cuanto a mejorar la obstrucción nasal, reducir el ronquido, disminuir la hipersomnia y minimizar los efectos negativos sobre el acompañante en la cama, el estudio polisomnográfico de control evidencia una mantención e incluso un incremento en los valores de IAH en un significativo porcentaje de estos pacientes (33, 34).
La obstrucción nasal puede ser un obstáculo para adaptar un dispositivo oral, así como puede también obligar al usuario de CPAP a recurrir al empleo de altas presiones, lo que reduce la adherencia a su uso. En este contexto, la cirugía nasal tiene un rol positivo como parte del tratamiento de estos pacientes (33, 34).
Craig (35) revisó tres estudios con uso de corticoides tópicos versus grupos control con placebo en pacientes portadores de rinitis alérgica. Demostraron que el uso de corticoides intranasales como tratamiento único, mejoraba la calidad del sueño, disminuía en forma significativa la congestión nasal, los TRS y la hipersomnia diurna. No está claro si estos cambios se deben sólo a un efecto mecánico producto de la corrección de la obstrucción nasal, o si bien juega un papel pre-ponderante el efecto antiinflamatorio producto de la disminución de citokinas pro-inflamatorias tales como IFN-gama, TNF-alfa, IL-1β, IL-4 e IL 10.
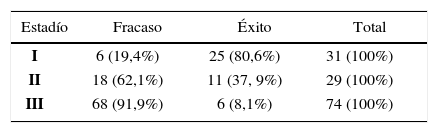
La uvulopalatofaringoplastía (UPFP), técnica descrita inicialmente en 1964 por Ikematsu en Japón (36), fue luego introducida el año 1981 a Estados Unidos por Fujita (37) para el tratamiento quirúrgico del SAOS y la Roncopatía. Existen en la actualidad múltiples variaciones de la técnica. Los modestos resultados publicados en la literatura mundial, en el tratamiento del SAOS, se han debido especialmente a una inadecuada indicación y selección de pacientes. La Tabla 3 expone resultados quirúrgicos utilizando UPFP como tratamiento único, según la etapificación de Friedman (16, 38), en la que los estadíos bajos corresponden a pacientes con amígdalas grandes y base de lengua pequeña, y los estadíos altos viceversa.
TASA DE ÉXITO DE LA UPFP (utilizada como tratamiento único en el manejo de los trs. selección del paciente quirúrgico clasificación de Friedman)
| Estadío | Fracaso | Éxito | Total |
|---|---|---|---|
| I | 6 (19,4%) | 25 (80,6%) | 31 (100%) |
| II | 18 (62,1%) | 11 (37, 9%) | 29 (100%) |
| III | 68 (91,9%) | 6 (8,1%) | 74 (100%) |
Teniendo en cuenta estos resultados, podemos concluir que mediante una adecuada selección de pacientes se pueden lograr buenos resultados con esta técnica en el tratamiento del SAOS. No obstante, la UPFP es considerada por algunos como una cirugía demasiado agresiva para el tratamiento de una RP aislada.
En niños normales, gran parte de la Roncopatía Habitual se origina de una hiperplasia adenoidea y/o amigdalina, siendo menos frecuente la hipertrofia de cornetes, la rinitis crónica y las desviaciones septales. En este contexto, la adenoamigdalectomía, por tratarse de una cirugía rápida, de relativo bajo costo y de pronta recuperación en los niños, es el tratamiento lógico para quienes presentan un TRS causado por la hiperplasia de estos órganos.
Como alternativa quirúrgica ante otras etiologías, existe lo que conocemos como procedimientos mínimos, usados para aumentar la rigidez del velo del paladar y así disminuir su capacidad de vibración durante el sueño, con la consiguiente reducción del ronquido. Entre los más usados están la inyección de sustancias esclerosantes y la cauterización con radiofrecuencia, esta última provoca una quemadura de baja temperatura en el espesor de la musculatura del paladar, generando una reacción inflamatoria que conduce a la fibrosis a partir del primer mes post cirugía. También puede utilizarse la colocación de implantes en los músculos palatinos, lo que induce una reacción inflamatoria con la consiguiente fibrosis y rigidez del velo. Todos estos procedimientos pueden ser realizados en forma ambulatoria y bajo anestesia local, con una baja tasa de complicaciones (16, 38). Los resultados de estos procedimientos para RP a corto y mediano plazo son aceptables, sin embargo, presentan una efectividad cuestionable cuando se evalúan a largo plazo (16, 38, 39).
El empleo de la radiofrecuencia puede efectuarse también para reducir el volumen de los cornetes y la base de lengua, generalmente como tratamiento asociado a otras técnicas quirúrgicas.
En los años 90 se preconizó el uso del LASER CO2 como alternativa para el manejo de la roncopatía y el SAOS, realizándose diferentes técnicas de resección y vaporización de tejidos faríngeos, palatinos y amigdalinos (38). Los resultados a largo plazo han sido decepcionantes, por no mencionar lo doloroso del periodo postoperatorio y el porcentaje significativo de complicaciones reportadas, tales como estenosis faríngeas e insuficiencia velofaríngea, situaciones muy difíciles de corregir. Por lo anterior, su uso tiene actualmente pocos adeptos.
DiscusiónComo primer concepto, es necesario rescatar y establecer el hecho de que la R P, por si misma, constituye una entidad patológica con repercusiones clínicas importantes y de perpetuarse en el tiempo, eventualmente graves, tanto para el paciente que lo padece, como también para su compañero de cama.
Estas repercusiones adquieren mayor trascendencia por cuanto se presentan desde la infancia, demostrándose ya alteraciones anatómicas, fisiológicas, bioquímicas y conductuales durante la edad escolar; lo que debiera condicionar, no sólo un cambio en el paradigma de enfrentamiento de la RP, sino también en el enfrentamiento preventivo de la patología cardiovascular.
Los mecanismos exactos por los cuales la RP puede generar deterioro cognitivo, académico y metabólico no están aún aclarados.
Una posibilidad es que los actuales estudios PSG no sean lo suficientemente sensibles en detectar cambios mínimos producidos en los parámetros cardiovasculares, de oxigenación y arquitectura del sueño eventualmente producidos por la R P. Por otro lado, en gran parte de los estudios disponibles, se realizó el monitoreo con PSG durante sólo una noche, lo que a la luz de los nuevos conocimientos en roncopatía, pudiera resultar insufuciencia.
Desde el punto de vista metabólico, un estudio experimental en animales demostró que la estimulación con intensos sonidos, causando vibración traqueal y del velo palatino durante tres horas, indujo una significativa sobre expresión de biomarcadores pro-inflamatorios, tales como TNF alfa y Proteina inflamatoria 2 macrofágica (40). Por lo tanto, la vibración de los tejidos faríngeos podría desencadenar la liberación de citoquinas proinflamatorias que podrían ser los causantes de los efectos descritos en RP.
El estudio de la RP como entidad clínica y no sólo como manifestación de un cuadro más complejo, plantea múltiples interrogantes, a la vez que expone nuevas áreas de investigación hasta ahora inexploradas, pero cuyo conocimiento tendrá sin duda repercusiones importantes en la neurología, otorrinolaringología, la endocrinología y la cardiología, entre otras áreas del desarrollo médico.
Los autores declaran no tener conflictos de interés, con relación a este artículo.