El sueño es la actividad que ocupa la tercera parte de la vida del ser humano y plantea, a pesar de los numerosos avances científicos de las últimas décadas, importantes interrogantes que aclarar.
El número de personas que presenta alteraciones del sueño, ya sea en su patrón o en su calidad, es muy alto en la sociedad actual, donde los avances tecnológicos constituyen un factor muy importante en disminuir las horas dormidas. Se puede afirmar que la calidad de vida del ser humano es, en gran medida, dependiente de la relación directa entre la calidad del sueño y el número de horas que se duerme. Este creciente conocimiento de las implicancias del sueño normal sobre la salud física y mental de la persona, ha provocado que sea un tema de continuo interés e investigación, que permite investigar múltiples disciplinas relacionadas con el dormir.
El sueño normal, su fisiología y su evolución a lo largo de la vida, serán tratadas en este artículo.
Sleep is an activity that consumes a third of a human lifespan and even after numerous scientific advances over the past decades, still raises important questions that require clarification.
Actually, the amount of people that suffer from alterations in their sleep, either in its pattern or in its quality, has risen significantly. Technological advances have been an important factor in the diminishing number of sleep hours. It can be asserted that the quality of a person’s life is, to a great extent, directly dependent on the quality of sleep and the time spent sleeping. The increasing knowledge about the implications of regular sleep on a person’s mental and physical health has made it a research topic that incites permanent interest and generates numerous investigations in several disciplines related to sleeping disorders.
Normal sleep, its physiology and its evolution throughout life will be revised in this article.
El interés científico y médico por el sueño y sus trastornos es muy reciente. Sin embargo, desde la antigüedad, científicos, filósofos, escritores y eruditos religiosos de diversas culturas se han planteado al menos dos preguntas: qué es el sueño y por qué dormimos, interrogantes que aún no tienen una respuesta completamente satisfactoria.
El sueño es un estado fisiológico, activo y rítmico, que aparece cada 24 horas, alternándose con otro estado que es la vigilia. Tiene una estructura y características propias, que han permitido identificar los patrones normales y anormales de sueño en el ser humano. Su evolución a lo largo de la vida ha experimentado variaciones significativas, especialmente en la sociedad actual (1, 2).
Para una buena comprensión de la compleja interacción entre el sueño y algunas enfermedades neurológicas, se detallarán algunas características propias del sueño normal, considerando su arquitectura, diferencias por grupo etario, género y la fisiología del dormir.
De los estudios epidemiológicos actuales y la experiencia clínica se desprende que los pacientes con quejas relacionadas con el sueño y sus trastornos son numerosos. Además, la repercusión de dichos trastornos sobre la salud pública y la sociedad moderna hace que los médicos y otros profesionales de la salud se preocupen cada vez más de contribuir a la solución de esos problemas.
Sueño normalAspectos generalesEl sueño del ser humano, según criterios polisomnográficos (electroencefalograma, electrooculograma y electromiograma) se divide fundamentalmente en sueño REM (R) (rapid eye movement) y en sueño No REM (NREM); los que se repiten en cuatro o cinco ciclos por noche, a intervalos de 90-120 minutos (1, 2). El sueño NREM, caracterizado por una actividad electroencefalográfica sincronizada, comprende a su vez, tres etapas: Sueño superficial o sueño en etapa 1 (N1), sueño intermedio o etapa 2 (N2), y sueño profundo o etapa 3 (N3) (1). El sueño en etapa N1 es considerado una transición entre la vigilia y el sueño, y representa entre el 2 al 5% del tiempo total dormido. La etapa N2 se caracteriza por la presencia de una lentitud θ difusa basal, con la presencia de husos de sueño y actividad de vértex, representando, en el adulto, el 45-55% del tiempo total dormido. Finalmente, el sueño profundo en etapa N3, se caracteriza por la presencia de ondas lentas, ä, de amplio voltaje y representa el 15-20% de la noche. En la medida que las etapas del sueño NREM progresan, se requiere un estímulo cada vez más poderoso para despertar al individuo. El sueño REM, caracterizado por una actividad electroencefalográfica más desincronizada y de bajo voltaje, por atonía muscular y por movimientos oculares rápidos, representa a su vez, el 20-25% del tiempo total dormido en el adulto y comprende componentes fásicos y tónicos. El componente fásico es controlado por el sistema simpático y se caracteriza por los movimientos oculares rápidos, contracciones musculares breves y por la variabilidad de la respiración. El componente tónico del sueño R, es controlado por el sistema parasimpático y se caracteriza por ausencia de los movimientos oculares rápidos (3).
En el adulto normal, el primer ciclo de sueño R, se produce a los 80-100 minutos de iniciado el dormir. Los adultos jóvenes habitualmente presentan cuatro a cinco períodos de sueño R a lo largo de la noche. Es anormal para el adulto, iniciar el sueño a través del sueño R. Por el contrario, en los niños, hasta los 3 meses de vida, pueden comenzar el dormir a través del sueño R (3).
A modo de ejemplo, algunas de los principales trastornos que pueden originar que el adulto comience a dormir a través de sueño R son: privación de sueño, cambios de husos de horario, caracterizados por un desequilibrio producido entre el “reloj interno” de una persona (que marca los periodos de sueño y vigilia) y el nuevo horario que se establece al viajar en avión largas distancias, a través de varias regiones horarias (jet-lag) ; Narcolepsia, fármacos, turnos laborales, apneas del sueño, entre otros, los cuales serán tratados en detalle en los diferentes capítulos de la presente edición (1, 2).
Por otra parte, en los mayores de tres meses de edad, el sueño R tiende a predominar la segunda mitad de la noche, a diferencia del sueño NREM, fase N3, el cual predomina la primera mitad de la noche. Hallazgo importante de considerar, por la connotación que tiene en el estudio y diagnóstico de las diferentes enfermedades del sueño (2, 3).
Características del sueño relativos a la edad de la personaEl sueño sufre modificaciones en función del desarrollo y madurez del niño, teniendo características propias que lo diferencian del sueño del adulto y del anciano.
La edad es un factor decisivo para la cantidad de horas de sueño. El recién nacido duerme entre 14 y 18 horas, el lactante entre 12 y 14 horas, el niño en etapa escolar entre 11 y 12 horas y en la edad adulta, la mayoría duerme entre 7 y 8 horas por noche. En otras palabras, es fisiológico que el número de horas dormidas vaya disminuyendo progresivamente a lo largo de la vida, pudiendo existir una diferencia de hasta 16 horas como promedio entre la niñez y la edad adulta. En los ancianos, el número de horas de diferencia entre las horas de sueño propias v/s las horas de sueño de la niñez, es aún mayor (5).
Es bien conocido y aceptado que lo ideal es dormir entre 7-8 horas por noche para mantener una buena salud y bienestar, sin embargo, existe la evidencia práctica de que cada individuo debe satisfacer su “cuota de sueño” para sentirse bien. Se describen así personas con un patrón de “sueño corto”, que necesitan pocas horas de descanso nocturno, con una media de 5 horas; otros sujetos con “patrón largo”, que duermen más de 9 horas por noche; y los que tienen un “patrón intermedio”, que constituyen la mayoría de los individuos, los que duermen entre 7 y 8 horas (4, 6).
Los estudios sobre la cantidad de horas del sueño en individuos sanos y su repercusión en salud, son aún escasos. Algunos estudios longitudinales y transversales sugieren que las personas con un patrón largo y corto de sueño, tienen un mayor riesgo de deterioro en su salud; los que duermen entre 7 y 8 horas gozarían de una mejor salud física y psíquica (6). En relación a las características propias del sueño, se sabe que los husos de sueño, característicos de la fase N2 del sueño NREM, aparecen habitualmente alrededor de las 6 a 8 semanas de vida. Sin embargo, el sueño NREM como tal, recién se reconoce claramente alrededor de los 3 a 6 meses de vida. Hasta entonces, el sueño NREM se identifica como “sueño quieto” y el sueño R, como “sueño activo”. También se describe el sueño “indeterminado o transicional”, el cual se caracteriza por un patrón electroencefalográfico que no corresponde a un patrón de sueño activo o quieto, el cual desaparece progresivamente con la maduración del niño (5, 6).
Otra característica del sueño infantil es que la proporción del sueño R y NREM se distribuye en partes iguales, es decir, cercano al 50% para cada uno, a diferencia del adulto joven, donde el sueño R no sobrepasa el 20-25% de la noche.
Otro cambio importante en relación a la arquitectura normal del sueño y el grupo etario, son los cambios propios del adulto mayor, especialmente después de los 60 años de edad. Se observa una disminución en la eficiencia del sueño (disminución del tiempo total de sueño), dado por una mayor dificultad para conciliar y mantener el sueño, por un aumento de los despertares nocturnos, por una reducción del sueño profundo en fase N3 y, en menor grado, por una reducción del sueño en fase R. En forma compensatoria, se ve un aumento del sueño en etapa N2 (7).
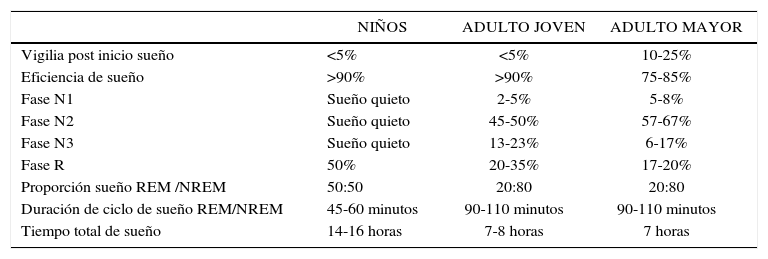
Patrón normal de sueño en el ser humano (1)
| NIÑOS | ADULTO JOVEN | ADULTO MAYOR | |
|---|---|---|---|
| Vigilia post inicio sueño | <5% | <5% | 10-25% |
| Eficiencia de sueño | >90% | >90% | 75-85% |
| Fase N1 | Sueño quieto | 2-5% | 5-8% |
| Fase N2 | Sueño quieto | 45-50% | 57-67% |
| Fase N3 | Sueño quieto | 13-23% | 6-17% |
| Fase R | 50% | 20-35% | 17-20% |
| Proporción sueño REM /NREM | 50:50 | 20:80 | 20:80 |
| Duración de ciclo de sueño REM/NREM | 45-60 minutos | 90-110 minutos | 90-110 minutos |
| Tiempo total de sueño | 14-16 horas | 7-8 horas | 7 horas |
Se han realizado varias investigaciones para estudiar las posibles diferencias en el patrón de sueño entre hombres y mujeres (8, 9).
En la vida adulta, las mujeres tienen una mejor calidad de sueño que los hombres, ya que se les identifica una latencia menor para iniciar el sueño y una eficiencia más alta. Sin embargo, las quejas de insomnio y somnolencia diurna son bastante más frecuentes en ellas, con un 58% frente a un 42% de los hombres (8, 10). Estas diferencias se atribuyen principalmente al efecto de los cambios hormonales propios de la mujer. Períodos fisiológicos de la vida de ellas, como lo son la pubertad, la menstruación, el embarazo y la menopausia, se asocian a mayor susceptibilidad de alteraciones en el patrón del dormir.
La mujer pre-menopáusica presenta una tendencia hacia una mejor eficiencia de sueño que el hombre. Se le describe además un sueño en fase N3 más prolongado, y una latencia para iniciar el sueño menor que el sexo masculino.
Por el contrario, la mujer post menopáusica presenta habitualmente una eficiencia de sueño más reducida, con un aumento de los microdespertares, dado principalmente por síntomas vasomotores tales como “bochornos” y sudoración nocturna; síntomas propios del climaterio, los que se corrigen rápidamente con el tratamiento de sustitución hormonal (8-10).
Fisiología del sueñoA pesar que el sueño es un estado de reposo, se ha podido determinar que la actividad neuronal del sistema nervioso central, en las distintas etapas del ciclo vigilia-sueño, están activas, tanto en vigilia como en el sueño. Durante el sueño, el cerebro estaría más sensible a estímulos internos más que externos (6).
El “interruptor” que permite conciliar el sueño, se encuentra localizado en el núcleo preóptico ventrolateral del Hipotálamo anterior. Esta área se activa durante el sueño y utiliza neurotransmisores inhibitorios GABA y galanina para iniciar el sueño, mediante la inhibición de las regiones del despertar (12, 13).
Durante el sueño de ondas lentas, la mayoría de las neuronas presenta una actividad menor que durante la vigilia, con excepción del grupo de neuronas del núcleo del tracto solitario y de la región preóptica, las que aumentan su actividad durante esta fase de sueño (14).
Durante el sueño R, la actividad general de las neuronas es igual o incluso mayor que en la vigilia, salvo las células serotoninérgicas del rafe y las noradrenérgicas del locus ceruleus que se silencian en esta etapa del sueño, volviéndose inactivas. Estas neuronas son las conocidas como las “REM-off”, dado por una inhibición de la liberación de dichos neurotransmisores durante esta fase. Algunos fármacos, tales como los antidepresivos, pueden aumentar la cantidad de norepinefrina y serotonina, causando una supresión del sueño en fase R. Otros neurotransmisores y neuromoduladores, tales como la acetilcolina, se liberan muy activamente durante el sueño R, tanto como en la vigilia. Las neuronas colinérgicas encargadas de esta producción del neurotransmisor se denominan “REM-on”, ubicadas en el tegmento mesopontino. Estas neuronas originan las características electroencefalográficas de una desincronización de bajo voltaje, propia del sueño R (14, 15).
El patrón del sueño tiene un ritmo circadiano.
El ser humano, al igual que en otras especies animales, presentan cambios cíclicos en sus funciones biológicas. En la mayoría de ellos, estas variaciones están estrictamente acopladas con claves ambientales (ej: luz solar, temperatura). Cuando la duración de estos ciclos es cercana a 24 horas se les llama “ritmos circadianos”, del latín circa (cercano a) y dia (día). En el ser humano, el ritmo circadiano se observa principalmente en la alternancia entre sueño y vigilia, pero también es posible observarlo en otras variables biológicas, como la temperatura corporal, la secreción de hormonas (ej: cortisol), las funciones cognitivas e incluso las emociones (11).
El sustrato neurológico que explica esta ritmicidad se encuentra en el hipotálamo, particularmente en el Nucleo Supraquiasmático, que regula el reloj biológico en 24.2 horas.
Esta estructura tiene múltiples conexiones dentro del Sistema Nervioso Central, que le permiten ejercer una función sincronizadora del organismo. Presenta 2 mecanismos: uno endógeno (que le permite variar su nivel de actividad en forma espontanea) y uno exógeno (que le permite coordinar su funcionamiento con variables externas relevantes).
En algunos individuos esta coordinación puede perderse, provocándose un desacople entre el patrón de sueño y el horario socialmente aceptado para dormir. Cuando esto produce malestar y disfuncionalidad signifcativos se denomina “Trastorno del ritmo circa-diano del sueño” (11, 12).
Sistema Cardiovascular durante el sueñoEl sistema cardiovascular, al igual que los otros sistemas orgánicos del ser humano, presenta un funcionamiento diferente en el sueño en relación a la vigilia.
Durante el sueño lento hay hipotensión, bradicardia, una reducción en la resistencia vascular periférica y una reducción de la eyección cardíaca en comparación con la vigilia. La bradicardia se produce fundamentalmente por un aumento de la actividad parasimpática vagal. La hipotensión se explica por la reducción del gasto cardíaco y de la resistencia vascular, dado por una vasodilatación de los vasos periféricos.
Por otra parte, la disminución de la frecuencia cardíaca puede atribuirse además, a un ritmo circadiano independiente del sueño, pues se ha descrito un efecto claro de la hora de la noche sobre los valores de la frecuencia cardíaca. Así, la frecuencia cardíaca disminuye significativamente al inicio de la fase de sueño lento y, posteriormente, continúa descendiendo hasta alcanzar sus valores mínimos durante la fase N3, siguiendo un patrón indicativo de influencia combinada tanto de la propia fase de sueño como de una puramente circadiana sobre esta variable. Es característico que la bradicardia que aparece durante el sueño lento es bastante regular, a diferencia de la irregularidad del latido durante el sueño en fase R (13-15).
La actividad parasimpática aumenta al inicio del sueño y permanece elevada durante toda la fase de sueño lento, a diferencia de la actividad simpática, la cual desciende durante esta fase del sueño. Durante el sueño R, la actividad parasimpática tiende a retornar a los niveles de la vigilia, aunque ligeramente más elevada. La actividad simpática aumenta durante el sueño REM y sus valores incluso superan los que se presentan durante la vigilia.
Las reducciones de la presión arterial, frecuencia cardíaca y tono simpático durante el sueño lento permiten que el corazón esté sometido a menor trabajo durante la gran parte de la noche, mientras que la disminución de la resistencia vascular permite asegurar la perfusión adecuada de los órganos vitales (12, 13).
Durante el sueño en fase R se produce un aumento marcado de la presión arterial y de la frecuencia cardíaca, así como una mayor variabilidad del latido cardíaco. Las diferencias de estas variables es menos clara entre el sueño REM y durante la vigilia.
Esta inestabilidad en los valores de la presión arterial y en la frecuencia cardíaca durante el sueño R, pueden comprometer el equilibrio entre las demandas metabólicas y la perfusión tisular de órganos vitales, por lo que se considera como un período de riesgo cardiovascular potencial, especialmente en aquellos individuos con enfermedades coronarias o cerebrovasculares (12-16).
Cambios fisiológicos del sistema cardiovascular durante el sueño (14)
| Caracteristicas fisiológicas | NREM | REM |
|---|---|---|
| Frecuencia cardíaca | ↓ | ↓↑ |
| Eyección cardíaca | ↓ | ↓↓ |
| Presión arterial sistémica | ↓ | ↓↑ |
| Presión arterial pulmonar | ↑ | ↑ |
| Resistencia vascular periférica | --↓ | ↓ |
| Flujo sanguíneo cerebral | ↓ | ↑ |
| ↑aumento; ↓descenso; ↓↑incierto; --sin cambios. | ||
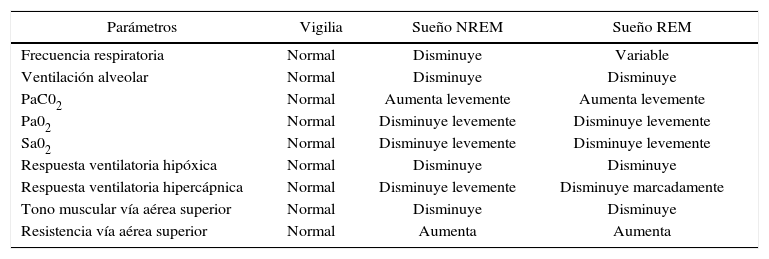
La vigilia es un estímulo potente para la ventilación, el cual es bastante independiente de los estímulos aferentes centrales o periféricos provenientes de los quimioreceptores. Durante el sueño, sin embargo, la respiración depende de una manera crítica del buen funcionamiento de las señales provenientes de los quimioreceptores.
El ritmo respiratorio disminuye durante el sueño debido a una disminución del metabolismo basal y por los cambios que ocurren en el control neural de la respiración. Durante el sueño lento, la frecuencia respiratoria es regular y levemente más baja que en la vigilia. Por otro lado, la respiración en el sueño lento es ligeramente más profunda que en la vigilia, ya que el volumen de aire inspirado es solo un poco mayor.
La sensibilidad de los centros respiratorios a la concentración de CO2 es menor cuando dormimos. Por lo tanto, durante el sueño lento, la ventilación pulmonar disminuye, lo que da lugar a un aumento del CO2 alveolar e hipercapnia; esto se traduce en una disminución del pH sanguíneo o acidosis típica del sueño. Por otra parte, presiones altas de CO2, que en vigilia producirían una respuesta ventilatoria taquipneica inmediata, no la producen durante el sueño lento. Ante la presencia de niveles altos de CO2 durante el sueño lento, se produce un despertar, con la consiguiente respuesta ventilatoria (12, 14, 15).
La sensibilidad al CO2 disminuye aún más durante el sueño en fase R. Las respuestas ventilatorias a la hipercapnia están muy atenuadas. Por término medio, la respiración en el sueño REM es algo más rápida y, por sobre todo, más irregular que durante el sueño lento. Es característica la presencia alternante de breves episodios de bradipnea y taquipnea.
El control respiratorio durante el sueño R parece depender exclusivamente del sistema nervioso central, siendo independiente de factores autonómicos o metabólicos, ya que estas irregulares del patrón ventilatorio se presentan tanto en la hipocapnia como en la hipercapnia (17).
Finalmente, durante el sueño, los músculos de las vías respiratorias altas presentan una hipotonía marcada, lo que puede originar una dificultad en el flujo aéreo en las vías respiratorias superiores, produciendo el ronquido. En el sueño R, los movimientos respiratorios se generan gracias al funcionamiento del diafragma, ya que la actividad de la musculatura intercostal está abolida. Durante el sueño, las secreciones respiratorias se retienen en la vía respiratoria, la cual se ve favorecida además por la ausencia del reflejo tusígeno, el cual está presente únicamente en la vigilia o en los despertares intrasueño, los que permiten despejar la vía aérea mientras dormimos (15-17). Condiciones propias del dormir que pueden favorecer la aparición de trastornos respiratorios del sueño, como lo son las apneas de tipo obstructivas.
(Tabla 3)
Cuadro resumen de los cambios fisiológicos respiratorios en el sueño (14)
| Parámetros | Vigilia | Sueño NREM | Sueño REM |
|---|---|---|---|
| Frecuencia respiratoria | Normal | Disminuye | Variable |
| Ventilación alveolar | Normal | Disminuye | Disminuye |
| PaC02 | Normal | Aumenta levemente | Aumenta levemente |
| Pa02 | Normal | Disminuye levemente | Disminuye levemente |
| Sa02 | Normal | Disminuye levemente | Disminuye levemente |
| Respuesta ventilatoria hipóxica | Normal | Disminuye | Disminuye |
| Respuesta ventilatoria hipercápnica | Normal | Disminuye levemente | Disminuye marcadamente |
| Tono muscular vía aérea superior | Normal | Disminuye | Disminuye |
| Resistencia vía aérea superior | Normal | Aumenta | Aumenta |
La temperatura corporal es una variable fisiológica compleja cuya regulación, controlada por el sistema nervioso autónomo, está sujeta a variaciones provocadas por múltiples causas externas e internas: hora del día, estación del año, edad, estado de salud, nutrición, ciclo menstrual y otros ritmos biológicos.
La temperatura corporal sufre oscilaciones de su valor a lo largo del día, controlada por un marcapaso circadiano interno (14, 15). Se sabe que la temperatura comienza a subir a primera hora de la tarde, alcanzando
sus valores más elevados alrededor de las 20:30 hrs, para luego comenzar a descender progresivamente, hasta alcanzar sus valores más bajos entre las 3 y 6 de la mañana. Se considera normal hasta 1.5 °C de diferencia entre el valor máximo y el valor mínimo; oscilaciones normales de la temperatura corporal durante las 24 hrs (12).
La regulación de la temperatura corporal está modulada por el sistema circadiano y por los mecanismos propios de control del sueño, según sea el estado: vigilia o sueño. Se sabe que la temperatura y el sueño tienen una estrecha relación evolutiva, considerando que todas las especies “mamíferas” duermen durante el descenso circadiano de la temperatura corporal. Lo anterior ha permitido deducir que hay una estrecha relación entre la inducción del sueño y el descenso de la temperatura corporal.
El patrón circadiano de la temperatura corporal se produce como resultado del equilibrio entre la producción y pérdida de calor. Esta pérdida de calor supone una conservación de la energía debida a la reducción del metabolismo corporal, lo que podría explicar uno de los motivos de por qué se origina el sueño. Es así como el sueño se origina cuando la temperatura corporal desciende como consecuencia de la redistribución del calor desde el interior del cuerpo hacia la periferia, siendo esta redistribución del calor una señal crucial para la iniciación del sueño. Este proceso de termorregulación tiene una modulación circadiana, la cual, se piensa, podría constituir un mecanismo modificador del ciclo sueñovigilia (11, 12, 15).
Tanto la temperatura ambiente como la temperatura corporal afectan profundamente la arquitectura del sueño. La influencia de la temperatura ambiente en la distribución de las fases del ciclo sueño-vigilia en seres humanos muestra que en ambientes fríos hay un aumento de la vigilia, de la latencia del sueño y del período de movimientos y, en general, una disminución del tiempo total de sueño, debido principalmente a la disminución de las fases de sueño N2 y de sueño R. Este mismo efecto sobre el sueño se describe en ambientes nocturnos cálidos. El tiempo total de sueño, la fase N3 del sueño NREM y el sueño R, alcanzan niveles máximos en ambientes térmicos neutros. Por lo anterior es importante señalar que la temperatura ambiente es un factor crucial tanto para la cantidad como para la calidad del sueño. Se sabe además que el sueño R es más sensible a estas variaciones de la temperatura ambiente, en relación al sueño NREM (17).
Estudios recientes, que miden la temperatura corporal en diferentes puntos de la piel, han mostrado que el grado de dilatación de los vasos sanguíneos de la piel de las manos y pies, con el consiguiente aumento de la pérdida de calor, es el parámetro más fiable para predecir una pronta entrada en el sueño. Esta pérdida de calor corporal de las partes distales de las extremidades, produce somnolencia, seguida de una fase de sueño (15, 17).
Estos efectos termofisiológicos representan el punto de unión entre el ciclo circadiano de la temperatura y el ciclo sueño-vigilia. La interrelación entre estos dos ciclos se ha podido estudiar ampliamente en un grupo de individuos que padecen de “manos y pies fríos”, conocido como el Síndrome Vasoespástico (15). Las personas con Síndrome Vasoespástico, generalmente del sexo femenino, presentan no sólo una bajísima capacidad de perder calor durante el día, sino también una prolongada latencia del sueño, y, una alteración del ciclo circadiano con respecto al ciclo sueño-vigilia. De estos estudios se deduce que las dificultades para iniciar el sueño pueden deberse a una disminución en la capacidad para regular la pérdida de calor (15, 17).
Finalmente, las relaciones entre el sueño y el control de la temperatura corporal tienen implicancias importantes en una gran variedad de problemas clínicos, desde el síndrome de muerte súbita del recién nacido, hasta el insomnio y las alteraciones de sueño producidas por el desajuste de los ritmos circadianos del sueño y la temperatura corporal (17).
Sistema Endocrino y sueñoEs bastante conocido ya que la secreción de numerosas hormonas sigue un ritmo circadiano que puede o no estar asociado al ciclo sueño-vigilia.
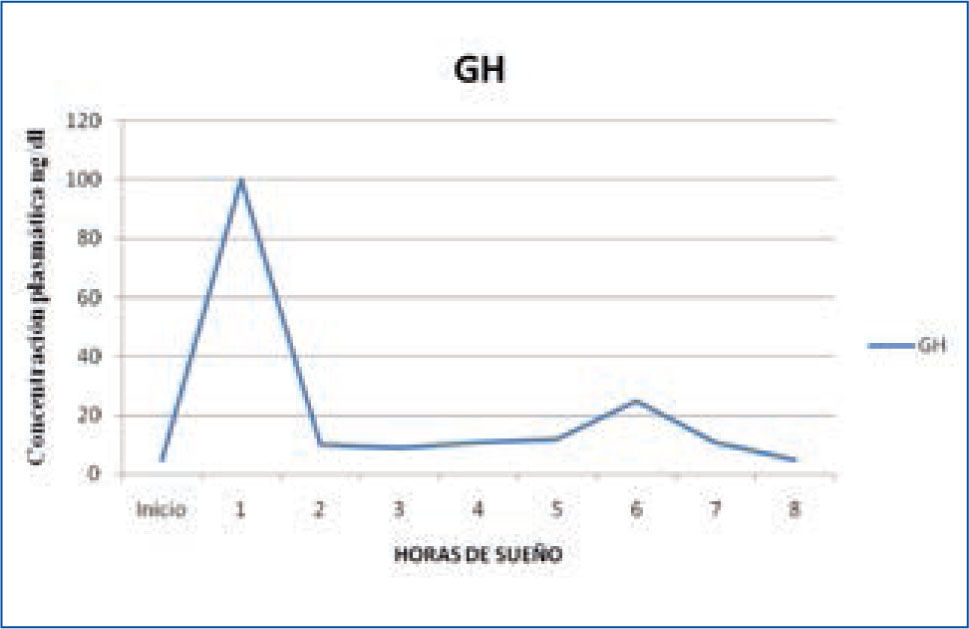
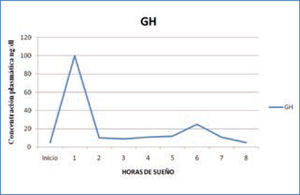
a) Hormona del Crecimiento: la hormona del crecimiento (GH) es secretada por la Hipófisis, bajo la regulación del Hipotálamo, mediante el factor de regulación de esta hormona: GHRH. Su secreción se produce al principio de la noche, en relación al primer episodio de sueño N3 del sueño NREM, alcanzando niveles de hasta 60 ng/ml, con una correlación entre el tiempo transcurrido en sueño lento y la cantidad de GH secretada a la sangre. Existe una relación tan estrecha, que si se interrumpe el sueño, se produce una disminución significativa de la secreción de GH (3,12,15). (Figura 1)
Variación nocturna de GH
Con la edad, tanto la proporción del sueño lento como la cantidad de secreción de GH disminuyen progresivamente. En personas mayores de 50 años, ya no hay liberación de GH durante el sueño, lo que coincide con la disminución fisiológica progresiva del sueño lento N3 (15).
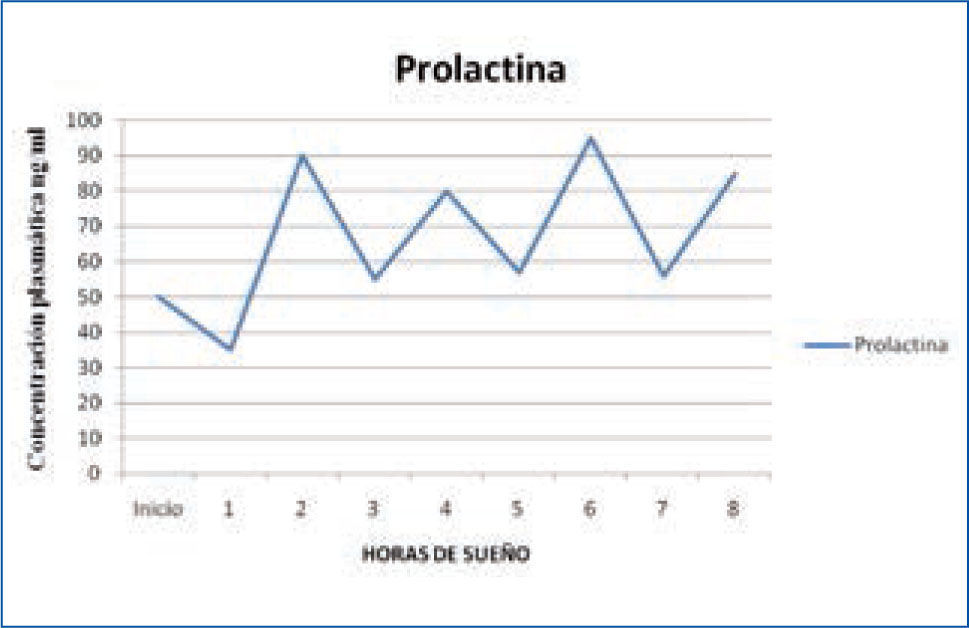
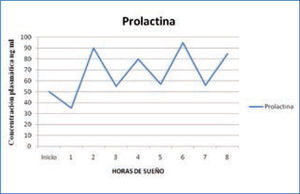
b) Prolactina: la secreción de prolactina (PRL) aumenta de forma continua durante la noche y alcanza la concentración máxima antes de terminar el período de sueño, entre las 5 y 7 am (1,15) (Figura 2).
Variación nocturna de prolactina
La concentración disminuye rápidamente cuando el individuo despierta y se mantiene en niveles estables durante el día. Un despertar nocturno, también se asocia a una inhibición de la secreción de la PRL. Se ha demostrado además que el sueño aumenta la secreción de la PRL, fundamentalmente asociada a la cantidad de sueño lento N3. Por ende, si el sueño es fragmentado, la producción de PRL es claramente menor (15).
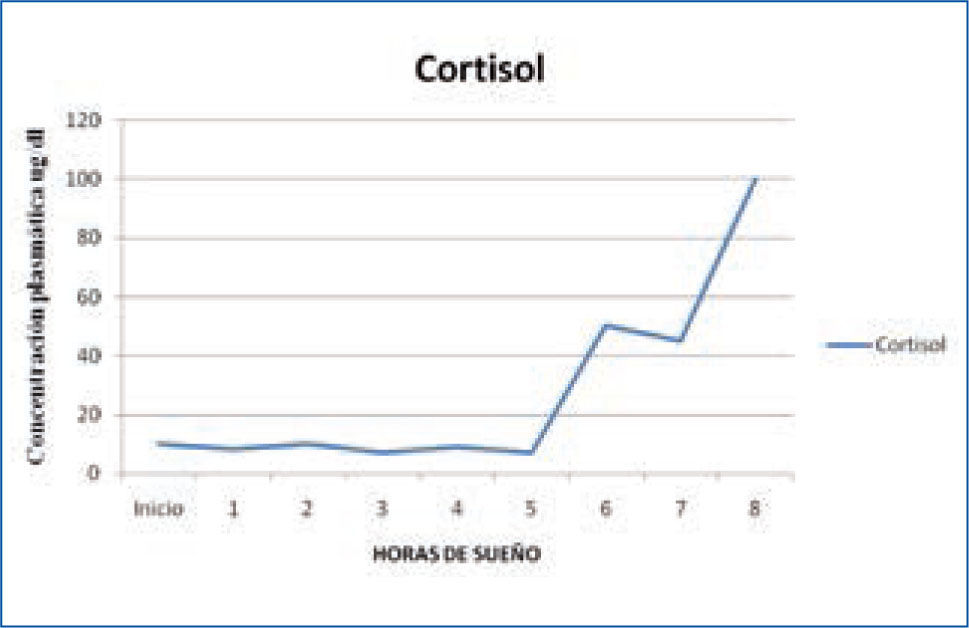
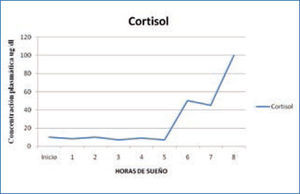
c) Adrenocorticotropina y cortisol: la secreción de la hormona adrenocorticotropina (ACTH) y de la hormona adrenal cortisol, controlada por la ACTH, se modula durante el ciclo sueño-vigilia siguiendo un ritmo circadiano. El primer “pick” de secreción se produce en las últimas horas de la noche, y los niveles más altos se alcanzan durante el día; los niveles más bajos se producen al final de la tarde y en las primeras horas de la noche. La secreción de cortisol sigue un ritmo circadiano que sólo se modifica ligeramente cuando se hacen cambios en el ciclo sueño-vigilia. (Figura 3). Se ha establecido que el sueño lento N3, inhibe la secreción de cortisol (15, 17).
Variación nocturna cortisol
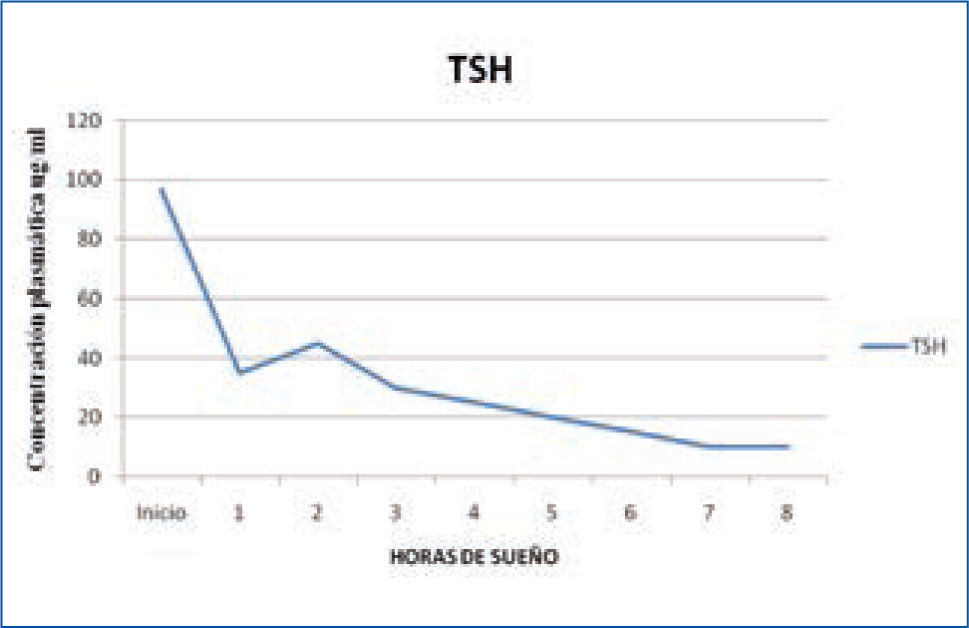
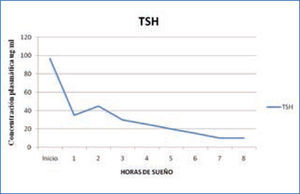
d) Tirotropina: los niveles de Tirotropina u hormona estimulante de la tiroides (TSH) son bajos durante el día, comenzando a elevarse las últimas horas de la tarde, alcanzando su máximo al comienzo del sueño (Figura 4). Estudios de privación de sueño han demostrado la clara asociación entre el sueño y la secreción de TSH. Durante la privación se produce una secreción de TSH 200% mayor que durante el sueño, demostrando que el sueño tiene un efecto inhibidor de la secreción de esta hormona. Este efecto inhibidor solo se produce durante la noche, ya que un período prolongado de sueño durante el día, no modifica los niveles de TSH en la sangre (14, 15).
Variación nocturna de TSH
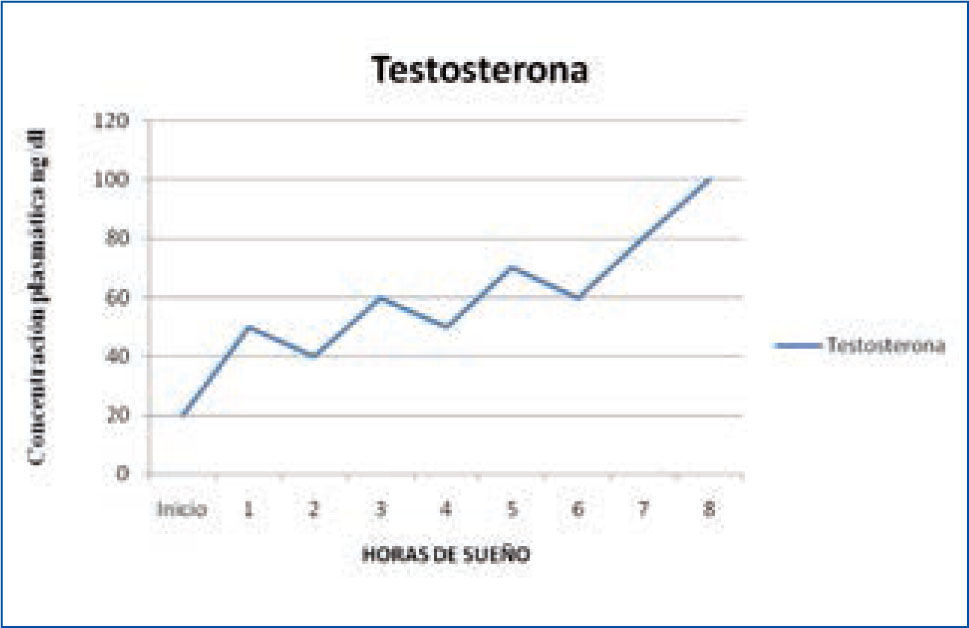
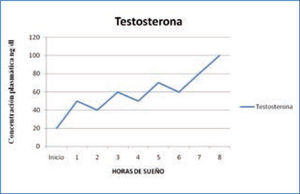
e) Testosterona y hormona luteinizante: la testosterona y la hormona luteinizante (LH) también tienen un ciclo de secreción asociado al sueño. La secreción de testosterona aumenta al principio del período de sueño, está asociada a la aparición del primer ciclo de sueño R y se mantiene elevada durante toda la noche (Figura 5). La LH también sigue un ritmo similar, asociado al primer ciclo de sueño R, aunque los cambios de concentración durante las 24 horas son menores (13-15).
Variación nocturna de testosterona
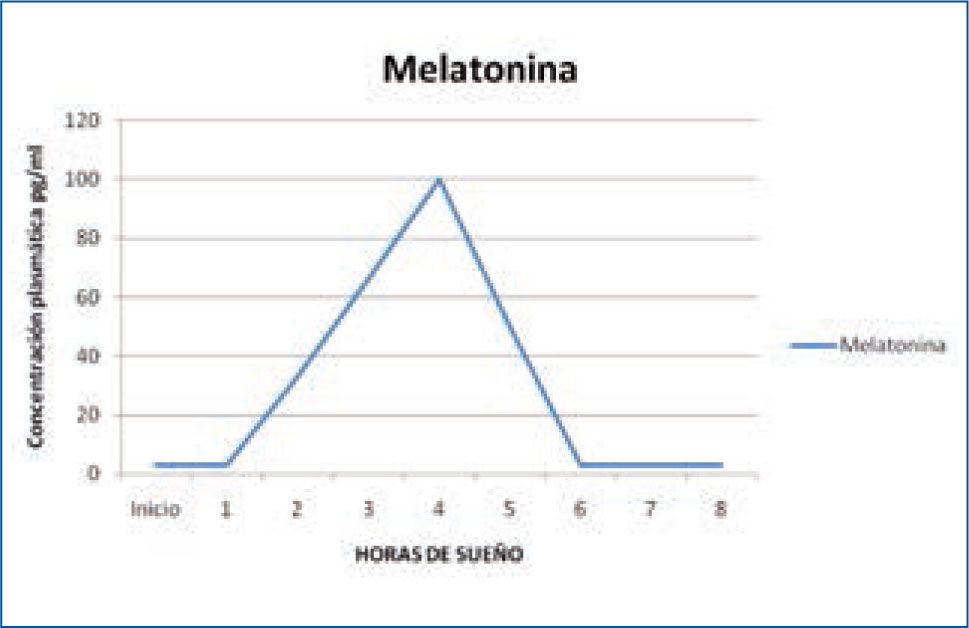
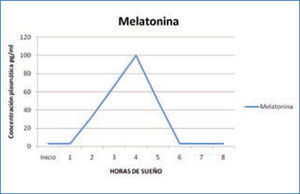
f) Melatonina: la glándula pineal, que constituye una interfase principal entre el medio ambiente luminoso, el sistema endocrino y el sistema nervioso central, sintetiza la hormona melatonina a partir del triptófano y la libera a la circulación sanguínea, en condiciones de oscuridad; por tanto, esta hormona alcanza su concentración máxima durante la noche (Figura 6).
Variación nocturna de melatonina
La liberación de melatonina no se potencia durante el sueño ni se inhibe por la vigilia, sino que su liberación nocturna se inhibe por la luz. Por lo tanto, se considera que la melatonina tiene todas las características de un “marcapaso” de muchas de las actividades del individuo. El incremento nocturno de la melatonina, parece favorecer la aparición de sueño. Los niveles nocturnos más altos de esta hormona, se ven entre los 1 a 5 años de edad, y luego disminuyen constantemente hasta la pubertad. La melatonina ejerce funciones reguladoras del ciclo sueño-vigilia, favoreciendo la propensión al sueño; pero además, influye en el ritmo de la temperatura corporal, en el de secreción de cortisol y en el de la propia secreción interna de melatonina (15).
Por sus efectos favorecedores para iniciar el sueño, la melatonina tendría una indicación ideal para tratar el insomnio producido por alteración del ritmo natural del sueño en viajeros, “jet lag”, y en trabajadores con turnos irregulares. Actualmente se investiga su efecto sobre otras causas que producen insomnio (13, 15, 17).
El sistema inmune y el sueñoEstá bien establecido que los cuadros febriles se asocian a un aumento del sueño. Numerosos estudios en animales han demostrado que la fiebre produce un aumento del sueño lento, fase N3 del sueño NREM, así como una disminución del sueño R. Se sabe además que los efectos de la infección sobre el sueño no son debidas exclusivamente al aumento de la temperatura corporal, ya que experimentalmente se ha podido separar la respuesta pirógena y la respuesta en el sueño (15). Se acepta hoy en día que los efectos de la infección sobre el sueño son desencadenados por la participación de determinadas citocinas producidas por el sistema inmune: la administración de citocinas proinflamatorias como la interleucina 1, el factor de necrosis tumoral o el interferon producen un aumento del sueño lento. Varias de estas citocinas y sus receptores están en el tejido cerebral, por lo que no se descarta que, aun en ausencia de infección, puedan actuar como moduladores en los circuitos cerebrales de los estados de sueño, fundamentalmente, en las fases de sueño lento. Hay datos también que apoyan que la actividad del sistema inmune varía con el ciclo sueño-vigilia: en el hipotálamo se han detectado “pick” de liberación de citocinas relacionadas con el inicio del sueño; en humanos sanos, este “pick” de liberación es mayor tras la privación de sueño y en los pacientes con apneas del sueño, el patrón de liberación está alterado (17).
Estos datos sobre la relación bidireccional entre el sueño y el sistema inmune permiten afirmar que el sueño no es un simple estado de preservación de energía y consolidan la hipótesis que el sueño, especialmente el sueño lento, pueda tener una función reparadora favoreciendo funciones del sistema inmune (15, 17).
La sociedad moderna y la evolución del dormir a los largo de la vidaEl sueño es un excelente indicador del estado de salud de los individuos. Los problemas de salud que generan alteraciones en el dormir son muy numerosos y constituyen hoy en día, uno de los problemas de salud más importantes en la sociedad actual y, además, son también los menos comprendidos.
Estudios recientes revelan que aproximadamente un 30% de las personas tiene una mala calidad del dormir, esto es, alteraciones en la duración, latencia, número de despertares del sueño (18). Este hecho pone de manifiesto la alta prevalencia de los trastornos del sueño a lo largo de la vida y la necesidad de su medición. Lo más frecuente dentro de los problemas del sueño, son las dificultades para conciliar y/o mantener el sueño nocturno, la excesiva somnolencia diurna y la dificultad para levantarse (18, 19).
La luz artificial que emiten las diferentes pantallas (televisión, computadores, celulares) y el estado de alerta que generan estos dispositivos, suprimen la liberación de melatonina, hormona relacionada con la iniciación del sueño, tal como se señaló previamente. Estos avances tecnológicos afectan seis de cada diez personas, según un estudio publicado por la Fundación Nacional del Sueño (NSF) de Estados Unidos (19).
Numerosos y diversos otros estudios revelan que, desde principios del siglo XX hasta la fecha, se han perdido en promedio dos horas de sueño por noche, como consecuencia de la expansión de la luz eléctrica, y luego de la televisión y los computadores, entre otros (18, 20).
En el caso de Chile, a pesar que los datos son escasos, según la Encuesta Nacional de Salud del año 2010, el 63.2% de los mayores de 15 años, reconoce tener problemas para dormir (21). El 50% de los chilenos no es capaz de conciliar o mantener el sueño por más de unas pocas horas, según cifras de la encuesta realizada por la consultora Collect GFK el año 2012. De estos, al menos un 25% padece de Insomnio crónico, es decir, dificultad para conciliar el sueño superior a 3 semanas o un mes. Se sabe además que el número de chilenos que duerme seis horas por noche aumentó de un 30 a un 80% en la última década (21).
Potenciar hábitos saludables y practicar una correcta higiene del sueño implica mejorar la salud, prevenir las enfermedades y acrecentar la calidad de vida (18, 20).
La autora declara no tener conflictos de interés, con relación a este artículo.