El asma bronquial una de las patologías crónicas más frecuentes en el embarazo, afectando entre el 6 al 10% de la población de mujeres en gestación según reportes internacionales. De este grupo de pacientes, aproximadamente un tercio presentará un deterioro importante de los síntomas, exponiendo a la madre y el feto a un alto riesgo de exacerbaciones y uso de corticoides sistémicos. El mal control de los síntomas del asma se debe en muchos casos a dosis subóptimas, e incluso suspensión de la terapia con corticosteroide inhalado, que constituye la base de la terapia antiinflamatoria y controladora en el asma. Está demostrado que el asma mal controlada en el embarazo aumenta el riesgo de complicaciones obstétricas. El manejo respiratorio de estas pacientes debe ser proactivo, basado en la educación y el uso informado de los tratamientos antiasmáticos, altamente efectivos y de fácil acceso para la mayoría de las pacientes. En este artículo se revisará la fisiopatología, el diagnóstico y manejo farmacológico del asma en el embarazo.
Bronchial asthma is considered one of the most common chronic pathologies in pregnancy, affecting between 6 to 10% of pregnant women according to international reports. In this group of patients, approximately one third will present a significant aggravation in asthma symptoms, exposing the mother and fetus to a high risk of exacerbations and use of systemic corticosteroids. Poor control of asthma symptoms is in many cases due to suspension or suboptimal therapy with inhaled corticosteroid, which constitutes the basis of anti-inflammatory and controller therapy in asthma. It has been shown that poorly controlled asthma during pregnancy increases the risk of obstetric complications. The respiratory management of these patients must be proactive, patient education based and with informed use of anti-asthmatic treatments, which are highly effective and, for most patients, easily accessible. This article will review the pathophysiology, diagnosis and pharmacological management of asthma in pregnancy.
El asma bronquial es una comorbilidad prevalente en el embarazo que puede evolucionar con deterioro de la enfermedad respiratoria en el transcurso de la gestación y complicarse con resultados perinatales adversos que afecten la unidad materno-fetal. A menudo estas complicaciones se deben a que la madre sufre de asma mal controlada durante el embarazo como también a la ocurrencia de episodios de asma aguda (conocida como exacerbaciones o crisis asmáticas). Las exacerbaciones de asma se asocian con alteraciones en la función placentaria e impactan en el desarrollo y crecimiento fetal. Estudios de seguimiento de hijos de madres asmáticas han revelado que estos niños tienen mayor riesgo de desarrollar asma bronquial, pudiendo presentar alteraciones de la microvasculatura con posible riesgo cardiovascular a futuro, así como modificación del funcionamiento de células del sistema inmune por probables cambios epigenéticos.
En cambio, se ha demostrado que las embarazadas que han llevado un buen control del asma tienen resultados perinatales normales con un desarrollo fetal normal. Por esta razón, se necesita mejorar el manejo de las asmáticas durante el embarazo para prevenir efectos adversos para el feto.
La educación de los profesionales de la salud que participan en el control de la embarazada asmática y de su entorno son factores clave para facilitar el manejo adecuado del asma durante el embarazo.
En este artículo se revisará la fisiopatología, el diagnóstico y manejo farmacológico del asma en el embarazo.
EpidemiologíaEl asma bronquial es una patología crónica frecuente en el embarazo e implica un riesgo potencial de complicaciones graves para la madre y el hijo. Es por ello que en Chile, y en otros países, las embarazadas son derivadas a una atención especializada en un Policlínico de Alto Riesgo si se detecta o sospecha el diagnóstico de asma1. Las cifras de prevalencia de asma bronquial durante el embarazo se reportan entre el 3 y 6% a nivel mundial, y en Estados Unidos se reporta hasta en el 10% de las embarazadas2. En Latinoamérica, no existen datos actualizados de prevalencia de asma en embarazo, a excepción de Brasil donde se realizó un estudio observacional con un cuestionario aplicado a 4 757 mujeres, que identificó una prevalencia de 6,3% en el diagnóstico de asma durante o previo al embarazo3. En las pacientes con asma y embarazo hasta el 19% presenta asma severa, superando la prevalencia de asma grave en la población adulta4. La estadística basada en la experiencia que afirma que “un tercio de las embarazadas mejora los síntomas del asma, un tercio empeora y que un tercio persiste sin cambios” se confirmó en un metaanálisis que incluyó 14 estudios clínicos5.
Cambios fisiológicos en el embarazoDebido a cambios fisiológicos adaptativos presentes en distintos sistemas durante la gestación, la disnea es frecuente hasta en el 60% de las embarazadas6.
El sistema cardiovascular se adapta a los requerimientos del embarazo con un aumento de la frecuencia cardíaca, del índice cardíaco y con disminución de la resistencia vascular periférica. El consumo de oxígeno se incrementa en un 20% por aumento del metabolismo6,7.
La elevación de los niveles de progesterona produce un aumento de la ventilación desde el primer trimestre del embarazo, produciendo una característica disminución de la PaCO2 y una alcalosis respiratoria fisiológica y transitoria6,7.
En el aparato respiratorio se producen cambios en la conformación del tórax a medida que avanza la gestación. Se produce una elevación del diafragma (hasta 4cm), con ensanchamiento de la base del tórax, lo que produce una disminución del volumen residual (VR) y del volumen de reserva espiratoria (VRE), mientras que se incrementa el volumen corriente (VC) sin incremento importante de la frecuencia respiratoria. Es relevante destacar que en las embarazadas no asmáticas la espirometría se mantiene sin variación significativa, la capacidad vital (CV) persiste en rangos normales al igual que la medición de los flujos espiratorios (forced expiratory volume in 1 second (FEV1) y peak expiratory flow (PEF)). Por lo tanto, en mujeres embarazadas con asma, cualquier cambio espirométrico debe ser motivo de alerta6,7.
¿Cómo influye el embarazo en el curso del asma?Se conoce que el embarazo puede influir en el curso del asma, produciendo un potencial deterioro de los síntomas de la enfermedad en aproximadamente el 30% de las pacientes5. Se postula que este deterioro podría ocurrir como respuesta a los cambios hormonales, cambios fisiológicos respiratorios y a una mayor susceptibilidad a las infecciones virales8. La limitación del flujo de aire puede objetivarse en las embarazadas con la espirometría (es decir, la presencia de un patrón ventilatorio obstructivo con la disminución del FEV1 y una relación FEV1/FVC bajo el límite del valor teórico). Los síntomas clásicos de asma en conjunto con la reducción de los flujos espiratorios (del FEV1 en la espirometría o del PEF) pueden ser útiles para detectar el deterioro del asma en las embarazadas9.
¿Cómo afecta el estado del asma en el curso del embarazo?La relación entre el estado del asma y la evolución del embarazo es muy compleja. Actualmente existe bastante evidencia del impacto del control de los síntomas y de la severidad del asma en el buen desarrollo del embarazo (tabla 1).
Resultados adversos maternos y fetales y su relación con el asma mal controlada
| Materno | Perinatal | Fetal |
|---|---|---|
| Hemorragia pre y post parto | Placenta previa | Muerte fetal |
| Cesárea de urgencia | Desprendimiento de placenta | Hospitalización neonatal |
| Diabetes gestacional | Ruptura prematura de membranas | Bajo peso al nacer |
| Hipertensión arterial gestacional | Recién nacido pequeño para edad gestacional | |
| Preeclampsia | Fisura labio-palatina |
(Adaptado de Bonham et al)7.
Algunos estudios muestran que la severidad del asma y la intensidad del tratamiento se asocian a un mayor riesgo de preeclampsia9. Existe evidencia que demuestra que además de preeclampsia, existe un aumento del riesgo para otras complicaciones como cesárea de urgencia, bajo peso al nacer y manejo en unidad de intensivo neonatológico10.
Una paciente embarazada con mal control de los síntomas de asma puede sufrir hipoxia, lo que afecta directamente al feto. Las crisis o exacerbaciones del asma en el embarazo conllevan mayor riesgo de morbilidad y mortalidad fetal, lo que parece estar relacionado además al uso de corticoide oral o sistémico en el manejo de las exacerbaciones. El análisis del uso de esteroide sistémico en las crisis asmáticas en el embarazo ha mostrado un aumento significativo del riesgo de bajo peso al nacer (RR: 1,41)9,11,12.
Adicionalmente, el asma en embarazadas se asocia al desarrollo de otras complicaciones o comorbilidades. Un metaanálisis de hace ya una década demostró el aumento del riesgo de diabetes gestacional en embarazos con asma (RR: 1,39)13. Si bien existen estudios más recientes, muestran resultados no concluyentes.
La tasa de embolia pulmonar reportada en embarazo es baja, sin embargo, es significativamente superior en el grupo de pacientes con asma (0,06% en embarazadas no asmáticas y 0,12% en asmáticas)14.
El asma también puede aumentar la susceptibilidad a infecciones virales en embarazo, haciendo más frecuentes y severos los episodios de infecciones virales. En un estudio controlado que incluyo a 297 embarazadas hospitalizadas por influenza se demostró que el asma es el factor de riesgo más importante para hospitalización, con un odds-ratio (OR) o razón de probabilidad de 10,63 (95% CI, 8,18-13,81)15. Por ello, es de vital importancia dentro del manejo de estas pacientes insistir en la importancia de la inmunización para la influenza. Durante la pandemia de H1N1, en el grupo de pacientes embarazadas que fallecieron por influenza la comorbilidad más frecuente fue el asma en el 44% de los casos16.
Una preocupación frecuente de las pacientes se relaciona al riesgo de malformaciones congénitas y el tratamiento farmacológico del asma. Actualmente existe literatura médica contradictoria sobre el efecto del asma materna como causa de malformaciones congénitas y de patología neonatal. En una cohorte de 36 587 mujeres asmáticas se detectó un aumento del riesgo de malformaciones congénitas en las pacientes que presentaron exacerbaciones severas de asma durante el primer trimestre de la gestación (se incluyó a pacientes con uso de corticoide sistémico, consulta en urgencia u hospitalización por asma en el primer trimestre). Se registró en este grupo que el 9,2% de los recién nacidos presentaba al menos una malformación congénita y que el 6% presentó malformación congénita compleja o mayor. El OR para todas las malformaciones fue de 1,48 (IC del 95%, 1,04-2,09) en las pacientes que sufrieron una exacerbación asmática severa en el primer trimestre del embarazo17.
El metaanálisis de Murphy et al., que incluyó estudios entre 1975 y 2012, estratificó a las gestantes por severidad del asma, el uso de broncodilatadores, el uso de corticoide oral e historia de exacerbaciones durante el embarazo. Se detectó una asociación significativa entre la severidad del asma de la madre y la presencia de fisura palatina o labio leporino (RR: 1,30) en el recién nacido. En este metaanálisis no se encontró una asociación entre el uso de broncodilatadores o el uso de corticosteroides inhalados (CSI) y malformaciones congénitas18.
Por otra parte, existe evidencia que el manejo pro-activo del asma con un tratamiento adecuado al propósito de lograr un buen control de la enfermedad en el embarazo es un factor protector de complicaciones para la unidad materno fetal; así se demostró en un meta-análisis que mostró una reducción del riesgo de trabajo de parto prematuro y parto prematuro en los estudios de manejo pro-activo19.
El asma tiene influencia incluso antes de la concepción del embarazo, disminuyendo la fertilidad en mujeres asmáticas. Sin embargo, cuando las asmáticas están bajo terapia adecuada con CSI tienden a tener mejores niveles de fertilidad en comparación con mujeres que sólo reciben terapia broncodilatadora (ej. salbutamol)20.
Posibles mecanismos del impacto del asma en el curso del embarazoActualmente se conocen algunos posibles mecanismos del efecto del asma sobre el desarrollo del embarazo. Se han estudiado los posibles mecanismos fisiopatológicos intrauterinos responsables de la alteración del desarrollo fetal en mujeres afectadas por asma. La mayoría de los estudios sugieren que los efectos del asma en sí (y no el uso de corticoide inhalado durante el embarazo) es lo que tendría el mayor impacto sobre desarrollo fetal. Hay estudios interesantes que describen diferencias específicas según el sexo del hijo en el proceso de adaptación fetoplacentaria en las pacientes con asma. Un estudio del 2003 demostró que el asma materna se asocia con un menor crecimiento de los fetos de sexo femenino: los niveles placentarios de 11 beta-hidroxiesteroide deshidrogenasa tipo 2 (11-β-HSD2) al momento del parto se encontraron disminuidos en los fetos de sexo femenino, con una monocitosis circulante en la madre, una reducción del estriol fetal, y un cortisol plasmático fetal elevado. En gestantes asmáticas con feto femenino que no fueron tratadas con corticosteroide inhalado (solo con salbutamol) se observó una reducción significativa del peso al nacer, mientras que en gestantes asmáticas con feto masculino con el mismo tratamiento antiasmático los fetos tuvieron peso normal al nacer21.
Otro estudio también evaluó las diferencias cuando los embarazos se estratificaron según el sexo del feto: las mujeres asmáticas embarazadas con fetos femeninos tenían un mayor riesgo de tener recién nacidos pequeños para la edad gestacional; en cambio, en el caso de los embarazos con fetos masculinos mostraban una tendencia al parto prematuro22. Las diferencias en el resultado de los embarazos según el sexo fetal se revisan en una interesante publicación de estudios de medicina traslacional enfocados en la función placentaria y su adaptación en presencia de asma materna23.
Existen mecanismos clave en la placenta que dependen del sexo fetal y que pueden influir en la supervivencia y el normal crecimiento del feto en presencia de asma materna. La placenta tiene una notable capacidad para adaptarse al estrés oxidativo desde el inicio del embarazo, como ocurre en el asma no controlada y con exacerbaciones; esta adaptación se produce en una forma distinta y específica según el sexo fetal. Se investigan los mecanismos por los que el feto masculino tendría un riesgo mayor de complicaciones en comparación con el feto femenino en presencia de asma materna y una exacerbación. Uno de los mecanismos específicos en este aspecto se refiere a las diferencias en la respuesta inmune placentaria al asma materna según el sexo fetal y su regulación por el cortisol. En forma fisiológica se produce un aumento de hasta 4 veces de los niveles de cortisol materno durante el embarazo; para regular la exposición a los niveles de cortisol circulante la placenta cuenta con una barrera natural a los glucocorticoides, la glicoproteína P, la enzima 11β-HSD2 e isoformas del receptor de glucocorticoides. En las embarazadas con asma se ha demostrado una menor eficacia de esta barrera. La 11β-HSD2 es una enzima que controla la disponibilidad del cortisol y la activación de los receptores de glucocorticoides en la placenta mediante el paso de cortisol materno al metabolito inactivo cortisona, con lo que impide la exposición fetal a niveles anormalmente elevados de cortisol. Los fetos masculinos tienen una placenta con resistencia al efecto glucocorticoide, lo que facilita el crecimiento fetal en un ambiente rico en cortisol. En el caso de los fetos femeninos, se postula que la sensibilidad continua al efecto del cortisol puede modular vías inmunes con un resultado protector ante el estrés, por ejemplo, ante la presencia de infecciones23.
En embarazadas con asma bronquial en que se ha demostrado una reducción de la enzima 11β-HSD2 con un aumento de la exposición fetal a cortisol, se pueden reconocer trastornos en la programación de diversos sistemas, principalmente cardiovascular y metabólico. Una consecuencia vascular es la alteración de la transcripción del gen del receptor de angiotensina II tipo 1 (AGTR1), con vasoconstricción a nivel placentario, menor flujo sanguíneo fetal y mayor inflamación de la placenta. Este fenómeno sería responsable del mayor riesgo de preeclampsia y bajo peso al nacer24.
El riesgo obstétrico varía con el grado de control del asma: el efecto de las exacerbacionesLas exacerbaciones de asma son un marcador de mal control de la enfermedad y el asma mal controlada se asocia a un aumento de las complicaciones materno-fetales.
En un estudio publicado el año 2020 en una población de embarazadas asmáticas en Canadá, se analizó el resultado de 103 424 gestaciones únicas, reportando que las exacerbaciones o crisis asmáticas se asociaron con tasas significativamente más altas de malformaciones congénitas (OR 1,21, 95% CI 1,05-1,39), parto prematuro (OR 1,14, 95% CI 1,01-1,29) y bajo peso al nacer (OR 1,14, 95% CI 1,00-1,31)25.
Según distintos estudios, se sabe que hasta el 45% de las mujeres sufre de una exacerbación de asma durante el embarazo. Una historia pregestacional de exacerbaciones frecuentes y de mal control de sintomatología asmática pese a un tratamiento adecuado con dosis de CSI moderada a alta y broncodilatadores de acción prolongada, son predictores de exacerbaciones asmáticas graves durante el embarazo26.
Recientemente se publicó un metaanálisis con una revisión sistemática de la literatura científica que identificó los principales factores de riesgo para presentar exacerbaciones durante el embarazo: edad materna mayor a 35 años, la presencia de obesidad, tabaquismo, raza negra, multiparidad, depresión/ansiedad y asma moderada a severa pregestacional27. Otra causa muy frecuente de exacerbaciones asmáticas es la falta de tratamiento con CSI como terapia antiinflamatoria, factor modificable que tiene efecto protector para las exacerbaciones y la salud materno fetal28.
La falta de adherencia a la terapia con CSI en el embarazo es frecuente y decae hasta menos del 30% de las pacientes en el primer trimestre. Las razones principales reportadas por las pacientes son la falta de información y temor por la seguridad farmacológica en embarazo y durante la lactancia29. Es fundamental entregar educación a las pacientes en edad fértil y en embarazadas para evitar el abandono de la terapia antiinflamatoria con CSI.
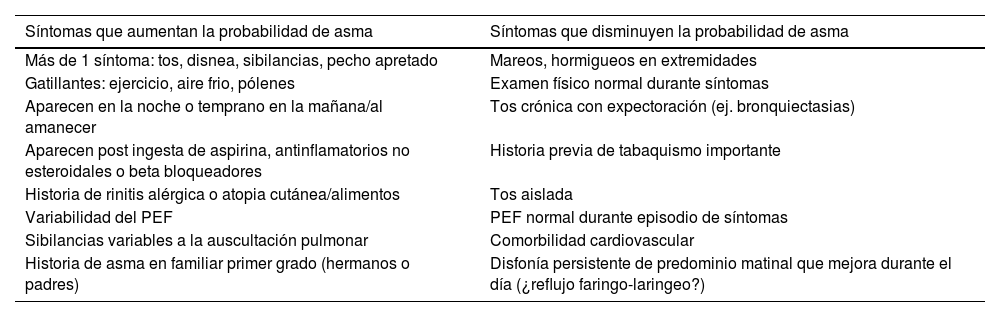
Evaluación y diagnóstico de asma en el embarazoPara realizar el diagnóstico (al igual que en pacientes sin la condición de embarazo), se requiere la presencia de síntomas característicos y de la variabilidad de los flujos espiratorios. Existen síntomas y signos que orientan a favor o en contra de la probabilidad del diagnóstico de asma en el embarazo (tabla 2).
Síntomas y signos que orientan o reducen la probabilidad de asma en el embarazo
| Síntomas que aumentan la probabilidad de asma | Síntomas que disminuyen la probabilidad de asma |
|---|---|
| Más de 1 síntoma: tos, disnea, sibilancias, pecho apretado | Mareos, hormigueos en extremidades |
| Gatillantes: ejercicio, aire frio, pólenes | Examen físico normal durante síntomas |
| Aparecen en la noche o temprano en la mañana/al amanecer | Tos crónica con expectoración (ej. bronquiectasias) |
| Aparecen post ingesta de aspirina, antinflamatorios no esteroidales o beta bloqueadores | Historia previa de tabaquismo importante |
| Historia de rinitis alérgica o atopia cutánea/alimentos | Tos aislada |
| Variabilidad del PEF | PEF normal durante episodio de síntomas |
| Sibilancias variables a la auscultación pulmonar | Comorbilidad cardiovascular |
| Historia de asma en familiar primer grado (hermanos o padres) | Disfonía persistente de predominio matinal que mejora durante el día (¿reflujo faringo-laringeo?) |
PEF: peak expiratory flow.
La espirometría es segura en el embarazo a menos que exista una contraindicación de esfuerzo. La confirmación de la limitación de los flujos espiratorios se puede realizar por espirometría o flujometría (PEF). Las pruebas de provocación con ejercicio o metacolina y el prick test o test cutáneo están relativamente contraindicados en el embarazo30 (tabla 3).
Pruebas diagnósticas para la detección de la obstrucción bronquial variable en el embarazo
| Test para evaluar obstrucción bronquial variable | Criterio diagnostico |
|---|---|
| Espirometría con obstrucción bronquial reversible post broncodilatador | Índice FEV1/CVF reducido con aumento en el FEV1 de >12% y >200ml post salbutamol (400μg) |
| Aumento de la variabilidad de PEF | Variabilidad >20%, se calcula:PEF máx-PEF min/PEF máxóPEF máx-PEF min/(PEF máx+PEF min)/2 |
Además de la presencia de síntomas y la medición de los flujos espiratorios, la evaluación de biomarcadores de inflamación tipo 2 de la vía aérea también es de ayuda en el diagnóstico en embarazo. Se ha observado que la asociación clínica de eosinófilos elevados en sangre y el aumento de la fracción espirada de óxido nítrico (FeNO) son predictores de inflamación tipo 2 en la vía aérea. La presencia de valores aumentados de eosinófilos en sangre (recuento absoluto > a 500 eosinófilos por microlitro) y de FeNO (>50 partes por mil millones (ppb, por sus siglas en inglés)) se asocia a un mayor riesgo de exacerbaciones de asma durante el curso del embarazo. El recuento de eosinófilos en sangre refleja la actividad de citoquinas de inflamación tipo 2, en especial de la interleuquina 5 (IL-5) mientras que la elevación de FeNO refleja la actividad de IL-13 e IL-4, también citoquinas de inflamación tipo 231.
El estudio clínico para evaluar la presencia de atopía se puede realizar con la medición de IgE total en sangre y las IgE específicas a los agentes ambientales que sugiera la anamnesis de síntomas. Estos resultados pueden orientar al diagnóstico de asma atópica en el embarazo. Es importante recalcar que estos resultados serológicos deben correlacionar con el cuadro clínico para su interpretación y no considerarse en forma aislada. En general, se recomienda evaluar la sensibilización a agentes ambientales como Aspergillus, ácaros del polvo de habitación (Dermatophagoidespteronyssinus), alergenos estacionales como pólenes y malezas, mascotas o animales presentes en ambiente de la paciente (epitelio de gato, perro, hámster, cuyes u otros).
Recomendaciones para el manejo del asma en la embarazadaLos objetivos del manejo del asma en la paciente embarazada se resumen en:
- -
Lograr un adecuado control de los síntomas de asma (que reflejan la actividad inflamatoria de la vía aérea)
- -
Prevenir las crisis o exacerbaciones
- -
Mantener una función pulmonar normal
Para alcanzar estos objetivos existen intervenciones farmacológicas y no farmacológicas, que incluyen información y educación a la embarazada y su entorno social, lo que es clave para evitar malos resultados materno-fetales. Si bien es de preocupación el uso de medicamentos en el embarazo, la ventaja de realizar un manejo activo sobrepasa largamente los potenciales riesgos de su uso (evidencia A)32.
La educación es parte de la terapia no farmacológica de las pacientes, y es responsabilidad del médico y del equipo de salud tratante, idealmente multidisciplinario. Las enfermeras especializadas en asma son un elemento clave en el equipo para el manejo de estas pacientes.
La educación para la embarazada con asma debe incluir ciertos aspectos fundamentales, como:
- -
Identificar los desencadenantes de los síntomas de asma para evitar su exposición (alergenos ambientales, laborales, etc.)
- -
Conocer y distinguir el rol de los medicamentos antiasmáticos entre “controladores” y “para el alivio de los síntomas de la enfermedad”
- -
-Reforzar la vacunación para la influenza en embarazo, además de la vacuna para el COVID-19 y Bordetella pertussis. En Chile, existe la indicación de dos vacunas programáticas en embarazadas: la vacuna contra la influenza estacional inactivada y la vacuna contra difteria, tétanos y tos ferina (dTaP), si bien en cada país los programas de inmunización establecen los lineamientos que se seguirán a nivel local.
- -
-Recibir educación repetida de la técnica inhalatoria correcta según los dispositivos inhalatorios (polvo seco o presurizados con aerocámara)
- -
-Disponer y comprender un plan de manejo personalizado para el manejo de síntomas y detección de las exacerbaciones
Actualmente existe una mirada enfocada en la medicina de precisión e individualizada que también se extrapola al manejo de la embarazada con asma. El concepto de medicina de precisión se define como “el uso de terapias enfocadas a las necesidades del paciente en base a características fenotípicas y de biomarcadores” y tiene por objeto mejorar los resultados clínicos. Así surge el paradigma de los “rasgos tratables” (“treatable traits”) que se aplican a un plan de manejo individualizado. De esta forma se sugiere detectar aspectos específicos en el embarazo para optimizar el control del asma: tratar la inflamación tipo 2 (uso de esteroides inhalados), mejorar la obstrucción de la vía aérea (broncodilatadores), manejo de patología laríngea, prevenir y tratar las infecciones respiratorias (inmunizaciones), enfermedades crónicas respiratorias asociadas, comorbilidades extrapulmonares como el reflujo gastroesofágico, rinitis y/o rinosinusitis crónica, apnea del sueño, obesidad, salud mental, entre otras33.
Terapia farmacológica en asma y embarazoEl manejo farmacológico es fundamental en estas pacientes. Las guías y recomendaciones internacionales de asma refuerzan con claridad que el tratamiento del asma no difiere en mujeres embarazadas, por lo que la seguridad y la eficacia de la terapia debe ser recalcada incluso desde antes de la gestación. En caso de introducir medicamentos nuevos en la paciente ya embarazada se debe evaluar el perfil de seguridad y en acuerdo con la paciente34.
El uso de broncodilatadores en embarazo no debe ser utilizados en forma aislada, pues no tienen efecto antiinflamatorio. Por el contrario, existe evidencia del efecto deletéreo como terapia de primera línea32. Los broncodilatadores agonistas β2 adrenérgicos (β2A) inhiben la contractilidad de la vía aérea disminuyendo la hiperreactividad de las vías respiratorias. Según las recomendaciones actualizadas del Global Initiative for Asthma (GINA), los agonistas β2A de acción prolongada (LABA, long-acting β2-agonist) e inicio rápido adicionado a un CSI (ej. formoterol con budesonida) constituyen una de las estrategias de inicio en el manejo del asma, sin reportes de efectos teratógenos de formoterol en dosis terapéuticas (< de 72μg/día) desde su uso hace más de una década. El uso de salbutamol está permitido como terapia de rescate de síntomas, pero siempre asociado al uso de terapia antiinflamatoria con un CSI según la última recomendación GINA32.
Otros broncodilatadores de tipo LABA de inicio de acción más lenta incluyen al sameterol, de amplio uso y con una evidencia acumulada de seguridad en el embarazo, además de los nuevos LABA de acción ultra larga (24 horas) como el vilanterol y olodaterol. Para estos medicamentos existe menos evidencia de seguridad acumulada en embarazo por haber sido introducidos más recientemente al mercado, si bien existen estudios que demuestran bajo riesgo de su uso en animales en gestación. Las recomendaciones de expertos sugieren la asociación de CSI más LABA ultra largos (ej. vilanterol más fluticasona una vez al día) en casos de falla de adherencia a la terapia35.
Los broncodilatadores antimuscarínicos inhiben el tono vagal de la vía aérea. El bromuro de ipratropio se considera seguro en el embarazo por lo que puede utilizarse al igual que el salbutamol como aliviador de síntomas y en las exacerbaciones de asma. El bromuro de tiotropio es un antimuscarínico de acción prolongada (LAMA, long-acting muscarinic antagonist) que puede reducir las exacerbaciones en el asma grave. Actualmente no hay evidencia de riesgo de su uso en embarazo y lactancia35.
Los CSI son la base de la terapia controladora en la embarazada con asma. Su efecto antiinflamatorio reduce síntomas, previene las exacerbaciones y disminuye el riesgo de morbimortalidad en asma. Su uso se asocia a una reducción de la exposición de corticoide sistémico. Las moléculas de uso sugerido en embarazo son hasta hoy la budesonida, fluticasona propionato y la beclometasona. Otros CSI disponibles son la ciclesonida, mometasona y fluticasona furoato, que hasta ahora no presentan estudios que contraindiquen su uso en embarazo.
Los corticoides sistémicos en cursos cortos tienen indicación en el manejo de las exacerbaciones asmáticas moderadas a severas (ej. prednisona hasta 40mg/día por 5 días), con un beneficio que supera el riesgo en estas situaciones. Se sabe que el 90% de la prednisona es metabolizada por la placenta y que el feto solo se expondría al 10% de la dosis administrada. Otro dato importante de recordar es que el cierre palatino se completa a las 12 semanas de gestación por lo que el riesgo de esta malformación fetal se reduce luego de esta etapa de la gestación. En los casos en que se requiera de un uso prolongado de corticoide sistémico a dosis alta es posible que el recién nacido pueda presentar insuficiencia suprarrenal al momento del parto, por lo que se debe considerar el manejo con hidrocortisona. Cuando se requiera mantener con dosis altas de corticoide sistémico a la madre en el post parto y durante la lactancia se recomienda retardar la alimentación del hijo hasta 3 a 4 horas posterior a la dosis para reducir la posibilidad de transferencia a través de la leche materna34.
Los antileucotrienos son medicamentos de uso oral en pacientes con asma alérgica, con un efecto broncodilatador menor y modesto en comparación con la terapia broncodilatadora por vía inhalatoria. En el embarazo no se han encontrado efectos teratogénicos si bien es escasa la evidencia de calidad, por lo que no se sugiere su inicio durante el embarazo35.
Las metilxantinas si bien se utilizan cada vez menos en la terapia antiasmática habitual son seguras en el embarazo y lactancia, pero requieren de monitorización de rango terapéutico en sangre más frecuente por una reducción del metabolismo en embarazo34.
Los antihistamínicos no han demostrado generar riesgo en el embarazo, los más utilizados por evidencia acumulada de seguridad son la clorfenamina (evidencia tipo A), la loratadina (evidencia tipo B1) y cetirizina (evidencia tipo B2)34.
Los corticoides intranasales también son seguros en embarazo y lactancia. Existen varios estudios que demuestran que no aumentan el riesgo de teratogénesis y parto prematuro. La budesonida presenta evidencia de seguridad tipo A, mientras que la fluticasona y la mometasona reportan evidencia tipo B334.
No se recomienda el inicio de inmunoterapia subcutánea o sublingual durante el embarazo por la posibilidad de reacciones alérgicas graves, sin embargo, no se contraindica si la paciente se encuentra en la fase de mantenimiento de la inmunoterapia evaluando riesgo versus beneficio en forma individual34,35.
El uso de medicamentos biológicos con anticuerpos monoclonales se recomienda para el manejo de pacientes con asma grave atendidos en centros de mayor complejidad y en manos de un equipo multidisciplinario. Estudios muestran que la exposición fetal a los anticuerpos monoclonales aumenta en el segundo y tercer trimestre de la gestación. En el embarazo, la evidencia muestra que el uso de omalizumab (anti-IgE) es probablemente seguro (evidencia tipo B1), según estudios de la cohorte XolairPregnancy Registry; luego de numerosos reportes de casos realizados desde que la Food and Drug Administration de Estados Unidos aprobó su uso el año 2007. Existe evidencia que muestra que los resultados de los embarazos bajo la exposición a omalizumab en el primer trimestre no difieren de los resultados de pacientes no tratadas. En pacientes en lactancia tratadas con omalizumab, existen estudios que también muestran su perfil de seguridad con evidencia tipo B134,35.
En el caso de los biológicos anti IL-5, existen diferentes medicamentos según el mecanismo de acción. En el caso de mepolizumab y reslizumab se produce un bloqueo de la citoquina circulante y en el caso de benralizumab se bloquea su efecto por unión al receptor de IL-5. En estudios en primates en gestación no se ha demostrado efectos deletéreos con mepolizumab a dosis supra máximas, pero para reslizumab no se dispone aún de datos de seguridad para embarazo en humanos. Se dispone de datos de seguridad farmacológica en humanos para mepolizumab desde el inicio de su uso experimental el año 2000, sin señales de mayor riesgo en embarazo y lactancia. Para mepolizumab y benralizumab existe evidencia de seguridad tipo B134.
Dupilumab (anti IL-4 y IL-13) no cuenta aún con muchos estudios de seguridad por su introducción más reciente en el manejo del asma grave, si bien se reporta evidencia de seguridad tipo B1 en embarazo en un task force conjunto de la European Respiratory Society/Thoracic Society of Australia and New Zealand publicado el 202034.
Las recomendaciones de sociedades y de expertos para el manejo del asma en el embarazo también incluyen la consejería y ajuste de la terapia pregestacional en mujeres asmáticas en edad fértil. Se propone un manejo activo en el asma, con ajuste precoz de la terapia si es necesario a medida que cursa la gestación. Las guías internacionales recomiendan una visita mensual con un médico para el manejo del asma en la embarazada, y si el control de los síntomas de asma es deficiente se debe incluir mediciones objetivas con espirometría o flujometría y marcadores de inflamación tipo 2 (eosinófilos en sangre y FeNO). Siempre se debe revisar la adherencia en la evaluación de los factores causantes de la pérdida del control del asma en embarazo35.
Manejo del asma estable durante el partoLas pacientes con asma en el parto pueden recibir la misma terapia analgésica que las mujeres sin asma. De los medicamentos utilizados para inducir el parto se puede también utilizar prostaglandina E2 y la oxitocina sin inconvenientes de seguridad. No se deben suspender los inhaladores de corticoide ni broncodilatadores durante el preparto y post parto, se deben mantener con uso continuo sin interrupción35.
En el manejo de la hemorragia obstétrica se debe evitar el uso de prostaglandina F2α por su efecto broncoconstrictor. Si la madre está en tratamiento continuo con esteroide sistémico al momento del parto, en las últimas dos semanas con una dosis equivalente a >7,5mg/día de prednisona se debe administrar hidrocortisona endovenosa en dosis de estrés para evitar un evento de insuficiencia suprarrenal36.
Manejo de las exacerbaciones de asma en el embarazoLa definición de crisis o exacerbación del asma se refiere a un aumento de los síntomas respiratorios sobre la condición basal como resultado de una mayor obstrucción de las vías respiratorias y que requiere una modificación de la terapia. Las características clínicas de la gravedad de la exacerbación asmática en el embarazo se detallan en la tabla 432. Las crisis o exacerbaciones leves pueden ser manejadas en domicilio con aumento del uso de la terapia broncodilatadora, sin suspender el corticoide inhalado. En los casos de pacientes con exacerbación asmática que no se encontraban en tratamiento con corticoide inhalado es el momento de iniciar la terapia. Toda paciente embarazada que haya presentado una exacerbación reciente, incluso una exacerbación leve, debe ser evaluada a la brevedad por un médico.
Evaluación clínica inicial de la gravedad de la exacerbación de asma en el embarazo
| Hallazgos | Leve a moderada | Grave |
|---|---|---|
| Habla | Oraciones o frases | Palabras |
| Frecuencia respiratoria | <30 por minuto | >30 por minuto |
| Frecuencia cardíaca | <120 latidos por minuto | >120 latidos por minuto |
| Peak flow/FEV1 (%predicho) | 50-75% | <50% |
| Saturación de oxígeno (FiO2 ambiental) | 90-95% | <90% |
El tratamiento farmacológico del asma exacerbada no difiere en el embarazo. En la evaluación inicial es fundamental establecer el nivel de saturación de oxígeno materno (mantener a un nivel mínimo de >95%) y en los casos más graves obtener la presión arterial de CO2 (PaCO2) mediante la medición de gases en sangre arterial (una PaCO2 normal traduce una acidosis respiratoria aguda e indica insuficiencia respiratoria grave). Es importante recordar que en forma fisiológica en el embarazo existe una alcalosis respiratoria compensada con una PaCO2 entre 28 y 32mmHg, por lo que el valor de PaCO2 normal o leve alteración de estos valores ya es anormal. En el caso de una acidosis respiratoria franca con retención de CO2 es signo de agotamiento respiratorio inminente y se debe realizar reanimación en unidad de cuidados intensivos.
La base del manejo farmacológico es el uso de corticoide sistémico en dosis alta habitual y los broncodilatadores μ-agonistas de acción corta e inicio de acción rápido, como el salbutamol. En los casos graves se puede administrar salbutamol cada 20 minutos o en uso continuo en nebulización. La epinefrina puede reducir la perfusión placentaria por lo que debe evitarse el uso en lo posible. La mezcla de gas heliox (helio y oxígeno) no ha demostrado mayor eficacia en pacientes embarazadas con exacerbaciones de asma grave. El uso de sulfato de magnesio tampoco tiene evidencia de mayor eficacia en exacerbaciones asmáticas en embarazo y sin embarazo, si bien no está contraindicado35.
La ventilación mecánica no invasiva (VMNI) en la exacerbación asmática grave durante el embarazo se ha evaluado en series de casos y no se dispone de evidencia clara de eficacia por lo que no se puede recomendar de manera concluyente en forma general y se sugiere para médicos intensivistas experimentados en su uso. Existe el riesgo de aspiración y deterioro brusco de la ventilación, por lo que el uso de VMNI en el embarazo puede retrasar y dificultar el manejo con soporte respiratorio invasivo en los casos más graves. La intubación en embarazo tiene dificultades inherentes a la hiperemia de la vía aérea relacionada al embarazo, por lo que debe realizarla un operador competente. En el manejo ventilatorio invasivo se debe anticipar la hipotensión por efecto de la presión positiva y la sedación, se sugiere el manejo de fluidos de forma cuidadosa36.
La ventilación mecánica invasiva debe ser con un manejo que evite el atrapamiento aéreo (auto-PEEP), con una ventilación minuto baja: tiempo espiratorio prolongado, volumen corriente bajo (6-8ml/kg), frecuencia respiratoria baja (8-12 ciclos/min) y flujo inspiratorio elevado (hasta 100 l/min). Se debe programar el ventilador para obtener una ventilación minuto reducida con estos ajustes, lo que hace casi inevitable la hipercapnia secundaria hasta niveles tan altos como PaCO2 de 100mmHg. La estrategia ventilatoria de “hipercapnia permisiva” si bien es controversial (la transferencia del CO2 del feto a la madre depende del gradiente en sangre con una acidosis fetal como consecuencia), existen estudios de series pequeñas de casos en que no se ha demostrado producir secuelas aparentes en los recién nacidos.
Para la exacerbación asmática grave refractaria a las terapias ya descritas, en el embarazo se ha descrito el uso de oxigenación por membrana extracorpórea (ECMO), procedimiento que debe considerarse en casos extremos por la alta mortalidad materna y fetal. En un reporte de 12 casos de distrés respiratorio agudo por influenza H1N1 se informó de una mortalidad fetal del 71% de los fetos y del 66% de las madres, principalmente por complicación hemorrágica37.
¿Cómo se puede evaluar el control del asma en el embarazo?Existen algunas escalas o score validados y de uso amplio en clínica para evaluar en forma cuantitativa el control del asma. Dentro de los más utilizados se dispone el ACT (Asthma Control Test), escala GINA y ACQ (Asthma Control Questionnaire)32. El ACT está validado para pacientes embarazadas (p-ACT), con una versión en español disponible en forma libre en la página web de la American Academy of Allergy, Asthma and Immunology38,39.
En estos instrumentos se cuantifica la frecuencia y la intensidad de los síntomas de asma que traducen inestabilidad clínica y necesidad de ajustes en la terapia antiasmática. En las pacientes con un ACT<20 se debe realizar un control del asma, idealmente presencial, para evaluar posibles causas del deterioro y para escalar en la terapia en caso necesario.
Según la propuesta de GINA32, en las pacientes con asma se sugiere un control médico mensual por asma y cada 2 semanas en los casos de pacientes con asma no controlada (ACT<20).
ConclusionesEl asma es la patología crónica respiratoria más común que afecta el embarazo y que en el caso de pacientes con asma no controlada pudiese tener un efecto perjudicial para el feto. El manejo de las pacientes asmáticas embarazadas es un área clínica de necesidades insatisfechas en el mundo real a nivel global, a pesar de disponer de terapia efectivas y de bajo riesgo para la madre y el feto. Por ello, actualmente se incentiva el manejo personalizado enfocado en rasgos tratables que pueden mejorar el control del asma, como la monitorización con FeNO, el cumplimiento de la medicación (cuestionario Test de Adhesión a los Inhaladores (TAI)) y la técnica de inhalación, junto al seguimiento de la función pulmonar. De igual modo se debe hacer seguimiento del manejo de tabaco y de comorbilidades como la depresión y ansiedad, la obesidad, enfermedad por reflujo gastroesofágico, rino-sinusitis crónica (con o sin pólipos nasales) y el síndrome de apnea del sueño40.
La atención de un equipo de salud multidisciplinario que incluya enfermeras es una estrategia comprobada de eficacia y rentabilidad para mejorar los resultados en asma en pacientes obstétricas, entregándoles educación y manejo personalizado que evita el abandono de la terapia antiasmática. El asma durante el embarazo genera incertidumbres en la madre que deben ser abordadas de manera integral por distintos especialistas. Las embarazadas necesitan estar siempre informadas y empoderadas en el manejo activo del asma. En los casos de asma de difícil control o asma grave se puede estratificar y monitorizar la terapia mediante biomarcadores (FeNO y eosinófilos en sangre) para reducir las exacerbaciones durante el embarazo.
En pacientes gestantes, el manejo adecuado del asma da beneficios demostrados para la madre y el feto, mediante terapia antiinflamatoria inhalada que resulta muy eficaz en la mayoría de los casos. La evidencia clínica demuestra que el mal control de la enfermedad se traduce en un alto costo para el feto desde el primer trimestre. El asma mal tratada incluso impacta generando cambios en la epigenética fetal, lo que influye en la salud del hijo a largo plazo.
Como reflexión final, el deterioro de los síntomas del asma en la embarazada no debe subestimarse y el manejo médico se debe realizar de manera proactiva, evaluando a las pacientes con asma no controlada en forma oportuna para decidir si se requiere escalar la terapia antiasmática, evitando así la ocurrencia de exacerbaciones. El manejo de la asmática embarazada se debería realizar idealmente por un equipo multidisciplinario, con un enfoque personalizado según otras comorbilidades o necesidades de cada paciente. En estos equipos es relevante la participación de especialistas en neumología, gineco-obstetras, enfermeras y matronas, otorrinolaringólogos, fonoaudiólogos, psicólogos y psiquiatras, químico-farmacéuticos, con una pauta de visitas y seguimiento clínico frecuente para lograr buenos resultados.
Los médicos requieren estar informados en cuanto a los aspectos fisiológicos, de manejo clínico y de la seguridad de la terapia para evitar el riesgo de exacerbaciones del asma que exponen a la madre y al feto a complicaciones graves.
Conflicto de interésLa autora declara no presentar conflictos de interés para esta publicación.