Las bronquiectasias son una enfermedad inflamatoria crónica de la vía aérea que se manifiesta por tos crónica, broncorrea mucosa o mucopurulenta y exacerbaciones recurrentes. Su etiología es variada, pero es esencial dentro de su estudio tratar identificar la causa para evitar el daño pulmonar progresivo, producto del llamado “círculo vicioso” con infecciones recurrentes, inflamación y daño estructural permanente. El diagnóstico es clínico, y se debe confirmar con la realización de una tomografía computarizada de tórax de alta resolución. El enfrentamiento terapéutico debe estar dirigido a controlar la infección y la inflamación bronquial, como también a el manejo de las complicaciones y comorbilidades asociadas.
Bronchiectasis is a chronic inflammatory disease of the airways that is manifested by chronic cough, mucosal o mucopurulent bronchorrhea, and recurrent exacerbations. Its etiology is varied, but it is essential within its study to try to identify the cause to avoid progressive lung damage, a product of the so-called “vicious circle” with recurrent infections, inflammation and permanent structural damage. The diagnosis is clinical and must be confirmed by performing a high-resolution chest computed tomography. Therapeutic management should be aimed at controlling infection and bronchial inflammation, as well as managing associated complications and comorbidities.
Las bronquiectasias (BQ) son una enfermedad pulmonar inflamatoria crónica, caracterizada por presentar una dilatación permanente e irreversible de las vías respiratorias inferiores. Son el resultado final de diferentes enfermedades, cuya alteración provoca una acumulación de moco, que desencadenando un círculo vicioso de infecciones recurrentes, inflamación bronquial crónica y daño pulmonar progresivo. Como consecuencia, esto se asociará con un declive progresivo de la función pulmonar, un deterioro de la calidad de vida y un incremento de la morbimortalidad1.
En cuanto a su frecuencia, las BQ constituyen la tercera enfermedad inflamatoria crónica de la vía aérea, después de la enfermedad pulmonar obstructiva crónica (EPOC) y del asma, con una prevalencia entre 42 y 566 casos por cada 100 000 habitantes, siendo algo más frecuente en mujeres y personas de edad avanzada2.
El interés por las BQ va en aumento, ya sea por el incremento progresivo en la prevalencia producto de la mayor edad en la población, el mayor uso de la tomografía de alta resolución y por el consumo de recursos que genera su tratamiento crónico y manejo hospitalario1,2.
El objetivo de este artículo es dar una visión actualizada y simple a médicos internistas y especialistas en neumología de cómo abordar, estudiar y tratar esta enfermedad.
EtiologíaLas BQ se pueden originar como resultado de múltiples procesos patológicos, tanto pulmonares como sistémicos. En la mayoría de las series, las causas post-infecciosas son las más frecuentes, representando hasta un 30% de los casos. Se consideran BQ de origen desconocido o idiopático a aquellas en que no se identifica la causa a pesar de un estudio etiológico. Según reportes llegan a constituir entre un 25-45% de los casos. Las causas que siempre habrá que descartar son: inmunodeficiencias, reflujo gastroesofágico (RGE), fibrosis quística (FQ), discinesia ciliar primaria, aspergilosis broncopulmonar alérgica (ABPA), infecciones por micobacterias no tuberculosas y déficit de alfa-1 antitripsina (alfa-1 AT) (tabla 1)3,4.
Etiología y enfermedades asociadas a bronquiectasias
| Post-infecciosas (30%) | Bacterianas, TBC, micobacterias no TBC, virus, hongos |
| Asociadas a enfermedades respiratorias crónicas | EPOC (3,9-7,8%)Asma (1,4-5,4%) |
| Genéticas con alteración del sistema mucociliar (2,5-2,9%) | Discinesia ciliar primariaFibrosis quística |
| Inmunodeficiencias (4-5,9%) | Primarias: déficit cuantitativos o cualitativos humorales, celulares o combinadosSecundarias: neoplasias, VIH, tratamientos biológicos e inmunosupresores |
| Asociadas a enfermedades sistémicas (1,4-3,8%) | Artritis reumatoidea, lupus, síndrome de Sjögren, síndrome de Marfán, sarcoidosis, enfermedad inflamatoria intestinal, policondritis recidivante |
| Neumonitis post inflamatoria (<1%) | Aspiración, reflujo gastroesofágico, radioterapia, inhalación de gases tóxicos o drogas |
| Hipersensibilidad (0,9-2,6%) | Aspergilosis broncopulmonar alérgica |
| Causas obstructivas (<1%) | Intrínsecas (tumores, cuerpos extraños, estenosis)Extrínsecas (tumores, adenopatías) |
| Otras (<1%) | Bronquiolitis obliterante post trasplante, síndrome de las uñas amarillas, panbronquiolitis difusa, síndrome de Swyer-James, amiloidosis, defectos congénitos de árbol bronquial |
El espectro clínico de las BQ puede ser muy amplio, pudiendo variar de una presentación silente a cursar con infecciones respiratorias a repetición o tos con expectoración mucosa o mucopurulenta. Otros síntomas, como hemoptisis, disnea y dolor torácico son de frecuencia variable en función de la edad, gravedad y tiempo de evolución de la enfermedad (tabla 2)1,4.
Prevalencia de manifestaciones clínicas
| Síntomas | Tos crónica (41-100%)Expectoración crónica (46-76%)Infecciones respiratorias a repeticiónHemoptisis (26-51%)Dolor torácico pleurítico (46%)Disnea (60-72%)Sinusitis a repetición (fibrosis quística, discinesia ciliar primaria, inmunodeficiencias) |
| Examen físico | NormalCrepitantes, roncus o sibilanciasAcropaquiaBaja de peso |
| Enfermedad avanzada | Caquexia, insuficiencia respiratoria, cor pulmonale |
Extraído de Romero S y Graziani D.11.
La anamnesis será esencial para poder identificar el historial de enfermedades y síntomas que pudiesen ser la causante de las BQ (tabla 3).
Claves en el diagnóstico diferencial de pacientes con sospecha de bronquiectasias
| Historia familiar de enfermedad respiratoria y rinosinusal |
| Edad de aparición de síntomas |
| Antecedentes de infección: neumonía, sinusitis, amigdalitis, otitis a repetición, infección crónica por S. aureus o P. aeruginosa |
| Enfermedades asociadas:- Asma- EPOC- Enfermedad inflamatoria intestinal- Sistémicas: VIH, AR, LES |
| Reflujo gastroesofágico |
| Infertilidad |
| Pancreatitis de etiología no clara |
| Hiperreactividad bronquial |
AR: artritis reumatoidea; LES: lupus eritematoso sistémico; VIH: virus de inmunodeficiencia humana; EPOC: enfermedad pulmonar obstructiva crónica.
Síntomas de compromiso de vía aérea superior (obstrucción nasal, rinorrea, sinusitis recurrente, otitis, anosmia) pueden observarse en FQ, asma, discinesia ciliar primaria y en inmunodeficiencias. Síntomas digestivos (diarrea, esteatorrea, rectorragia, RGE) pueden presentarse en la enfermedad inflamatoria intestinal, FQ, inmunodeficiencias, hernia al hiato. Las enfermedades reumatológicas pueden tener síntomas articulares (artralgias, mialgias)6. La anamnesis será esencial para poder identificar el historial de enfermedades y síntomas que pudiesen ser la causante de las BQ (tabla 3).
Historia naturalEl curso de la enfermedad es crónico, generalmente progresivo y dependerá de la enfermedad subyacente, de su extensión (localizadas, bilaterales o difusas), del compromiso funcional respiratorio, de la frecuencia y gravedad de las exacerbaciones, así como de la presencia, o no, de infección crónica por Pseudomonas1,7.
La historia natural de la enfermedad es similar a otras enfermedades crónicas de la vía aérea. Inicialmente puede ser asintomático u oligosintomático, con síntomas asociados a la enfermedad subyacente. A medida que avanza la enfermedad, los pacientes presentan tos persistente y eventual colonización por gérmenes como Haemophilusinfluenzae o Pseudomonasaeruginosa. Posteriormente, aparecen exacerbaciones recurrentes, deterioro de la calidad de vida y, en fases avanzadas de enfermedad, puede haber múltiples agudizaciones y hospitalizaciones1,7.
Las principales complicaciones en la evolución de la enfermedad son1,7:
- 1)
Insuficiencia respiratoria: que puede requerir oxigenoterapia domiciliaria y/o ventilación mecánica no invasiva.
- 2)
Hemoptisis: Se origina por el daño en la mucosa superficial neovascular de las arterias bronquiales. Si es persistente o severa (>100ml) constituye una urgencia respiratoria.
- 3)
Amiloidosis: La inflamación crónica presente en BQ favorece la producción hepática de amiloide A. El diagnóstico se realiza por biopsia del órgano afectado.
- 4)
Cor pulmonale en fases avanzadas de la enfermedad.
La radiografía de tórax, aunque tiene una baja sensibilidad y especificidad, constituye generalmente el primer examen a realizar, dada su utilidad en la detección de complicaciones como neumonía, derrame pleural, neumotórax o atelectasias4,6.
La tomografía axial computarizada de tórax es el examen de elección para confirmar la sospecha diagnóstica (figura 1), permitiendo valorar además la extensión y progresión de la enfermedad. Las BQ que afectan predominantemente los lóbulos superiores se observan más frecuentemente en TBC, FQ y sarcoidosis; aquellas localizadas en el lóbulo medio y língula sugieren infección por micobacterias atípicas y las de predominio central se pueden presentar en cuadros de aspergilosis broncopulmonar alérgica4,6.
Analítica sanguíneaSe solicitan exámenes generales como hemograma, velocidad de sedimentación globular, y proteína C reactiva, que nos ayudan a evaluar si hay exacerbación aguda en el paciente.
En todos los pacientes se recomienda: cuantificación de inmunoglobulinas, pruebas para ABPA (IgE total, IgE específica para Aspergillus), test de sudor, alfa-1 AT (tabla 4), que nos ayude a identificar alguna enfermedad de base6,8.
Exámenes complementarios en estudio de pacientes con BQ
| Inmunodeficiencias: cuantificación de Ig; estudio de inmunidad celular, subclases de IgG, estudio genético de inmunidad, VIH |
| Fibrosis quística: test de sudor, estudio genético |
| ABPA: IgE total elevada, IgG e IgE especifica Aspergillus, prick test Aspergillus |
| Discinesia ciliar primaria: óxido nítrico nasal, ultraestructura ciliar, espermiograma |
| Déficit de alfa-1 AT (enfisema y hepatopatía): niveles de alfa-1 AT, fenotipo |
| RGE: pHmetría y manometría esofágica |
| Infección por micobacterias: baciloscopía, cultivo de Koch |
| Obtrucción bronquial: broncoscopía |
El diagnóstico de inmunodeficiencia con déficit de producción de anticuerpos, la FQ y la discinesia ciliar primaria deber confirmarse en centros especializados.
Estudio de esputoSolicitar cultivos de bacterias, micobacterias y hongos al momento del diagnóstico y en las exacerbaciones para guiar la terapia antibiótica6. Los gérmenes más frecuentemente aislados en secreciones respiratorias de pacientes con BQ son Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus y en fases avanzadas Pseudomonas aeruginosa. En años recientes, se ha observado un aumento de las denominadas bacterias emergentes como Burkholderia cepacia, Achromobacter spp, Stenotrophomonas maltophilia, siendo generalmente resistentes a antibióticos convencionales1.
Pruebas funcionales respiratoriasLa espirometría debe ser realizada en todos los pacientes al momento del diagnóstico. Cuando las BQ son localizadas o en etapas iniciales estas pruebas pueden ser normales. Sin embargo, a medida que progresa la enfermedad, con la evolución de la enfermedad, se puede encontrar un trastorno ventilatorio obstructivo, no reversible, con capacidad vital forzada normal o ligeramente reducida. La hiperreactividad bronquial puede estar presente en el 30-69% de los pacientes, siendo más frecuente en BQ secundarias a asma y ABPA1,4.
En etapas avanzadas de enfermedad se produce un trastorno de la ventilación-perfusión con la consiguiente hipoxemia y, en ocasiones, hipercapnia. En esta fase se aconseja realización de gases arteriale1,4.
FibrobroncoscopíaLas principales indicaciones de la fibrobroncoscopía son: hemoptisis no explicada o sospecha de obstrucción endobronquial y, excepcionalmente, cuadros infecciosos de evolución tórpida, recidivantes o sin respuesta a terapia antibiótica indicada1,4.
Gravedad y factores pronósticosPara valorar la gravedad y el pronóstico inicial de pacientes con BQ, se recomienda utilizar escalas clínicas multidimensionales como son la E-FACED (tabla 5) y el índice de severidad de bronquiectasias, siendo la primera, la de uso más frecuente por su sencillez y con buena capacidad pronóstica en términos de mortalidad y gravedad de las agudizaciones. Se recomienda su aplicación anualmente para monitorizar la progresión clínica de la enfermedad4,9,10.
Escala pronóstica multidimensional (E-FACED)
| Variable | Valores | Puntuación |
|---|---|---|
| Exacerbaciones con ingreso hospitalario (año previo) | NoAl menos 1 | 01 |
| VEF1 (% predicho) | Al menos el 50%Menos del 50% | 02 |
| Edad | < 70 años>70 años | 02 |
| Infección/colonización bronquial crónica por P. aeruginosa | NoSí | 01 |
| Extensión radiológica (número de lóbulos) | 1-2 lóbulosMás de 2 lóbulos | 01 |
| Disnea (escala MRC modificada) | 0-23-4 | 01 |
VEF1; volumen espiratorio máximo en el primer segundo; MRC: Medical Research Council.Rango total de creciente gravedad de 0-9 puntos: 0-3 leves; 4-6 moderadas; 7-9 graves.
En caso de identificar la causa, el manejo debe ir dirigido a la enfermedad de base8:
- 1.
Fibrosis quística: moduladores del CFTR (cystic fibrosis transmembrane conductance regulator), DNasa.
- 2.
Déficit de alfa-1 AT: no fumar y administración de alfa-1 AT intravenosa en fenotipos PiZZ.
- 3.
Discinesia ciliar primaria: técnicas de aclaramiento mucociliar.
- 4.
Inmunodeficiencias: inmunoglobulinas intravenosas/subcutáneas.
- 5.
Aspergilosis broncopulmonar alérgica: corticoides y/o antifúngicos.
- 6.
Infección por micobacterias no tuberculosas: según guías clínicas y tipo de micobacterias.
- 7.
RGE: inhibidores de la bomba de protones.
- 8.
Obstrucción bronquial: considerar cirugía o dilatación bronquial.
- 9.
Enfermedades asociadas: EPOC, asma, enfermedad inflamatoria intestinal y enfermedades sistémicas.
Se define exacerbación como un deterioro en 3 o más de los siguientes síntomas o signos: tos, volumen del esputo y/o consistencia, purulencia del esputo, disnea y/o tolerancia al ejercicio, fatiga y/o malestar general, y hemoptisis por al menos 48 horas en que el clínico determine que es necesario un cambio de tratamiento. Se puede asociar a fiebre, incomodidad torácica, sudoración nocturna, deterioro de la función pulmonar o incremento en marcadores de inflamación11,12.
Se considera exacerbación leve a moderada las que pueden ser manejadas en forma ambulatoria con terapia antibiótica vía oral; y graves son las que requieren hospitalización y/o se asocian a insuficiencia respiratoria, sepsis, compromiso hemodinámico, hemoptisis grave, necesidad de ventilación mecánica no invasiva (VMNI) o ventilación mecánica invasiva (VMI)12,13.
La frecuencia y gravedad de las exacerbaciones alteran no solo la calidad de vida, sino también la progresión de enfermedad y aumento de morbimortalidad12.
Durante las exacerbaciones los patógenos más frecuentemente aislados son: Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae, Staphylococcus aureus, Moraxella catarrhalis y las enterobacterias. Los virus se identifican en un 25% de los casos (rinovirus, influenza, coronavirus)11.
El tratamiento antibiótico en BQ está basado más en la experiencia clínica que en estudios controlados aleatorizados. Los ATB vía oral son el tratamiento de primera línea excepto en pacientes con síntomas severos o con criterios de hospitalización. La experiencia sugiere mejores resultados si se usan dosis altas de ATB y por tiempos prolongados debido a la dificultad de lograr adecuadas concentraciones en el lumen de la vía aérea de las BQ13.
Se recomienda iniciar antibióticos según cultivos previos y considerar cubrir Pseudomonas en caso de hospitalización reciente, uso frecuente de antibióticos, bronquiectasias extensas y aislamiento previo de Pseudomonas. La vía de administración dependerá de la gravedad y presencia de patógenos multiresistentes (tabla 6)12,13.
Esquemas de tratamiento en exacerbación según microorganismo
| Elección | Alternativa | Duración | |
|---|---|---|---|
| Streptococcus pneumoniae | Amoxicilina 500mgcada 8 horas vo | Doxiciclina 100mgcada 12horas | 14 días |
| H. influenzae beta lactamasa negativaH. influenza beta lactamasa positiva | Amoxicilina 500mgcada 8 horas voAmoxicilina/ácido clavulánico 875mg/125mg cada 8horas | Doxicilina 100mgcada 12horas oCiprofloxacino 750mg cada 12horas voCeftriaxona 2g ev | 14 días |
| SAMS | Flucloxacilina 500mgcada 6 horas vo | Claritromicina 500mgcada 12horas o doxicilina 100mg cada 12horas o Amoxicilina-ácido clavulánico 875/125 cada 8horas vo | 14 días |
| SAMR | Doxicilina 100mg cada 12horasRifampicina 450mg/día (<50kg) o 600 mg/día (>50kg)Cotrimoxazol 160/800mg cada 12horas voVancomicina 1g cada 12horas ev (ajustar dosis según niveles) o teicoplanina 400mg/día ev | Linezolid 600mg cada 12horas vo/ev | 14 días |
| Pseudomona aeruginosa | Ciprofloxacino 750mg cada 12 horas | Monoterapia:Ceftazidima 2g ev cada 8 horasPiperacilina/tazobactam 4,5g cada 8 horas ev o aztreonam 2g cada 8 horas ev o meropenem 2g cada 8 horas evTerapia combinada:Agregar a lo descrito- Gentamicina 5-7mg/kg/día cada 24horas- Tobramicina 5-10mg kg ev día- Colistin 2 millones de unidades cada 8horas | 14-21 días |
SAMS: Staphylococcus aureus multisensible. SAMR: Staphylococcus aureus multiresistente; vo: Vía oral; ev: endovenosa.
El objetivo es la erradicación bacteriana cuando se identifica el germen por primera vez en la historia natural del paciente. Se considera infección crónica tras 3 intentos fallidos de erradicación.
- a)
Pseudomonas aeruginosa
Se recomienda erradicar dado que su infección crónica se asocia a progresión de enfermedad y a un mayor descenso de la función pulmonar12.
Esquema:
- 1.
Ciprofloxacino 750mg vo cada 12 horas por 21 días
- 2.
Agregar antibiótico inhalado (aztreonam lisina, colistimetato de sodio, tobramicina, gentamicina) durante 3 meses en casos de BQ graves (E-FACED 6-9 puntos) y en pacientes inmunosuprimidos.
- -
Colistimetato 2 millones de unidades cada 12 horas (usar con e-Flow, Pari LC plus)
- -
Tobramicina: solución para inhalación 300mg/5ml cada 12 horas ((usar e-Flow, Pari LC plus) o polvo seco 112mg/día (4 inhalaciones cada 12 horas).
- -
Aztreonam 75mg cada 8 horas (usar e-Flow).
- -
Gentamicina: Formulación ev administrada vía inhalada 80mg cada 12 horas.
- -
En caso que primoinfección coincida con un ingreso hospitalario, se recomienda antibióticos intravenosos.
En alergia a ciprofloxacino, se recomienda usar antibióticos inhalados por 3 meses según dosis sugerida en punto 2.
Realizar cultivo esputo mensual durante los 3 primeros meses para evaluar la erradicación.
Si fracasan al menos 2 estrategias con antibióticos inhalados y orales se recomienda el uso de antibióticos inhalados más terapia endovenosa.
- 1.
- b)
Staphylococcus aureus resistente a meticilina8,12.
Esquema:
- 1.
Cotrimoxazol 160/800mg cada 12 horas por 14 días
- 2.
Linzolid 600mg cada 12 horas por 14 días
- 3.
Vancomicina intravenosa, administrada por vía inhalada 250mg cada 12 horas (emplearla simultáneamente a ATB vo)
- 4.
La vía intravenosa se reservará para los fracasos de tratamiento.
Para otros microorganismos: No hay mucha evidencia de beneficio de su tratamiento y este se realizará según el antibiograma durante 14 días.
- 1.
Se define como un aislamiento de 3 o más cultivos consecutivos para un organismo en al menos 6 meses, en muestras separadas entre sí por el menos 1 mes8,11–13.
- a)
Pseudomonas aeruginosa
Esquema:
Usar antibióticos inhalados en forma intermitente (on-off): Tobramicina (NBZ 300mg cada 12 horas), gentamicina (80mg cada 12 horas), colistimetato de sodio (2 millones de U cada 12 horas), aztreonam lisina (75mg cada 8 horas).
En pacientes con compromiso pulmonar moderado o grave, o deterioro clínico en periodos de descanso, evaluar tolerancia para uso de antibióticos inhalados de uso continuo.
- b)
Staphylococcus aureus resistente a meticilina o Stenotrophomonas maltophilia.
Esquema:
Vancomicina intravenosa administrada en forma inhalada 250mg cada 12 horas de forma continua. En caso de mala evolución o no tolerancia añadir o sustituir con cotrimoxazol 160/800mg cada 12 horas por vo.
Aspectos a tener en cuenta:
- -
El orden de administración debe ser: broncodilatador, solución salina hipertónica, fisioterapia y antibiótico inhalado.
- -
Limpiar y desinfectar adecuadamente los nebulizadores después de su uso.
- -
Debido a la posibilidad de broncoespasmo, disnea, o tos, se sugiere que la primera dosis sea administrada de forma supervisada después de la broncodilatación.
- -
Se debe tener precaución en pacientes con hemoptisis a repetición, hiperreactividad bronquial o alteración funcional pulmonar severa.
- -
En pacientes con trastornos auditivos y disfunción renal, evaluar el riesgo-beneficio del uso de colistin y aminoglucosidos e ir monitoreando con audiometría y seguimiento de función renal.
- -
Modulan respuesta inflamatoria bronquial e interfieren con formación de biopelículas. Reducen número de exacerbaciones, la cantidad de esputo y mejoran la calidad de vida12,13. Están recomendados en pacientes en fase estable, que a pesar de seguir un buen tratamiento presenten 2 o más exacerbaciones anuales. Se sugiere azitromicina 500mg trisemanal.
Se debe tomar ECG previo (no usar si el QT está prolongado), y no administrar si el cultivo de micobacterias es positivo.
Se debe evaluar su eficacia cada 6 meses basada en disminución de número de exacerbaciones12.
Corticoides InhaladosNo deben ser utilizados de rutina; solo en casos de hiperreactividad bronquial y asma11,12.
BroncodilatadoresSe recomiendan broncodilatadores beta-2 adrenérgicos de acción corta antes de la fisioterapia para facilitar drenaje de secreciones, al igual que antes del empleo de ATB inhalados11,12.
Los B2 adrenérgicos de acción prolongada en pacientes con obstrucción al flujo aéreo sintomáticos.
MucolíticosLa bromhexina en dosis altas (30mg/8 horas) durante 15 días junto a un ATB podría mejorar el drenaje de secreciones en pacientes exacerbados y en pacientes estables con broncorrea mayor a 30ml día11,12.
En pacientes con EPOC y BQ podría evaluarse el uso de N-acetilcisteína (400-1800mg/día) o ambroxol (75mg día) a largo plazo.
DNasa no ha mostrado utilidad en pacientes con BQ no FQ.
Soluciones hipertónicasEn pacientes broncorreicos o con exacerbaciones recurrentes (>2 en el año) se recomienda realizar nebulizaciones con NACL al 7%, 1 o 2 veces al día durante al menos 3 meses y evaluar efectos. Mejora la calidad de vida, el VEF1 y reduce las exacerbaciones dado que facilita el drenaje bronquial, disminuyendo la viscosidad de las secreciones12,13.
Manejo nutricionalLa pérdida de masa magra y un IMC menor a 20kg/m2 se asocian a complicaciones y mayor mortalidad. Por lo tanto, se recomienda remitir a los pacientes a un equipo de nutrición12,13.
Rehabilitación kinésica y respiratoriaSe recomienda enviar a pacientes estables para entrenamiento muscular y ejercicios aeróbicos con cicloergómetro y/o elíptica para mejorar la tolerancia al ejercicio y la calidad de vida.
Programas con una frecuencia de 3 veces por semana, durante un mínimo de 8 semanas han mostrado ser eficaces12,13.
Drenaje de secrecionesPueden ser manuales (espiración lenta con glotis abierta y ciclo activo con técnicas ventilatorias) e instrumentales (oscilación espiratoria positiva, presión espiratoria positiva). Estas medidas reducen la disnea y la tos y facilitan la expectoración. Debe realizarse al menos 1 vez al día o según requiera el estado de paciente12,13.
No está recomendada en pacientes inestables, con hemoptisis persistente, broncoespasmo, neumotórax, cirugía ocular reciente. Si se realizan sobre el tórax, no realizarlas en pacientes con alteraciones óseas metastásicas, osteoporosis severa o fracturas costales.
CirugíaSe debe evaluar en forma multidisciplinaria a los pacientes con BQ localizadas con exacerbaciones recurrentes que alteren su calidad de vida; o en pacientes con hemoptisis grave con embolización inefectiva con intención paliativa, habiendo descartado enfermedades subyacentes que favorezcan su aparición12,13.
Trasplante pulmonarSi bien el pronóstico de pacientes con BQ con enfermedad avanzada es variable y en general pueden tener una evolución estable durante muchos años, se recomienda derivar a un centro de trasplante pulmonar a pacientes con VEF1 <30%, oxígeno domiciliario, retención de CO2, con hipertensión pulmonar (presión sistólica de arteria pulmonar (PSAP) >35mmHg en ecocardiograma) y/o con exacerbaciones recurrentes hospitalarias (>2 en el año) que hayan presentado hemoptisis masiva (>240ml) o requerido VMNI o VMI12,13.
VacunasLas vacunas antineumocócica y antiinfluenza han demostrado reducir de manera significativa las exacerbaciones infecciosas, por lo que están recomendadas en todos los pacientes12,13.
SeguimientoEn pacientes con BQ estables, el seguimiento debería realizarse cada 6 -12 meses y en pacientes con enfermedad avanzada o graves cada 1-3 meses con estudio clínico, funcional y microbiológico en cada visita.
El control clínico implica preguntar por disnea (escala mMRC), hemoptisis, volumen de esputo, fiebre, baja de peso, saturación, adherencia a terapia.
Además, realizar estudio funcional con espirometría anual o en cada visita a pacientes graves o con enfermedad avanzada más test de caminata anual12,13.
ImágenesRadiografía de tórax en caso de complicaciones o sospecha de complicaciones como neumonía o neumotórax.
TAC de tórax de baja dosis cada 4-5 años en pacientes estables
MicrobiologíaRealizar cultivo de esputo corriente con antibiograma y recuento de colonias en cada control y exacerbación, mientras que BK y cultivo micobacterias y hongos deben ser realizados anualmente.
NutriciónSe debe realizar una valoración nutricional anual
OtrosRevisar medicación, educación de técnicas de drenaje y técnica inhalatoria
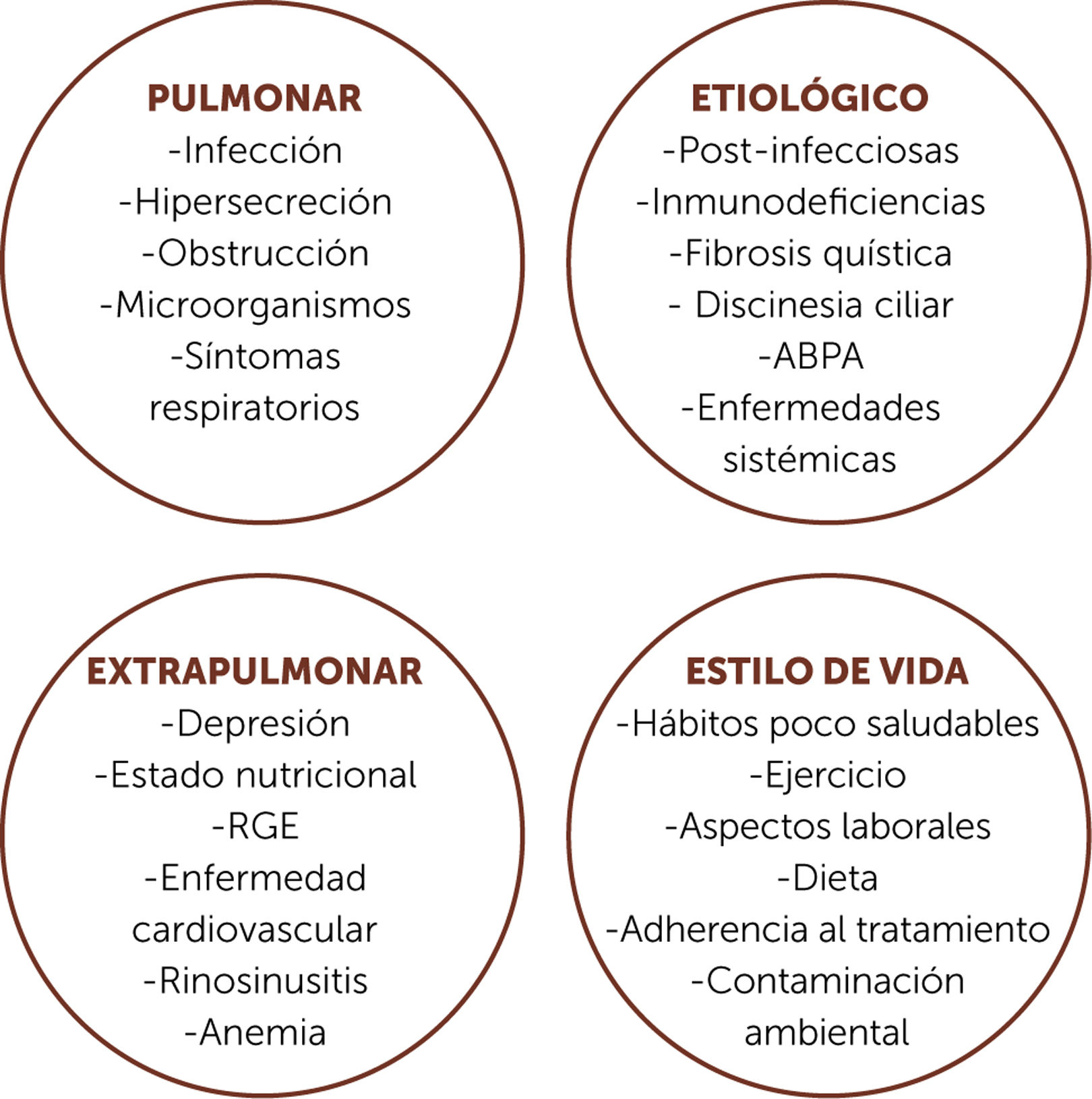
Rasgos tratables en BQLas BQ debe ser manejada como una enfermedad multidimensional, con afectación multisistémica, debiendo ser abordada como tal para el control óptimo del paciente. En la figura 2 se observa la importancia de evaluar y manejar no solo el compromiso pulmonar, sino también los aspectos extrapulmonares, etiológicos y de estilo de vida de cada paciente14.
Aspectos multidimensionales que hay que abordar en BQ
BQ: bronquiectasias; ABPA: aspergilosis broncopulmonar alérgica; RGE: reflujo gastroesofágico.
Adaptado de Girón RM et al14.
Las bronquiectasias representan la manifestación final de diversas enfermedades, quedando los pacientes susceptibles a infecciones recurrentes, con daño pulmonar progresivo que conlleva a una significativa morbimortalidad. La historia clínica y una evaluación diagnóstica exhaustiva son fundamentales para identificar causas tratables y abordar las posibles complicaciones en forma oportuna. Su manejo debe ser multidisciplinario y debe considerar aspectos clínicos, funcionales, extensión radiológica y perfil microbiológico, como también sus manifestaciones extrapulmonares a modo de mejorar la calidad de vida y reducir el impacto clínico en los pacientes afectados por esta enfermedad.
Consideraciones ÉticasSe ha obtenido la autorización por parte del paciente para el uso de sus imágenes, que se encuentran anonimizadas.
Conflictos de interesesEl autor declara no tener conflictos de intereses.