El Coronavirus SARS-CoV-2 produce la enfermedad COVID-19, cuya manifestación más grave y potencialmente letal es la neumonía. En este artículo revisaremos las manifestaciones clínicas del COVID-19, la fisiopatología de la neumonía, el manejo intrahospitalario previo al ingreso a Unidades de Cuidados Intensivos, la embolia pulmonar que es una complicación muy frecuente de esta enfermedad y el seguimiento de los pacientes posterior al alta. Para esta publicación nos hemos basado en publicaciones médicas y en estudios que hemos hecho durante esta pandemia en nuestro Centro de Enfermedades Respiratorias.
The SARS-CoV-2 Coronavirus causes the COVID-19 disease, the most severe and potentially fatal manifestation of which is pneumonia. In this article, we will review the clinical manifestations of COVID-19, the pathophysiology of pneumonia, in-hospital management prior to admission to Intensive Care Units, pulmonary embolism, which is a very frequent complication of this disease, and the follow-up of patients after hospitalization. For this publication we have relied on medical publications and studies that we have done during this pandemic at our Center for Respiratory Diseases.
El virus SARS-CoV-2, produce la enfermedad COVID-19, cuya manifestación más grave es la neumonía que se manifiesta por fiebre, tos, disnea y opacidades pulmonares bilaterales en la radiología de tórax. En un estudio con más de 70.000 casos la enfermedad fue leve en 81% (con neumonía leve o sin ella), moderada en 14% (neumonía con hipoxemia) o grave en 5% (insuficiencia respiratoria que requiere ventilación mecánica, shock o falla multiorgánica). La letalidad general fue de 2,3%, y de 49% entre los casos graves1.
El virus SARS-CoV-2 se transmite de persona a persona, a través de gotitas respiratorias que se producen cuando el paciente tose, estornuda o habla. Estas gotitas parecen no viajar más de dos metros. También puede haber contagio al tocar superficies contaminadas y pasarse las manos por boca, nariz u ojos2. Existen reportes recientes de contagio por virus que se mantienen en el aire en suspensión, por minutos u horas, en espacios mal ventilados. Esta vía se denomina transmisión aérea, y dificulta más el control de la enfermedad.
El período de contagiosidad comienza alrededor de dos días antes del inicio de los síntomas, llega a su máximo el día de inicio y disminuye durante los siete días posteriores. Es muy improbable el contagio luego de 10 días de síntomas en casos de infecciones no severas3. Luego de la exposición, el período de incubación es de hasta 14 días, siendo de 4 a 5 días para la mayor parte de los casos.
Factores de riesgo: las comorbilidades más frecuentes entre 5.700 pacientes hospitalizados en Nueva York fueron hipertensión (57%), obesidad (42%) y diabetes 34%)4. La obesidad es un factor de riesgo para intubación o muerte en menores de 65 años. Otras publicaciones confirman que la obesidad es un factor de riesgo de mortalidad, incluso al ajustarla por comorbilidades asociadas a obesidad. El riesgo relativo fue de 2,7 para índice de masa corporal de 40 a 45 y de 4,2 para mayor de 45.
Otros factores de riesgo son diabetes presente en 34%, enfermedades cardiovasculares en 32%, y enfermedades pulmonares crónicas en 18%, entre las que no se incluye el asma. El porcentaje de pacientes asmáticos hospitalizados por COVID-19 no es mayor que el de la población general. Entre los pacientes que tenían alguna comorbilidad, la hospitalización fue 6 veces más y la mortalidad 12 veces más que en aquellos que no tenían comorbilidades5.
La edad es un factor de riesgo independiente en diversas publicaciones. En China la tasa de letalidad fue de 15% en mayor o igual a 80 años, 8% entre los 70 a 79 años, 3,6% entre los 60 a 69 años y 1,3% entre los 50 a 59 años1.
Síntomas: COVID-19 se puede presentar como una influenza con síntomas respiratorios bajos. La fiebre está presente entre el 30 y 90% de los pacientes, siendo más frecuente entre quienes se hospitalizan y menos entre pacientes ambulatorios y de mayor edad. La adinamia, la cefalea y las mialgias son los síntomas más comúnmente reportados entre los pacientes ambulatorios, mientras que la odinofagia, la rinorrea y la conjuntivitis también son síntomas frecuentes. Muchos pacientes con COVID-19 tienen síntomas digestivos como náuseas, vómitos o diarrea, antes que aparezcan la fiebre y los síntomas respiratorios inferiores, al igual que la anosmia y la ageusia. Estos últimos síntomas se ven más frecuentemente en pacientes de edad media que no requieren hospitalización. La anosmia aparece como un síntoma muy específico de COVID-196. Otros síntomas neurológicos además de la cefalea son alteración de conciencia, mareos, convulsiones, agitación y signos meníngeos7.
En la población pediátrica, la enfermedad es habitualmente leve, con síntomas respiratorios altos. Sin embargo, se han reportado casos graves, incluso muertes especialmente en menores de 1 año. En esta población se ha descrito un sindrome de inflamación multisistémica, con compromiso del corazón, pulmones, riñones, cerebro, piel o tubo digestivo8.
En el examen físico se puede encontrar fiebre, polipnea y reducción de la saturación de oxígeno. El examen pulmonar muestra pocas alteraciones en contraposición con la disnea del paciente.
Sin embargo, la enfermedad podría ser asintomática hasta en un 40%9; si a esto agregamos que el período de contagio se inicia previo a la aparición de síntomas en la población que los tiene, el control de esta infección se hace aún más dificil.
Una estrategia para reducir el riesgo de contagio del personal de salud y de los otros pacientes, es hacer una selección de los casos sospechosos en lugares de atención médica. Entre el 1 de marzo y el 31 de julio de 2020 estudiamos a 791 pacientes que consultaron en el Departamento de Medicina Interna y Otorrinolaringología de Clínica Las Condes y encontramos que los mejores indicadores de tener infección por SARS-CoV-2 son anosmia, fiebre, mialgias y tos. Si el paciente presenta anosmia la probabilidad de tener SARS-CoV-2 podría ser hasta 7 veces más que si no la tiene.
Entre las alteraciones de los exámenes de laboratorio destacan la linfopenia presente en el 90% de una serie de pacientes hospitalizados por COVID-1910, también se describe elevación de proteína C reactiva, Dímero D (DD), LDH, ferritina, transaminasas hepáticas, con disminución de albumina y plaquetas.
Existen varios calculadores pronósticos que incluyen edad, sexo, comorbilidades, imágenes y exámenes de laboratorio, pero todos tienen problemas metodológicos importantes11.
FISIOPATOLOGÍA DEL COMPROMISO PULMONAR POR SARS-COV-2El dominio de unión al receptor (DUR) de la proteína Spike (S) de SARS-CoV-2 reconoce específicamente el receptor de la enzima convertidora de angiotensina 2 (ECA2) del huésped. Tras la unión, la proteasa sérica de transmembrana tipo 2 (TMPRSS2) corta la proteína S y da como resultado la fusión de las membranas virales y celulares. El receptor ECA2 se expresa en la vía aérea, principalmente en neumocitos tipo 2 alveolares, también en el resto de tracto respiratorio, corazón, riñón y tracto gastrointestinal. Sin embargo, los pulmones parecen ser particularmente vulnerables al SARS-CoV-2 debido a su gran superficie y porque los neumocitos tipo 2 actuarían como un reservorio para la replicación del virus12. Pese a que los inhibidores y bloqueadores de ECA tienen un efecto hiperregulador, estudios observacionales no han demostrado mayor riesgo de infección, ni mortalidad hospitalaria de los pacientes sometidos a estos tratamientos13. La injuria directa en el tejido pulmonar, por la respuesta inflamatoria local mediada por la infección viral, es uno de los mecanismos propuestos detrás de las manifestaciones pulmonares de COVID-1914.
Los pacientes con COVID-19 pueden presentar marcada linfopenia, como ocurre en otras virosis respiratorias (influenza), debido a la infección y destrucción de linfocitos T por el virus. Cuando la multiplicación viral se acelera, se compromete la integridad de la barrera alvéolo-capilar y se afectan las células de los capilares pulmonares, acentuando la respuesta inflamatoria con mayor atracción y acumulación de neutrófilos, monocitos y exacerbación de la endotelitis capilar. Esto se correlaciona con los hallazgos de autopsias que revelan engrosamiento difuso de la pared alveolar por células mononucleares y macrófagos, infiltrando los espacios aéreos que se suma a la inflamación endotelial y edema15. Esto se visualiza como opacidades en vidrio esmerilado en tomografía axial computada (TAC) pulmonar.
La disrupción de la barrera alveolo-capilar, la alteración de la transferencia alveolar de O2 y el deterioro de la capacidad de difusión son los trastornos característicos de la neumonía COVID-19. Cuando al edema se agrega formación de membrana hialina llenando el espacio alveolar, estamos frente a la etapa temprana del síndrome de distrés respiratorio agudo (SDRA). Además de lo descrito, puede ocurrir activación y consumo dramático de los factores de coagulación. Estudios chinos reportan que más de un 70% de los fallecidos por COVID-19 cumplían un criterio de coagulación vascular diseminada16. La inflamación alveolar y endotelial pueden generar microtrombos con complicaciones trombóticas a distancia.
Existe controversia respecto a si el SDRA asociado a COVID-19 tiene particularidades fisiopatológicas comparadas con las del SDRA clásico. En una serie pequeña de casos de pacientes con SDRA COVID-19 en ventilación mecánica, Gattinoni y cols.17 describieron hipoxemia grave a pesar de una distensibilidad pulmonar relativamente normal, un hallazgo inusual en pacientes con SDRA grave. En la mitad de los pacientes, los gases sanguíneos y las TAC pulmonares revelaron una gran corto circuito arterio-venoso en regiones pulmonares mal ventiladas, lo que sugería hiperperfusión desregulada en esas regiones. Los mismos autores destacaron la ausencia de uniformidad de pacientes con SDRA asociado a COVID-19 y propusieron la existencia de dos fenotipos primarios: tipo L (por Low) con valores bajos de elastancia (distensibilidad elevada), de corto circuito arterio-venoso, de peso pulmonar y de capacidad de reclutamiento) y tipo H (por High) con valores altos de elastancia (distensibilidad baja), de corto circuito arterio-venoso, de peso pulmonar y de capacidad de reclutamiento, siendo este último fenotipo más consistente con lo clásicamente descrito en SDRA grave18. Propusieron que la mayoría de los pacientes se presentan inicialmente con el tipo L y que algunos pacientes evolucionan al tipo H, potencialmente debido a los efectos sinérgicos de progresión de la neumonía COVID-19 y la lesión pulmonar auto infligida por el paciente. Ésta se produciría por grandes esfuerzos respiratorios, con presiones transpulmonares elevadas y liberación de mediadores inflamatorios nocivos. Estos autores plantean un patrón de ventilación liberal con volúmenes corrientes altos (hasta 8-9ml/kg) y presión de fin de espiración bajas en pacientes con fenotipo L e hipercápnicos19,20, contrastando con el modelo de ventilación protectora demostrada como beneficiosa en el SDRA no COVID-19.
Otros grupos han propuesto que la heterogeneidad fenotípica de la neumonía y SDRA COVID-19 es la misma a la descrita para todos los SDRA en general, y que se debe aplicar las mismas intervenciones beneficiosas basada en la evidencia en medicina crítica pre-pandemia21. La estrategia ventilatoria protectora ha demostrado ser beneficiosa en SDRA con distensibilidades bajas y también altas22. Las indicaciones de ventilación en prono y oxigenación por membrana extracorpórea (ECMO) en COVID-19 deben ser las mismas que en SDRA en general14.
Otra gran pregunta en discusión, a 10 meses de iniciada la pandemia en el mundo, es si el SDRA asociado COVID-19 tiene mayor tendencia a desarrollar fibrosis pulmonar, hipertensión pulmonar y deterioro funcional respiratorio progresivo en los pacientes que sobreviven, más allá de lo descrito para SDRA grave pre-pandemia23,24.
MANEJO INTRAHOSPITALARIOCorticoidesDurante los primeros meses de la pandemia por SARS-CoV-2 se desaconsejó el uso de corticoides sistémicos, basado en experiencias previas con otros coronavirus (SARS-CoV-1 y MERS) en donde se evidenció aumento de excreción y disminución del aclaramiento viral25 e incluso aumento de mortalidad e infecciones nosocomiales en neumonía por Influenza H1N126.
Si analizamos la fisiopatología de la infección viral respiratoria observamos que la respuesta inmune inicial es fundamental para reducir la carga viral y alertar al huésped. La respuesta comienza con el reclutamiento de inmunidad innata, y si esta no logra limitar la progresión de la infección se desencadena una liberación de citoquinas inflamatorias (IL-6, IL-1 y TNF-α), con mayor inflamación e inmunosupresión, caracterizada por un aumento de la actividad citotóxica de Th17 y CD8 y disminución de las células auxiliares T CD4+de memoria. Esta respuesta debe estar en equilibrio entre la eliminación del virus y evitar el daño pulmonar inmunomediado, que es en donde los corticoides juegan un rol antiinflamatorio, inhibiendo múltiples citoquinas27. Además, se ha evidenciado que los corticoides, como efecto de familia, aumentan la transcripción de la ECA228, que al ser usada por el SARS-CoV-2 para infectar a las células, se depleta promoviendo un exceso de angiotensina lo que aumenta el daño pulmonar en fases tardías.
A inicios de marzo 2020 Villar et al.29 publicaron el DEXA-ARDS (estudio multicéntrico aleatorizado), donde se evidenció una reducción del 15,3% en mortalidad a favor de los pacientes con SDRA tratados con dexametasona. Posteriormente Wu et al.30 en un trabajo retrospectivo evidenció un aumento significativo en la sobrevida (HR: 0,38; IC 95% 0,20-0,72) en un grupo de 84 sujetos con COVID-19 que desarrollaron SDRA y que recibieron metilprednisolona, destacando que aquellos tratados con corticoides tenían un mayor score de gravedad. En otro estudio retrospectivo Wang et al.31 evidenciaron recuperación más precoz de la saturación y estadías más cortas en intensivo y hospitalización en pacientes que fueron tratados con metilprednisolona.
Si bien existían varias series pequeñas de baja/moderada calidad metodológica que evidenciaban un efecto positivo en el uso de corticoides, no fue hasta la publicación del estudio RECOVERY32 que se comenzó a usar en forma consistente. El estudio RECOVERY reclutó a pacientes hospitalizados con COVID-19, en 176 centros hospitalarios en Reino Unido, aleatorizando a cuidado habitual (n: 4.321) o dexametasona 6mg al día (n: 2.104) por hasta 10 días. La mortalidad a 28 días se redujo con un RR: 0,83 (IC 95% 0,74 - 0,92; p<0,001; RRA: 3%; NNT: 33) en favor del grupo tratado con corticoides. Este beneficio fue mayor en sujetos en ventilación mecánica (RRA: 11,7%; NNT: 9) que en aquellos que requerían oxigenoterapia (RRA: 3,5%; NNT: 29), e incluso evidenciándose una tendencia a dañar en sujetos que no requerían oxígeno (mortalidad 17,0% vs 13,2%). En análisis por subgrupos se evidenció que los que más se beneficiaron fueron los hombres (RR: 0,80; IC 95% 0,71–0,91), menores de 70 años (RR: 0,64; IC 95% 0,53–0,78), y aquellos con más de 7 días de síntomas (RR: 0,69; IC 95% 0,59–0,80).
En este mismo sentido el estudio de Keller et al.33 evidenció que existía diferencias en la mortalidad con el uso de corticoides según el nivel de inflamación, se reducía con PCR mayor de 20mg/dL, OR: 0,20; IC 95% 0,06-0,67; y aumentaba para PCR menor de 10mg/dL, OR: 3,14; IC 95% 1,52-6,50).
En suma, la evidencia actual nos permite afirmar que existe un efecto beneficioso a nivel de mortalidad por COVID-19 en pacientes más graves, con una enfermedad más prolongada y que se encuentren más inflamados, lo que es concordante con el efecto buscado del uso de los corticoides para evitar el daño de la segunda etapa del COVID-19, que se encuentra mediada por una respuesta exagerada del sistema inmune. Hasta la fecha la dexametasona es el corticoide que ha demostrado mayor beneficio clínico. Actualmente existen estudios en curso para determinar el tiempo y dosis de corticoides. Durante su prescripción deben considerarse sus efectos adversos como hiperglicemia, infecciones, miopatía, y trastornos mentales.
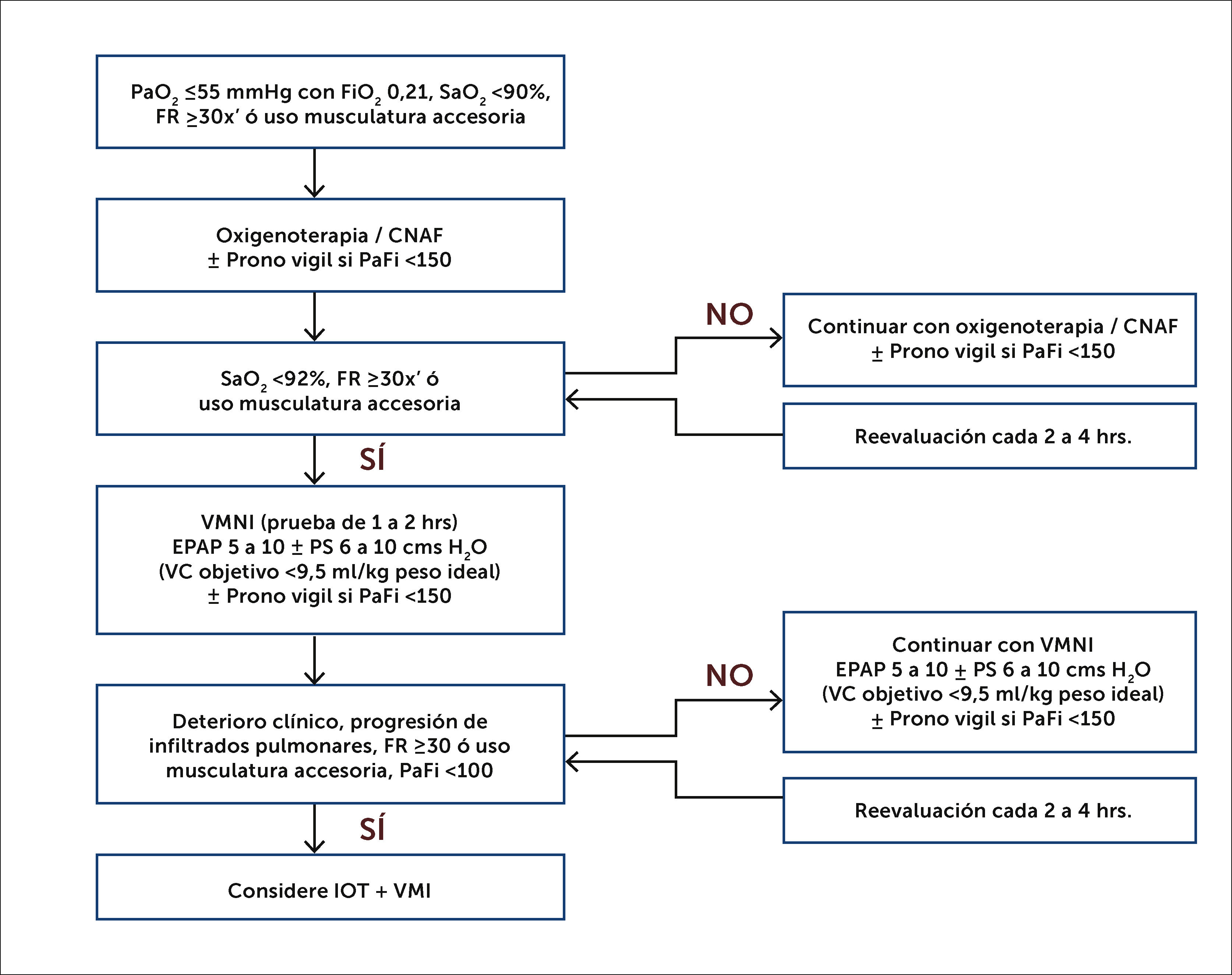
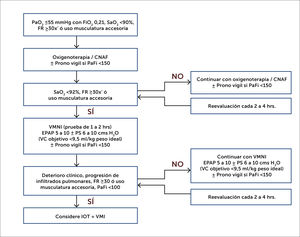
Oxigenoterapia y Prono VigilLa infección por SARS-CoV-2 en la mayoría de los sujetos produce manifestaciones leves a moderadas, sin requerimientos de oxígeno suplementario en más del 80% de los pacientes, mientras que se estima que alrededor del 5% requerirá apoyo con ventilación mecánica invasiva (VMI)34. En aquellos que desarrollan compromiso pulmonar se ha reportado que existe un fenómeno de “happy hypoxemia”, dado que los sujetos consultan con avanzada hipoxemia, pero con escasos síntomas35. Si se requiere de mayores requerimientos de fracción inspirada de oxígeno (FiO2) o existe un trabajo ventilatorio aumentado se debe iniciar un mayor apoyo para evitar la necesidad de VMI (Figura 1).
Oxigenoterapia y prono vigil
Abreviaturas: PaO2, presión del oxígeno en sangre arterial; FiO2, fracción inspirada de oxígeno; SaO2, saturación arterial de oxígeno; FR, frecuencia respiratoria; CNAF, cánula nasal de alto flujo; PaFi, índice de oxigenación entre presión arterial de oxígeno y la fracción inspirada de oxígeno (PaO2/ FIO2); VMNI, ventilación mecánica no invasiva; EPAP, presión positiva espiratoria; VC: volumen corriente PS: presión de soporte; IOT, intubación orotraqueal; VMI, ventilación mecánica invasiva; VMNI, ventilación mecánica no invasiva.
La CNAF permite aportar una alta FiO2, calentada y humidificada a un alto flujo, lo que genera una PEEP extrínseca de±4 a 6cm H2O y permite el barrido de la nasofaringe con oxígeno al exhalar, mejorando la oxigenación y reduciendo el espacio muerto anatómico, permitiendo a su vez disminuir el trabajo ventilatorio. Durante la pandemia de COVID-19 se ha usado ampliamente en combinación con prono vigil y ventilación mecánica no invasiva (VMNI), principalmente para pacientes con oxigenación límite y trabajo ventilatorio leve a moderadamente aumentado. La humidificación activa facilita la eliminación de secreciones. La CNAF es mejor tolerada que la VMNI y dado que puede favorecer a dispersión de aerosoles con SARS-CoV-2, se recomienda que el paciente use una mascarilla por sobre ella36.
Ventilación Mecánica No Invasiva (VMNI)La VMNI se ha usado rutinariamente en los últimos 30 años en insuficiencia ventilatoria37. Dentro de los beneficios de la VMNI es que permite una mayor presión de vía aérea lo que se traduce en una mejoría en la presión del oxígeno en sangre arterial (PaO2); aumenta la ventilación alveolar con reducción de la presión del dióxido de carbono en sangre arterial (PaCO2) y mejora del equilibrio acido base, además disminuye el trabajo respiratorio lo que reduce la disnea y el consumo de oxígeno. Sus principales complicaciones son la intolerancia a la interfaz, úlceras por presión, dificultad para eliminar secreciones y comunicarse con el entorno. Al igual que con la CNAF, durante la pandemia de COVID-19 se ha usado en combinación con prono vigil. Se debe usar con un filtro intercambiador de humedad y de calor (HME-F) e interfaz sin fuga para evitar la generación de aerosoles contaminados. Si luego de una prueba de 1 a 2 horas se evidencia frecuencia respiratoria aumentada o uso de musculatura accesoria se recomienda pasar a ventilación mecánica invasiva38, igualmente se ha observado que volúmenes corrientes mayores a 9,5ml/kg peso ideal se asocian a fracaso de VMNI39.
Prono VigilLa maniobra de prono fue descrita hace más de 4 décadas40 y se ha usado rutinariamente en pacientes con en VMI que cursan con SDRA, dado la mejoría en sobrevida evidenciada en el estudio PROSEVA41. Los beneficios fisiológicos del prono son múltiples, reducción de la sobre distensión alveolar en las áreas no dependiente, así como del colapso de alvéolos en áreas dependientes mejorando las alteraciones V/Q, además permite una menor compresión de la región dorsal pulmonar con mantenimiento de la perfusión lo que también mejora la relación V/Q, facilita el drenaje de vías respiratorias y permite una ventilación más homogénea. Durante la pandemia por COVID-19 su uso se ha expandido en sujetos con hipoxemia a pesar de uso de CNAF o VMNI, sobre todo, con PaO2 / FiO2 menor de 150 y con opacidades pulmonares difusas en las imágenes pulmonares42. Si bien es una maniobra segura, puede genera incomodidad, la que se puede disminuir con uso de almohadas bajo los puntos de presión y sedantes.
OTRAS TERAPIASActualmente se encuentran en fase de prueba otras posibles terapias para COVID-19 con antivirales, anticuerpos monoclonales, fármacos inmunomoduladores y plasma convaleciente, cuyos resultados en los próximos meses podrían aportar nuevas estrategias para manejo de esta patología.
Trombo embolismo pulmonarLos pacientes con COVID-19 que requieren hospitalización frecuentemente muestran un perfil de laboratorio compatible con hiper coagulabilidad43 y una alta prevalencia de eventos trombóticos, tanto arteriales como venosos. La prevalencia de trombo embolismo pulmonar (TEP) reportada en pacientes críticos con COVID-19 alcanza un 20-30%44 y estos eventos se pueden producir a pesar de anticoagulación, profiláctica o terapéutica. Desde el punto de vista fisiopatológico existen 4 fenómenos que son cruciales en la aceleración de la formación de trombos, todos ellos íntimamente relacionados al aumento de citoquinas pro-inflamatorias:
- 1.
Activación de la coagulación
- 2.
Supresión de la fibrinólisis
- 3.
Activación plaquetaria con unión al endotelio
- 4.
Injuria endotelial directa.
Estos hallazgos son característicos de pacientes con COVID-19 y sindrome de distrés respiratorio agudo (SDRA).
En los pacientes graves con COVID-19 existen importantes alteraciones en la microcirculación. Se ha demostrado una injuria vascular y endotelial directa con la consiguiente formación de micro trombos. Un estudio post mortem45 evidenció una importante infiltración por células polimorfonucleares y mononucleares, junto con apoptosis de las células endoteliales. En una revisión sobre hallazgos patológicos en pacientes con COVID-1946 se reporta la presencia de engrosamiento de la pared vascular, estenosis luminal y formación de micro trombos, además de los hallazgos típicos de daño alveolar difuso. Un estudio más reciente47 informa la presencia de anticuerpos anti-fosfolípidos.
Con respecto al análisis de laboratorio, estudios realizados en pacientes que requieren ingresar a cuidados intensivos1 evidencian alzas importantes de DD (hasta 10 veces el valor normal), aumento en los niveles de fibrinógeno y alteraciones en los exámenes de tromboelastografía. Una serie de pacientes hospitalizados por COVID-19 en China48 muestra que el 43% de los pacientes no graves y un 60% de los pacientes graves en intensivo tienen niveles elevados de DD. En otras series de casos49 los niveles elevados de DD (>1 ug/L al ingreso), se asocian a aumento de la mortalidad intrahospitalaria. Es importante destacar que la coagulopatía asociada a COVID-19 parece tener un patrón diferente al observado en otros tipos de sepsis. La coagulopatía observada en pacientes con COVID-19 se caracteriza por elevación del fibrinógeno y del DD, lo que se correlaciona con un aumento paralelo en los marcadores de inflamación, prolongación del tiempo de protrombina y del tiempo parcial de tromboplastina activada. No obstante, la trombocitopenia, si aparece, suele ser leve o moderada50.
En un registro en curso en pacientes hospitalizados en Clínica Las Condes (estudio en vía de publicación) se comparó, desde un punto de vista clínico y de laboratorio, a aquellos enfermos con COVID-19 que desarrollaron TEP versus aquellos que no la presentaron.
De 171 pacientes, 36 (21%) tuvieron embolia pulmonar a pesar de estar con trombo profilaxis. Las variables que mejor discriminaron a los pacientes con TEP de los sin TEP fueron el DD y la frecuencia cardíaca pre Angio-TAC y la Ferritina de ingreso.
En relación al manejo, se recomienda la profilaxis farmacológica antitrombótica en todos los pacientes hospitalizados con COVID-19, independientemente de que se encuentren en unidades de pacientes críticos o no y sin diferenciar si existen motivos médicos, quirúrgicos u obstétricos para su estadía hospitalaria, a menos que exista contraindicación para la anticoagulación. La indicación actual corresponde al uso de heparinas de bajo peso molecular, administradas a través de la vía subcutánea en pacientes con clearance de creatinina >15ml/min. Bajo este valor de filtración glomerular o en presencia de terapias de reemplazo renal, se recomienda el uso de heparina no fraccionada subcutanea51.
En el grupo de enfermos considerados de alto riesgo de eventos trombóticos: DD mayor a 2.000 ng/ml, marcadores inflamatorios elevados, tales como proteína C reactiva, procalcitonina o ferritina se sugiere utilizar profilaxis pero en dosis más altas (ejemplo, enoxaparina 0.5mg/kg 2 veces al día)52. En pacientes con persistencia de factores de riesgo al momento del alta como movilidad reducida o DD mayor al doble del valor normal y bajo riesgo de sangrado, se recomienda darlos de alta con profilaxis53.
La anticoagulación plena es apropiada en pacientes con un evento tromboembólico demostrado.
En aquellos pacientes donde no sea posible un examen confirmatorio de TEP, el tratamiento anticoagulante empírico se debe plantear en presencia de un súbito deterioro de la condición respiratoria y/o hemodinámica, especialmente en presencia de estabilidad clínica y radiológica previa, ausencia de una alteración cardíaca evidente y presencia de DD elevado (6 veces sobre el valor normal)54. Un test confirmatorio posterior es necesario para dirigir la intensidad y duración de la terapia.
Al alta, los pacientes COVID-19 que han tenido un evento tromboembólico requieren al menos 3 meses de terapia anticoagulante.
SEGUIMIENTO POST ALTASi bien existe muy poca evidencia del seguimiento a mediano y largo plazo, los pacientes de mayor gravedad pueden quedar con secuelas imagenológicas y funcionales derivadas del compromiso pulmonar parenquimatoso (secundario a SDRA) y vascular (secundario a enfermedad tromboembólica). Se describe que la resolución, tanto clínica como radiológica, es más lenta que en otras neumonías virales55. En el seguimiento post alta se ha reportado intensa fatiga y disnea, ya sea por compromiso general o desarrollo de patología en el parénquima pulmonar de tipo neumonía en organización o de fibrosis pulmonar tardía56.
Además, hay que agregar las secuelas derivadas de una hospitalización prolongada en unidades de cuidados Intensivos, con requerimiento de ventilación mecánica invasiva, uso de esteroides en altas dosis y relajantes musculares como lo son la polineuropatía del paciente crítico, miopatía, desnutrición y secuelas psíquicas, que requieren de programas de rehabilitación integral57.
En el Centro de Enfermedades Respiratorias de Clínica Las Condes, se realizó un seguimiento ambulatorio de pacientes ≥18 años, hospitalizados entre 1 de abril a 31 de julio 2020 por COVID-19 y que acudieron al menos a un control post alta. En esta cohorte se le evaluaron características demográficas, comorbilidades, uso de ventilación mecánica no invasiva (VMNI) e invasiva (VMI), y en el control ambulatorio, saturación oxígeno al caminar, espirometría y TAC.
La cohorte fue de 164 pacientes, hombres 68%, edad 57 años (21 a 89), estadía hospitalaria 9 días (3 a 69). Las principales comorbilidades fueron: Hipertensión arterial 34%, diabetes mellitus 26% y un 41% de los pacientes tenía un IMC >30. En relación al compromiso funcional respiratorio, el 31% requirió VMNI y el 11% VMI.
En control clínico post alta destacó tos residual escasa, anosmia en algunos pacientes, pero lo que predominaba era una gran fatiga, pérdida de peso y de masa muscular. Esta sintomatología es muy similar a la reportada en un estudio italiano en 143 pacientes estudiados posterior al alta58. En el examen clínico llamó la atención que en caminata simple de 50-70 mt por pasillo se observó caída saturación de oxígeno (SaO2) de 2 a 8 puntos en 90% de ellos. La función pulmonar se realizó a 75 pacientes a una mediana de 34 días y se describe en Figura 1. La capacidad de difusión pulmonar (DLCO) es el examen de función pulmonar que más se altera en los pacientes que han tenido neumonía. En un estudio de 110 pacientes posterior al alta, entre los que tuvieron neumonía la DLCO estaba anormal en 51 pacientes (47%), mientras que el volumen espiratorio forzado en 1 segundo (VEF1) fue anormal en 15 (14%) y la capacidad vital forzada en 10 (9%)59.
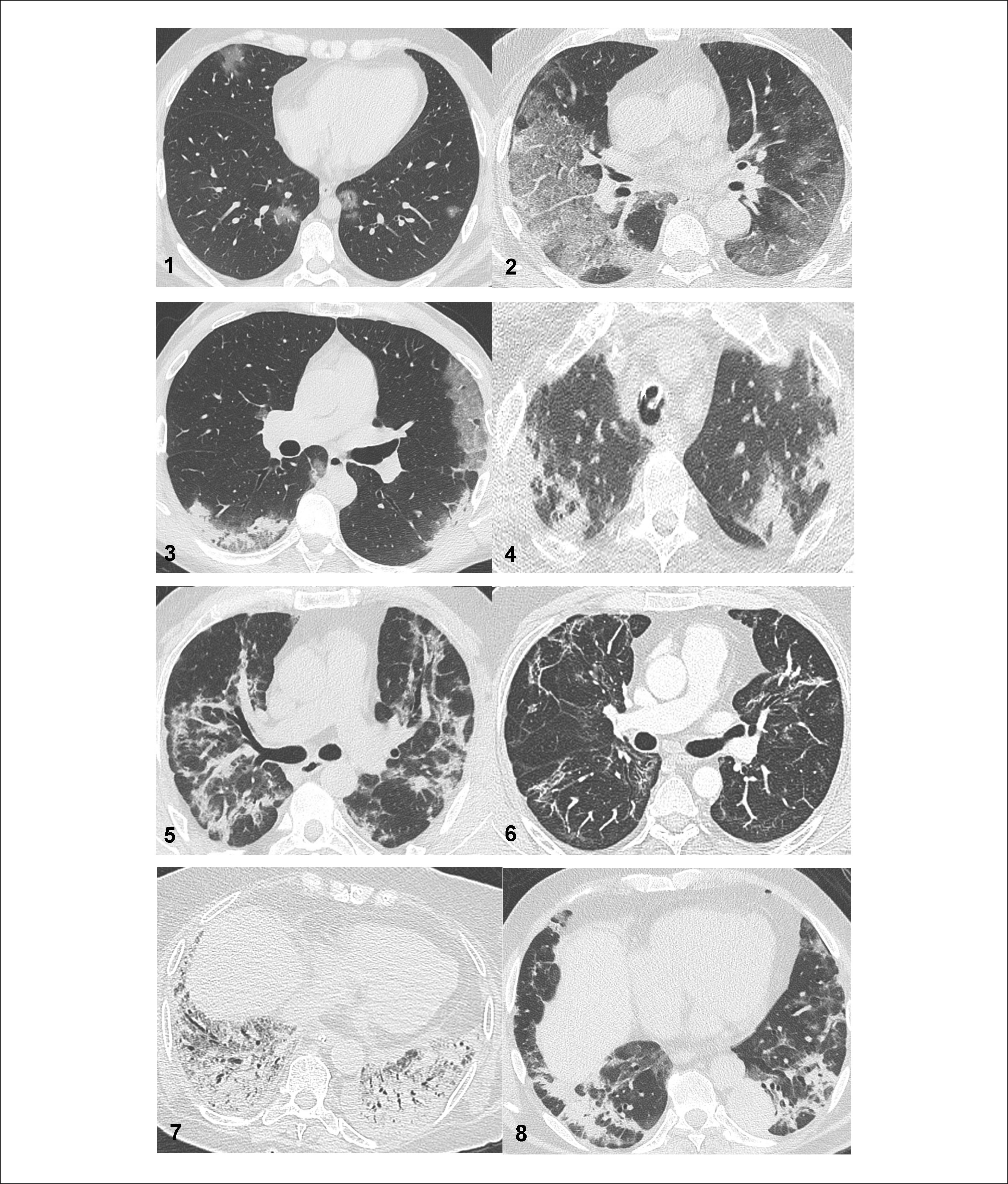
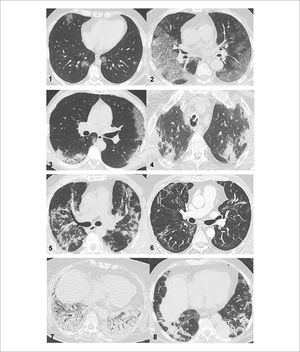
Hasta la fecha de esta publicación, se han realizado 28 TAC de tórax de seguimiento, 36 días (10 a 76) posterior al alta. En 17 (61%) pacientes la TAC mostró alteraciones no fibróticas (atelectasias, vidrio esmerilado y opacidades reticulares), en 6 (21%) pacientes fue normal y en 5 (18%) mostró algún tipo de fibrosis. Los hallazgos imagenológicos habituales de ver en la neumonía COVID-19 varían según la etapa de la enfermedad. Las alteraciones iniciales son opacidades en vidrio esmerilado generalmente basal y periférico, que en los días sucesivos progresa en extensión y aparición en densidad, de áreas de vidrio esmerilado con patrón en empedrado y otras zonas de consolidación. Luego de alcanzar el máximo de alteraciones, aproximadamente 9 a 14 días de iniciado los síntomas, comienza la fase de reabsorción, en que se identifican áreas de consolidación con pérdida de volumen, muchas veces con aspecto de neumonía en organización, dilatación cilíndrica de bronquios, y bandas de atelectasia. Las alteraciones descritas no son sincrónicas y suelen verse en un mismo momento los hallazgos de las distintas fases. En el seguimiento de los pacientes, hasta 4 a 5 meses posteriores al cuadro agudo, puede persistir el compromiso pulmonar, siendo los hallazgos más frecuentes bandas de atelectasia, vidrio esmerilado por resolución de las condensaciones preexistentes o reexpansión de las zonas previamente atelectásicas, y opacidades reticulares con distorsión de los ejes bronco vasculares. Estos últimos, a pesar de simular compromiso fibrótico, muchas veces se resuelven o persisten por más tiempo como bandas atelectásicas (Figura 2).
Imágenes de Tomografía Axial Computada (TAC) en COVID-19
Imágenes de TAC de los patrones considerados para definir compromiso radiológico por COVID-19. 1) Vidrio Esmerilado (VE) puro: áreas en VE de configuración nodular, bilaterales. 2) VE y empedrado (“Crazy Paving”): áreas en VE con engrosamiento septal sobrepuesto, que determina patrón en empedrado, bilateral. 3) Mixto: áreas en VE y otras de condensación bilaterales. 4) Condensación: áreas fundamentalmente de condensación pulmonares bilaterales. 5) Condensación con pérdida de volumen áreas de condensación asociadas a pérdida de volumen, en algunas zonas con aspecto de neumonía en organización. 6) Bandas subpleurales, atelectasias y dilatación bronquial: bandas densas y de atelectasia bilaterales, peribronquiales y periféricas. 7) Distrés respiratorio: extensas áreas de condensación, con broncograma aéreo, simétricas y más densas en la superficie dependiente. 8) Neumonía en organización: áreas de condensación asociadas a pérdida de volumen peribronquiales bilaterales.
Los pacientes más severos, que requirieron de VMI o ECMO 18 (11%), fueron contactados con equipo de rehabilitación pulmonar previo al alta entregándoles pauta de ejercicio en domicilio e instrucciones uso de oxigenoterapia57.
A los dos meses de seguimiento los pacientes se encontraban más activos, con menor fatiga y autovalentes.
Hay pocos datos en la literatura de seguimiento de pacientes hospitalizados por neumonía por COVID-19. Se aconseja que pacientes con múltiples comorbilidades, con neumonía grave y hospitalizados en unidades de cuidados intensivos tengan un primer control 4-6 semanas post alta, con estudio funcional y de imágenes a las 12 semanas post alta60.
La valoración multidisciplinaria en estos pacientes es esencial. Complicaciones cognitivas o psiquiátricas deberían ser evaluadas por un especialista y los pacientes que han requerido VMI y/o traqueostomía, con neuromiopatía deben ser referidos a equipo de fisiatría y rehabilitación cuando son dados de alta60.
En suma, esta nueva infección por COVID-19ha generado nuevos retos en la práctica médica. Los pacientes que han requerido hospitalización por neumonía, deben tener un seguimiento clínico y funcional respiratorio; y en casos de neumonía grave, un apoyo con un equipo multidisciplinario que permita un manejo integral para mejorar la condición de los pacientes y su calidad de vida.
Declaración de conflicto de interés
Los autores declaramos que no tenemos conflictos de interés en relación a esta publicación.
Este es un artículo Open Access bajo la licencia CC BY-NC-ND.