La enfermedad pulmonar obstructiva crónica (EPOC) es una patología heterogénea que impacta a más de 380 millones de personas globalmente, siendo la tercera causa de muerte a nivel mundial. Desde su reconocimiento en la década de 1960, el entendimiento y manejo de la EPOC ha evolucionado significativamente, gracias a avances en el conocimiento sobre su etiopatogenia y tratamiento. Las guías de la Iniciativa Global para la EPOC (GOLD COPD, por sus siglas en inglés) representan un esfuerzo por estandarizar el diagnóstico y tratamiento, con su revisión en 2023 actualizando la definición de la enfermedad. El manejo adecuado de la EPOC incluye un diagnóstico preciso, terapias farmacológicas y no farmacológicas, y estrategias de prevención enfocadas especialmente en la cesación del tabaquismo, la principal causa de la enfermedad.
El diagnóstico se basa en la historia de exposición a partículas o gases nocivos, con la espirometría como examen clave para confirmar la obstrucción bronquial no completamente reversible. La estrategia de tratamiento ha mejorado con el desarrollo de nuevos fármacos y dispositivos de administración, enfocándose en reducir síntomas y el riesgo de exacerbaciones. La terapia farmacológica se adapta según la clasificación GOLD del paciente, con opciones que van desde terapias broncodilatadoras hasta combinaciones de múltiples fármacos para casos más severos. La importancia de la detección y tratamiento de las comorbilidades es crítica, dada su alta prevalencia en pacientes con EPOC y su impacto en la mortalidad.
Las estrategias no farmacológicas incluyen la cesación del tabaquismo, oxigenoterapia a largo plazo, actividad física y rehabilitación pulmonar, asegurando una adecuada inmunización. El manejo de las exacerbaciones debe ser adecuado y precoz, dado que se asocian con un aumento en la morbilidad y mortalidad.
En esta revisión se busca dar un enfoque integral al manejo de la EPOC, basado en la evidencia.
Chronic obstructive pulmonary disease (COPD) is a heterogeneous pathology that impacts more than 380 million people globally, being the third leading cause of death worldwide. Since its recognition in the 1960s, the understanding and management of COPD have significantly evolved, thanks to advances in knowledge about its etiopathogenesis and treatment. The guidelines from the Global Initiative for COPD (GOLD COPD) represent an effort to standardize diagnosis and treatment, with its review in 2023 updating the disease's definition. Proper management of COPD includes accurate diagnosis, pharmacological and non-pharmacological therapies, and prevention strategies focused especially on smoking cessation, the main cause of the disease.
Diagnosis is based on the history of exposure to noxious particles or gases, with spirometry as a key exam to confirm not completely reversible bronchial obstruction. The treatment strategy has improved with the development of new drugs and administration devices, focusing on reducing symptoms and the risk of exacerbations. Pharmacological therapy is adapted according to the GOLD classification of the patient, with options ranging from bronchodilator therapies to combinations of multiple drugs for more severe cases. The importance of detecting and treating comorbidities is critical, given their high prevalence in patients with COPD and their impact on mortality.
Non-pharmacological strategies include smoking cessation, long-term oxygen therapy, physical activity, and pulmonary rehabilitation, as well as ensuring adequate immunization. The management of exacerbations must be appropriate and early, as they are associated with an increase in morbidity and mortality.
This review seeks to provide an evidence based integral approach to the management of COPD.
La enfermedad pulmonar obstructiva crónica (EPOC) es una patología heterogénea y devastadora, que afecta a más de 380 millones1 de personas en el mundo en la actualidad. En vista a nuevos estudios y conocimientos de su etiopatogenia y tratamiento, su manejo ha cambiado a lo largo del tiempo, desde su introducción como patología en la década de 1960 y la descripción de su historia natural en 1977 por Fletcher y Peto2. Existen varias revisiones que se actualizan en el tiempo, siendo una de las más conocidas la desarrollada por la Iniciativa Global para la Enfermedad Pulmonar Obstructiva Crónica (GOLD COPD, por sus siglas en inglés), publicada por primera vez en 2001, que tiene como objetivo estandarizar el diagnóstico y tratamiento de la EPOC. Su más reciente revisión es del 2024, donde se actualizó la definición de la EPOC a una “condición pulmonar heterogénea, caracterizada por síntomas respiratorios crónicos (disnea, tos, expectoración, exacerbaciones) debidos a anormalidades de las vías aéreas (bronquitis, bronquiolitis) y/o alvéolos (enfisema) que causa limitación al flujo aéreo persistente y habitualmente progresiva”1.
Actualmente la EPOC es la 3a causa de muerte en el mundo3, con más de 3 millones de muertes anuales y una prevalencia estimada en 11,7% (IC 95% [8,4-15,0%]). Se proyecta que el año 2030 causará 4,5 millones de muertes4, debido al uso de tabaco y al envejecimiento poblacional.
El costo de la EPOC es considerable, siendo estimado un gasto de USD 49 mil millones5 el 2020 en Estados Unidos, del cual entre un 40% a 70% fue secundario al manejo de las exacerbaciones6.
Para lograr el adecuado manejo de la EPOC debemos realizar su correcto diagnóstico, al igual que implementar tratamiento farmacológico, no farmacológico, programas de seguimiento y prevención de patologías asociadas al tabaco, que es la causa más frecuente de la EPOC.
Objetivos de aprendizaje: al final de este artículo el lector debería ser capaz de:
- -
Explicar los criterios diagnósticos y factores de riesgo de la EPOC
- -
Iniciar los principales tratamientos actualmente aceptados para la EPOC
- -
Evaluar en forma integral a los pacientes con EPOC considerando, además de la propia patología, las comorbilidades
En la actualidad sabemos que la función pulmonar de la vida adulta se determina por factores que van desde previo a nuestro nacimiento, pasando por condiciones de nuestro desarrollo en la infancia y juventud7 y con un decline de la función pulmonar que es heterogéneo8. Por ende, el correcto diagnóstico de la EPOC se realiza mediante la historia de exposición significativa a partículas o gases nocivos, siendo el tabaco y la combustión de biomasa las más habituales, pero considerando también patologías (ej asma remodelada, bronquiectasias), y secuelas debido a infecciones en la infancia (ej. virus respiratorio sincicial, adenovirus), o adulta (ej. tuberculosis, VIH) y causas genéticas (ej. déficit de alfa 1 antitripsina).
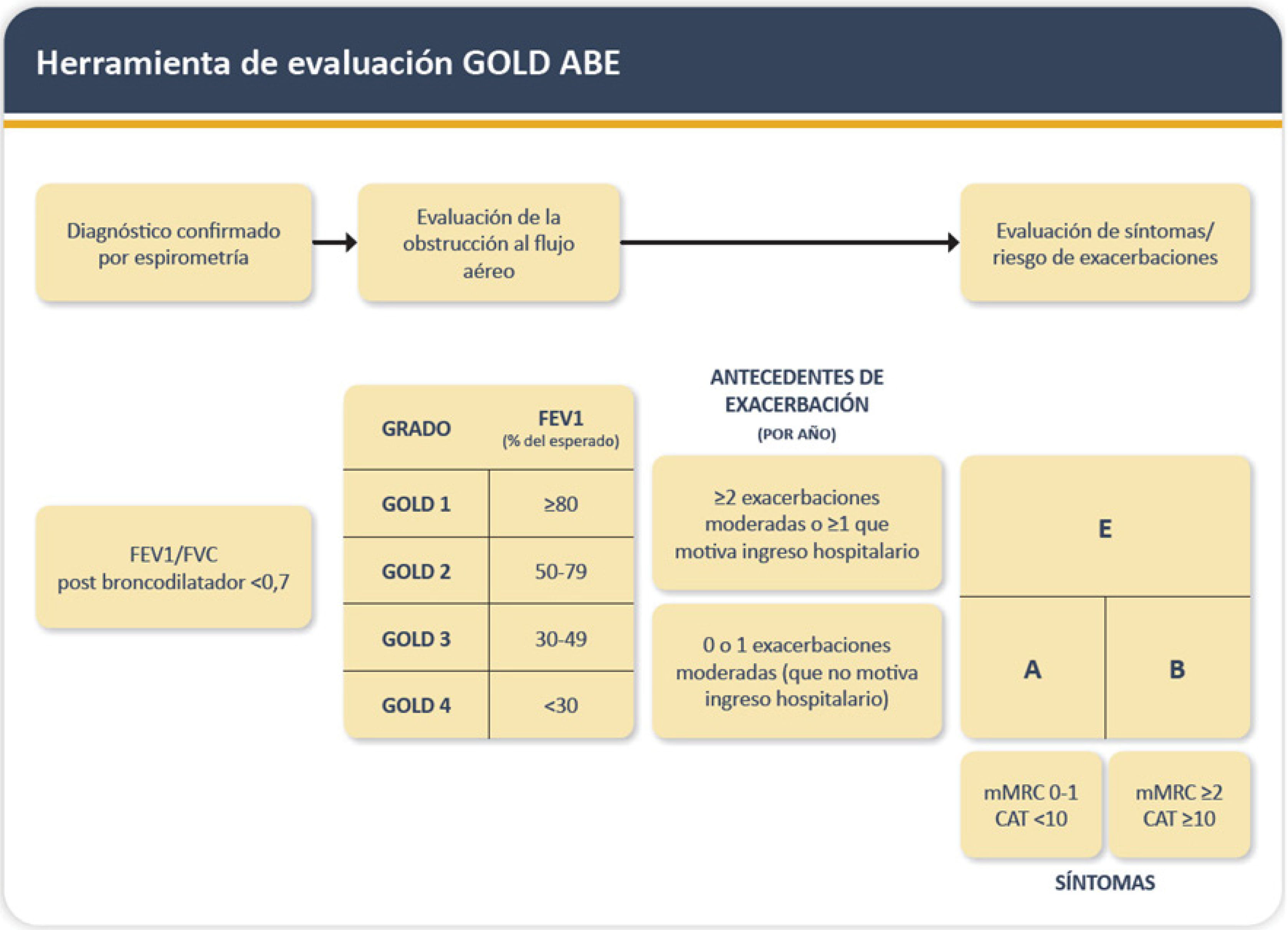
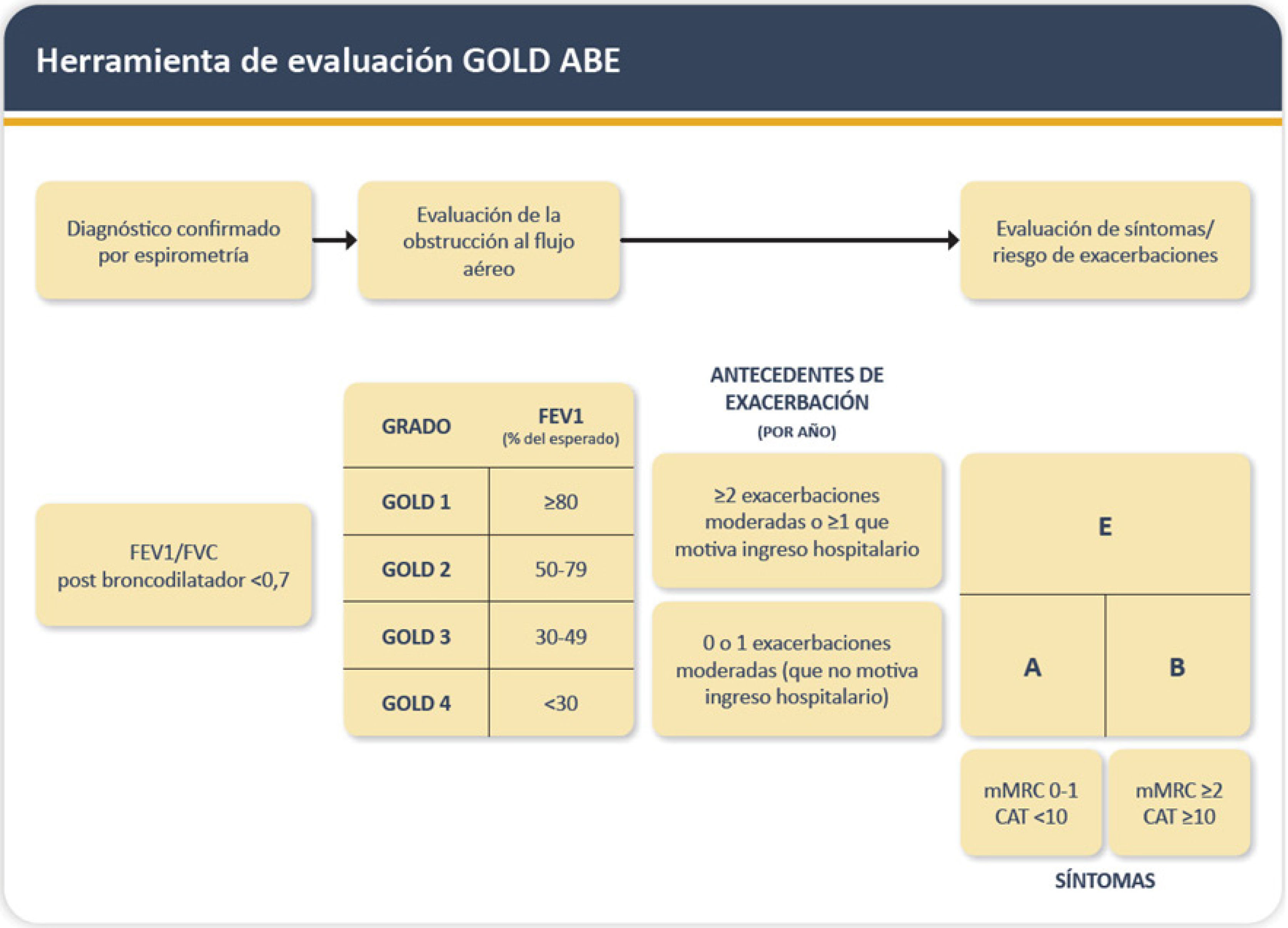
La espirometría con broncodilatador es el examen fundamental para un correcto diagnóstico de la EPOC, permitiendo confirmar la obstrucción bronquial no completamente reversible (VEF1/CVF <0,7 o menor al límite inferior de lo normal) y el grado de severidad de esta. Junto con la espirometría se debe evaluar la cantidad y severidad de exacerbaciones en el último año y el impacto en la calidad de vida, para lo que se usan dos escalas validadas: escala de disnea modificada del Medical Research Council (mMRC) y COPD Assessment Test (CAT)1 (figura 1).
Diagnóstico y clasificación de la EPOC
Adaptado de Global Strategy for Prevention, Diagnosis and Management of COPD: 2024 report. Disponible en: https://goldcopd.org/2024-gold-report1. Con permiso de GOLD COPD.
El concepto de pre-EPOC se ha acuñado para describir a personas que pueden presentar síntomas respiratorios y/o lesiones estructurales en los pulmones (ej. enfisema) y/o anomalías fisiológicas (incluyendo VEF1 bajo, atrapamiento de gas, hiperinsuflación, capacidad de difusión pulmonar reducida y/o disminución rápida de VEF1), sin obstrucción del flujo de aire (VEF1/CVF =0,7 post broncodilatación), que tienen riesgo de presentar obstrucción bronquial en el tiempo, si bien no todos la desarrollarán1.
En sus últimas revisiones la estrategia GOLD ha destacado el patrón PRISm (Preserved Ratio with Impaired Spirometry), que se define como reducción del VEF1 post broncodilatador con relación VEF1/CVF normal. En estudios clínicos se ha estimado una prevalencia del 7,1 al 11%, y cuyas posibles causas pueden ser enfermedad cardíaca con congestión pulmonar, estado inicial de enfermedades obstructivas o restrictivas pulmonar, enfermedad de vía aérea pequeña, enfisema con atrapamiento aéreo, o una mala maniobra espirométrica (inspiración o espiración incompleta). Este patrón tiene un significado aún incierto, pero varios estudios han observado un peor pronóstico de estos pacientes9.
La tomografía computarizada de tórax es un examen cada vez más asequible para evaluar a nuestros pacientes, permitiendo obtener información valiosa tanto de la EPOC (ej. gravedad y distribución del enfisema, presencia de tapones mucosos o estudio de infiltrados), como de otras patologías asociadas (ej. cardiopatía coronaria, anomalías pulmonares inespecíficas, enfermedades intersticiales asociadas, búsqueda activa de neoplasia pulmonar y diagnósticos diferenciales de la obstrucción bronquial, entre otros)1.
TerapiaEl tratamiento de la EPOC ha experimentado grandes avances desde sus inicios, tanto en cuanto a nuevos fármacos (mayor duración, selectividad de receptores y potencia), los dispositivos por los que se administran al paciente y en la introducción de terapias enfocadas en rasgos tratables, donde los pilares actuales del manejo son la reducción de síntomas y la reducción del riesgo de exacerbaciones1. Para esto se implementan estrategias farmacológicas y no farmacológicas durante su fase estable y manejo de las exacerbaciones.
Estrategias farmacológicas EPOC estableSegún la clasificación GOLD estableceremos el manejo inicial farmacológico con terapia broncodilatadora (figura 2). En el grupo poco sintomático y con 0 o 1 exacerbación leve a moderada (GOLD A), se recomienda inicio de terapia broncodilatadora de larga o corta duración, privilegiando la opción de larga duración cuando esté disponible, excepto en aquellos con disnea muy ocasional. El grupo sintomático y con 0 o 1 exacerbación leve a moderada (GOLD B), destaca principalmente por comorbilidades, siendo las más importantes las cardiovasculares y metabólicas; en este grupo se recomienda la terapia broncodilatadora dual con antagonistas muscarínicos de larga duración (LAMA, por sus siglas en inglés) y agonistas β2 de larga duración (LABA, por sus siglas en inglés), dado la mejoría evidenciada en calidad de vida y reducción significativa del riesgo de nuevas exacerbaciones10. Actualmente no se recomienda terapia combinada LABA+ICS (corticoides inhalatorios por sus siglas en inglés) dado que la terapia dual ha mostrado mayor disminución de riesgo de exacerbación y mejor calidad de vida11,12.
Manejo inicial broncodilatador de la EPOC
Adaptado de Global Strategy for Prevention, Diagnosis and Management of COPD: 2024 report. Disponible en: https://goldcopd.org/2024-gold-report1. Con permiso de GOLD COPD.
*El tratamiento con un solo inhalador puede ser más conveniente y efectivo que con varios inhaladores. Eos: eosinófilos; LAMA: antagonistas muscarínicos de larga duración (por sus siglas en inglés); LABA: agonistas β2 de larga duración (por sus siglas en inglés); GCI: corticoides inhalados.
En el grupo con ≥2 exacerbaciones leves a moderadas o ≥1 que requiera hospitalización (grave) (GOLD E) también se recomienda iniciar con terapia dual o terapia triple (LAMA+LABA+ICS), en especial en pacientes con eosinófilos en sangre ≥300 cels/μl, puesto que varios estudios en los últimos años han demostrado beneficios en función pulmonar, calidad de vida, exacerbaciones y mortalidad13,14.
La EPOC es una enfermedad habitualmente considerada como secundaria a inflamación mediada por neutrófilos, pero en la última década la medición de eosinófilos en sangre o esputo en los pacientes con EPOC ha marcado el inicio de un nuevo rasgo tratable, el cual se correlaciona con mayor riesgo de exacerbación mientras más alto sea el recuento de estos,13,14 demostrándose mejoría de los parámetros clínicos con la adición de corticoides inhalados (figura 3). Si bien el riesgo de neumonía asociado a su uso parece ser un efecto de clase (OR 1,229 IC95% [1,001-1,508])15, este es notablemente menor al beneficio asociado a la reducción del riesgo de exacerbaciones.
Uso de corticoides inhalados
Adaptado de Global Strategy for Prevention, Diagnosis and Management of COPD: 2024 report. Disponible en: https://goldcopd.org/2024-gold-report1. Con permiso de GOLD COPD.
Si bien aún existen pocos estudios, y con resultados disimiles, en relación al uso de terapia biológica en EPOC, el subgrupo de pacientes con eosinofilia ha sido el que ha mostrado mejores resultados al disminuir un 18% riesgo de exacerbación moderada a severa y aumentar el tiempo a la primera exacerbación16.
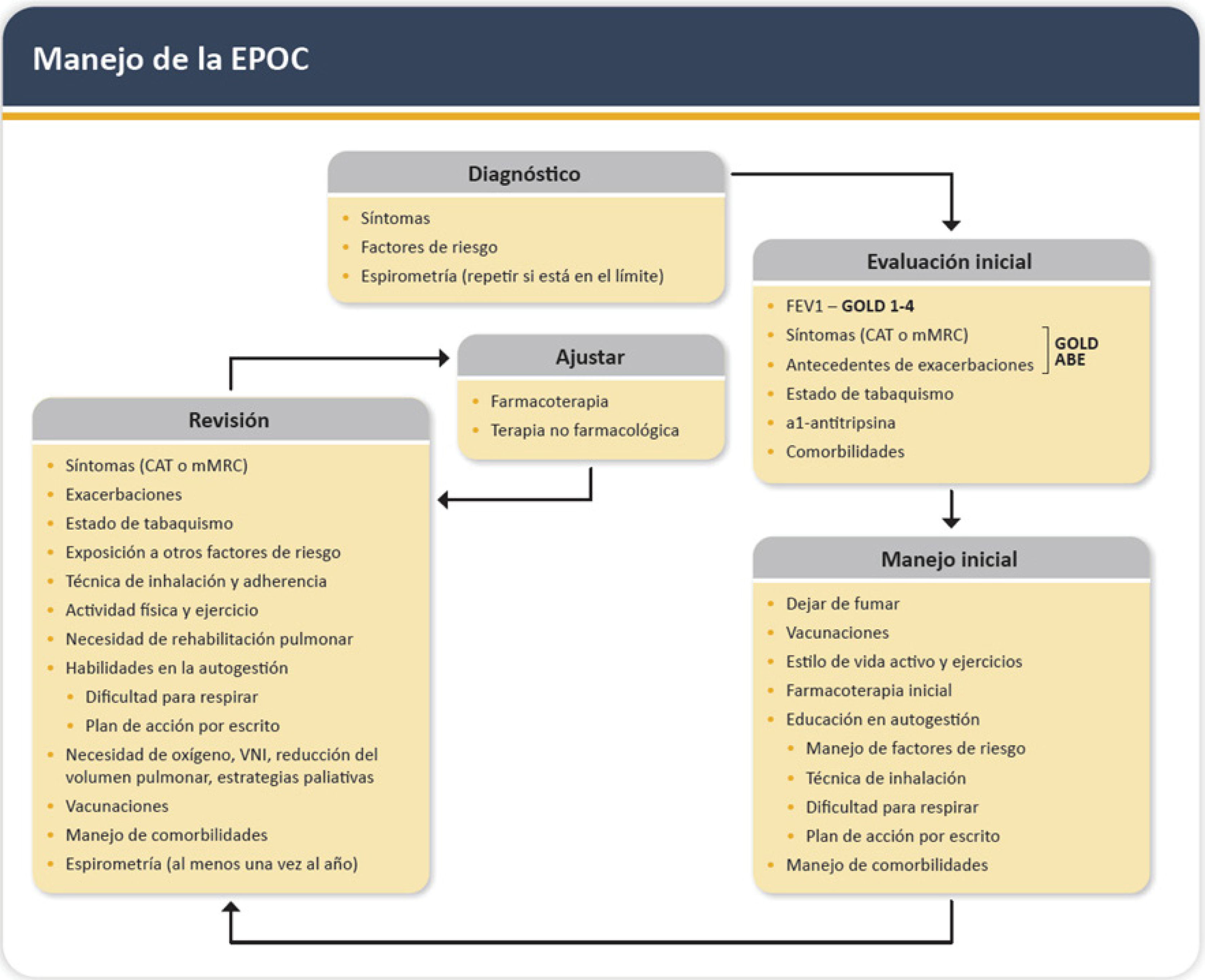
Durante cada oportunidad de atención en salud del paciente EPOC, se debe establecer un proceso de revisión de los antecedentes, técnica inhalatoria, evaluación de función pulmonar y establecimiento de planes en caso de exacerbaciones, lo que se conoce como ciclo de manejo del EPOC (figura 4).
Ciclo de manejo de la EPOC
Adaptado de Global strategy for prevention, diagnosis and management of COPD: 2024 report. Disponible en: https://goldcopd.org/2024-gold-report1. Con permiso de GOLD COPD.
*El tratamiento con un solo inhalador puede ser más conveniente y efectivo que con varios inhaladores. Eos: eosinófilos; LAMA: antagonistas muscarínicos de larga duración (por sus siglas en inglés); LABA: agonistas β2 de larga duración (por sus siglas en inglés); GCI: corticoides inhalados.
La cesación del tabaquismo es la medida única de mayor impacto en la evolución natural de la EPOC, por lo que se debe ofrecer asesoramiento a todos los fumadores actuales. Actualmente existen terapias multidisciplinarias (apoyo con psicofármacos, reemplazo de nicotina, grupos de ayuda, entre otros) que favorecen el éxito en la cesación tabáquica.
La terapia con oxígeno a largo plazo ha mostrado beneficios en pacientes con hipoxemia en reposo repetida (O2 ≤55mmHg o SpO2 ≤88%) post 1 mes de terapia óptima, o PaO2 56-60mmHg con policitemia concomitante o cor pulmonale17.
Se debe incentivar la realización de actividad física a todos los pacientes con EPOC, independiente de la severidad de su enfermedad, y motivarlos a ingresar a un programa de rehabilitación pulmonar estructurado a pacientes en grupos GOLD B y E18.
Se debe asegurar la inmunización adecuada basada en las recomendaciones de cada país, especialmente COVID-19, neumococo, influenza, tos ferina, virus respiratorio sincicial y herpes zoster19.
La ventilación mecánica no invasiva (VNI) está indicada para pacientes con hipercapnia diurna crónica PaCO2 =50mmHg y hospitalizaciones por acidosis respiratoria, evidenciando beneficios en tiempo a nueva hospitalización (RR 0,49 CI 95%, [0,31-0,77]; p=0,002) y del riesgo de muerte (ARR 17,0% CI 95%, 0,1-34,0%)20; si bien este beneficio no se logró demostrar en un reciente metaanálisis21. Por otra parte, la asociación entre EPOC y el síndrome de apnea/hipopnea del sueño (SAHOS), se estima entre el 11% y 29%, y en este grupo se ha demostrado el beneficio del uso de VNI en la mejoría de la sobrevida y disminución de exacerbaciones22.
La estrategia de reducción del volumen pulmonar se debe evaluar en aquellos pacientes con volumen residual >175% del teórico después de terapia óptima, y se fundamenta principalmente en los hallazgos del estudio LIBERATE23 que evidenció mejoría en la calidad de vida, pruebas de función pulmonar y capacidad de ejercicio. Actualmente, se prefiere la reducción pulmonar mediante técnicas de broncoscopía intervencional.
El trasplante pulmonar debe considerarse en pacientes seleccionados, con EPOC en etapa terminal y expectativa de vida limitada, según las guías de cada país. Habitualmente se debe considerar haber agotado las opciones de tratamiento conservador, cesación tabáquica por >12 meses, potencial físico y psicológico para la rehabilitación y descartar enfermedades malignas activas y otras disfunciones severas de órganos.
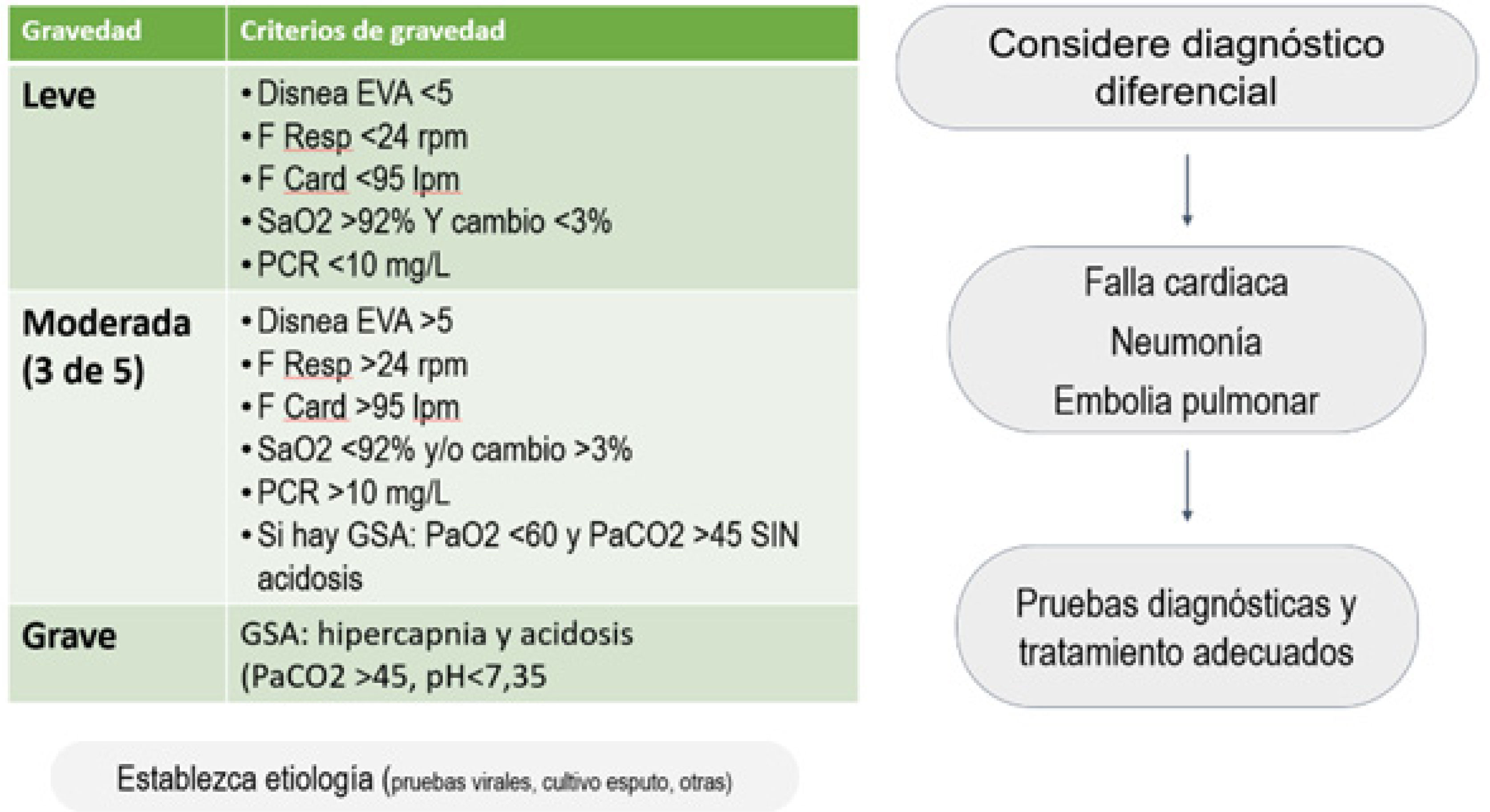
Manejo de la exacerbaciónLas exacerbaciones en la EPOC se definen como un evento caracterizado por disnea y/o tos y esputo que empeora en <14 días, y que puede ser acompañada de taquipnea y/o taquicardia y que a menudo se asocia con aumento de la inflamación local y sistémica causada por infección, polución u otros insultos a la vía aérea1. Han existido varias clasificaciones, siendo aún la más usada para los estudios clínicos la que se realiza posterior al evento en relación con los requerimientos de cuidados, considerándose leve si sólo requirió uso de inhaladores de acción corta como rescate; moderada si requirió además uso de corticoides sistémicos±antibióticos; y severa si requirió acudir a servicio de urgencias o hospitalizarse. Existen nuevos intentos por clasificación de las exacerbaciones, con el objetivo de lograr una estratificación de gravedad más contemporánea24, (figura 5) aunque estas aún no son completamente aceptadas. Más importante aún, menos del 2% de los pacientes con EPOC conocen el concepto de exacerbación25, lo que conlleva a que <50% sean reportadas26.
Clasificación de la gravedad de las exacerbaciones en EPOC
Propuesta de ROMA. Adaptado de: Celli BR et al., 21.
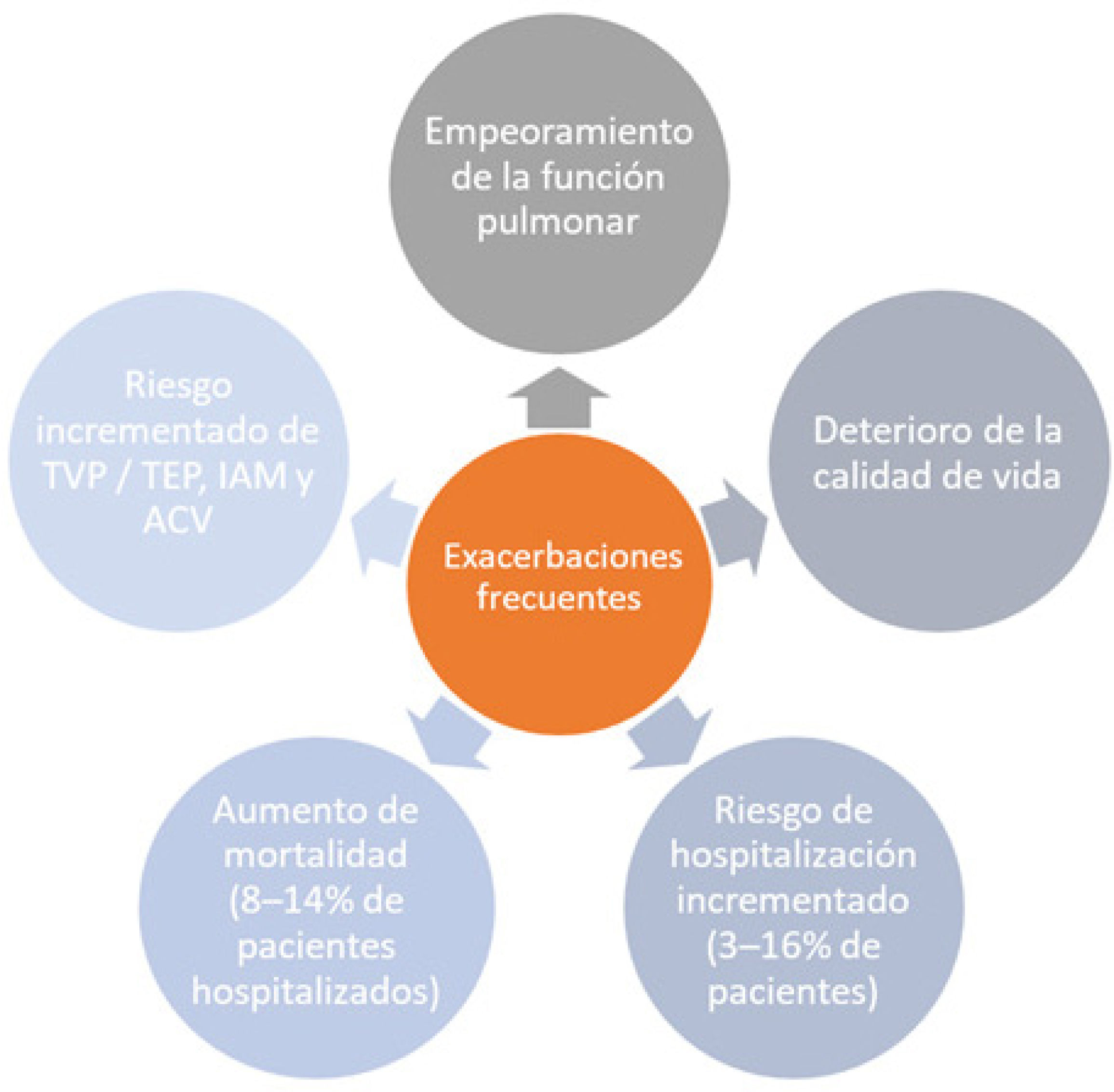
Es importante considerar que las exacerbaciones son un evento clave y devastador en la historia natural de la EPOC, en donde >50% de todos los pacientes ha presentado exacerbaciones en los últimos 3 años27, y estas conllevan deterioros en función pulmonar28, calidad de vida29 y aumento de morbimortalidad30–32 (figura 6). Incluso una sola exacerbación moderada ya se asocia a un aumento significativo en la mortalidad33,34, y una exacerbación grave se asocia a un 20% de reingreso hospitalario a 30 días, mortalidad intrahospitalaria del 5% y a 90 días del 11,3%35.
La etiología de las exacerbaciones graves en su mayoría corresponde a causas infecciosas, en un reciente estudio de MacLeod et al.36 el 29,7% fue de causa bacteriana, 23,3% virales (más frecuentemente detectados: rhinovirus, influenza, coronavirus y virus respiratorio sincicial), y en un 25% fueron coinfecciones viral/bacterianas. Las infecciones virales y bacterianas pueden interactuar e incrementar la severidad de las exacerbaciones.
El manejo agudo de las exacerbaciones consta de 5 pilares:- •
Broncodilatadores: agonistas β2 de corta acción inhalados (SABA), con o sin anticolinérgicos de corta acción (SAMA), administrado usando un inhalador de dosis medida o un nebulizador.
- •
Glucocorticoides: mejoran la función pulmonar, la oxigenación y riesgo de recaída temprana, reduciendo la falla al tratamiento y la prolongación de la hospitalización. Se recomienda 0,5mg/k de prednisona o equivalente al día por 5 días. Cursos más prolongados aumentan riesgo de neumonía y mortalidad. Prednisolona oral es equivalentemente efectiva a la administración intravenosa.
- •
Antibióticos: Se deben administrar a pacientes con un volumen de esputo aumentado y purulento. La duración recomendada de la terapia antibiótica es de 5-7 días. Seleccionar el antibiótico basado en los patrones de resistencia bacteriana y guías locales.
- •
Oxígeno: el oxígeno suplementario para la hipoxemia debe ajustarse a una saturación objetivo del 88-92%, y así evitar posible hipercapnia.
- •
Ventilación no invasiva: Indicado en pacientes con acidosis respiratoria (pH 7,2 a 7,35), mejora el intercambio de gases, disminuye la frecuencia respiratoria, el trabajo respiratorio, la gravedad de la disnea, la tasa de intubación (65%), estadía hospitalaria (3,39 días) y la mortalidad (46%)37. En los últimos años, el uso de la cánula nasal de alto flujo (CNAF) ha ido ganando su espacio en el manejo de la exacerbación de la EPOC. Xu et al.38 realizaron un metaanálisis y revisión sistemática donde comparó el uso de CNAF vs VNI en pacientes con exacerbación de EPOC hipercápnica, evidenciándose menor riesgo de lesiones faciales (OR 0,11 IC95% 0,03; 0,41), mayor reducción de la PaCO2 (OR -2,64 IC95% [-3,12;-2,15]) y menor estadía hospitalaria (OR -1,19 IC95% [-2,33; -0,05]), sin encontrar diferencias en niveles de PaO2, incidencia de intubación y mortalidad.
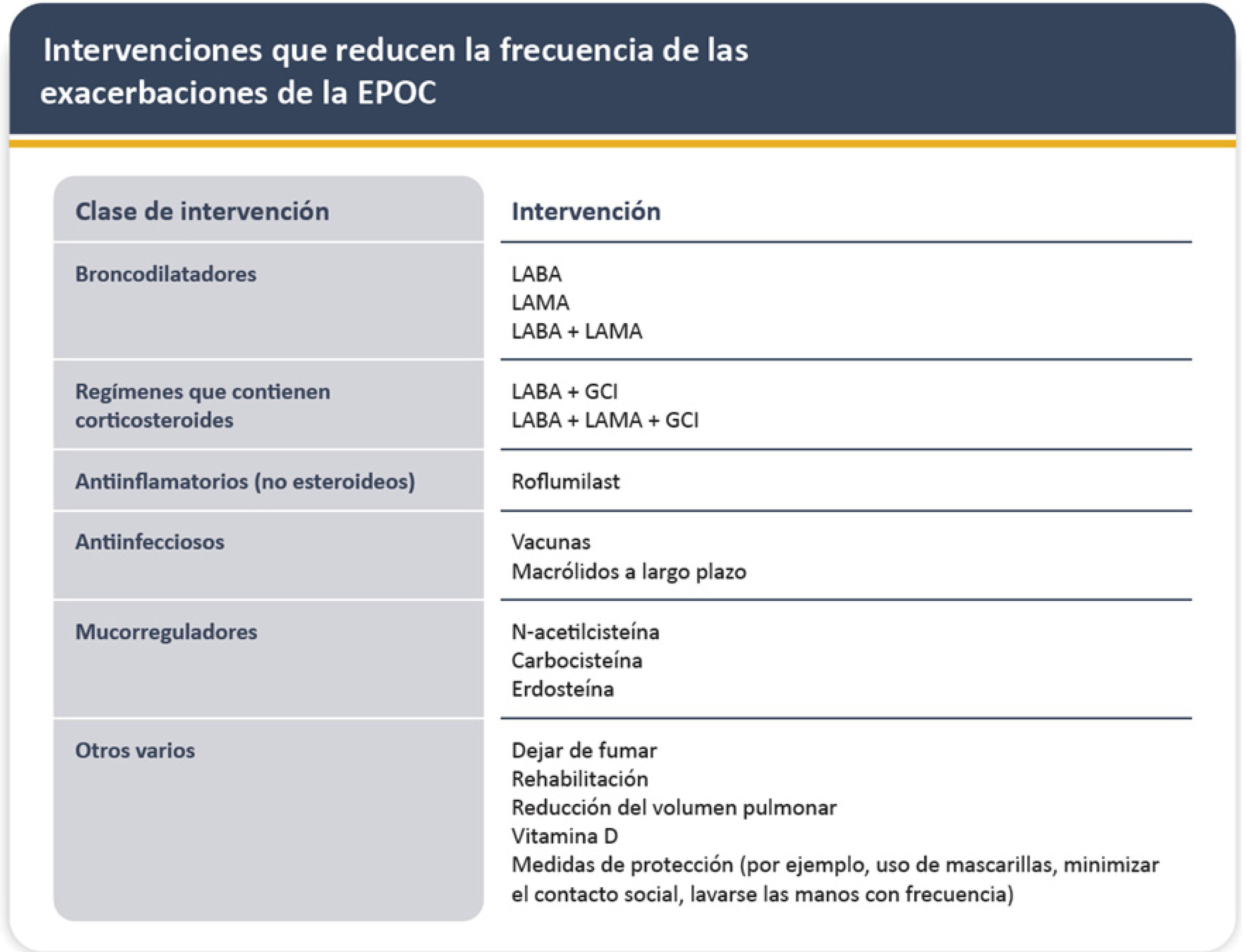
Existen varias intervenciones que han demostrado disminuir el riesgo de exacerbaciones (figura 7). Se debe realizar especial énfasis en el concepto de “optimización precoz” del manejo post exacerbación. Mannino et al.39 demostraron que en los pacientes con exacerbación moderada o grave cuya terapia es optimizada en forma precoz (dentro de los primeros 30 días vs entre días 31 a 180 post exacerbación), con escalamiento a terapia triple (LAMA/LABA/ICS), se logró una reducción del 43% de las exacerbaciones graves y 21% de las moderadas/graves.
Uso de corticoides inhalados
Adaptado de Global strategy for prevention, diagnosis and management of COPD: 2024 report. Disponible en: https://goldcopd.org/2024-gold-report1. Con permiso de GOLD COPD.
Sobre el 90% de los pacientes con EPOC presentan al menos una comorbilidad40 y casi la mitad 3 o más, por lo que es importante realizar una evaluación integral de la enfermedad, dado que más de la mitad de las causas de muertes no serán relacionadas a la EPOC41, siendo las principales causas las cardiovasculares y neoplasias. Las comorbilidades pueden diferenciarse en pulmonares o extrapulmonares.
PulmonaresEl asma es una de las principales comorbilidades de los pacientes con EPOC, llegando en algunos estudios a estimarse hasta en 27%42, y si bien actualmente el síndrome de sobreposición de asma y EPOC es menos aceptado, la tendencia es considerar que corresponden a pacientes con asma que fueron expuestos a factores de riesgo (ej. tabaco) y desarrollaron EPOC, o pacientes con asma subtratada que evolucionaron a remodelación de la vía aérea, presentando una obstrucción fija al flujo aéreo espiratorio. Es importante considerar este grupo, dado que es un grupo con inflamación T2, y que potencialmente puede responder a dosis más altas de ICS o terapias biológicas.
El cáncer pulmonar es una causa frecuente de muerte en los pacientes con EPOC, dado que el factor de riesgo del tabaco es compartido, presentando una prevalencia que aumenta con el grado de enfermedad y edad43. Los programas de EPOC deben contar con cribado anual en poblaciones de alto riesgo, que pueden estratificarse con score PLCOm2012 model44 que en recientes estudios ha demostrado ser más eficiente que los criterios USPSTF201345.
Las bronquiectasias se encuentran entre el 4% y 72%46 de los pacientes con EPOC, y se han asociado a mayor riesgo de exacerbación, portación bacteriana (ej. pseudomonas), inflamación local y sistémica, deterioro de la función pulmonar, deterioro de la calidad de vida y mortalidad. El manejo adecuado de las bronquiectasias debe basarse en el estudio de su causa (ej. infección crónica, déficit de inmunoglobulina, fibrosis quística en el adulto), y erradicación precoz de la colonización bacteriana de estas, junto con terapias que ayuden a la eliminación efectiva de las mucosidades (ej. mucolíticos, inhibidores de la fosfodiesterasa 4 (PDE4), antibióticos).
Extra pulmonaresLas enfermedades cardiovasculares son unas de las mayores causas de mortalidad en pacientes con EPOC, dado que comparten factores de riesgo común (ej. tabaquismo, sedentarismo, edad avanzada). La hipertensión se ha reportado en más del 50% de los pacientes con EPOC; la cardiopatía coronaria aumenta en forma significativa, sobre todo posterior a una exacerbación aguda47; la insuficiencia cardíaca en donde la hiperinflación pulmonar genera mayor stress sobre las paredes de los ventrículos y disminuye el retorno venoso; las arritmias como la fibrilación auricular que se ve favorecida por uso de β2 agonistas; la hipertensión pulmonar si bien es rara en etapas leves o moderadas, en pacientes con enfermedad avanzada puede llegar a ser de grado moderado o severo hasta en el 50% de los que se someten a trasplante pulmonar o cirugía de reducción de volumen pulmonar48.
Las enfermedades metabólicas como la diabetes, síndrome metabólico y la dislipidemia son habituales49. La diabetes (15-17%) afecta el pronóstico de la EPOC, y se debe manejar según guías de la patología. Hasta 30% de los pacientes con EPOC presenta síndrome metabólico50, con el aumento de riesgo cardiovascular. La dislipidemia si bien es frecuente de encontrar asociada a la EPOC no afecta su evolución, y su tratamiento debe estar dirigido según guías de reducción de riesgo cardiovascular.
Las patologías psiquiátricas son comunes en pacientes con EPOC, destacando la depresión y el trastorno ansioso, estimándose una prevalencia entre 20% a 25%51. Se debe tener en consideración los factores asociados a la interacción farmacológica tanto de terapias de la EPOC (ej. teofilina o roflumilast), como de antidepresivos (ej. antidepresivos tricíclicos aumentan riesgos cardiovasculares de broncodilatadores β2 agonistas y antimuscarínicos).
Si bien no se puede considerar una comorbilidad, no se debe desconocer el impacto social que genera un paciente con EPOC, en donde 2/3 requieren de cuidadores y prácticamente el 90% son cuidadores informales (ej. familiares o amigos)52. Esto conlleva a un deterioro de la calidad de vida del cuidador informal, sometiéndolo a riesgo de “burn-out”, con el consiguiente deterioro en el cuidado del paciente EPOC.
ConclusionesLa EPOC se mantiene como una de las principales causas de morbimortalidad a nivel mundial, con un impacto creciente debido a factores como el tabaquismo y el envejecimiento poblacional. A pesar de los avances significativos en el entendimiento de su patogenia, diagnóstico y manejo, la EPOC sigue presentando desafíos importantes en su tratamiento. La actualización de la definición de EPOC por GOLD COPD en 2023 refleja la complejidad y heterogeneidad de esta condición, destacando la importancia de un enfoque individualizado y multidisciplinario en el manejo de los pacientes.
El diagnóstico temprano y preciso de la EPOC, utilizando herramientas como la espirometría y considerando el historial de exposición a factores de riesgo, es fundamental para un manejo efectivo. El tratamiento de la EPOC ha evolucionado hacia una combinación de terapias farmacológicas y no farmacológicas, incluyendo la cesación del tabaquismo, la rehabilitación pulmonar, y la inmunización contra patógenos respiratorios, lo cual ha demostrado mejorar la calidad de vida de los pacientes y reducir el riesgo de exacerbaciones.
La evaluación de comorbilidades asociadas, el manejo de las exacerbaciones y el enfoque en las intervenciones preventivas siguen siendo áreas que requieren atención continua y enfoques innovadores. La identificación de subgrupos de pacientes con características específicas, que se puedan considerar rasgos tratables, podría permitir terapias más dirigidas y personalizadas, mejorando así los resultados clínicos.
El manejo futuro de la EPOC se beneficiará de un enfoque holístico que no solo aborde los síntomas respiratorios y la función pulmonar, sino también las comorbilidades y el bienestar general del paciente. La colaboración multidisciplinaria, la investigación continua y la adaptación de las guías de tratamiento a las evidencias más recientes son esenciales para avanzar en el cuidado de los pacientes con EPOC y reducir su carga global.
Conflicto de interésGSK: financiamiento congresos, speaker y consejero médico. Boehringer Ingelheim: financiamiento congresos y estudios clínicos.
Grifols: financiamiento congresos. Octapharma/Bagó: speaker y financiamiento congresos.