La administración de fármacos mediante inhalación se ha consolidado como la principal vía de administración para tratar enfermedades pulmonares obstructivas. En este contexto, el depósito eficiente de las partículas de medicamento en la vía aérea desempeña un papel fundamental en la eficacia del tratamiento inhalado, ofreciendo beneficios superiores en términos de rapidez y reducción de efectos sistémicos en comparación con otras vías de administración.
Es crucial asegurar que una cantidad suficiente de medicamento alcance más allá de la zona orofaríngea para garantizar la efectividad terapéutica. Dentro de los dispositivos disponibles para esta forma de administración, los inhaladores de dosis medida presurizados (pMDI) y los inhaladores de polvo seco (DPI) son los más utilizados. Cabe mencionar que, en esta revisión, no se abordan los dispositivos de nebulización.
Aunque la diversidad de opciones terapéuticas es beneficiosa, la disponibilidad de distintos dispositivos puede generar cierta complejidad al momento de instruir a los pacientes sobre su correcta utilización. Por consiguiente, resulta vital que los pacientes sigan de forma precisa la técnica de inhalación recomendada. Los errores en el manejo del dispositivo pueden llevar a una distribución inadecuada del fármaco, lo que reducirá la dosis efectiva y comprometerá la eficacia del tratamiento. En esta revisión se presentan explicaciones detalladas del mecanismo de acción de estos dispositivos, así como instrucciones prácticas para el personal encargado del cuidado del paciente. Se enfatiza la importancia de una correcta técnica de inhalación para maximizar la eficacia del tratamiento y garantizar un uso óptimo del fármaco.
The administration of drugs via inhalation has become the primary route for treating obstructive pulmonary diseases. In this context, the efficient deposition of medication particles in the airway plays a fundamental role in the effectiveness of inhaled therapy, offering superior benefits in terms of speed and reduction of systemic effects compared to other routes of administration. It is crucial to ensure that a sufficient amount of medication reaches beyond the oropharyngeal region to guarantee therapeutic effectiveness. Among the available devices for this form of administration, pressurized metered-dose inhalers (pMDIs) and dry powder inhalers (DPIs) are the most commonly used. It is worth mentioning that nebulization devices are not covered in this review.
Although the diversity of therapeutic options is beneficial, the availability of different devices can create some complexity when instructing patients on their proper use. Consequently, it is vital for patients to precisely follow the recommended inhalation technique. Errors in device handling can lead to improper drug distribution, reducing the effective dose and compromising treatment efficacy. This review provides detailed explanations of the mechanism of action of these devices, as well as practical instructions for patient care personnel. Emphasis is placed on the importance of correct inhalation technique to maximize treatment efficacy and ensure optimal drug use.
La terapia inhalatoria es un método fundamental en el tratamiento médico, que consiste en la administración directa de medicamentos a los pulmones mediante la inhalación. Este enfoque terapéutico es ampliamente utilizado para tratar diversas condiciones respiratorias, como el asma, la enfermedad pulmonar obstructiva crónica (EPOC), fibrosis quística, entre otras1,2.
Los medicamentos administrados mediante terapia inhalatoria incluyen broncodilatadores, corticosteroides, anticolinérgicos y otros agentes destinados a aliviar síntomas respiratorios, reducir la inflamación bronquial y mejorar la función pulmonar. La inhalación permite que estos medicamentos actúen de manera más eficaz y rápida en comparación con la administración oral.
Existen diferentes dispositivos para la terapia inhalatoria, como inhaladores de dosis medida (MDI, por sus siglas en inglés), nebulizadores y dispositivos de polvo seco3. La correcta técnica de inhalación es crucial para asegurar que la dosis adecuada del medicamento alcance los pulmones4. Esta forma de administración juega un papel fundamental en el manejo de enfermedades respiratorias, contribuyendo significativamente a mejorar la calidad de vida de los pacientes.
La vía inhalatoriaLa terapia inhalatoria ofrece ventajas significativas en comparación con otras formas de administración. La administración directa al pulmón permite lograr concentraciones terapéuticas elevadas con dosis inhaladas mucho menores que las sistémicas, lo que mejora la función pulmonar y reduce los efectos secundarios en todo el organismo5. Además, la rápida velocidad de acción en el pulmón, que puede manifestarse en cuestión de minutos en algunos casos, constituye una ventaja crucial de la administración inhalada6.
A menudo se asume que la efectividad de un fármaco depende de su concentración en el lugar de acción. No obstante, es importante tener en cuenta que el pulmón no es uniforme, sino más bien complejo, con una vía de acceso ramificada y diversas estructuras morfológicas especializadas que incluyen las vías respiratorias conductivas, bronquiolos y alvéolos7. Esta complejidad pulmonar da lugar a procesos farmacocinéticos específicos en la administración inhalatoria8. En este sentido, las características del fármaco inhalado, como su naturaleza fisicoquímica, formulación y dispositivo de administración; que a su vez se ven influenciados por aspectos del paciente, como su habilidad técnica en la inhalación, tendrán un impacto directo en la eficacia de la terapia9.
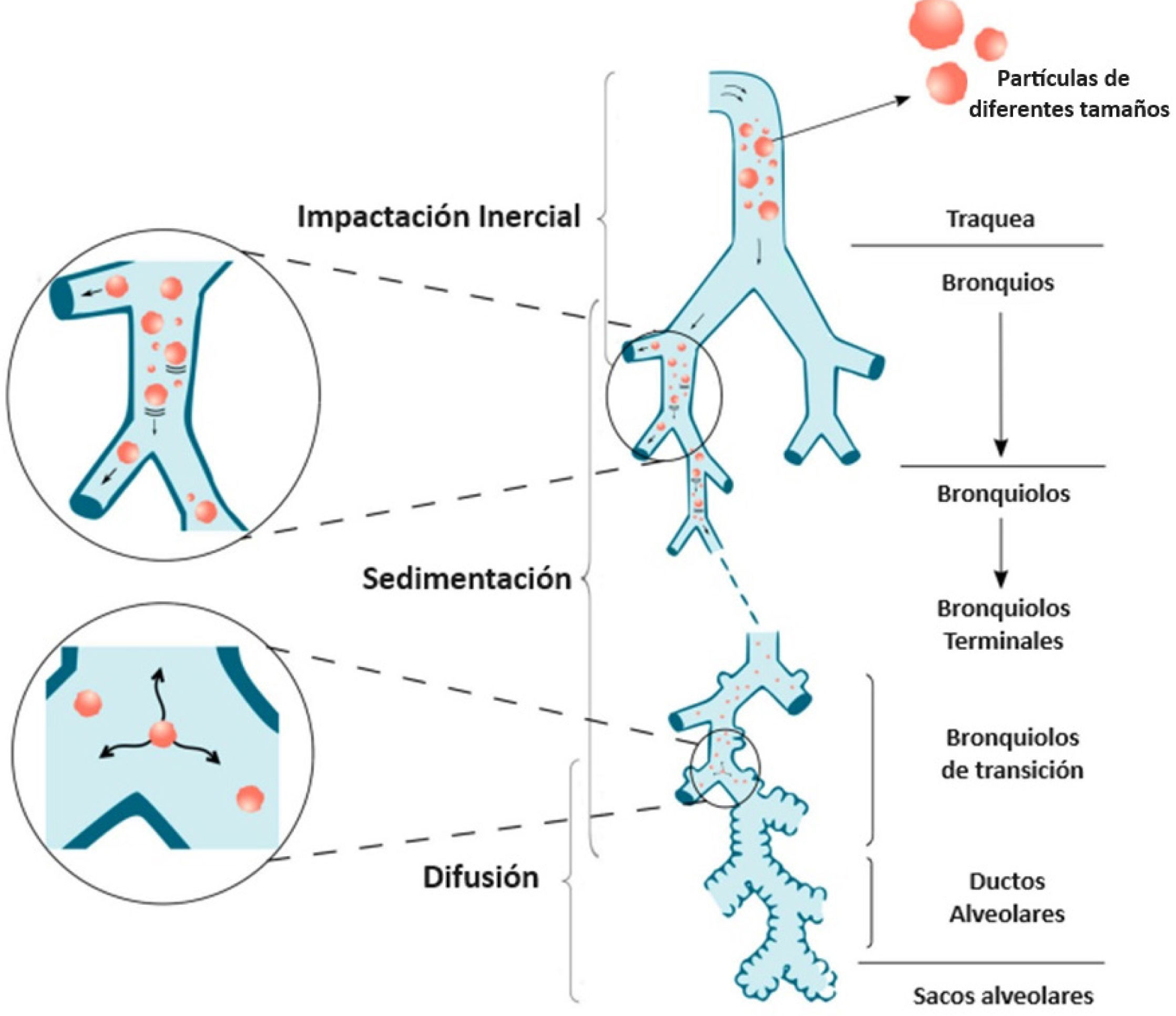
Principios básicos del depósito de partículas en el tracto respiratorioEn el contexto de la correcta utilización de la terapia inhalada, un aspecto crítico radica en el depósito de partículas del medicamento. Durante la inhalación, una porción de la dosis se deposita en el dispositivo mismo, mientras que el resto se dispersa en la orofaringe, las vías respiratorias y/o los pulmones. La cantidad total de medicamento que llega a los pulmones se conoce como “dosis pulmonar”, y los patrones de depósito se dividen en centrales (en las vías respiratorias más grandes) y periféricos (en las vías más pequeñas y en el espacio alveolar). Estos patrones están influenciados por factores como el tamaño de las partículas, la velocidad de inhalación, las características del dispositivo y aspectos relacionados con la enfermedad del paciente10,11. Los dispositivos de inhalación generan aerosoles con partículas de distintos tamaños, clasificados por su diámetro de masa media aerodinámica (DMMA, por sus siglas en inglés). Un tamaño óptimo para que las partículas se depositen en los alvéolos y las pequeñas vías respiratorias es de 0,5-5μm de DMMA. Una vez que las partículas son inhaladas correctamente, la efectiva deposición del fármaco se convierte en un paso fundamental, implicando diversos mecanismos, entre los cuales destacan la impactación inercial, la sedimentación y la difusión (véase tabla 1 y figura 1)12.
Mecanismo de deposición en los pulmones de acuerdo al tamaño de las partículas
| Tamaño de la partícula | Mecanismo | Lugar de depósito |
|---|---|---|
| Mayor a 5μm | Impactación inercial | Orofaringe y vía aérea conductiva |
| 0,5-5μm | Sedimentación | Bronquios, bronquiolos y alvéolos |
| 0,5-3μm | Sedimentación y difusión | |
| Menor a 0,5μm | Difusión y movimiento browniano | Región alveolar- exhalación |
Adaptado de Magramane et al (2023)12.
Mecanismo de deposición en los pulmones de acuerdo con el tamaño de las partículas
Adaptado de Magramane et al (2023)12.
Impactación inercial: destaca como el principal mecanismo de depósito en la orofaringe y las vías respiratorias conductivas. Las partículas con un diámetro superior a 5μm, al ser consideradas de gran tamaño, experimentan inercia y resisten los cambios bruscos en dirección y velocidad. Este fenómeno desvía a estas partículas de su trayectoria inicial en el flujo de aire, llevándolas a impactar finalmente contra las paredes de las vías respiratorias superiores13,14, constituyendo uno de los principales mecanismos de pérdida de fármaco15.
Sedimentación: este mecanismo afecta a partículas con tamaños entre 0,5 y 5μm. A medida que estas partículas se desplazan más profundamente en los pulmones, especialmente en los bronquios, bronquiolos y la región alveolar, su velocidad disminuye, reduciendo así la probabilidad de depósito por impactación. El proceso de sedimentación influye en las partículas que han superado la impactación y han llegado a las generaciones 5a y 6a del pulmón. Con el incremento del tiempo y la reducción de la velocidad del flujo de aire, las partículas comienzan a asentarse debido a la fuerza gravitatoria. Favorecer este mecanismo en los pacientes es crucial para mejorar el depósito pulmonar, lo cual se logra reteniendo la respiración después de la inhalación al usar algún dispositivo de terapia inhalatoria. Las partículas con diámetros de 3-5μm alcanzan la región traqueobronquial por sedimentación, mientras que se espera que las partículas de 0,5-3μm alcancen la región alveolar mediante sedimentación y difusión13–15.
Difusión: el depósito en las vías respiratorias inferiores y en la región alveolar de partículas de tamaño inferior a 0,5μm se rige principalmente por este proceso, el cual está impulsado por el movimiento browniano: la trayectoria impredecible de las partículas debido a sus colisiones con las partículas de gas circundantes. Debido a su tamaño reducido, la mayoría de estas partículas son exhaladas, depositándose solo unas pocas13–15.
En resumen, el depósito de partículas juega un papel fundamental en la eficacia de las formas de dosificación inhaladas. Es crucial lograr que una cantidad suficientemente alta de la dosis de medicamento se deposite más allá de la región orofaríngea para garantizar la efectividad de la administración.
Inhaladores presurizados de dosis medida (pMDI, por sus siglas en inglés)La introducción de los inhaladores presurizados de dosis medida (pMDI) en la década de 1950 marcó un hito en la entrega personalizada y ampliamente accesible de terapias inhaladas para el tratamiento farmacológico de enfermedades obstructivas de las vías respiratorias, como el asma y la enfermedad pulmonar obstructiva crónica (EPOC). A lo largo del tiempo, estos dispositivos han demostrado su valía en términos de beneficio/riesgo y tolerabilidad. A pesar de sus ventajas, los pMDI presentan una debilidad significativa: su tendencia a ser utilizados de manera subóptima o incorrecta16. Este problema ha sido reconocido desde los inicios de estos dispositivos y lamentablemente sigue siendo prevalente en la actualidad. El uso inadecuado de los pMDI puede impactar negativamente en la eficacia, seguridad y adherencia al tratamiento por parte de los pacientes.
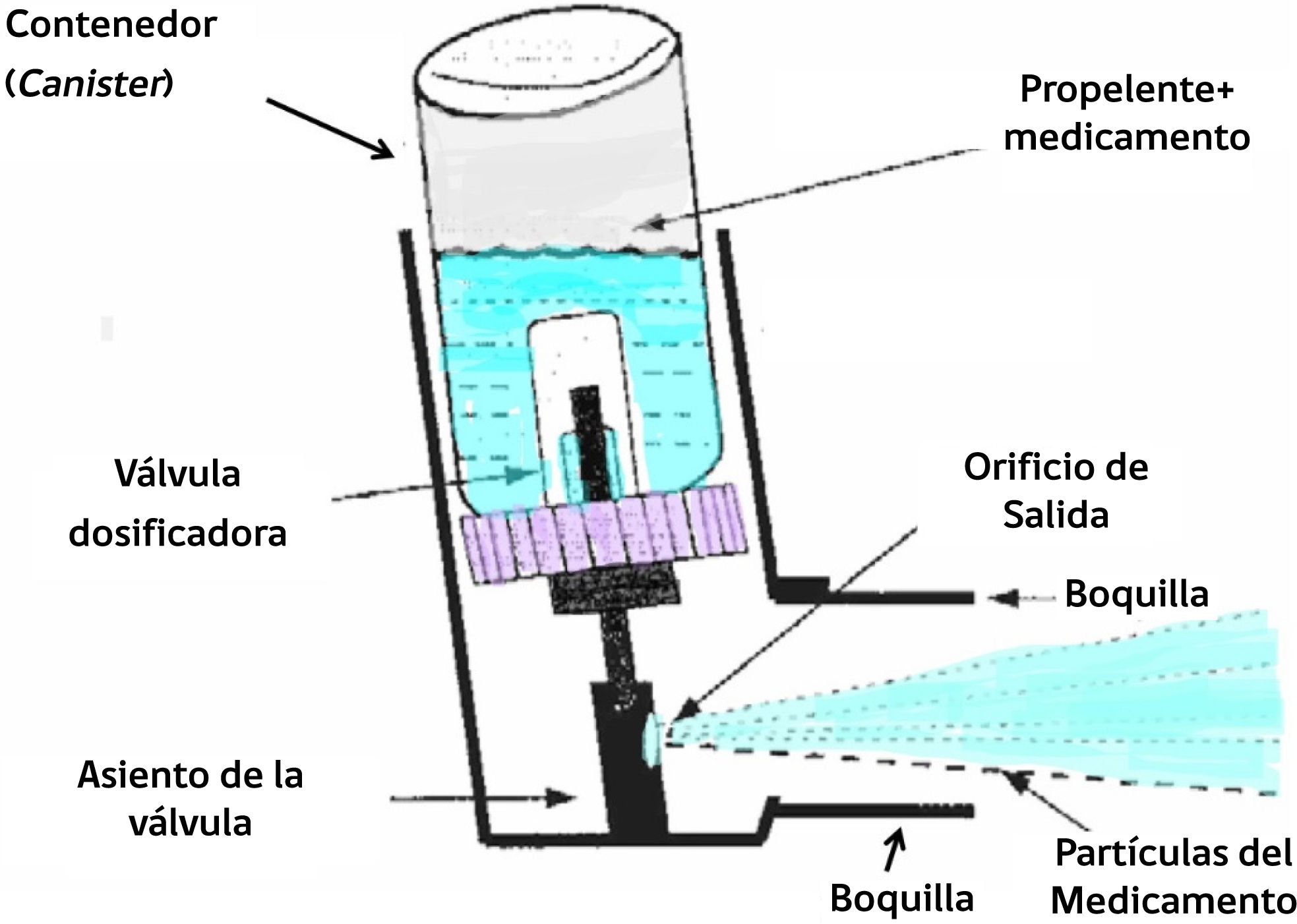
Componentes y formulaciónEl pMDI representado en la figura 2, es un dispositivo portátil y con múltiples dosis que se compone de un envase de aluminio (llamado canister) colocado en un soporte de plástico (actuador). El canister contiene una suspensión o solución presurizada de partículas de medicamento micronizadas dispersas en un propelente y cosolventes. La tecnología de los pMDI experimentó una evolución constante desde mediados de la década de 1950 hasta mediados de la década de 1980. Hasta hace poco, estos dispositivos solían emplear clorofluorocarbonos (CFC) como propelentes para administrar los medicamentos. Sin embargo, siguiendo las directrices del Protocolo de Montreal de 1987, los propelentes CFC están siendo sustituidos por hidrofluoroalcanos (HFA), que poseen un menor potencial de calentamiento global17. En términos de eficacia, el depósito a nivel orofaríngeo es menor con los HFA que con los CFC, debido a que tienen una menor velocidad de salida, factor que incide en la posibilidad de alcanzar las vías aéreas periféricas, produciendo una mejor penetración pulmonar.
Un componente fundamental del pMDI es la válvula dosificadora o de medición, la cual libera en cada activación un volumen preciso y conocido de propelente que contiene el medicamento micronizado. Al presionar el canister, se produce la liberación de la formulación dentro de la cámara dosificadora, generando explosivamente un aerosol heterodisperso de gotas a través de un vástago hacia una boquilla de atomización, conformado por diminutas partículas de medicamento envueltas en una capa de propelente. Este último se evapora rápidamente con el paso del tiempo y la distancia, lo que resulta en una reducción del tamaño de las partículas18.
DepósitoPara maximizar el depósito en las vías respiratorias de un fármaco administrado mediante pMDI, se requiere una inhalación lenta (a 30 l/min), profunda, que comience inmediatamente después de la activación del pMDI, seguida de una pausa en la retención de la respiración de al menos 4 segundos, preferiblemente hasta 10 segundos. Incluso con una técnica óptima y el uso de modernos propelentes de hidrofluoroalcano, los pMDI solo logran entregar aproximadamente el 20% de la dosis emitida a las vías respiratorias inferiores, dejando alrededor del 80% en la orofaringe19. Con una técnica subóptima o incorrecta, esta fracción puede reducirse aún más, incluso a cero.
Ventajas y desventajasLos inhaladores presurizados de dosis medida (pMDI) presentan varias ventajas: son compactos, portátiles, relativamente económicos y contienen al menos 200 dosis medidas por envase listas para su uso inmediato. Además, aproximadamente el 40% de las partículas de aerosol generadas se encuentra dentro del rango respirable (con un diámetro aerodinámico inferior a 5μm), y la dosificación suele ser altamente reproducible de una dosis a otra20–22. A pesar de estas ventajas, la mayoría de los pacientes tienen dificultades para utilizar correctamente los pMDI, incluso después de recibir instrucciones repetidas23,24. Esto se debe a que se requiere una buena coordinación entre la inspiración del paciente y la activación del inhalador para garantizar una inhalación y un depósito adecuada del medicamento en los pulmones. La técnica correcta de inhalación con pMDI implica activarlo mientras se realiza una inhalación profunda y lenta, continuar inhalando después de la activación y luego hacer una pausa en la respiración para permitir el depósito de las partículas en las vías respiratorias24. Además, es importante que los pacientes agiten el pMDI antes de usarlo para asegurar una correcta mezcla de la formulación25. Otra desventaja de algunos pMDI es la falta de contadores integrados para alertar al paciente cuando el inhalador se está agotando. Aunque muchos pMDI contienen más dosis de las indicadas, la entrega de medicamento por cada activación puede volverse muy inconsistente e impredecible después de alcanzar el número indicado de activaciones. Más allá de este punto, los propelentes podrían liberar una nube de aerosol que contiene poco o ningún medicamento, lo que se conoce como “tail-off”25.
Uso de espaciador o aerocámara valvuladaLa técnica de usar un espaciador (un reservorio adicional ubicado entre la boquilla del pMDI y la boca del paciente) o una aerocámara valvulada (VHC) (un reservorio con una válvula unidireccional que permite el flujo de aire hacia adentro, pero no hacia afuera, de la boca del paciente) antes de la inhalación fue desarrollada en la década de 195026,27 para abordar ciertos problemas y errores potencialmente críticos al usar un pMDI. Utilizar un espaciador/VHC ralentiza las partículas aerosolizadas emitidas por el pMDI, lo que puede potencialmente mejorar el depósito pulmonar de las partículas finas respirables. De manera significativa, también filtra y reduce el depósito orofaringeo de las partículas más grandes liberadas por un pMDI28. El empleo adecuado de un espaciador/VHC aborda el común y crítico problema de la mala coordinación entre la activación del pMDI y el inicio de la inhalación16. Aunque sigue siendo importante lograr cierta sincronización entre la activación del pMDI y la inhalación, el uso de un espaciador/VHC proporciona a los pacientes un período de tiempo más amplio para lograr esta coordinación de manera efectiva. Además, existen pMDI activados por la respiración para la administración de algunos fármacos inhalados, los cuales también pueden ayudar a corregir la falta de coordinación, aunque no ofrecen todos los beneficios potenciales de un espaciador/VHC. Es importante tener en cuenta que ningún dispositivo espaciador puede eliminar por completo la tendencia de los pacientes a no contener la inhalación o a inhalar de forma demasiado rápida, aunque recientemente se han implementado ciertas soluciones, como avisos de sonido de silbato activados por un flujo por encima de un umbral específico, así como dispositivos que emiten un silbido cuando se usa correctamente29.
Todos los pacientes que utilizan un pMDI para la administración de medicamentos inhalados deberían recibir la recomendación de emplear un espaciador/VHC tanto para los tratamientos regulares como para los de emergencia, especialmente aquellos pacientes que tienen dificultades para coordinar la activación del pMDI con la inhalación29.
-TamañoLos espaciadores de volumen pequeño (hasta 100ml) generalmente son extensiones en forma de tubo de la boquilla del pMDI y no poseen válvulas. A pesar de ser menos voluminosos, estos dispositivos son menos propensos a eliminar la necesidad de una coordinación adicional entre la activación del pMDI y el inicio de la inhalación por parte del paciente. Por otro lado, los espaciadores de volumen mediano (100-350ml) y los de volumen grande (>700ml) típicamente incluyen una válvula unidireccional en el extremo de la boquilla, lo que permite la inhalación desde el espaciador, pero evita la exhalación hacia él. Estos dispositivos, conocidos como VHC, brindan un mayor margen de tiempo para que el paciente inicie la inhalación después de activar el pMDI. Aunque son más voluminosos y menos portátiles, consideraciones teóricas sugieren que un espaciador/VHC óptimo debería tener un volumen de 100-700ml y mantener una distancia de al menos 10cm entre el pMDI y la boca del paciente30.
-VálvulasLos espaciadores sin válvulas, en forma de tubo abierto, simplemente separan el pMDI de la orofaringe del paciente. Por otro lado, los VHC, que integran una válvula unidireccional de baja resistencia detrás de la boquilla, retienen el aerosol dentro del dispositivo hasta que el paciente inhala y previenen que el aliento exhalado regrese al VHC. Esta característica permite que el VHC se utilice tanto con la respiración normal como con una inspiración profunda única. Es importante mencionar que una proporción significativa de niños muy pequeños, menores de 24 meses, puede no generar la suficiente presión inspiratoria (subatmosférica) para abrir la válvula unidireccional en varios VHC disponibles en el mercado. Por lo tanto, se recomienda evaluar esta capacidad antes de recetar estos dispositivos31. Por otro lado, las válvulas pueden obstruirse si se ensucian o dañan, aunque este problema suele detectarse fácil y posiblemente se pueda resolver mediante la limpieza o la sustitución del dispositivo.
Inhaladores de polvo seco (DPI)Los inhaladores de polvo seco (DPI, por sus siglas en inglés) surgieron como una alternativa a los inhaladores de dosis medida presurizada (pMDI) para abordar los desafíos relacionados con la coordinación entre la activación del dispositivo y la inhalación. La técnica recomendada para utilizar los DPI garantiza la generación de una dosis de partículas capaz de depositarse en las vías respiratorias en cada inhalación. Se ha observado que las partículas con un tamaño entre 1 y 5μm tienen la mejor capacidad de depositarse en los pulmones durante la inhalación32, lo que facilita una distribución uniforme en el sistema respiratorio33. Esta parte de la dosis emitida por el inhalador se conoce como la dosis respirable o dosis de partículas finas.
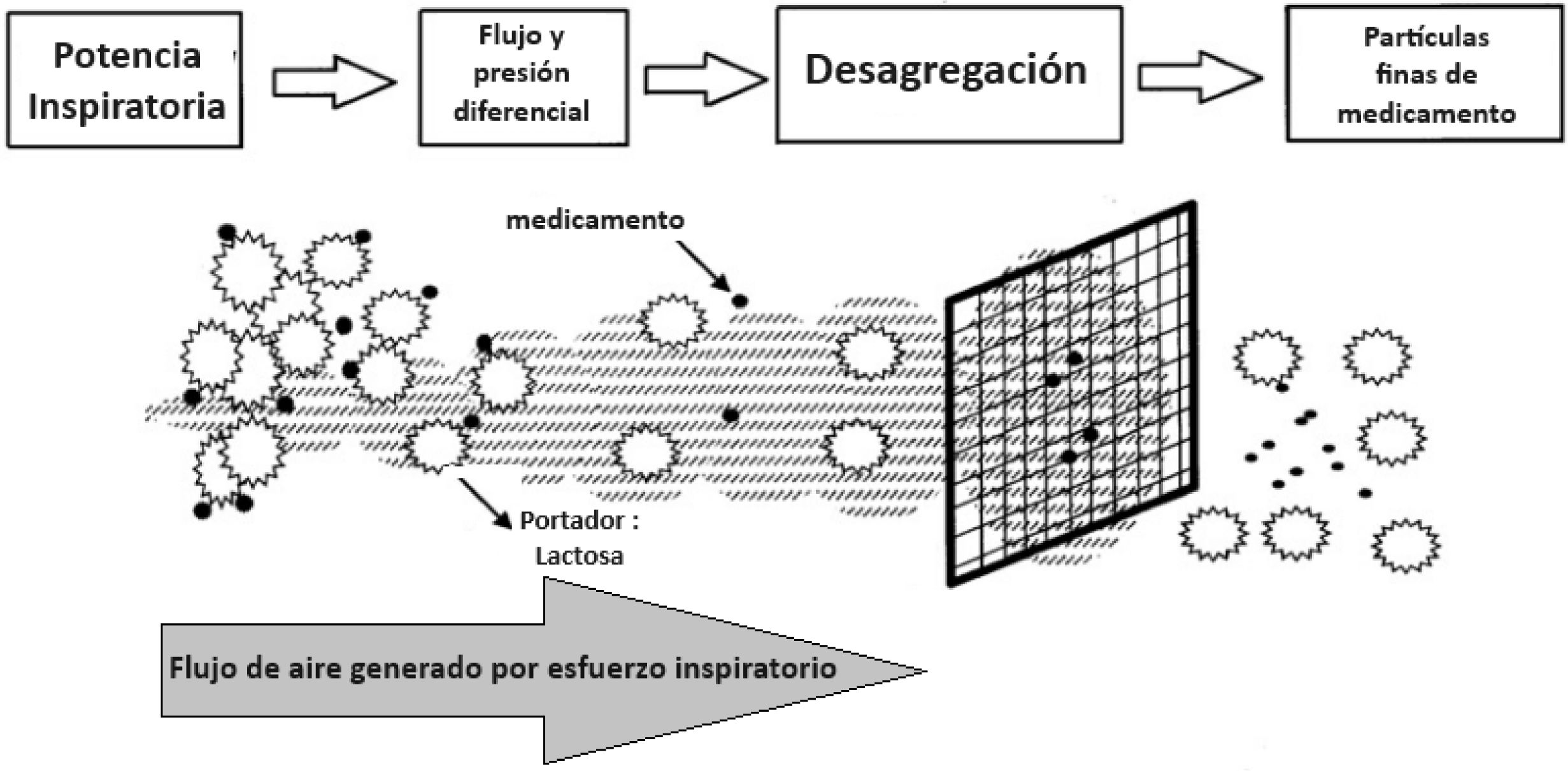
Durante la generación y administración de la dosis, es crucial mantener un flujo constante y suave del polvo. Sin embargo, las partículas más pequeñas de 5 μm carecen de estas propiedades de flujo, lo que requiere ajustes en la formulación. Habitualmente, se mezclan las partículas micronizadas del medicamento con un portador inerte de partículas más grandes, comúnmente lactosa. Estos elementos se combinan, y el fármaco se adhiere al portador. Para liberar la dosis respirable durante la inhalación, es necesario romper esta unión entre el fármaco y la lactosa. Este proceso de separación se logra al generar ‘energía’ dentro del dispositivo durante la inhalación, aprovechando la resistencia en el dispositivo, como se muestra en la figura 3. Este proceso de separación entre el fármaco y su portador se conoce como desaglomeración o desagregación34.
Desagregación o desaglomeración
La potencia inspiratoria, fundamental para desaglomerar y aerosolizar el polvo del medicamento en inhaladores de polvo seco, se puede aumentar generando una mayor presión diferencial al inhalar en dispositivos de mayor resistencia o incrementando el flujo de aire inspirado. La resistencia interna (rejilla) limita la velocidad del flujo de aire, y los pacientes deben inhalar con fuerza para superarla, creando la presión necesaria para desaglomerar el polvo y convertirlo en partículas finas que lleguen a las vías respiratorias periféricas. Modificado de Chrystyn34.
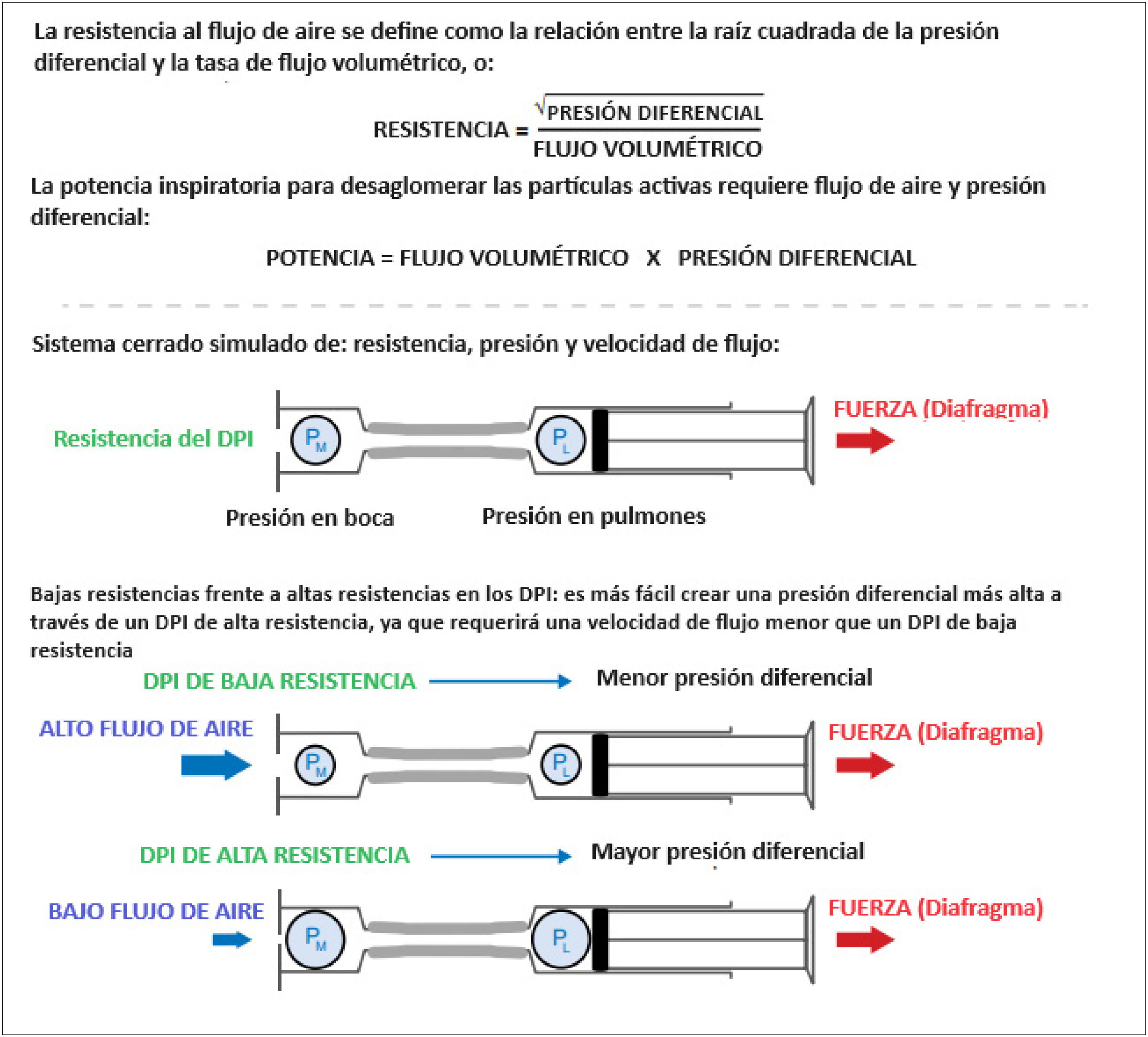
La resistencia en los inhaladores de polvo seco, conocida como resistencia interna, implica la limitación en la velocidad del flujo de aire a través de estos dispositivos. Dado que los DPI se activan por medio de la inhalación, los pacientes deben inhalar con fuerza para vencer esta resistencia del dispositivo. Esto permite crear una presión diferencial interna necesaria para desaglomerar el polvo del medicamento de sus portadores, convirtiéndolo en partículas finas capaces de penetrar en las vías respiratorias periféricas35. Es importante destacar que la resistencia varía entre los diferentes DPI, dependiendo de factores como los componentes de diseño del dispositivo (como cámaras de remolino, rejillas, entre otros) y la formulación específica del medicamento36. La figura 4 ilustra cómo la resistencia en los DPI afecta la presión diferencial y el flujo de aire.
Impacto de la alta y baja resistencia en los inhaladores de polvo seco (DPI) sobre la presión diferencial
Adaptado de Capstick et al. (2024)37.
La potencia inspiratoria, que se refiere a la energía aprovechable para desaglomerar y aerosolizar el polvo del medicamento, se determina al multiplicar el flujo de aire por la presión diferencial, que es la diferencia entre la presión atmosférica y la presión bucal. De este modo, los pacientes pueden aumentar la potencia inspiratoria de desaglomeración al generar una presión diferencial a través del DPI (al inhalar en dispositivos de mayor resistencia) o al incrementar el flujo de aire inspirado37.
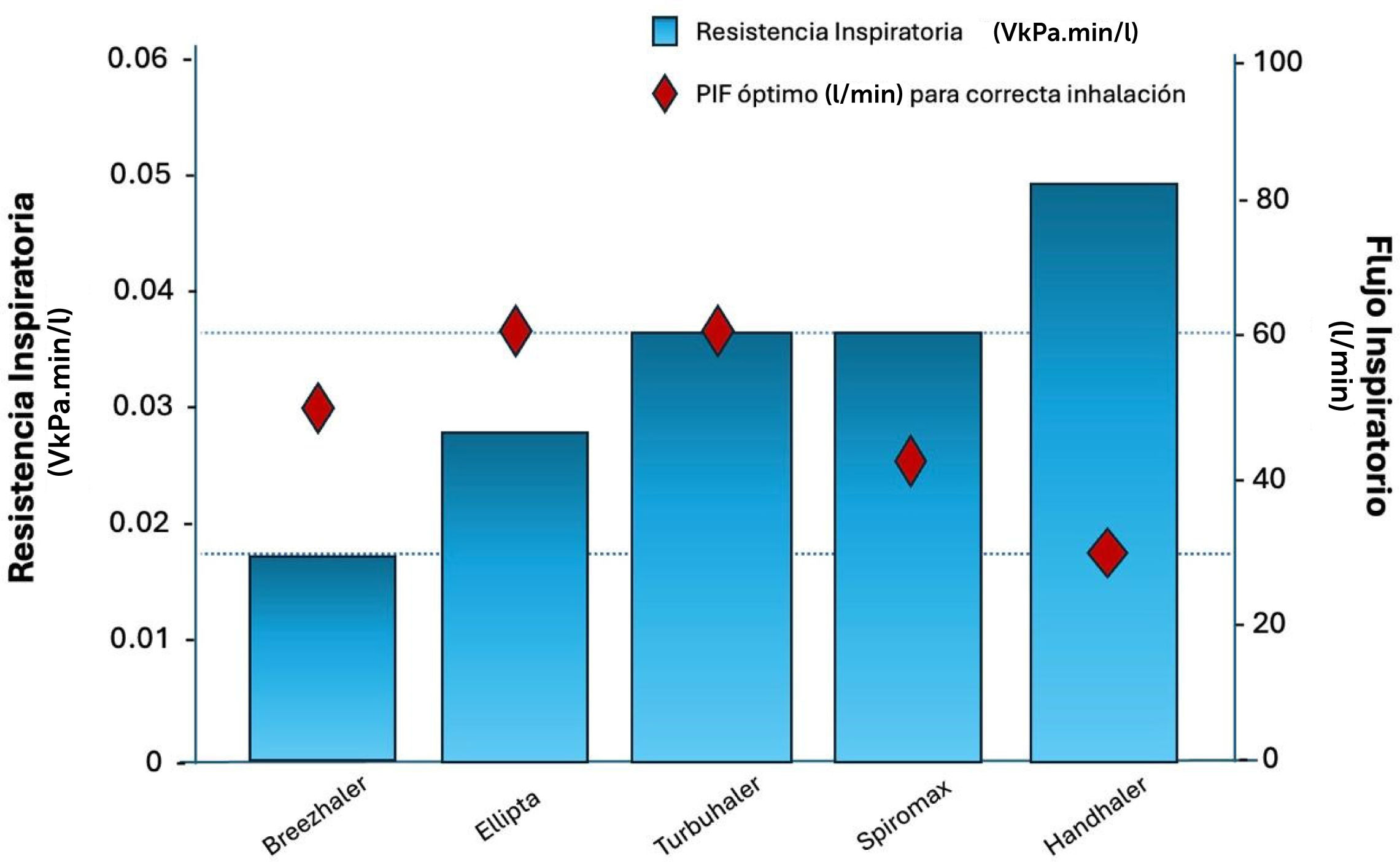
A menudo, el término “alta resistencia” puede resultar confuso. Contrariamente a la intuición, una resistencia alta no es necesariamente una desventaja para los pacientes. Los DPI con resistencia media o alta requieren menos esfuerzo inspiratorio para transportar las moléculas del medicamento a los pulmones36. Dado que la presión necesaria para desaglomerar las moléculas activas en partículas finas está directamente asociada con la resistencia interna del dispositivo inhalador y la velocidad del flujo de aire inspiratorio, los dispositivos de baja resistencia, aunque pueden parecer más fáciles de inhalar, en realidad requieren una mayor velocidad de flujo de aire y esfuerzo inspiratorio, algo que puede resultar difícil para pacientes con afecciones pulmonares. Por el contrario, en dispositivos de alta resistencia, la velocidad del flujo de aire inspiratorio es menos relevante para la desaglomeración del medicamento que la presión diferencial (figura 5). Por lo tanto, los pacientes pueden generar una presión diferencial más alta con un menor flujo de aire inspiratorio y menos esfuerzo38.
Resistencia del inhalador de polvo seco y flujo inspiratorio óptimo para una entrega adecuada del fármaco
El gráfico ilustra cómo los dispositivos de baja resistencia requieren una mayor velocidad del flujo de aire inspiratorio. En contraste, los dispositivos de alta resistencia permiten una desaglomeración efectiva del medicamento con menor esfuerzo y un flujo de aire inspiratorio más bajo.
La velocidad del flujo inspiratorio del paciente afecta directamente la distribución del medicamento en distintas áreas respiratorias como la orofaringe, las vías respiratorias superiores y los bronquiolos pulmonares. Al usar dispositivos de inhalación con alta resistencia, la velocidad del aire que transporta el medicamento se reduce debido a la restricción en la tasa máxima de flujo inspiratorio. Este flujo más lento disminuye la inercia de las partículas del medicamento, permitiendo una penetración más profunda en el pulmón y, por ende, una mayor efectividad terapéutica35,36.
Flujo inspiratorioSe ha establecido que una tasa de flujo inspiratorio máximo (PIF) de 30 l/min es adecuada para una variedad de inhaladores de polvo seco con diferentes mecanismos de funcionamiento, como Easyhaler, Handihaler y Ellipta39. La variabilidad en los esfuerzos inspiratorios de los pacientes ha sido evidente en diversos grupos etarios, desde pediátricos hasta geriátricos, y en diferentes condiciones, que van desde asma hasta EPOC40–42. A pesar de estas disparidades, se considera que un PIF de 30 l/min se encuentra dentro de límites aceptables. Por ejemplo, al examinar el PIF en pacientes adultos y pediátricos con asma, así como en adultos con EPOC, en Easyhaler, un dispositivo con una resistencia relativamente alta en comparación con Turbuhaler de Symbicort, se observó que los percentiles 10, 50 y 90 para el PIF fueron de 44,7l/min, 61,1l/min y 74,8l/min43, respectivamente. De esta forma, las evidencias sugieren que la mayoría de los pacientes pueden alcanzar el flujo inspiratorio requerido para utilizar DPI de alta resistencia, sin importar su edad o la gravedad de su enfermedad41,44.
Los esquemas presentados ilustran cada paso del proceso de inhalación para diferentes modelos de dispositivos de polvo seco (DPI): Turbuhaler (esquema A), Respimat (esquema B), Handihaler (esquema C), Ellipta (esquema D), Spiromax (Esquema E), Breezhaler (esquema F) Estos esquemas ofrecen una guía visual clara y precisa, con el objetivo de reforzar las instrucciones de uso específicas y minimizar los errores comunes, garantizando así la eficacia del tratamiento inhalado.
Errores en el uso de inhaladores pMDI y DPILos inhaladores de dosis medida (pMDI) y de polvo seco (DPI) son los dispositivos más comúnmente utilizados para la administración de fármacos en el tratamiento del asma o la EPOC45,46. Sin embargo, un gran número de pacientes que requiere este tipo de medicamentos no utiliza correctamente sus dispositivos inhaladores. Los errores pueden afectar la efectividad del fármaco administrado y, por lo tanto, llevar al control subóptimo de la enfermedad47,48.
La literatura destaca que la confusión en las definiciones de errores críticos y no críticos radica en la variabilidad de criterios entre diferentes estudios y dispositivos. Esta variabilidad dificulta establecer criterios uniformes para identificar los errores más comunes. En términos generales, un error crítico se refiere a una falla que puede comprometer significativamente la efectividad del fármaco administrado, contribuyendo al control subóptimo de la enfermedad. Por otro lado, un error no crítico puede referirse a un paso en la lista de verificación que, aunque importante para el funcionamiento del dispositivo, puede tener menos impacto si la enfermedad está bien controlada.
Se realizó una revisión sistemática49 para estimar las tasas de error (la proporción de pacientes con al menos un error, crítico y/o no crítico) por tipo de dispositivo. Pese a las limitaciones de los datos, se observó que tanto las tasas de error en general, como las tasas de errores críticos informadas, son altas en todos los dispositivos, oscilando entre el 50% y el 100%, y entre el 14% y el 92%, respectivamente. Además, se señala que varios errores son comunes tanto en los dispositivos de inhalador de dosis medida (pMDI) como en los de polvo seco (DPI), donde los más frecuentes son: “no exhalar antes de la inhalación” y “no contener la respiración durante unos segundos después de la inhalación”. Y en los pMDI con aerocámara, no “asegurar un sellado adecuado alrededor de la boquilla”.
Por otra parte, Melani et al., estudiaron los errores asociados con el usuario cometidos por 1664 adultos con asma y EPOC que usaban inhaladores de dosis medida y dispositivos de polvo seco en casa. Los errores más comunes con los DPI fueron exhalar dentro del dispositivo antes de la activación y la falta de retener la respiración después de la inhalación50. Sandler et al. mostraron que un tercio de los adultos sin experiencia con inhaladores podían usar un inhalador correctamente sin entrenamiento (Spiromax, Easyhaler o Turbuhaler), pero después de recibir orientación cuidadosa por parte de un profesional de atención médica, el 95% puede dominar los aspectos técnicos necesarios para una inhalación exitosa51. Pese a esto, una revisión sistemática llevada a cabo por Lavorini et al.52 reveló que hasta un 25% de los pacientes no reciben instrucciones verbales sobre el uso adecuado de sus dispositivos de inhalación. Estudios que han comparado el uso de inhaladores pMDI y DPI, determinaron que la administración es significativamente mejor con usuarios de DPI (67,8%) que MDI (38,4%)53).
Estos puntos son sumamente relevantes para garantizar la eficacia de los tratamientos. Es crucial seguir correctamente las instrucciones de uso de los dispositivos inhalados. La tabla 2 ofrece una visión general de las recomendaciones básicas para la preparación y administración de pMDI y DPI, además de destacar los errores más frecuentemente cometidos por los pacientes.
Recomendaciones generales para el uso de pMDI y DPI
| pMDI | DPI |
|---|---|
| Agitar el dispositivo antes de su activación | Preparar el dispositivo para la inhalación siguiendo las instrucciones específicas de cada modelo |
| Conectar inhalador a un espaciador/aerocámara | *Exhalar el aire fuera del dispositivo |
| *Exhalar el aire | *Colocar boquilla con los labios firmemente alrededor, asegurando un adecuado sellado |
| *Asegurar un sellado adecuado alrededor de la boquilla del espaciador/aerocámara | Inspirar rápida y profundamente a través de la boquilla |
| Inhalación lenta (a 30 l/min), profunda, que comience inmediatamente después de la activación del pMDI | *Contener respiración tanto como sea posible, idealmente 10 segundos |
| *Contener respiración tanto como sea posible, idealmente 10 segundos. |
Los autores declaran no presentar ningún conflicto de interés.