Los pacientes críticamente enfermos pueden experimentar a diario situaciones de agitación, dolor y delirium durante su internación en la UCI, las que pueden tener consecuencias a corto y largo plazo. Un abordaje coherente y ordenado ofrece una mejoría en su pronóstico. Una aproximación racional requiere la implementación de una serie de prácticas, idealmente establecidas en protocolos de actuación, que incluyan la utilización de herramientas de valoración de los síntomas, un tratamiento analgésico adecuado, prioritario y titulado, establecer el nivel objetivo de sedación, con la utilización ideal de niveles de sedación superficial, eligiendo el fármaco sedante apropiado, utilizando además estrategias no farmacológicas para el manejo de los síntomas, involucrando a todos los miembros del equipo profesional así como a los familiares asociados activamente en la atención del paciente. El efecto combinado de estas medidas proporciona la base de un estándar de atención para los pacientes de la UCI, ofreciendo oportunidades para mejorar los cuidados, el confort y los resultados a largo plazo.
During their ICU stay, critically ill patients could experience daily episodes of agitation, pain and delirium that might lead to short and long term consequences. A judicious and orderly approach offers these patients an improvement in their prognosis. A rational approach requires the implementation of a series of practices, ideally organized into action protocols, which include the use of tools for the assessment of symptoms, a prioritized, adequate and titrated analgesic treatment, establishing a targeted objective level of sedation, looking for the achievement of superficial sedation levels, with the use of the most appropriate sedative drug, and non-pharmacological strategies for the management of symptoms while involving all members of the professional team and family members into an active participation in the patient's care.
The associated effect of these measures provides the basis for the current standard of care for ICU patients, offering opportunities to improve results, comfort and long-term outcomes.
El paciente crítico durante su estadía en la Unidad de Cuidados Intensivos (UCI) experimenta situaciones que provocan estados de ansiedad, disconfort, desasosiego, agitación y dolor que pueden conducir a un sueño inadecuado, fatiga, desorientación, estrés, taquicardia, aumento del consumo de oxígeno miocárdico, hipercoagulabilidad, inmunosupresión y un incremento de su tasa metabólica. La situación clínica más frecuentemente asociada a estas complicaciones es la asistencia ventilatoria mecánica (AVM). Los profesionales de la UCI cuentan con regímenes de analgesia y sedación para intentar minimizar estas complicaciones. Para brindar la máxima seguridad y confort, estos regímenes requieren de un uso muy cuidadoso. La utilización de dosis inapropiadas y la falta de consideración de sus efectos tóxicos o colaterales pueden llevar a consecuencias potencialmente perjudiciales. Esta revisión aborda el tema basada en la mayor evidencia disponible y recomendaciones surgidas de las guías de práctica clínica que cuentan con el mayor consenso en la actualidad.
I.- Analgesia
El dolor es una experiencia frecuente en los pacientes críticos. A pesar de la conciencia de la necesidad de una analgesia adecuada, un número significativo de estos pacientes internados en UCI no recibe un diagnóstico y manejo apropiados1–3.
2Reconocimiento, evaluación y control del dolorAl tener un carácter subjetivo, la presencia o intensidad del dolor puede ser muy difícil de evaluar en pacientes críticos, especialmente cuando existen dificultades para la comunicación, como sucede en aquellos que se encuentran con trastornos de la conciencia o bajo intubación orotraqueal. Algunos estudios han mostrado que alrededor del 70% de los pacientes en UCI presenta dolor no reconocido o insuficientemente controlado.
La estadía en UCI se ha descrito en muchas oportunidades como una experiencia humana dramática, siendo el dolor uno de los principales componentes de esa desagradable vivencia. Por sí mismo, el dolor puede impactar también en la morbilidad de los pacientes.
El dolor interfiere en la fisiología cerebral, cardiovascular y respiratoria, pudiendo generar un retraso en la recuperación y el alta de los pacientes. Además, puede desencadenar estados de ansiedad, depresión y estrés postraumático que podrían prolongase más allá del alta de la UCI.
Por lo tanto, el reconocimiento del dolor es un desafío diario que enfrenta el equipo de profesionales de la UCI, por lo que se recomienda una evaluación frecuente y protocolizada mediante la utilización de escalas validadas para su identificación y cuantificación.
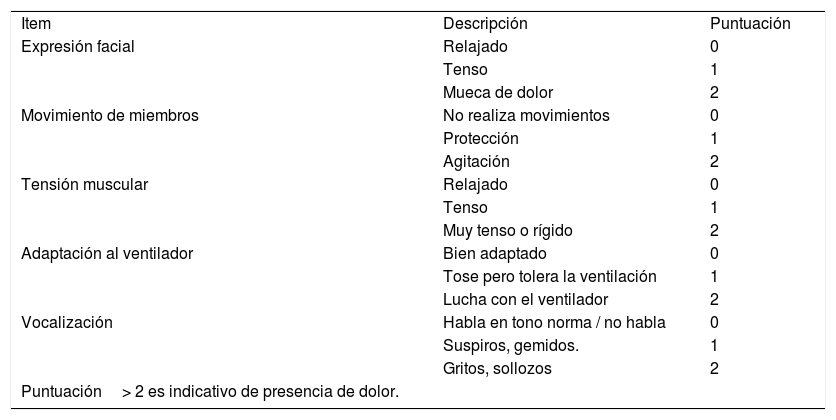
En pacientes que puedan hablar y/o comunicarse se recomienda la utilización de herramientas tales como la escala visual analógica (EVA) o la escala numérica de dolor, que son fáciles de aplicar, y están aceptadas y validadas para la evaluación y monitoreo del dolor. En pacientes con trastornos de la conciencia o intubados sin posibilidad de comunicación, se debe sospechar dolor cuando se presentan expresiones faciales evocativas del mismo, excitación psicomotriz o asincronías paciente-ventilador. Para su identificación se recomienda la valoración mediante la utilización de herramientas validadas como pueden ser la Critical Care Pain Observation Tool (CPOT) y/o la Behavioral Pain Scale (BPS) (Ver tablas 1 y 2). Estas herramientas exploran conductas y comportamientos relacionados con la presencia de dolor, y pueden utilizarse no solamente para la pesquisa sino también para el monitoreo de la respuesta terapéutica del dolor4,5.
Herramienta de observación de dolor en cuidados críticos (CPOT scale)
| Item | Descripción | Puntuación |
| Expresión facial | Relajado | 0 |
| Tenso | 1 | |
| Mueca de dolor | 2 | |
| Movimiento de miembros | No realiza movimientos | 0 |
| Protección | 1 | |
| Agitación | 2 | |
| Tensión muscular | Relajado | 0 |
| Tenso | 1 | |
| Muy tenso o rígido | 2 | |
| Adaptación al ventilador | Bien adaptado | 0 |
| Tose pero tolera la ventilación | 1 | |
| Lucha con el ventilador | 2 | |
| Vocalización | Habla en tono norma / no habla | 0 |
| Suspiros, gemidos. | 1 | |
| Gritos, sollozos | 2 | |
| Puntuación> 2 es indicativo de presencia de dolor. |
Adaptado y traducido de Gelinas C, et al. Am J Crit Care. 2006;15[4]:420-42748.
Escala de comportamiento del dolor (BPS scale)
| Item | Descripción | Puntuación |
| Expresión facial | Relajada | 1 |
| Parcialmente tensa | 2 | |
| Totalmente tensa | 3 | |
| Haciendo muecas | 4 | |
| Movimiento de miembros superiores | Relajado | 1 |
| Parcialmente flexionado | 2 | |
| Totalmente flexionado | 3 | |
| Totalmente contraído | 4 | |
| Ventilación mecánica | Tolerando movimientos | 1 |
| Tosiendo, pero tolerando la ventilación durante la mayor parte del tiempo | 2 | |
| Luchando contra el ventilador | 3 | |
| Imposibilidad de controlar el ventilador | 4 | |
| Puntuación> 5 es indicativo de presencia de dolor siendo máximo con puntuación de 12 |
Adaptado y traducido de Payen J, et al. Crit Care Med. 2001;29 (12);2258-226349.
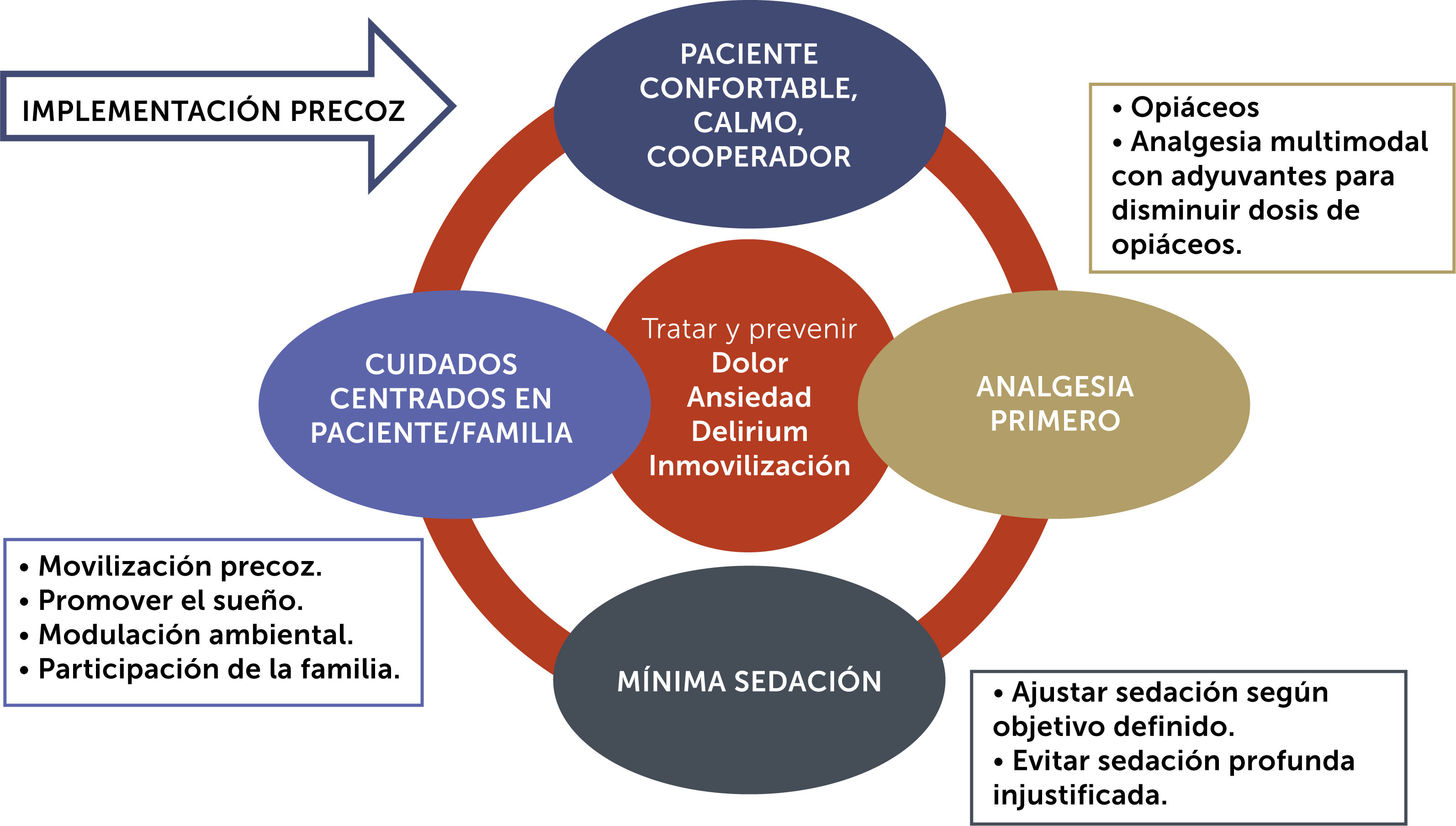
El concepto de eCASH: implementación temprana para controlar y prevenir el dolor, la ansiedad, la agitación, el delirium y la inmovilización, y promulgar la atención centrada en el paciente. La sedación moderada o profunda solo debe ser utilizada en situaciones como: insuficiencia respiratoria grave con asincronia paciente-ventilador, pacientes que requieren uso de bloqueantes neuromusculares, status epiléptico, afecciones quirúrgicas que requieren inmovilización estricta y algunos casos de lesión cerebral grave con hipertensión intracraneal.
Estas escalas deben ser utilizadas de manera periódica, como parte de un protocolo de actuación y evaluación global idealmente aplicándolas cada 4 a 6 horas así como antes y después de procedimientos que puedan provocar o exacerbar el dolor.
Los protocolos de actuación deberían estar basados fundamentalmente en estrategias diseñadas para el control del dolor como objetivo primordial. Su utilización ha demostrado una disminución en la duración de la ventilación mecánica y estadía en la UCI así como una menor utilización de sedantes6,7.
Una vez reconocido el dolor se deben extremar las medidas para su tratamiento adecuado con el fin de minimizar su repercusión pronóstica. Para ello se cuenta con una amplia variedad de fármacos.
Los opioides siguen siendo el principal pilar para el control del dolor en la mayoría de los escenarios de la UCI. Sin embargo, sus efectos secundarios y/o tóxicos son frecuentes y potencialmente riesgosos. Efectos tales como la sedación, euforia, delirium, náuseas, depresión respiratoria, retención urinaria, espasmo de la vía biliar, íleo, constipación e inmunosupresión, favorecen la prolongación de la estadía en la UCI y pueden empeorar los resultados de estos pacientes aún después del alta de la UCI.
En la actualidad se ha extendido el concepto de “analgesia multimodal”, descrito inicialmente para pacientes postoperatorios, pero fácilmente extrapolable al resto de los pacientes críticos. Esta práctica tiene como objetivo reducir el uso de opioides apoyándose en la utilización de analgésicos y medidas no farmacológicas, tales como la rehabilitación física precoz y la inclusión familiar en la UCI entre otras8.
Dada su potencia analgésica, los opioides intravenosos siguen siendo el analgésico de primera línea para la mayoría de los pacientes internados en la UCI.
La morfina es un analgésico opiáceo utilizado con menos frecuencia en la UCI. El inicio de su efecto analgésico se produce a los 5 a 10 minutos, luego de su administración IV, su efecto máximo se alcanza alrededor de 1-2 horas y presenta una vida media de eliminación de 4-5 horas. Su metabolismo implica su conjugación hepática dando lugar a la formación de metabolitos glucurónidos, con una eliminación renal que se produce en 24 horas. En pacientes críticos con Clearence de Creatinina disminuido (particularmente por debajo de 30ml/min), este metabolito puede acumularse provocando con prolongación de su efecto analgésico y potenciando la aparición de efectos secundarios tales como sedación y depresión respiratoria. Se puede administrar de manera intermitente intravenosa (IV) en dosis de 2–4mg cada 1–2 horas o en una infusión continua de 2–15mg/h, que en casos especiales podría llegar hasta los 30mg/h9,10.
El fentanilo es un derivado sintético de la morfina aproximadamente 100 veces más potente que ella. Su inicio de acción es más rápido debido a su mayor solubilidad en lípidos y mayor penetración de la barrera hematoencefálica. Su potencial acumulación en tejidos grasos y músculos hace que su uso en infusión continua prolongada se encuentre asociado a una prolongación de su efecto sedante y depresor del centro respiratorio. En caso de disfunción renal, podría preferirse su uso en bolos aislados antes que en una infusión continua. Sus dosis son de 0.35–0.5μg/kg en administración IV intermitente cada 0.5–1h y de 0.7 a 5μg/kg/h (en casos especiales hasta 10μg/kg/h) para su uso en infusión continua11.
El remifentanilo es otro opiáceo utilizado en la UCI. Es un derivado del Fentanilo de acción ultracorta, con un inicio y disminución acción muy rápida (<3 a 5-10min) y similar potencia analgésica que el Fentanilo. Tiene una farmacocinética favorable vinculada a que su metabolismo se realiza a través de esterasas plasmáticas, por lo que resulta una buena opción en pacientes con disfunción hepática y/o renal. Cuando se administra en infusión continua, su potencia y efectos sedantes hacen que pueda ser utilizado como droga principal en protocolos de analgosedación, eventualmente requiriendo como complemento bolos aislados de sedantes de acción corta. Esta estrategia podría reducir la duración de la ventilación mecánica y la estadía en UCI11.
El principal inconveniente que presenta el uso de este fármaco está dado por su potencia depresora sobre el centro respiratorio, aún a dosis relativamente bajas, lo que lo hace desaconsejable en pacientes respiratoriamente inestables, restringiéndose su uso a aquellos pacientes que se encuentran bajo AVM. Debe tenerse presente que en el momento de la suspensión brusca de su administración podrán observarse fenómenos de hiperalgesia, generalmente expresados por episodios de agitación psicomotriz, por lo que se recomienda la disminución progresiva de las dosis antes de su suspensión definitiva. Solo estaría recomendada su utilización durante periodos cortos que no superen los 5 días. La dosis recomendada es de un bolo inicial de 1.5μg/kg IV, seguido de un régimen de mantenimiento en infusión continua IV de 0.5 a 15μg/kg/h.
El tramadol es un opioide de acción central que actúa uniéndose al receptor opiáceo μ como un agonista puro. Se utiliza en el tratamiento del dolor moderado a intenso. Sus efectos adversos más comunes incluyen náuseas, vómitos, mareos, sequedad bucal y cefalea. Produce menor depresión respiratoria, efectos cardiovasculares, euforia y constipación que la morfina. Se utiliza en dosis intermitentes IV de 50 a 100mg cada 6-8 horas. Cuando se administra en infusión continua, se da una dosis inicial de 100mg IV, seguida de 12 a 24mg/h, aunque esta forma de administración no encuentra evidencias definitivas en la literatura.
Los analgésicos no opioides tales como paracetamol, nefopam, ketamina, lidocaína, así como agentes utilizados en el tratamiento del dolor neuropático tales como pregabalina, carbamazepina o gabapentina, y los antiinflamatorios no esteroideos (AINEs) tienen efectos sinérgicos cuando se los asocia a los opioides, permitiendo un ahorro en la dosis de estos y logrando mejores resultados analgésicos.
El paracetamol es un agente analgésico y antipirético utilizado para el tratamiento de la hipertermia y/o el dolor leve. En pacientes quirúrgicos una dosis de 1g IV cada 6 horas, ha demostrado disminuir la necesidad de opioides. La respuesta individual a los efectos analgésicos del Paracetamol es variable y algunos pacientes son refractarios a sus efectos analgésicos. En pacientes sensibles, el paracetamol preventivo asociado con dosis de rescate de tramadol puede ser una buena estrategia en el control del dolor postoperatorio leve a moderado. La hipotensión arterial (frecuentemente transitoria y que raramente requiere intervención farmacológica) es un efecto secundario descripto, particularmente con su administración parenteral, por lo que su uso debería evitarse en pacientes hemodinámicamente inestables o con disfunción hepática12,13. La disfunción renal no contraindica su utilización. La dosis utilizada habitualmente va de 325 a 1000mg cada 4–6 horas; con una dosis máxima ≤4g/día por vía oral, y de 650-1000mg IV cada 4-6h; con una dosis máxima IV ≤4g/día.
El nefopam es un analgésico no opioide derivado de la benzoxacina, que posee una actividad inhibidora sobre los receptores dopaminérgicos, noradrenérgicos y serotoninérgicos. Una dosis de 20mg produce un efecto analgésico comparable a 6mg de morfina IV. No tiene efectos secundarios sobre la hemostasia, la mucosa gástrica, la función renal, el centro respiratorio y la motilidad intestinal. Sin embargo, su uso puede asociarse a taquicardia, elevación de la presión intraocular, convulsiones y delirium. En pacientes con cirugía cardiaca, su efecto analgésico se asemeja al del Fentanilo IV. Se sugiere su utilización ya sea como complemento o como reemplazo de la terapia con opioides con el propósito de reducir el uso de los mismos y sus efectos secundarios12. Habitualmente se utiliza en dosis IV intermitentes de 20mg (en 15-20min) en intervalos de 4 a 6 horas, con una dosis máxima de 120mg/día, o en infusión continua IV de 60 a 120mg/día. También se puede administrar por vía oral a una dosis de 90 a 180mg/día en intervalos de 4-6 horas. Este fármaco aún no está disponible para su utilización en Chile ni Argentina.
La ketamina proporciona anestesia y analgesia disociativa bloqueando los receptores de N-metil-d-aspartato (NMDA) uniéndose a los receptores opiáceos σ. Se emplea como sustituto o complemento de la terapia con opioides en pacientes seleccionados, particularmente postquirúrgicos o que hayan desarrollado tolerancia a los opiáceos. Está asociado al eventual desarrollo de alucinaciones por lo que es aconsejable su uso bajo premedicación con diazepam o midazolam12. Se administra en una dosis inicial de 0.1-0.5mg/kg IV, seguida de una infusión continua IV de 0.05–0.4mg/kg/h.
Otro grupo de fármacos que pueden ser utilizados como terapia analgésica adyuvante en la UCI son los fármacosantidepresivos, los anticonvulsivantes y los neurolépticos.
Los anticonvulsivantes como la carbamazepina, la gabapentina y la pregabalina muestran su mayor eficacia en el tratamiento del dolor crónico, si bien múltiples ensayos clínicos sugieren su potencial en el tratamiento del dolor agudo o en la prevención del dolor crónico postoperatorio14. El gabapentina y la pregabalina son análogos del ácido gamma-aminobutírico (GABA), que habitualmente se utilizan para el tratamiento del dolor neuropático en la población general, pero también pueden ser utilizados como parte de la estrategia multimodal en el control del dolor en la UCI. Se los ha evaluado en pacientes críticos con síndrome de Guillain-Barré o en el postoperatorio reciente de cirugía cardíaca, mostrando una reducción significativa del consumo de opioides dentro de las 24 horas de su inicio. Entre los pacientes con cirugía cardiaca, su uso no afectó el tiempo hasta la extubación ni la estadía en la UCI14. Los efectos adversos más comúnmente relacionados con su uso son la somnolencia y la confusión, que podrían limitar su utilización. La administración por vía oral de carbamazepina se realiza con una dosis inicial de 50 a 100mg cada 6 horas; seguida de una dosis de mantenimiento que va de 100mg hasta 200mg cada 4 o 6 horas; con una dosis máxima de 1200mg/día con su uso son la somnolencia y la confusión, que podrían limitar su utilización. La gabapentina se administra en una dosis inicial de 100mg cada 8 horas por vía oral, llegando a una dosis de mantenimiento que va desde 900 a 3600mg/día dividida en tres dosis. La pregabalina se administra por vía oral inicialmente a una dosis de 50mg cada 12 horas pudiendo llegar hasta 300-600mg en 2 o 3 dosis diarias, de acuerdo a la respuesta terapéutica.
Los AINEs pueden ser empleados como terapia principal en el control del dolor o asociados a los opiáceos como parte de una estrategia multimodal. Sus efectos sinérgicos permiten la reducción de la dosis y los efectos secundarios asociados a los opiáceos como se ha mencionado con otros analgésicos. Su utilización puede desencadenar efectos secundarios potencialmente graves sobre todo en pacientes con disfunción renal, hemorragia gastrointestinal, hemorragia quirúrgica reciente, disfunción plaquetaria, cirrosis o asma, en quienes deben considerarse como de alto riesgo y deben evitarse. Su uso debe cotejarse cuidadosamente con los eventuales efectos secundarios de los opiáceos y limitarlos a pacientes postoperatorios estables sin disfunción renal, hepática o plaquetaria.
El tratamiento analgésico farmacológico puede ser combinado con el uso de medidas tales como la anestesia regional o intervencionesnofarmacológicas tales como la kinesioterapia con movilización temprana, la estimulación eléctrica transcutánea (TENS), técnicas de relajación, terapias de masaje y musicoterapia, así como brindando herramientas que favorezcan la comunicación. Las medidas no farmacológicas podrían contribuir a un mejor manejo del dolor en los pacientes internados en la UCI15.
Una adecuada estrategia para el control del dolor debe estar basada en un enfoquemultimodal. Este concepto surge con la idea de proporcionar un control adecuado del dolor utilizando el efecto aditivo y sinérgico de distintos tipos de analgésicos a bajas dosis y diferentes vías (intravenoso, enteral, epidural, bloqueos locales, etc), con la consiguiente reducción de sus efectos secundarios, todo esto sumado a medidas no farmacológicas. El tratamiento farmacológico analgésico se debe realizar con una combinación de drogas con mecanismos de acción diferentes que incluyan analgésicos opiáceos, analgésicos no opiáceos y eventualmente anestesia regional. El tratamiento no farmacológico debe considerar también la adecuación postural, la contención emocional, la movilización precoz y la participación familiar. Ante intervenciones que puedan contribuir a la aparición o exacerbación del dolor tales como la necesidad de maniobras quirúrgicas, colocación de dispositivos invasivos, remoción de drenajes, catéteres, curación de heridas, punciones arteriales o movilización para la higiene se recomienda realizar un tratamiento farmacológico analgésico preventivo. Las ventajas potenciales de este enfoque incluyen una analgesia más efectiva, dosis más bajas de opioides y una disminución del riesgo de los efectos secundarios relacionados con su utilización.
II.- Sedación
La utilización de fármacos sedantes es una práctica diaria en los pacientes internados en las UCI. Estos fármacos a menudo se utilizan por vía intravenosa en regímenes de infusión continua. Su empleo tiene el propósito de brindar confort, reducir la ansiedad, prevenir las complicaciones asociadas a la agitación y (en situaciones especiales) disminuir el consumo de oxigeno optimizando la interacción entre el paciente y el ventilador. Sin embargo, el uso de estos fármacos puede tener consecuencias a corto y largo plazo que deben ser conocidas, monitoreadas y prevenidas, ya que predisponen a un aumento de la morbilidad, fundamentalmente expresadas en una prolongación de la AVM, una mayor estadía en la UCI y en el hospital, así como una mayor incidencia de delirium, trastornos depresivos y estrés postraumático16.
Diferentes ensayos clínicos mostraron que ciertas intervenciones, tales como el uso de protocolos de actuación, permiten disminuir las complicaciones derivadas de la utilización de estos fármacos. Estos protocolos de actuación son pautas o guías preestablecidas que, mediante la evaluación periódica del nivel de sedación, usando escalas de valoración validadas, permiten realizar ajustes frecuentes de las dosis de los fármacos con el propósito de evitar la infra o sobre sedación de los pacientes.
3Nivel adecuado de sedaciónLa sedación es un componente clave en el cuidado de los pacientes que requieren AVM en la UCI. La minimización del dolor y la ansiedad es una recomendación considerada un estándar de la calidad de la atención. La aproximación habitual al control del dolor y la ansiedad se realiza con analgésicos y sedantes que, además, permiten mejorar la sincronía con el ventilador y disminuir el trabajo respiratorio. Algunos estudios han demostrado, sin embargo, que la sedación excesiva se asocia con peores resultados, con una mayor incidencia de delirium, AVM prolongada, neumonía asociada a la ventilación mecánica, mayor estadía en la UCI y hospitalaria, estrés postraumático y deterioro cognitivo, así como con un aumento de los costos hospitalarios17,18. En cuanto al momento de la instalación de la sedación y su profundidad, ensayos clínicos han mostrado que la sedación profunda temprana (al inicio de la AVM, en las primeras 48-72 horas) está fuertemente asociada a peores resultados clínicos con prolongación de la duración de la asistencia ventilatoria, y una mayor mortalidad19. En contraste, numerosas experiencias clínicas indican que niveles superficiales de sedación en pacientes adultos internados en la UCI, están asociados a una menor duración de la ventilación mecánica y menor estadía en la UCI20.
La definición exacta de qué es aquello a lo que se denomina “sedación superficial” no está clara, pero la mayoría de las publicaciones la describen como una calificación de -2 a+1 (con un ideal de 0) en una escala de RASS (o bien su equivalente en otras escalas), lo que clínicamente representa un paciente despierto, tranquilo y colaborador.
La utilización de una sedación profunda solo debería estar reservada para situaciones especiales como la insuficiencia respiratoria grave con asincronía paciente-ventilador, frente al requerimiento del uso de bloqueantes neuromusculares, en pacientes con lesiones cerebrales graves con hipertensión endocraneana y en aquellos con estatus epiléptico. En esta última situación, el monitoreo de la sedación podría además beneficiarse con apoyo a través de la utilización de un monitoreo electroencefalográfico intermitente o continuo (BIS®, Sed Line® u otros dispositivos).
Con la utilización de un protocolo de sedación superficial, se deberá prestar especial atención a la eventual aparición de episodios de asincronía paciente-ventilador o agitación, que podrían requerir para su control la modificación de los parámetros del ventilador, el uso de analgésicos de rescate (si fuese secundaria a dolor) o la administración de drogas alternativas a los sedantes tales como los antipsicóticos atípicos, la Clonidina o la Dexmedetomidina21.
Las guías de práctica clínica más recientes recomiendan que los sedantes sean titulados evitando la sedación profunda y manteniendo un nivel de sedación superficial (paciente despierto, tranquilo y colaborador) a menos que la misma se encuentre estrictamente contraindicada12,22,23. (Ver fig. 1)
4Monitoreo de la sedaciónEl nivel de sedación ideal es aquel que proporciona un grado de sueño tal que el paciente pueda ser fácilmente despertado, sin dolor, ni ansiedad, idealmente con amnesia del proceso, y presentándose calmo y colaborador. El nivel adecuado de sedación permite evitar la infra o sobre utilización de fármacos sedantes.
Para lograr una sedación adecuada y segura se requiere una estrecha vigilancia de la dosis del fármaco sedante administrado. El nivel objetivo de sedación fijado debe reevaluarse con frecuencia con el propósito de evitar una sedación excesiva o disconfort y modificarse cada vez que se produzca un cambio en la situación clínica del paciente.
La herramienta ideal utilizada para el monitoreo debería tener validez (permitir diagnosticar con precisión los diversos niveles de sedación), confiabilidad (mostrar el mismo resultado a lo largo del tiempo y entre los diferentes examinadores) y factibilidad (que sea fácil de administrar, recordar y comunicar entre los diferentes examinadores). Estas características permiten no solo la titulación precisa del nivel de sedación sino también la corrección oportuna de otras causas de alteración de la conciencia tales como dolor, delirium o alteraciones de la conciencia secundarias a injuria cerebral aguda.
Las herramientas de monitoreo pueden ser subjetivas, es decir, basadas en escalas de sedación realizadas a intervalos frecuentes, u objetivas, a través de la tecnología mediada por instrumentos que diagnostican automáticamente el nivel de sedación. Sin embargo, las escalas de valoración basadas en instrumentos clínicos subjetivos son herramientas que se han demostrado robustas y han podido ser validadas.
Estudios bien diseñados y experiencias clínicas demostraron que el uso del monitoreo adecuado de la sedación permite una reducción significativa de las dosis de sedantes, del tiempo en AVM, de la estadía en la UCI y el hospital, además de una menor incidencia de delirium, neumonía asociada al ventilador y disfunción cognitiva a largo plazo24. Algunos autores también han informado una disminución en la mortalidad luego de la introducción del monitoreo sistemático de los niveles de sedación25.
A lo largo de los años se han creado y validado numerosas escalas clínicas con el objetivo de monitorear la efectividad de la sedoanalgesia. Aquellas que presentan una mayor aceptación son: Escala de Ramsay, Motor Activity Assessment Scale (MAAS), Adaptation to the Intensive Care Environment (ATICE), Minnesota Sedation Assessment Tool (MSAT), Vancouver Interaction and Calmness Scale (VICS), Sedation-Agitation Scale (SAS), y Richmond Agitation-Sedation Scale (RASS). De éstas, las más utilizadas y recomendadas por las principales sociedades científicas por su alta confiabilidad, validez, alto grado de aceptación por parte del personal del equipo de salud y fácil utilización son las escalas de SAS y RASS, fundamentalmente12,22 (Ver tablas 3 y 4). tabla 4
Escala de agitación-sedación (SAS scale)
| Item | Descripción | Puntuación |
| No despierta | Mínima o nula respuesta al dolor. No obedece órdenes | 1 |
| Muy sedado | Despierta a estímulo táctil. No se comunica o mueve espontáneamente | 2 |
| Sedado | Despierta al estímulo táctil o verbal suave. Obedece ordenes simples | 3 |
| Calmo | Tranquilo, despierta fácilmente, obedece órdenes | 4 |
| Agitado | Ansioso, leve agitación. Intenta sentarse. Calma con instrucciones | 5 |
| Muy agitado | No se calma a la orden verbal frecuente. Muerde el tubo endotraqueal | 6 |
| Agitación peligrosa | Tira del tubo endotraqueal, trata de removerlo. Agrede al personal. Se mueve de un lado a otro | 7 |
Adaptado y traducido de Riker RR et al. Crit Care Med 1999; 27: 1325-950.
Escala de agitación y sedación de Ritchmond en español (RASS scale)
| Item | Descripción | Puntuación |
|---|---|---|
| Combativo | Abiertamente combativo o violento. Peligro inmediato para el personal | 4 |
| Muy agitado | Se retira tubo(s) o catéter(es) o tiene un comportamiento agresivo hacia el personal | 3 |
| Agitado | Movimiento frecuente no intencionado o asincronía paciente-ventilador | 2 |
| Inquieto | Ansioso o temeroso pero sin movimientos agresivos o vigorosos | 1 |
| Alerta y calmo | - | 0 |
| Somnoliento | No completamente alerta, pero se ha mantenido despierto (más de 10 segundos) con contacto visual, a la voz (llamado) | -1 |
| Sedación ligera | Brevemente, despierta con contacto visual (menos de 10 segundos) al llamado | -2 |
| Sedación moderada | Algún movimiento (pero sin contacto visual) al llamado | -3 |
| Sedación profunda | No hay respuesta a la voz, pero a la estimulación física hay algún movimiento | -4 |
| No despierta | Ninguna respuesta a la voz o a la estimulación física | -5 |
Escala RASS validada al español por Rojas-Gambasica et al.51.
La utilización de protocolos de sedación y analgesia en pacientes críticos bajo AVM se ha utilizado desde fines del siglo pasado luego de que Brook y col demostraran que la utilización de un protocolo podía reducir la duración de la AVM, la necesidad de traqueostomía y la estadía en UCI26. Luego de este estudio inicial, otros confirmaron este hallazgo, mostrando además la asociación entre una “sedación titulada” (la menor sedación necesaria para alcanzar los objetivos de bienestar y seguridad del paciente) con la disminución de la dosis de sedantes utilizados, disminución de los costos, menor incidencia de delirium y una menor incidencia de trastornos cognitivos a largo plazo27. A pesar de la contundencia de la evidencia, varias publicaciones muestran que sólo el 54% de los intensivistas emplea protocolos de sedación en su práctica diaria de la UCI.
Diversos factores pueden atentar contra su implementación y pueden explicar la gran diferencia existente entre las recomendaciones y la práctica diaria de las UCI. Algunos de ellos incluyen falta de aceptación por parte del personal médico y enfermería, la preocupación del personal acerca de que una sedación insuficiente pueda poner en riesgo al paciente, el potencial incremento en la carga de trabajo en el equipo de salud, así como la preocupación por el probable disconfort que pudieran percibir los pacientes.
Para ser exitoso en la implementación de un protocolo de sedoanalgesia es necesaria su aplicación estricta, la participación de todo el equipo de salud y su educación permanente. El reconocimiento de las limitaciones locales que puedan atentar contra su implementación asociado al máximo esfuerzo para lograr su funcionamiento es de vital importancia para alcanzar el éxito.
6Interrupción diaria de la sedaciónDesde hace casi 20 años, Kress y col. reportaron los beneficios de la interrupción diaria de la infusión continua de sedantes en los pacientes críticos bajo AVM28. Estos beneficios se demostraron en una disminución de la estadía en AVM y en la UCI. Los resultados se confirmaron en diferentes ensayos posteriores llevando a que esta práctica se incluyera como recomendación en las guías de práctica más importantes sobre el tema, incluyendo las más recientemente publicadas12.
El proceso de interrupción diaria de la sedación comienza con la identificación de los candidatos apropiados para ella, excluyendo a aquellos que presentan contraindicaciones tales como el uso de sedación debido a convulsiones activas o abstinencia alcohólica, la necesidad creciente de sedación por agitación, el requerimiento de bloqueantes neuromusculares, la presencia de hipertensión endocraneana o inestabilidad hemodinámica con evidencia de isquemia miocárdica activa en las últimas 24 horas. Una vez que un paciente es identificado como candidato, la infusión de sedantes es suspendida hasta que el paciente se despierta o muestra signos de agitación, desadaptación o intolerancia al despertar. Si el paciente no tolera clínicamente la interrupción, se puede reiniciar la sedación continua, generalmente a la mitad de la dosis previa, realizando una valoración previa de la presencia de dolor. Si el paciente se muestra despierto y tranquilo se debe valorar la posibilidad de realizar una prueba de ventilación espontánea con el propósito de intentar su extubación.
Al momento de realizar la interrupción de la sedación, pueden observarse episodios de confusión, agitación o ansiedad con el riesgo de auto-retirarse el tubo orotraqueal, los drenajes o los accesos vasculares. Esta interrupción puede también desencadenar una gran descarga adrenérgica con taquicardia e hipertensión arterial de severidad impredecible. Por lo tanto, y para garantizar la seguridad mientras se realiza esta práctica, es recomendable la presencia de un equipo multidisciplinario comprometido y con experiencia en el tema. Esto último crea una gran limitación para su implementación en las UCI latinoamericanas ya que en estas, la carencia de personal es un común denominador.
La interrupción diaria de la infusión de sedantes resulta un instrumento muy importante para la titulación, ajuste, administración racional y suspensión temprana de los mismos con beneficios en el pronóstico de estos pacientes.
En pacientes adultos con ventilación mecánica que son monitoreados con protocolos de sedación y analgesia, la adición de una interrupción diaria de sedación no ha demostrado reducir la duración de la ventilación mecánica o la permanencia en la UCI29.
Elección del sedante
El sedante ideal debería presentar mínimos efectos hemodinámicos, no producir depresión respiratoria, no presentar interacciones con otros fármacos, no producir metabolitos activos ni toxicidad, presentar una vida media corta, tener una eliminación independiente de la función de los órganos y ser de bajo costo. Ningún fármaco posee todas las características ideales, por lo que conocer la farmacología de los distintos agentes potencialmente utilizables permite adaptar su uso al objetivo deseado y a la condición clínica del paciente.
Los fármacos más comúnmente empleados para la sedación en la UCI son las benzodiacepinas (midazolam y lorazepam), el propofol y la dexmedetomidina.
Una abundante evidencia publicada muestra que la infusión de benzodiacepinas, especialmente en dosis altas y por tiempo prolongado, se asocia con peores resultados, con aumento de la morbilidad, de la incidencia de delirium, del tiempo de ventilación mecánica y de la estancia en la UCI30. Aunque su uso está en descenso, aún siguen siendo los sedantes más utilizados en los pacientes críticos. De estos el más utilizado es el midazolam ya que el lorazepam está asociado a una mayor incidencia de efectos adversos.
En la actualidad existen alternativas que podrían ser más seguras y efectivas que estos fármacos (propofol y dexmedetomidina) con menor frecuencia de resultados adversos.
Varios ensayos han comparado los resultados de las diferentes alternativas terapéuticas:
Propofol vs. benzodiacepinas: La utilización de propofol mostró una disminución de la necesidad de sedación y de la duración de la AVM en comparación con el uso de las benzodiacepinas. Algunas publicaciones demostraron que el uso de propofol podría asociarse a un mayor riesgo de incidentes de autoextubación sin que se pudiera concluir en los resultados si se asocia o no a una mayor necesidad de reintubación o incidencia de delirium31. Uno de los efectos adversos raros, pero potencialmente letal, asociado a la administración de propofol en infusión continua es la aparición del Síndrome por infusión de Propofol. Este se produce cuando se administra a dosis elevadas (mayor a 4mg/kg/min) y por un tiempo prolongado (más de 48 hs). Se caracteriza por disfunción multiorgánica, rabdomiólisis, acidosis metabólica, hiperkalemia, arritmias y –eventualmente- muerte súbita. Para evitar su aparición se aconseja evitar su uso en dosis elevadas y por tiempos prolongados. Las características deseables del uso de Propofol probablemente superen las indeseables, por lo que se recomienda su utilización por sobre la de las benzodiacepinas12.
Dexmedetomidina versus benzodiacepinas: La utilización de Dexmedetomidina como sedante mostró en una serie de estudios una disminución del tiempo de AVM, de estadía en UCI y una menor incidencia de delirium comparada con la infusión de benzodiacepinas. La posible aparición de bradicardia con el uso de Dexmedetomidina no se asoció a la necesidad terapéutica de su corrección. Los hallazgos permiten preferir el uso de dexmedetomidina por sobre el de la benzodiacepina12.
Propofol versus dexmedetomidina: Los estudios que compararon la infusión de estos dos fármacos mostraron una menor incidencia de delirium y un mejor grado de comunicación de los pacientes con el uso de dexmedetomidina sin diferencias estadísticamente significativas en el tiempo de AVM, en la estadía en UCI y hospitalaria, así como en la incidencia de efectos adversos tales como la hipotensión arterial y bradicardia. No existe aún evidencia suficiente para recomendar el uso de uno sobre otro. La decisión deberá basarse en consideraciones locales tales como su disponibilidad y costos12.
Las referencias previas han conducido a la tendencia creciente a evitar el uso de las benzodiacepinas como sedantes de primera línea en la UCI, avanzando hacia agentes de acción rápida, de fácil titulación y mejores resultados, tales como el propofol y la dexmedetomidina.
El midazolam se administra con un bolo inicial de 0.01–0.05mg/kgen 1-2min, seguido de un mantenimiento de 0.02–0.1mg/kg/h; el Lorazepam con un bolo inicial de 0.02–0.04mg/kg, seguido de una infusión continua de 0.01–0.1mg/kg/h; el Propofol con una dosis inicial de 5μg/kg/min en 5min, seguido de una infusión continua de 5–50μg/kg/min; y la Dexmedetomidina con una dosis en infusión continua a razón de 0.2–1.5μg/kg/h.
A la luz de la información disponible, a la hora de la elección del fármaco sedante deberá tenerse en cuenta cuál es el objetivo del nivel de sedación. Si el objetivo es alcanzar una sedación superficial se deberán preferir agentes tales como dexmedetomidina o el propofol. En cambio, si las condiciones clínicas requieren una sedación profunda debería preferirse la administración de oropofol o benzodiacepinas (a las dosis útiles más bajas y por el tiempo más corto posible).
6.1III.- DeliriumEl delirium es una entidad clínica muy frecuente en la UCI. Este síndrome puede ser considerado una forma de disfunción orgánica aguda caracterizada por trastornos en la atención, disfunción cognitiva, desorganización del pensamiento y trastornos del estado de conciencia. Se caracteriza por presentar un comienzo agudo y un curso fluctuante. El delirium es habitualmente reversible, y su aparición está asociada tanto a factores relacionados con los antecedentes del paciente, así como a variables relacionadas con la internación en la UCI.
7EpidemiologíaLa incidencia del delirium reportada en pacientes críticos es de aproximadamente 32-36%17,32 y hasta en el 60-80% de los pacientes que requieren AVM33.
En un estudio epidemiológico retrospectivo realizado en nuestra institución que incluyo 2127 pacientes ingresados a la UCI (datos aún no publicados), se demostró una incidencia de delirium del 34.5% observándose una mayor incidencia en el grupo de pacientes médicos (37.6%) en comparación a los quirúrgicos (32.6%). De los pacientes con delirium, el 69.1% requerían AVM.
El delirium se asocia a un aumento en la estadía en UCI y en la estadía hospitalaria, a mayores requerimientos de AVM, a un aumento de la mortalidad intra y extrahospitalaria, a deterioro cognitivo y a trastornos amnésicos posteriores17,32,34. En nuestro estudio epidemiológico, los pacientes con delirium presentaron una estadía en UCI de 11 días versus 2 días en aquellos que no lo presentaron.
Cuando se analizó la mortalidad, se observó que la misma fue del 19.8% en los pacientes con delirium versus un 5.5% en aquellos pacientes sin él. En nuestra serie, el grupo de pacientes críticos con delirium por una admisión clínica presentó una mayor mortalidad que aquellos que ingresaron en situación postoperatoria (32 versus 10.7%).
7.1Subtipos de deliriumDesde el punto de vista clínico, este síndrome se puede dividir en 3 subtipos basados en las características semiológicas:
- 1.
Hiperactivo
- 2.
Hipoactivo
- 3.
Mixto
Los más comunes son el mixto y el hipoactivo, siendo el último el de peor pronóstico, considerando la mortalidad a los 6 meses. En pacientes con delirium, el estudio de Peterson et al. mostró una distribución del 54.9% para el delirium mixto, 43.6% para el hipoactivo y solo 1.6% para el hiperactivo35.
7.2Factores de riesgoLos factores de riesgo relacionados al delirium pueden dividirse en factores predisponentes (aquellos relacionados a las condiciones preexistentes) y factoresprecipitantes (aquellos atribuibles a la patología aguda y/o a factores ambientales adquiridos durante su internación en la UCI).
Dentro de los factorespredisponentes, la edad avanzada, el tabaquismo severo, el consumo de alcohol, el sexo masculino y el deterioro cognitivo previo están descriptos como factores de riesgo independientes. En relación a los factores precipitantes, el uso de drenajes, tubos y catéteres, la gravedad clínica (valorada por SAPS, APACHE II o SOFA score), ciertos fármacos (morfina, benzodiacepinas), el coma (espontáneo o inducido) y la AVM se han demostrado como los determinantes más importantes para su desarrollo en la UCI. Los altos requerimientos transfusionales son una variable asociada a la aparición de delirium postoperatorio, probablemente como subrogante de la gravedad de los pacientes. Entre los factores ambientales descriptos como precipitantes se destacan el aislamiento, la ausencia de exposición a la luz natural, la transferencia a otras unidades, la utilización de la contención física y la mala calidad del sueño17 (Ver tabla 5).
Factores de riesgo relacionados con la aparición de delirium
| Factores predisponentes | Factores precipitantes | |
| Atribuibles a la patología | Ambientales | |
| Motivo de ingreso (sepsis, insuficienciarespiratoria)Gravedad (APACHE II)Uso de medicación psicoactivasDrogas (opioides, benzodiapinas)Alteraciones de medio internoDolorComaNecesidad de AVMRetención urinaria | Ausencia diaria de luzFragmentación del sueñoContención físicaInstrumentalización |
La pesquisa de la presencia de factores de riesgo cumple un rol importante en la prevención de la aparición del delirium.
8DiagnósticoEl beneficio de la detección temprana del delirium radica en la oportunidad de poder iniciar medidas de corrección de los factores de riesgo, registrar condiciones clínicas que puedan predisponer a su aparición e instaurar precozmente medidas terapéuticas apropiadas (tanto de la causa desencadenante como del síndrome en sí mismo). La actual guía de la Society of Critical Care Medicine sobre analgesia, sedación y delirium, recomienda utilizar herramientas de tamizaje diario y frecuente para la detección del delirium.
En 1990, Inouye et al. validaron la escala CAM (del inglés: Confusion Assessment Method) para el diagnóstico de delirium en pacientes internados en la sala de internación general. Esta escala está basada en la operacionalización de los criterios diagnósticos de delirium del tercer manual de diagnóstico y estadística de desordenes mentales (DSM III-R)36.
Muchas de las herramientas diagnósticas con las que se cuentan para la detección del delirium, fueron estudiadas y validadas en países europeos y de América del Norte. En lo que respecta a los países de habla hispana, solo contamos con la validación del CAM-ICU (del inglés: Confusion Assessment Method for the Intensive Care Unit) en Colombia y una adaptación cultural de esa validación en Chile. Ambas presentan una adecuada sensibilidad y especificidad para la detección de delirium en la UCI (Sensibilidad de 79.4% en validación en Colombia y de 80% en Chile, Especificidad de 97.9% en Colombia y 96% en Chile37,38.
En el año 2001, Ely et al. validaron el CAM para pacientes internados en la UCI (CAM-ICU), aún en pacientes con AVM33. Esta escala consiste en la valoración de 4 parámetros clínicos que se deben objetivar en un orden preestablecido. Se realiza mediante la observación de:
- 1.
Un cambio agudo del estado de conciencia o fluctuación del mismo.
- 2.
Un déficit en la atención.
- 3.
Pensamiento desorganizado.
- 4.
El nivel de la conciencia.
Para que se considere diagnóstico para delirium, el paciente debe cumplir con los dos primeros puntos asociados a la positividad del punto 3 o 4. Con la valoración diaria y frecuente del CAM-ICU, se busca la detección precoz de delirium además de permitir monitorear la evolución del mismo.
9Predicción de deliriumDada la alta incidencia y gran impacto pronóstico que presenta la aparición de delirium en los pacientes internados en UCI, varios autores plantean la necesidad de predecir su desarrollo, con el propósito de intervenir en su prevención. Van den Boogaard et al. realizaron un estudio prospectivo, observacional y multicéntrico con un modelo de predicción de delirium llamado ̈PREdiction of DELIRiumin ICupatients (PRE-DELIRIC)̈. En este estudio se demostró una buena correlación entre los valores obtenidos de una escala basada en la presencia de 10 factores de riesgo registrados después de las primeras 24 horas del ingreso a la UCI (edad, APACHE-II, tipo de admisión, admisión de urgencia, infección, coma, sedación, uso de morfina, nivel de urea y acidosis metabólica) y el posterior desarrollo de delirium39. Este mismo grupo ratificó estos hallazgos en otro estudio prospectivo y multicéntrico realizado en varios países de Europa40.
En 2015, Wassennar et al., validaron otro modelo de predicción de delirium con factores de riesgo presentes en el momento de la admisión a la UCI (edad, deterioro cognitivo previo, abuso de alcohol, BUN al ingreso, uso de corticoides y falla respiratoria) observando también una buena correlación entre este modelo y el desarrollo de delirium41.
La predicción de la aparición del delirium puede ser una herramienta útil para su prevención. Si bien las escalas tienen sus limitaciones, pueden servir para alertar al equipo de salud y poner en marcha las medidas anticipatorias pertinentes.
10Prevención de deliriumMedidas no farmacológicas
La discontinuación diaria de los sedantes y la valoración permanente de los requerimientos de sedación asociados a la movilización temprana y a pruebas de ventilación espontánea como parte de un protocolo de destete de la AVM, han mostrado asociarse con la disminución del requerimiento de AVM, de la duración del coma farmacológico y de la incidencia y duración del delirium.
Varios estudios demostraron que el uso de benzodiacepinas durante la estadía en la UCI se relaciona con un aumento en la incidencia de delirium, por lo que actualmente se desalienta su utilización, promoviéndose el uso de sedación superficial idealmente prescindiendo de estas drogas38,42,43.
El dolor ha sido relacionado con el desarrollo de stress postraumático y delirium, por lo que una adecuada monitorización de la analgesia es esencial para minimizar su aparición. La valoración diaria y frecuente de la analgesia por medio de las escalas validadas mencionadas anteriormente es una estrategia que contribuye a la disminución de la aparición de delirium42,42.
La estimulación sensorial con el fin de orientar al paciente en persona, tiempo y espacio son una de las intervenciones más importantes en la prevención del delirium. Su implementación incluye el estímulo con relojes, celulares y calendarios; la apertura de ventanas de modo de exponer a los pacientes a la luz solar; la ubicación espacial diaria, la disminución nocturna de la exposición a la luz artificial, la disminución de la intensidad de las alarmas durante la noche, la utilización de tapones para los oídos, el uso de antifaces, la musicoterapia, la provisión de anteojos o audífonos (si son de uso habitual del paciente), la exposición a fotos de familiares y amigos, la limitación de los procedimientos de monitoreo durante las horas del sueño, la remoción temprana de catéteres y sondas, la optimización de la comunicación con el personal del equipo de salud y el aliento y la facilitación de la interacción con los familiares. El objetivo de estas medidas es facilitar la adaptación del paciente al medio en el que se encuentra, optimizando de una manera no farmacológica el sueño y evitando su fragmentación tratando de conservar el ritmo circadiano42,44.
La movilización temprana también demostró tener distintos efectos beneficiosos en los pacientes internados en la UCI, entre los que se destacan la disminución del requerimiento de sedación, de los días de AVM, de la estadía en la unidad de cuidados críticos y de la estadía hospitalaria con algunos autores mostrando también una reducción de la incidencia y de la duración del delirium42,44.
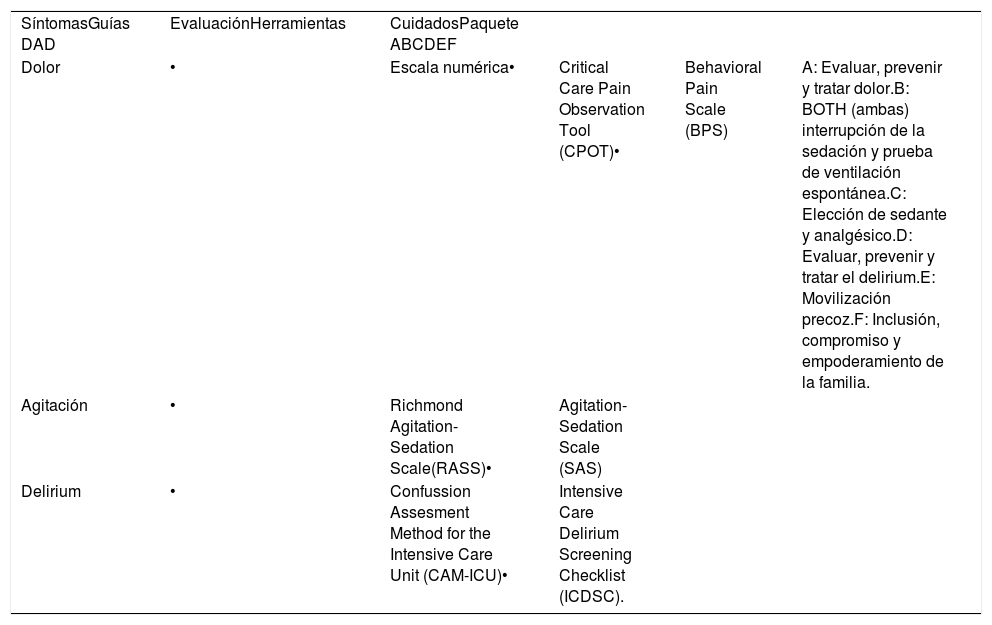
La puesta en acción de las distintas medidas destinadas a disminuir la incidencia de delirium en forma de “paquete de medidas” o “bundle” parece tener mayor impacto que cuando estas medidas se utilizan por separado. En el 2011 Morandi et al. propusieron una serie de intervenciones que disminuía la incidencia del delirium, llamando a este paquete “enfoque ABCDE” (Awakening and Breathing Coordination, Delirium assessment, Early exercise and mobilization: Despertar y coordinación respiratoria, monitoreo del delirium y ejercicio y movilización precoz), donde promovían la suspensión diaria y transitoria de los sedantes, una sedación superficial, la asistencia ventilatoria en modo espontáneo con pruebas diarias de ventilación espontánea, el monitoreo diario de la presencia de delirium y la movilización temprana. En el 2014 se realizó un estudio de cohorte, prospectivo que mostró que la implementación de este paquete de medidas reducía la probabilidad de desarrollar delirium. En la actualidad, algunos autores agregaron a este paquete de medidas la letra F (ABCDEF) alentando la participación de la familia en la UCI como medida asociada41,43 (Ver Tabla 6).
Bundle de medidas ABCDEF
| SíntomasGuías DAD | EvaluaciónHerramientas | CuidadosPaquete ABCDEF | |||
| Dolor | • | Escala numérica• | Critical Care Pain Observation Tool (CPOT)• | Behavioral Pain Scale (BPS) | A: Evaluar, prevenir y tratar dolor.B: BOTH (ambas) interrupción de la sedación y prueba de ventilación espontánea.C: Elección de sedante y analgésico.D: Evaluar, prevenir y tratar el delirium.E: Movilización precoz.F: Inclusión, compromiso y empoderamiento de la familia. |
| Agitación | • | Richmond Agitation-Sedation Scale(RASS)• | Agitation-Sedation Scale (SAS) | ||
| Delirium | • | Confussion Assesment Method for the Intensive Care Unit (CAM-ICU)• | Intensive Care Delirium Screening Checklist (ICDSC). |
El Paquete de medidas ABCDEF tiene como objetivo mantener al paciente Calmo, Colaborador y Cómodo, mediante una adecuada analgesia, mínima sedación y acompañado de su familia y seres queridos.
Adaptado de www.icudelirium.org.
Las medidas Farmacológicas en el Delirium están destinadas el tratamiento de la forma hiperactiva o a la prevención de la aparición del Síndrome en la UCI. Los resultados de múltiples estudios realizados con intervenciones farmacológicas con el fin de reducir la incidencia de delirium fueron dispares y no han demostrado una clara evidencia a favor de su uso rutinario en pacientes internados en la UCI.
Varios estudios sugirieron que el uso de haloperidol como profilaxis tenía un efecto en la disminución de los días de delirium y coma farmacológico. Sin embargo, un estudio reciente de Van den Boogaard et al., el que se incluye 1789 pacientes, no demostró beneficios con su uso en la sobrevida a 28 días, ni en los objetivos secundarios tales como los días libres de delirium, días libres de AVM o la estadía en la UCI45.
Otro fármaco evaluado con los mismos fines ha sido la dexmedetomidina. En un estudio multicéntrico, aleatorizado, doble ciego, y controlado que evaluó su uso en la profilaxis del delirium en pacientes que ingresaban a la UCI en postoperatorio de cirugía no cardíaca se demostró una disminución en la incidencia del mismo46. Otro estudio con la utilización de dexmedetomidina nocturna como estrategia en la prevención del delirium en pacientes gravemente enfermos en la UCI evidenció una menor incidencia de esta complicación47.
El uso de antipisicóticos, tanto típicos como atípicos, no ha mostrado beneficios en la disminución de los días de delirium, los días de AVM, la estadía en la UCI, así como tampoco en la mortalidad. Ante la falta de evidencia contundente, por el momento se desalienta su uso como tratamiento de rutina en pacientes con delirium. Entre aquellos pacientes que se manifiesten con alucinaciones, ansiedad o excitación psicomotriz o con comportamiento peligroso para sí mismo u otras personas podrían utilizarse tanto haloperidol como los antipsicóticos atípicos por periodos cortos de tiempo con la menor dosis posible, procurando su discontinuación tan pronto se haya controlado el episodio.
11ConclusiónEl dolor, la ansiedad y el delirium tienen una alta prevalencia en pacientes de la UCI y su presencia se asocia a un aumento de la morbimortalidad. El enfoque actual de la estrategia para el manejo de la sedación, la analgesia y el delirium debe apoyarse en la implementación de medidas integradas e individualizadas con la finalidad de favorecer el confort, la calma y la cooperación del paciente. Algunas de las medidas más importantes incluyen:
- 1)
Una adecuada analgesia mediante una estrategia multimodal basada en la cuidadosa utilización de drogas opiáceas y no opiáceas.
- 2)
Establecer un protocolo de sedación basado en objetivos según la situación clínica del paciente evitando la sedación profunda y la utilización de benzodiacepinas; y
- 3)
Articular los cuidados médicos y de enfermería basados en el paciente, privilegiando sus necesidades y favoreciendo la integración del grupo familiar en su cuidado. La utilización de este paquete de medidas genera un gran impacto en los indicadores de la UCI, como los días libres de AVM, los días de estancia en la UCI la morbimortalidad; y en la prevención del síndrome post unidad de cuidados críticos.
Sin conflictos de interés.
Agradecemos al Dr. Andrés Ferre Contreras por el aliento y la orientación que permitió avanzar con esta revisión.
PaCiente confortable, calmo, cooperador
Analgesia primero
Cuidados centrados en paciente/Familia
Mínima sedación
Implementación precoz
• Opiáceos
• Analgesia multimodal con adyuvantes para disminuir dosis de opiáceos.
• Ajustar sedación según objetivo definido.
• Evitar sedación profunda injustificada.
• Movilización precoz.
• Promover el sueño.
• Modulación ambiental.
• Participación de la familia.
Tratar y prevenir
Dolor
Ansiedad
Delirium
Inmovilización
Edad avanzada (> 65 años)
Sexo masculino
Deterioro coginitivo previo
Enolismo
Tabaquismo
Fragilidad
Uso previo de fármacos psicoactivos
[Enfoque actual de la analgesia, sedación y el delirium en Cuidados Críticos - Matías Olmos y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 126-139]
[Enfoque actual de la analgesia, sedación y el delirium en Cuidados Críticos - Matías Olmos y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 126-139]
[Enfoque actual de la analgesia, sedación y el delirium en Cuidados Críticos - Matías Olmos y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 126-139]
[Enfoque actual de la analgesia, sedación y el delirium en Cuidados Críticos - Matías Olmos y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 126-139]
[Enfoque actual de la analgesia, sedación y el delirium en Cuidados Críticos - Matías Olmos y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 126-139]
[Enfoque actual de la analgesia, sedación y el delirium en Cuidados Críticos - Matías Olmos y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 126-139]
[Enfoque actual de la analgesia, sedación y el delirium en Cuidados Críticos - Matías Olmos y cols.]
e-ISSN: 2531-0186/ ISSN: 0716-8640/© 2019 Revista Médica Clínica Las Condes. Este es un artículo Open Access bajo la licencia CC BY-NC-ND. (http://creativecommons.org/licenses/by-nc-nd/4.0/). https://doi.org/ 10.1016/j.rmclc.2019.03.002.