La falla respiratoria catastrófica corresponde a una condición crítica de alta mortalidad que puede llegar hasta el 50%. Su expresión clínica más importante es el síndrome de distrés respiratorio agudo. Durante los últimos años, se ha avanzado notablemente en el conocimiento de la fisiopatología del distrés, así como también en el conocimiento de los mecanismos de daño en relación a la ventilación mecánica invasiva. Así también, existe nueva evidencia en la literatura en relación al uso de ventilación en posición prono, ventilación oscilatoria de alta frecuencia, oxigenación de membrana extracorpórea y extracción extracorpórea de dióxido de carbono. En esta revisión, se analizan los últimos avances en el manejo de estos pacientes, haciendo hincapié en el manejo basado no sólo en la evidencia, sino en la fisiopatología de cada condición clínica individual.
Catastrophic pulmonary failure is a critic condition with a high mortality that can reach up to 50%. It has its more relevant clinical expression in the acute respiratory distress syndrome. Over the past several years a remarkable advance in the physiopathology of the knowledge of this condition has been done, likewise knowledge of the mechanism related to invasive mechanical ventilation. There is new evidence related to the use of prone position, high-frequency oscillation, extracorporeal membrane oxygenation and extracorporeal carbon dioxide removal. In this review we analyze the last advances in the management of these patients, we emphasize not only in the evidenced based medicine, but in the physiopathological management of each individual clinical condition.
El diccionario de la Real Academia Española define catástrofe como un suceso que produce gran destrucción o daño. El término falla respiratoria catastrófica fue utilizado por primera vez, por el Dr. William Briscoe en 1976 y la definió como una “enfermedad pulmonar tan grave que, mientras se respira oxígeno a concentración de 80% o más, la tensión arterial de oxígeno es 50mmHg o menos”1. A esta presión parcial y a nivel del mar, la hemoglobina se encuentra saturada apenas por sobre el 80%, disminuyendo considerablemente el transporte de oxígeno hacia los tejidos.
En la tierra, las condiciones mínimas de oxígeno a las que un ser humano puede estar expuesto corresponden a 20mmHg2. Exposiciones a estos entornos sin oxígeno suplementario no están exentas de riesgo y estudios en escaladores profesionales han detectado alteraciones en la resonancia nuclear magnética de encéfalo3. Los pacientes que desarrollan insuficiencia respiratoria grave hipoxémica también están en riesgo de desarrollar lesiones similares, sin embargo, esto no ha sido claramente demostrado y su impacto clínico no es del todo claro4.
Parece juicioso definir falla o insuficiencia respiratoria catastrófica, como la condición clínica que provoca una disminución persistente en la paO2≤50mmHg, la cual no puede ser corregida mediante ventilación mecánica invasiva convencional y, por lo tanto, el manejo del paciente necesita no sólo de la pericia de un especialista, sino que también, muy probablemente de maniobras complementarias o terapias poco habituales. Una definición basada en los pacientes con mayor riesgo de fallecer mediante terapias convencionales se presenta en la tabla 15.
Siendo el síndrome de distrés respiratorio agudo (SDRA) la condición más grave de insuficiencia respiratoria, a continuación, nos referiremos sobre cómo debemos enfrentar una falla respiratoria aguda grave secundaria a un SDRA.
1.1Síndrome de distrés respiratorio agudoDescrito en el año 19676, el SDRA corresponde a una forma de edema pulmonar no cardiogénico, causado por inflamación que genera aumento de la permeabilidad vascular pulmonar, con la correspondiente pérdida del tejido aireado. Corresponde a una vía final común de varias patologías y condiciones precipitantes (tabla 2). Al no ser una enfermedad en sí, el manejo del SDRA es complejo e involucra varios aspectos del conocimiento médico. Desde el año 1967, el SDRA ha tenido cuatro definiciones, siendo la última la propuesta en el año 2012, llamada la definición de Berlín (tabla 3)7.
Factores de riesgo para desarrollo de sdra
| Factores directos de daño | Factores indirectos de daño |
| Neumonia grave | Sepsis y shock septico (sin foco pulmonar) |
| Contusión pulmonar | Shock hipovolémico y politransfusiones |
| Quemadura de vía aérea | Pancreatitis aguda grave |
| Aspiración gástrica masiva | Gran quemado |
| Contusión pulmonar |
*No olvidar lo importante de obtener una anatomía clara del daño pulmonar, para clasificar el SDRA como potencialmente o no reclutable.
Definición de Berlin del Sindrome de Distres Respiratorio Agudo
| Tiempo | Menos de 7 días de evolución o síntomas respiratorios nuevos o empeoramiento. |
| Imágenes torácicas | Opacidades bilaterales, no explicadas completamente por derrame, colapso lobar/pulmonar o nódulos. |
| Origen del edema | Insuficiencia respiratoria no completamente explicada por insuficiencia cardíaca o exceso de volemización. |
| Oxigenacion PaO2/FiO2 | Incluye PEEP ≥ 5cmH2O o CPAP ≥5cmH2O (puede incluir VMNI) |
| Leve | 200mmHg <PaO2/ FiO2 ≤ 300mmHg |
| Moderado | 100mmHg <PaO2/ FiO2 ≤ 200mmHg |
| Grave | PaO2/ FiO2 ≤ 100mmHg |
*No olvidar lo importante de obtener una anatomía clara del daño pulmonar, para clasificar el SDRA como potencialmente o no reclutable.
Pese a los avances en los últimos 20 años, tanto en el conocimiento de su fisiopatología como en los tratamientos asociados, la mortalidad del SDRA sigue siendo cercana al 50%, concentrándose principalmente en los pacientes con mayor deterioro del intercambio gaseoso, caracterizados por relaciones PaO2/FiO2 menores a 150mmHg8.
Al ser una enfermedad heterogénea, los modelos experimentales animales son complejos y diversos, no existiendo modelos perfectos. Es necesario, por lo tanto, que para lograr entender la base de los estudios clínicos en pacientes con SDRA, tengamos un conocimiento de los modelos animales que sustentan las teorías actuales de la fisiopatología del SDRA en el adulto, ya que muchos de estos, no necesariamente traducen lo que verdaderamente sucede en los seres humanos.
2Modelos animales en el síndrome de distrés respiratorio agudoLos modelos animales en el SDRA se pueden dividir en dos grupos, dependiendo si el daño inducido es directo o indirecto.
Los modelos directos son a base de remoción del surfactante. Dentro de estos, los más utilizados son el lavado alveolar repetido y el daño por humo/quemadura, también existe la instilación directa de lipopolisacárido o ácido hidroclorhidrico, pero en general son menos utilizados. En los modelos indirectos están la producción de sepsis mediante inyección endovenosa de endotoxina, el modelo de ácido oleico, la ligación y punción cecal o isquemia/reperfusión mesentérica.
Realizar una revisión exhaustiva de los modelos animales en el SDRA está más allá de los fines de esta revisión, sin embargo, describiremos brevemente los más utilizados.
El modelo de lavado repetido consiste en un lavado pulmonar con 30-40ml/Kg de solución salina isotónica a temperatura corporal. Este procedimiento se repite alrededor de 8 veces9. El mecanismo de daño es debido a depleción de surfactante, la cual causa aumento en la tensión superficial alveolar con el consiguiente colapso de éste. El problema fundamental de este modelo es que no logra reproducir fehacientemente la fisiopatología del SDRA del humano adulto. Los cambios en la permeabilidad vascular son modestos y no hay reclutamiento de neutrófilos a nivel pulmonar10. Este es uno de los modelos en los que se basa, por ejemplo, la teoría del open lung approach.
Los modelos que se basan en la creación de sepsis son más complejos y los animales pueden fallecer si el inóculo bacteriano o la respuesta inflamatoria desarrollada es demasiado elevada. La respuesta inflamatoria sistémica desarrollada produce secuestro de polimorfonucleares y aumento de la permeabilidad vascular a nivel pulmonar, edema intersticial, aumento de la presión de arteria pulmonar y trombosis intravascular11, por lo que es notablemente similar al SDRA desarrollado en humanos adultos.
Finalmente, el modelo del ácido oleico, corresponde a un modo indirecto de desarrollo de SDRA en animales y simula la falla respiratoria asociada a la embolia grasa. Se inyecta una dosis de ácido oleico entre 0,06 a 0,15ml/kg lentamente en la aurícula derecha, con el objetivo de desarrollar una falla respiratoria hipoxémica. El mecanismo de daño es poco claro, se piensa que se debe a la unión de este ácido a las membranas biológicas, aunque también es directamente tóxico a las células endoteliales. Las limitaciones de este modelo son en relación al desconocido rol de la inflamación en el desarrollo de la falla respiratoria, el daño pulmonar tiende a mejorar en algunas horas y el daño producido es imprevisible12.
3Ventilación mecánica en el síndrome de distrés respiratorio agudo3.1Mecanismos de daño en la ventilación mecánicaLa ventilación normal pulmonar se realiza mediante la activación de la musculatura respiratoria, generando presión negativa a nivel pleural y provocando que el aire de la atmosfera ingrese a la vía aérea de forma pasiva.
En la ventilación a presión positiva, el excesivo estrés mecánico desarrollado, puede infringir daño tanto en los pulmones sanos como en los enfermos13. Este daño es producido mediante dos mecanismos principales: a) Sobredistención de las unidades (tejido) abiertas, b) percusión repetida de vías aéreas terminales cerradas (apertura y cierre cíclico), también conocida como atelectrauma.
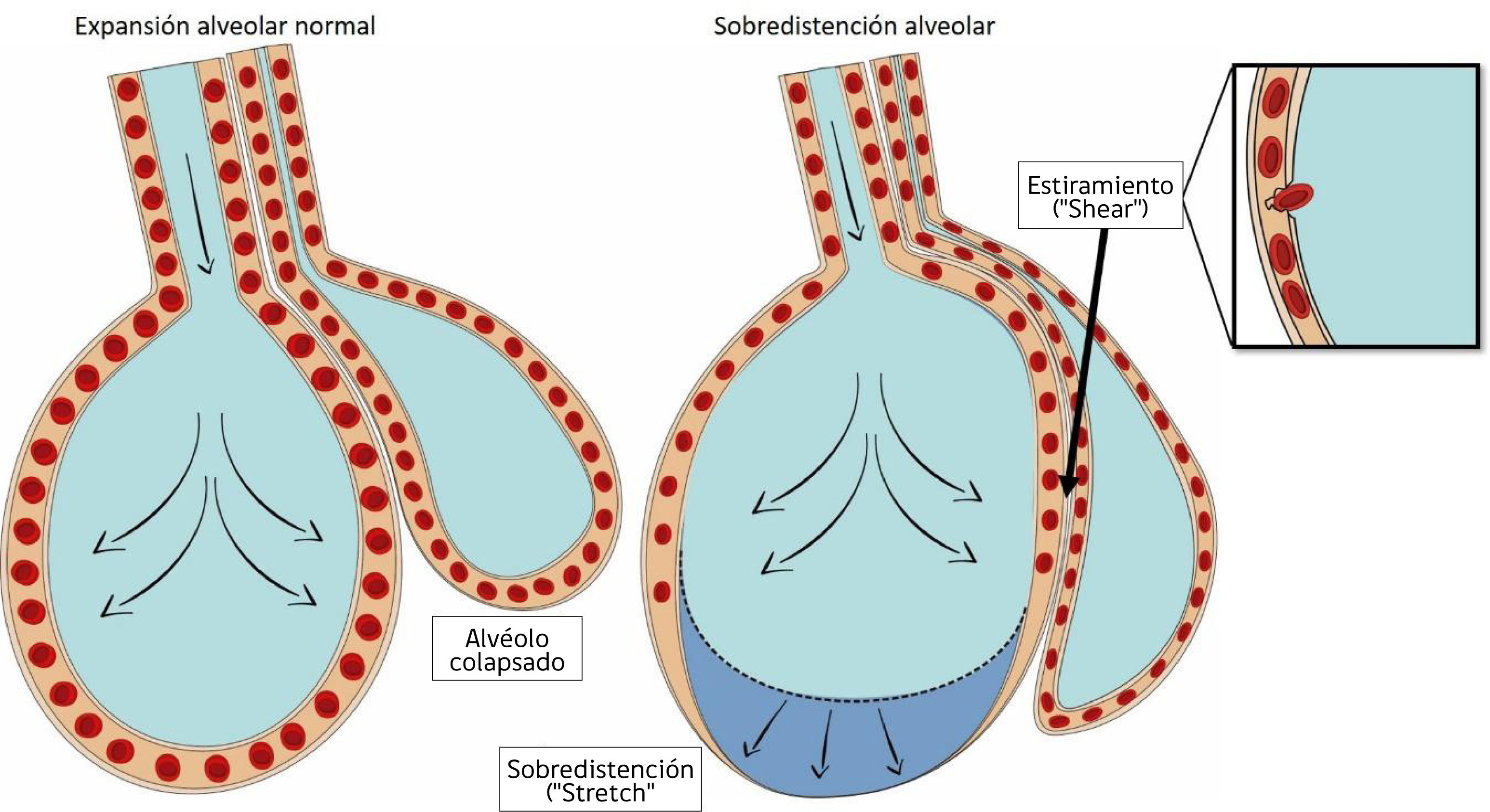
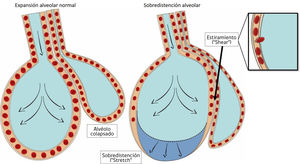
La aplicación repetida de presión positiva por sobre la capacidad de distención de las unidades alveolares, genera rotura de la barrera epitelial14 (fig. 1), fenómeno que aparece principalmente cuando no se utiliza presión positiva al final de la espiración (PEEP) la cual tiende a disminuir la inestabilidad alveolar15.
Formas de daño a nivel alveolar.
A la izquierda de la figura se aprecia un alvéolo normalmente expandido junto a un alvéolo colapsado a su derecha. Tanto un exceso de volumen corriente (volutrauma) como exceso de presión (altos niveles de PEEP) pueden generar sobredistención o “stretch”, nótese en la figura el colapso a nivel capilar, que provoca redistribución del flujo sanguíneo en la figura de la derecha. El mecanismo de atelectrauma se basa en el estiramiento o “shear” anormal y repetitivo de los alvéolos colapsados, mediante fuerzas que actúan de forma tangencial, en este caso el alvéolo que se distiende más allá de su capacidad normal, debido a que comparte parte del citoesqueleto con el alvéolo colapsado adyacente, genera fuerzas de cizallamiento. Esta fuerza afecta principalmente a las células del endotelio, provocando incluso ruptura de éste.
Cuando una fuerza externa se aplica a un objeto que tiene características elásticas se generan dos tipos de fuerza: el stress y el strain. El stress, corresponde a la fuerza interna, definida como la presión aplicada por unidad de área y que tiene su equivalente clínico con la presión transpulmonar. El barotrauma es consecuencia de un stress excesivo.
Por otro lado, la microestructura pulmonar se deforma más cuando se moviliza desde el colapso hacia su apertura (fig. 1), independiente si esta apertura genera o no sobredistención. Esta “deformación” o strain causa daño a nivel citoesquelético, generando fracturas a nivel endotelial, epitelial y en la matriz intercelular16. El equivalente clínico del strain corresponde a la relación entre el volumen corriente y la capacidad residual funcional (Vt/CRF).
Las zonas dependientes del pulmón son las más expuestas a estas fuerzas mecánicas, debido a la presencia de mayor inestabilidad alveolar. Específicamente en estas zonas, actúa una tercera fuerza mecánica de estiramiento o “shear” (fig. 1), que son fuerzas aplicadas de forma tangencial a la arquitectura alveolar17.
Durante la aplicación del volumen corriente, existen 2 etapas principales donde se puede generar daño. La primera corresponde a la aplicación del flujo, cuya velocidad puede generar mayores fuerzas de estiramiento en el tejido colapsado. La segunda corresponde a la presión transpulmonar generada al final de la inspiración, la cual debido a la heterogeneidad del compromiso en el SDRA afecta más a algunas zonas que otras18. La aproximación clínica más a mano corresponde a la presión de distención o driving pressure (diferencia entre el PEEP total y la presión meseta), la cual debe mantenerse en valores menores a 15cmH2O19.
3.2Terapia ventilatoriaLa limitación de las presiones meseta de la vía aérea Presión de distención o driving pressure<15cmH20 y la limitación del volumen corriente (6-8ml/Kg peso ideal), son pilares fundamentales en el otorgamiento de una ventilación mecánica que tienda a disminuir el daño producido por ésta.
Para lograr optimizar esta ventilación protectora, se han propuesto dos terapias fundamentales: la ventilación en posición prono y la ventilación oscilatoria de alta frecuencia.
3.3Ventilación en posición pronoEl uso exitoso de la posición prono en pacientes con falla respiratoria aguda grave hipoxémica fue descrito en el año 197620. Se describieron 4 casos de pacientes politraumatizados y quirúrgicos que desarrollaron insuficiencia respiratoria hipoxémica grave, que respondió a los cambios de posición. Tal como lo describen los autores, era popularmente conocida la relación entre cambios de posición y la oxigenación de los pacientes.
Durante la ventilación en posición prono, tanto en pacientes normales como en pacientes con SDRA, la distribución de la aireación es más heterogénea, en una compleja mezcla entre la forma del pulmón y fuerza gravitacional, lo que genera una disminución de la relación entre gas/tejido desde el esternón hacia las vértebras21. Esto se traduce no sólo en una mejoría de la oxigenación, sino que también en una mejoría de la ventilación, disminuyendo a su vez la sobredistención y la inestabilidad alveolar.
Varios estudios publicados entre los años 2001 y 2009, con más de 1500 pacientes reclutados en total, no encontraron mejoría en la mortalidad. Sin embargo, el metanálisis de estos y otros estudios menores, reclutando 1867 pacientes en total, sugería un beneficio significativo en la mortalidad en pacientes con PaO2/FiO2 menor a 140mmHg22.
Recientemente, en el estudio PROSEVA23, Guérin y cols. estudiaron un total de 474 pacientes con PaO2/FiO2<150mmHg, PEEP ≥5cmH2O y FiO2≥0.6, ventilados con un volumen corriente promedio de 6.1mL/kg de peso corporal previsto. El estudio demostró una disminución notable en la mortalidad a 28 y 90 días en el grupo de pacientes ventilados en prono (23.6% vs 41%, p <0.001, a 90 días), con una reducción absoluta en la mortalidad del 17% y una reducción del riesgo relativo del 50%.
¿Cuál es la explicación para tan drástico cambio? En primer lugar, está el tiempo en que los pacientes se mantuvieron en posición prono, en el primer estudio de Gattinoni y cols24, los pacientes mantuvieron la posición en prono sólo por 7-9hrs. diarias, en cambio en el estudio de Guerin y cols. se mantuvieron por 17hrs. y durante aproximadamente 4 días.
El limitado tiempo de uso de prono en los primeros estudios, se basa en disminuir la exposición de los pacientes a úlceras por presión en cara, torso y pelvis. El grupo de Gattinoni en su primer estudio de pacientes en posición prono encontró que hasta el 36% desarrollaban úlceras por presión en sitios expuestos24. Con el advenimiento de mejores técnicas de cuidados de prevención es posible disminuir el desarrollo de ulceras por presión en este grupo de pacientes25. En el estudio APRONET26 sobre prevalencia del uso de la posición prono en paciente con SDRA, menos del 6% de los pacientes desarrollaron úlceras por presión, sin embargo, este porcentaje tan bajo se debe muy probablemente no sólo al incorrecto diagnóstico de estas condiciones, sino que además el bajo reporte que se realiza27.
En segundo lugar, destaca que la estrategia de ventilación protectora fue aplicada en forma más estricta, incluyendo un alto porcentaje de pacientes con uso de bloqueadores neuromusculares, finalmente el estudio PROSEVA se concentró en el grupo de pacientes con SDRA más grave, el grupo de pacientes más beneficiados por esta maniobra según el metaanálisis antes publicado.
3.4Ventilación de alta frecuencia oscilatoriaLa ventilación de alta frecuencia oscilatoria o VAFO, corresponde a un tipo de ventilación que presuriza el sistema ventilatorio mediante una presión media de vía aérea relativamente constante, entrega pequeños volúmenes corrientes a altas frecuencias entre 3 a 15Hz. La VAFO limita, por lo tanto, no sólo la sobredistención durante la aplicación del volumen corriente, sino que además, mediante una mayor presión de vía aérea aplicada casi de forma constante, mitiga el atelectrauma28. Corresponde a un tipo de ventilación que se fundamenta en el open lung approach, en donde se pretende realizar un reclutamiento máximo de las unidades alveolares, manteniéndolas abiertas a la menor presión posible (PEEP decreciente).
Hasta el año 2013 existían dos estudios aleatorizados. El estudio de Derdak y cols29. incluyó 148 pacientes distribuidos para las ramas de VAFO vs ventilación convencional. Se incluyeron pacientes que tenían un valor de PaO2/FIO2 menor a 200 con más de 10cmH2O de PEEP en ventilación convencional. La mortalidad del grupo de ventilación convencional fue notablemente alta (63% vs 48%), pese a esto, ninguna de las metas estudiadas obtuvo diferencias estadísticamente significativas. En el segundo estudio, Bollen y cols30. estudiaron 61 pacientes que cumplían con los criterios de SDRA. El estudio tuvo problemas de enrolamiento y tuvo que ser detenido antes. No hubo diferencias en términos de mortalidad a los 30 días, ambas mortalidades eran notablemente altas, siendo para el grupo control de 67% vs 77% en el grupo VAFO.
Recientemente se han publicado dos grandes estudios de uso de VAFO en pacientes con SDRA.
El estudio OSCILLATE31 enroló pacientes con SDRA moderado a grave, en un total de 39 Unidades de Cuidados Intensivos de Canadá, EE.UU., Arabia Saudita, India, México, Reino Unido y Chile. Se aplicó una maniobra de reclutamiento a 40cmH2O de presión media de vía aérea (PMVA) por 40 segundos y posteriormente se aplicaron PMVA relativamente elevadas (media de 31cmH2O en el día 1), la cual se tituló de acuerdo a la gravedad de la hipoxemia. Esto, lamentablemente fue un grave error, ya que la potencial sobredistención impuesta a los pacientes, no solamente interponía un trabajo extra al corazón derecho, sino que también podía oscurecer un potencial beneficio de la limitación del atelectrauma, es decir, se podían estar reclutando y manejando pacientes con bajo potencial de respuesta a estas maniobras.
El estudio fue detenido antes, debido a la alta mortalidad en el grupo VAFO 47% vs el grupo de ventilación convencional 35% (RR 1.33, 95% IC 1.09-1.64), es más, el uso de vasopresores y de reanimación con fluidos fue mayor en el grupo estudio, lo que también pudo haber mermado en la sobrevida de estos pacientes.
El estudio OSCAR32 publicado en el mismo número de la revista The New England Journal of Medicine logró enrolar 795 pacientes con criterios de SDRA en 29 UCIs exclusivamente en el Reino Unido. Los pacientes fueron manejados según dos algoritmos que manejaban de manera independiente la oxigenación (en base a FiO2 y aumento de las presiones de vía aérea) y la ventilación (en base a cambios en la frecuencia en Hz y en el volumen ciclado), intentando mantener un pH ≥7.25. Al final del estudio no hubo diferencia estadísticamente significativa entre los grupos VAFO y ventilación convencional (41.7% vs 41.1% RR 1.02, 95% IC 0.86-1.20). Entre ambos estudios destaca la gran diferencia en términos de mortalidad, lo que podría estar en relación a las menores presiones de vía aérea utilizadas entre el estudio OSCAR (media de 26.9cmH2O) vs el estudio OSCILLATE (31cmH2O) lo que pudo haberse relacionado a sobredistención alveolar. Además, sólo entre el 27-29% de los pacientes en el estudio OSCILLATE utilizó bloqueadores neuromusculares al inicio del estudio, lo que aumentó a un 46% en el grupo VAFO y a un 31% en el grupo control en el primer día. En cambio, en el estudio OSCAR el 52.5% de los pacientes en el grupo VAFO y el 41.6% de los pacientes en el grupo control utilizaron bloqueadores neuromusculares en el primer día. El uso de bloqueadores neuromusculares, como se verá más adelante, se ha relacionado a mejoría en la mortalidad.
Un metaanálisis publicado recientemente, con participación de varios miembros del grupo OSCILLATE no logró asociar la utilización del VAFO con mejoría de la mortalidad en pacientes con SDRA33, donde el mismo grupo insiste en que aún hay posibilidades de utilizar exitosamente la VAFO en el subgrupo de pacientes más graves. En nuestro grupo creemos que los pacientes con mayor potencial de reclutamiento, es decir, pacientes cuyo SDRA en el TAC de tórax es difuso o los pacientes que mejoran la compliance del sistema respiratorio luego de una maniobra de reclutamiento, podrían beneficiarse de esta terapia, limitando así el uso de PEEP elevados a morfologías pulmonares que respondan a PEEP (fig. 2).
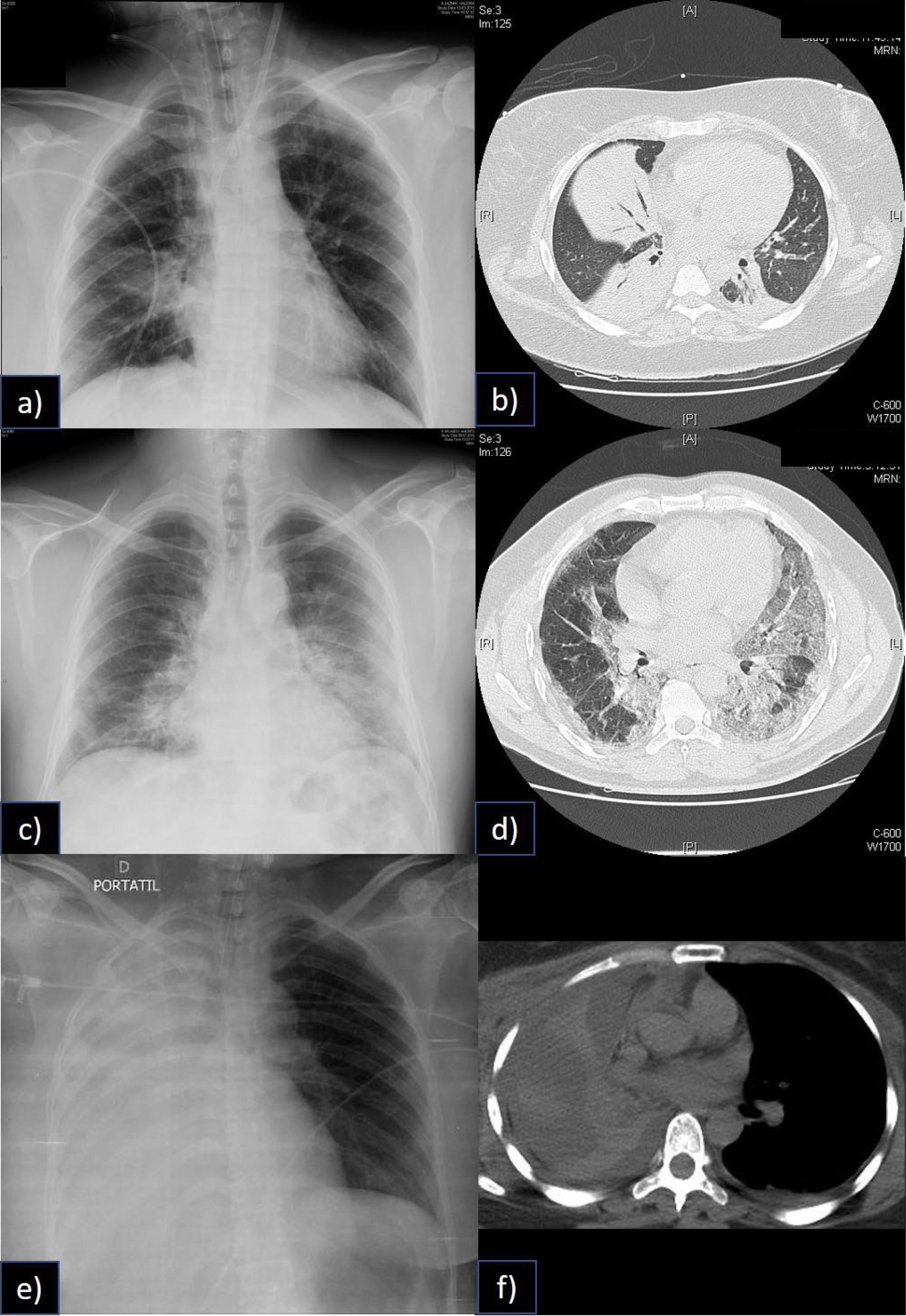
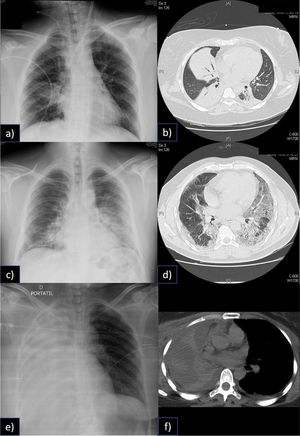
Heterogeneidad del Síndrome de distrés Respiratorio Agudo y la falla respiratoria catastrófica
En la figura, a) se aprecia una condensación en el lóbulo inferior derecho del paciente, sin embargo, en b) la tomografía computada muestra tres condensaciones, rodeadas de parénquima pulmonar normal. En un paciente que no tenía potencial de reclutamiento y que, por lo tanto, altos niveles de PEEP provocaban sobredistención. Fue manejado con volúmenes corrientes y PEEP bajos, además de ECCO2R.
En c) se aprecia una condensación en lóbulo inferior y superior izquierdos, así como también en base derecha. En la tomografía computada (d), se aprecia que el componente no es tan denso como en b, este paciente mostró buena respuesta al reclutamiento y a la ventilación en posición prono. Ambos pacientes desarrollaron una falla respiratoria catastrófica, sin embargo, las aproximaciones terapéuticas fueron notablemente distintas. En el tercer caso en e) podemos apreciar una atelectasia completa de todo el pulmón derecho (f), que también llevó al paciente a falla respiratoria catastrófica, sin ser un SDRA.
Sin embargo, y pese al razonamiento lógico anterior, actualmente no se ha encontrado ninguna evidencia de que el uso de VAFO disminuya la mortalidad en pacientes con SDRA, más aún, existen otras terapias que pueden ofrecerse a estos pacientes, mucho antes de pensar en la utilización de VAFO.
4Terapias extracorpóreasPese a los grandes avances en materia de ventilación mecánica, aún existe un grupo de pacientes con SDRA cuya mortalidad es elevada. En este grupo de pacientes se debe pensar en realizar una oxigenación extracorpórea con la finalidad de lograr un reposo pulmonar total en una ventilación casi apneica. A continuación, discutiremos la oxigenación de membrana extracorpórea (ECMO) y la extracción extracorpórea de dióxido de carbono.
4.1Oxigenación de membrana extracorpóreaMucho tiempo ha pasado de la primera publicación de uso de ECMO en pacientes adultos del año 1979, cuya mortalidad tanto en el grupo de ventilación mecánica como de ECMO bordeaba el 90%. No sólo el entendimiento de la fisiopatología del SDRA ha mejorado, sino que también la tecnología asociada, haciendo que un procedimiento limitado a casos de salvataje sea ahora notablemente más asequible y con menores complicaciones asociadas34.
En el estudio CESAR35 realizado en el Reino Unido, un total de 180 pacientes en 68 centros fueron aleatorizados a recibir ventilación mecánica convencional o ECMO. Uno de los hallazgos más notables de este estudio fue que de los 90 pacientes asignados a ECMO, una vez transferidos al centro de referencia, sólo 68 recibieron ECMO, es decir, 22 pacientes mejoraron sin su uso. Del grupo de pacientes que recibieron ECMO 57 de 90 alcanzaron el objetivo doble de sobrevida o ausencia de incapacidad comparado con 41 de 87 pacientes en el grupo de ventilación convencional (RR 0.69 95% IC 0.05-0.97, p=0.03). La mortalidad a los 6 meses, sin embargo, fue similar en ambos grupos ECMO vs ventilación convencional (57/90 vs 47/87, p=0.07).
En relación a la pandemia de influenza A H1N1 del año 2009, se publicaron un sinnúmero de estudios mostrando la experiencia a nivel mundial del uso de ECMO en este grupo de pacientes, sin embargo, ninguno de ellos corresponde a un RCT.
Otros grupos han demostrado éxito con el manejo en ventilación mecánica convencional en este mismo grupo de pacientes. Grasso y cols36., asumiendo que la forma más correcta de adecuar la ventilación protectora es en relación a la elastancia pulmonar, en vez de la elastancia torácica que habitualmente medimos, midieron la presión transpulmonar a través del uso de un catéter esofágico en un grupo de pacientes con SDRA grave secundario a influenza A H1N1. De los 14 pacientes transferidos al centro coordinador de ECMO, 7 de ellos tenían presiones meseta transpulmonares menores a 25cmH2O (16.6±2.9), pese a que el grupo total tenía niveles de presión meseta del sistema respiratorio por sobre los 31cmH2O. En estos 7 pacientes se aumentó el PEEP hasta 25cmH2O (±1.7cmH2O) mejorando notablemente la oxigenación. Para poder lograr mantener esta ventilación protectora, el volumen corriente de los pacientes se tuvo que restringir aún más, por lo que fueron sometidos a extracción extracorpórea de CO2, la presión de distención o driving pressure era de un promedio aproximado de 15cmH2O, pero la presión de distención transpulmonar de sólo 3cmH2O.
Recientemente se ha publicado el estudio EOLIA37 en donde se aleatorizaron un total de 240 pacientes con SDRA grave (PaO2/FiO2<80mmHg o <50mmHg dependiendo del tiempo y acidosis grave), a recibir tratamiento mediante ventilación mecánica protectora vs ECMO.
El estudio se detuvo antes de lograr reclutar los 331 pacientes debido a futilidad concluida a través de un análisis interino. Cuando el estudio se detuvo, la mortalidad del grupo ECMO fue 35% vs 46% del grupo de ventilación mecánica protectora (RR 0.76, 95% IC 0.55-1.04, p=0.09). Sin embargo, se destaca en este estudio que un total de 35 (28%) pacientes del grupo control debieron recibir ECMO debido a hipoxemia refractaria, el promedio de días en que se demoraron en conectar al paciente a ECMO fue de 4 días (mediada 6.5±9.7 días), este grupo de pacientes no sólo tenía mayor mortalidad a 60 días (57%), sino que además tenían presiones de distención mayores que el grupo control (20.2±6.1 vs 16.6±5.3 cmH2O).
Si bien es cierto, el estudio concluye que el uso de ECMO no se relaciona a mejoría de la mortalidad a los 60 días, existió un alto porcentaje de entrecruzamiento de pacientes graves, lo que puede limitar las conclusiones. En el manejo de estos pacientes en extremo graves, las terapias previas al uso de ECMO no deben mantenerse por más de 48-72hrs., sin antes tomar la decisión de trasladar al paciente a un establecimiento con experiencia en terapias de circulación extracorpóreas o de instaurar su uso.
4.2Remoción extracorpórea de CO2 y ventilación mecánica ultraprotectoraComo se ha mencionado, la restricción del volumen corriente es fundamental en el manejo SDRA. Respecto a esto, es importante recalcar que el ajuste del volumen corriente se realiza por “kilo de peso ideal” del paciente y no en relación a la capacidad residual funcional del pulmón enfermo, dada la posibilidad de provocar hiperinsuflación pese a tener volúmenes corrientes restringidos38. Debido a esto, algunos grupos han acuñado el término ventilación mecánica ultraprotectora para referirse al uso de volúmenes corrientes menores a 6mL/kg ideal.
La extracción extracorpórea de CO2 (ECCO2R) se ha propuesto no solamente como una estrategia para minimizar el daño pulmonar inducido por la ventilación mecánica, sino que también para evitar, por ejemplo, que pacientes con enfermedad bronquial obstructiva crónica (EPOC) sean ventilados de forma invasiva.
Terragni y cols39. usando un método extracorpóreo de extracción de CO2 demostraron que disminuyendo el volumen corriente a menos de 6ml/kg se logra disminuir notablemente las presiones meseta, correlacionándose con mejoría de la oxigenación y mejor compliance del sistema respiratorio. La extracción de CO2también se relaciona con disminución de la presión de arteria pulmonar, disminuyendo el estrés del ventrículo derecho y el trabajo respiratorio.
El CO2 debido a sus propiedades de difusión, puede ser extraído rápidamente de la sangre a través del paso por una membrana de polimetilpenteno, la cual actúa como una membrana alveolar. Los flujos necesarios para extraerlo son habitualmente bajos y más cercanos a los que necesita una terapia de reemplazo renal continuo, es decir, cercanos a 500mL/min. Evidentemente la tasa de extracción del CO2 dependerá de la producción de CO2 (VCO2) y los equipos habitualmente extraen cerca del 25% de la VCO2.
Debido al bajo flujo necesario para su extracción, se han introducido equipos sin bomba arterio venosa, los cuales dan flujos mayores a 500mL/min, sin embargo, necesitan mayor presión arterial media, índices cardíacos mayores y anticoagulación. A su vez, generan más hemólisis y activación de la coagulación.
También se han intentado métodos extracorpóreos no dependiente de membrana para extraer el CO2, mediante el uso del buffer tris-hidroximetil aminometano o THAM. Sin embargo, la osmolaridad del plasma aumenta notablemente y, por lo tanto, es necesario regularizar la osmolaridad mediante ultrafiltración continua40.
En un estudio aleatorizado, Bein y cols.41 estudiaron un total de 79 pacientes, dividiéndolos en grupos de ventilación convencional con volúmenes corrientes de 6ml/kg(n=39) y otro grupo con una estrategia más agresiva de limitación del volumen corriente (3ml/kg) en el cual debieron utilizar un extractor extracorpóreo de CO2 para evitar la acidosis respiratoria grave (n=40). Los pacientes sometidos a ECCO2R tuvieron PaO2/FiO2 levemente más bajas que el grupo control (152±37 vs 168±37, p=0.04), y en ambos grupos la presión meseta de vía aérea era menor a 30cmH2O, con una presión de distensión menor a 13cmH2O.
Se estudiaron factor de necrosis tumoral alfa, IL-6 e IL-8 en suero de pacientes sometidos a ECCO2R (n=20) y al grupo control (n=15), la única citocina en demostrar caída significativa entre ambos grupos fue la IL-6 a las24 y 48h post inicio de la aleatorización, sin embargo, a las 72hrs. los niveles en ambos grupos de pacientes eran similares. No hubo diferencia estadísticamente significativa en días libres de ventilador a los 28 o 60 días, tampoco en mortalidad hospitalaria.
Actualmente, es difícil conocer el rol futuro que tendrá el ECCO2R, básicamente por que los equipos, las cánulas, los circuitos y el oxigenador utilizados tienen altos costos, salvo en condiciones de arriendo. Debido a esto, las instituciones que disponen de equipo de ECMO, pueden preferir la instalación de cánulas de ECMO monolumen y así obtener los flujos necesarios para extraer el dióxido de carbono. Por otro lado, la evidencia aún no es satisfactoria y debería limitarse su uso a casos específicos graves, principalmente fallas respiratorias catastróficas ventilatorias, donde una ventilación mecánica protectora sea poco sustentable.
5Terapias farmacológicas en el manejo del SDRA5.1Bloqueadores neuromuscularesla justificación detrás del uso de bloqueadores neuromusculares (BNM) es debido a los efectos en la disminución de la inflamación sistémica y pulmonar, consumo de oxígeno, gasto cardíaco y al aumento del reclutamiento alveolar42. Eliminando el esfuerzo ventilatorio del paciente, se pretende disminuir la asincronía paciente-ventilador, la cual se ha asociado a colapso alveolar, aumento de las presiones alveolares y transpulmonares, lo que a su vez puede causar sobredistención en zonas no dependientes y daño pulmonar43.
El estudio ACURASYS44, evaluó el uso de BNM en 340 pacientes con SDRA y PaO2/FiO2<150mmHg. Se aleatorizaron los pacientes a recibir infusión de cisatracurio (37,5mg/h) o placebo por un total de 48 horas, junto a ventilación mecánica protectora. Las mortalidades a 28 días, UCI e intrahospitalarias no demostraron diferencias estadísticamente significativas, el Hazard ratio de mortalidad a los 90 días fue de 0.68 (95% IC 0.48-0.98, p=0,04), aunque la mortalidad absoluta a los 90 días no tuvo diferencia estadísticamente significativa (31.6% grupo BNM vs 40.7% placebo, p=0,08).
Un metaanálisis publicado posteriormente concluye que las infusiones cortas de BNM (cisatracurio) se asocia a menor mortalidad intrahospitalaria (RR, 0.72; 95% IC, 0.580.91, p=0,005; I2=0), sin embargo, hay que destacar que los tres estudios analizados en este metaanálisis provenían del mismo grupo45.
La mantención de la ventilación espontánea en pacientes ventilados, principalmente en pacientes con SDRA se ha asociado a mayores presiones transpulmonares y asincronía, ambos fenómenos asociados a mayor daño pulmonar46. El uso por tiempos cortos de BNM parece no estar asociado, por otro lado, a mayor debilidad muscular44.
5.2CorticoidesEl razonamiento del uso de los corticoides se basa en limitar la fase proliferativa del SDRA disminuyendo el daño que genera la cicatrización de esta fase a nivel pulmonar47. El estudio LaSRS, el mayor de los estudios publicados hasta ahora, evaluó el tratamiento con metilprednisolona en 180 pacientes con diagnóstico de SDRA entre los días 7 y 21 de evolución. El uso de metilprednisolona se asoció a mejoría en la oxigenación y días libres de ventilador, sin embargo, no hubo diferencias entre la mortalidad a los 60 ni 180 días48.
Los metaanálisis más recientes no han demostrado mejoría en la mortalidad49, no obstante incorporan estudios donde se utilizaban dosis elevadas de corticoides (120mg/kg de metilprednisolona o su equivalente), intervención actualmente considerada obsoleta50.
Si bien es cierto, en el estudio LaSRS no hubo mayor incidencia de infecciones en el grupo de pacientes tratados con metilprednisolona, en los pacientes sometidos a este tratamiento de manera tardía (>14 días) hubo mayor desarrollo de debilidad muscular y mortalidad48.
5.3Óxido nítricoEl óxido nítrico (NO) inhalado, actúa como un vasodilatador selectivo a nivel pulmonar. Atraviesa rápidamente la barrera de la célula epitelial alveolar, entrando en la célula muscular lisa estimulando la guanilciclasa (GMPc). Esta vasodilatación selectiva redistribuye el flujo de las áreas no ventiladas hacia áreas ventiladas, disminuyendo el shunt intrapulmonar. El NO que difunde a la circulación se une rápidamente a la hemoglobina siendo inactivado, por lo que no genera vasodilatación sistémica51.
Pese a la concordancia demostrada, en términos de mejoría de la oxigenación y disminución de la presión de arteria pulmonar, lamentablemente no se ha logrado demostrar mejoría en términos de mortalidad, asociándose además a insuficiencia renal aguda52,53. Aún así, es posible considerarlo en pacientes hipoxémicos refractarios que tengan contraindicación a otro tipo de terapias como ventilación en posición prono o ECMO, aunque su costo se mantiene aún elevado54.
6ConclusiónLa falla respiratoria catastrófica corresponde a un cuadro clínico de alta mortalidad, teniendo su expresión clínica más relevante en el síndrome de distrés respiratorio agudo, cuya mortalidad es cercana al 50%8. En las últimas décadas se ha avanzado notablemente en el conocimiento de su fisiopatología como también en los mecanismos del daño asociados a la ventilación mecánica invasiva.
Los modelos de experimentación animal tienen sus limitaciones, muchos de ellos se basan en la depleción de surfactante, que genera básicamente colapso alveolar, condición clínica que no necesariamente se expresa en los adultos. Aun así, en el último tiempo se ha podido determinar que el sistema respiratorio bajo presión positiva se expone a dos mecanismos principales de daño, por un lado, la sobredistención de unidades alveolares abiertas y por otro la apertura y cierre de unidades alveolares de forma cíclica. En estos mecanismos actúan al menos tres fuerzas generadoras de daño strain, stress y shear.
En la aplicación de terapias, probablemente la intervención más importante en la actualidad, en conjunto con limitar las presiones meseta y volumen corriente del paciente, es la ventilación en posición prono, donde la fisiopatología es congruente y estudios recientes han demostrado mejoría en la sobrevida, principalmente en los pacientes más graves.
Las terapias extracorpóreas han ido desarrollándose enormemente, principalmente al amparo de la pandemia de influenza A H1N1. Con equipos cada vez más compactos, mejores tecnologías en la creación de membranas de intercambio gaseoso y eventualmente menores costos. Es posible que a futuro el ECMO pueda masificarse, a pesar de que las potenciales complicaciones de estos pacientes hacen necesario que siempre sean manejados en un centro asistencial de alta complejidad con experiencia. Como alternativa, el ECCO2R requiere de menor equipamiento, menor necesidad de anticoagulación y es más económico; pero sólo nos permite optimizar la ventilación protectora, no permitiendo oxigenar al paciente.
La ventilación oscilatoria de alta frecuencia, exitosa en el manejo del SDRA del niño, lamentablemente no ha tenido el éxito esperado en adultos. Sin embargo, la evidencia es baja y además, es posible plantear la apertura y cierre cíclico de las unidades alveolares no sea el mecanismo fundamental de daño en el adulto.
Entre las alternativas farmacológicas de manejo del SDRA existen los bloqueadores neuromusculares, los cuales si bien es cierto tienen estudios limitados, en general se acepta su utilización dentro de los primeros días del SDRA, con la idea de maximizar la adaptación del paciente al ventilador, evitando de esta forma que el esfuerzo del paciente cree presiones transpulmonares elevadas. El uso de corticoides es aún controversial, pese a que parece adecuado plantearlo en los pacientes con SDRA prolongado. El óxido nítrico no ha demostrado mejoría en la mortalidad, tiene costo elevado y está asociado a insuficiencia renal, por lo tanto, debería reservarse para pacientes que no han respondido a terapias previas como ventilación en posición prono, relajo neuromuscular, o que tengan contraindicación para soporte extracorpóreo.
Los equipos locales deben definir pautas claras en el manejo del SDRA, dando énfasis en limitar las presiones de vía aérea (presión meseta, driving pressure), evitar esfuerzos respiratorios inefectivos del paciente, no exceder el uso de BNM y limitar el uso de infusiones endovenosas. Junto con lo anterior, otorgar ventilación en posición prono temprano al paciente con SDRA grave y saber cuando han fracasado los esfuerzos locales, para instalar o derivar a un paciente para soporte avanzado, es esencial.
7Declaración Conflicto de InterésLos autores declaran no tener ningún tipo de conflicto de interés.
Se agradece el aporte de Natalia Torres, por su trabajo y creación de la figura 1.
[¿Qué hemos aprendido de falla respiratoria catastrófica?-Daniel Morales y cols.]
[¿Qué hemos aprendido de falla respiratoria catastrófica?-Daniel Morales y cols.]
[¿Qué hemos aprendido de falla respiratoria catastrófica?-Daniel Morales y cols.]
[¿Qué hemos aprendido de falla respiratoria catastrófica?-Daniel Morales y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 140-150]
[¿Qué hemos aprendido de falla respiratoria catastrófica?-Daniel Morales y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 140-150]
[REV. MED. CLIN. CONDES - 2019; 30(2) 140-150]
[REV. MED. CLIN. CONDES - 2019; 30(2) 140-150]
[REV. MED. CLIN. CONDES - 2019; 30(2) 140-150]
Estiramiento
(“Shear”)
Sobredistención
(“Stretch”
Alvéolo
colapsado
e-ISSN: 2531-0186/ ISSN: 0716-8640/© 2019 Revista Médica Clínica Las Condes. Este es un artículo Open Access bajo la licencia CC BY-NC-ND (http://creativecommons.org/licenses/by-nc-nd/4.0/). https://doi.org/ 10.1016/j.rmclc.2019.02.001.