El uso de antimicrobianos es muy frecuente en las unidades de cuidados intensivos (UCI) donde, a menudo, su indicación es innecesaria, inapropiada o subóptima, contribuyendo a la selección y diseminación de cepas bacterianas resistentes. Esto ha hecho necesario el desarrollo de diversas estrategias para reducir su consumo, como son el de-escalar la terapia y reducir la duración de los esquemas antibióticos. La adscripción a estos planteamientos disminuye el uso de antimicrobianos de amplio espectro y acorta su uso con similar eficacia. El uso de guías clínicas, esquemas de administración y dosificación adecuados para garantizar la obtención de los objetivos farmacocinéticos/farmacodinámicos y el apropiado control del foco infeccioso, debiesen implicar resultados óptimos preservando altos rangos de seguridad, con el menor costo en términos de presión selectiva de los antimicrobianos.
El objetivo de esta revisión narrativa es definir estos conceptos y resumir la evidencia disponible que apoya su uso en las UCIs.
The use of antimicrobials is very common in intensive care units (ICU), a setting were their indication is often unnecessary, inappropriate or suboptimal, contributing to the selection and dissemination of resistant bacterial strains. This has led to designed different strategies focused to avoid the overuse such as de-escalation and shortened treatment duration. Adherence to these approaches decreases the use of broad-spectrum antimicrobials and shortens their use with similar effectiveness. The use of clinical guidelines, adequate dosing and administration regimens to ensure the attainment of pharmacokinetics/ pharmacodynamics targets and the appropriate source control, should cause optimal results while preserving high safety ranges, with the lowest cost in terms of antibiotic-related selection pressure.
The objective of this narrative review is to define these strategies and summarize the available evidence that supports their use in ICUs.
El uso de antibióticos es muy frecuente en las Unidades de Cuidados Intensivos (UCI). Como ejemplo de ello, el estudio EPIC II1, publicado el año 2009 evaluó prevalencia puntual de infecciones en cuidados críticos en 14414 pacientes, observó que un 51% de ellos fue considerado como infectado y un 70% estaba recibiendo tratamiento antibiótico. Los pacientes que cursaron con infección demostrada presentaron el doble de mortalidad.
Diversos estudios señalan que entre un 30 a 60% de los antimicrobianos utilizados en las UCIs son innecesarios, inapropiados o subóptimos2–4. Esto ha contribuido, en forma importante, al aumento de la resistencia a antibióticos; estudios de corte epidemiológico, han objetivado que el desarrollo y diseminación de cepas bacterianas multiresistentes impacta más allá de los límites de las unidades de pacientes críticos, alcanzando a todos los servicios hospitalarios5–7. La resistencia antimicrobiana se ha constituido en uno de los principales determinantes pronósticos entre pacientes portadores de infecciones severas, en concomitancia con factores de virulencia de los agentes involucrados y las situaciones de comorbilidad del hospedero8. Un reporte reciente estima que la mortalidad relacionada a la resistencia antibiótica, para el año 2050, ascenderá a 10 millones de personas, si no se toman medidas globales que confronten este problema9.
Se han descrito una serie de factores que llevan al médico de UCI a tener un bajo umbral para iniciar terapia antibiótica, entre éstos la severidad de la enfermedad, la disfunción orgánica y el estado de inmunoparálisis1. Además, están usualmente alteradas las barreras anatómicas debido a procedimientos diagnósticos y terapéuticos, sumado a la inserción de dispositivos como catéteres y drenajes que muchas veces son fuente de infecciones graves. Es frecuente también que el médico frente a la incertidumbre diagnóstica de un cuadro séptico -dada la limitada utilidad del examen clínico y de los exámenes complementarios-, inicie una terapia antibiótica empírica con miras a obtener mejores resultados10. Todos estos son elementos que impulsan abuso en la prescripción, tanto en frecuencia como en espectro, sin embargo, así como la guía de la Surviving Sepsis Campaign promueve el uso precoz de antibióticos, también recomienda la evaluación diaria de la terapia con miras a de-escalar y promueve el uso de biomarcadores que faciliten el acortamiento de la duración de los tratamientos10.
Por todo lo anterior, ha sido necesario el desarrollo de diversas estrategias para optimizar el uso de antibióticos y con ello mejorar los resultados clínicos, disminuir la presión selectiva sobre cepas de bacterias, reducir los efectos adversos y controlar los costos11.
1.2Estrategia 1: Adecuada elección de Tratamiento EmpíricoLa elección inicial de antimicrobianos en el contexto de una UCI, habitualmente, implica una decisión que muchas veces ocurre sin toda la información requerida. La aproximación a esta problemática obliga a que el intensivista considere elementos como la epidemiología local, el foco infeccioso sospechado y los agentes más frecuentemente involucrados en él.
Accesoriamente, los factores del hospedero resultan fundamentales en este proceso. Elementos como comorbilidades y condiciones que involucren riesgo de portación de organismos multirresistentes (uso previo de antimicrobianos, hospitalización o procedimientos invasivos recientes, usuario de dispositivos, residente de unidades de larga estancia, entre otros.), deben ser explorados y considerados al momento de definir la terapia. De igual manera, la elección del fármaco implica conocer las características farmacocinéticas y farmacodinámicas, que permitan asegurar su concentración óptima en el sitio de infección.
Recomendar esquemas específicos no resulta posible, dado que, la variabilidad de los factores mencionados resulta en que cada institución de salud deba elaborar políticas y guías clínicas que incluyan propuestas sobre terapias empíricas según su realidad local.
1.3Estrategia 2: Control de focoExisten ciertos cuadros clínicos donde identificar y controlar el foco infeccioso, de manera oportuna, es tanto o más importante que iniciar rápidamente la terapia o establecer el espectro y dosis de antimicrobianos12. Desbridar, drenar, remover un cuerpo extraño, permitirá restablecer la fisiología normal y lograrlo en forma precoz tendrá implicancias en términos pronósticos13,14. Además, muchas veces, permitirá la obtención oportuna y representativa de muestras microbiológicas. Con ello se facilitará el desarrollo de las estrategias tendientes a mejorar el uso de los antibióticos en UCI, como son el de-escalar y el utilizar esquemas acortados de terapia.
1.4Estrategia 3: De-escalamiento1.4.1¿Qué entendemos por de-escalar?Consensuar el concepto de de-escalamiento resulta complejo. Una revisión sistemática que incluyó 14 estudios (2 estudios aleatorizados y 12 estudios de cohorte) evidenció que no existe una definición uniforme para este término. En estas publicaciones, el de-escalamiento se asoció con: reducción del uso de antimicrobianos de amplio espectro, disminución del número de antibacterianos y menor duración de la terapia15,16. Leone et al.17 utilizaron el concepto de “antibiótico principal” para referirse, generalmente, a un β-lactámico de espectro extendido que, en concomitancia con otro fármaco destinado al tratamiento del Staphylococcus aureus resistente a la meticilina (SAMR) y un “antimicrobiano acompañante” (aminoglucósidos, fluoroquinolona o macrólido), definiría una aproximación antimicrobiana empírica inicial. Los autores describieron “de-escalar” como reemplazar el antimicrobiano principal por uno de menor espectro, suspendiendo los antibióticos acompañantes y la terapia anti SAMR de no ser éstas necesarias.
Un aspecto adicional y relevante en términos del proceso de de-escalamiento es comprender qué significa amplio espectro o espectro reducido. Un grupo francés exploró esta temática, intentando llegar a un consenso y elaboró una clasificación de los betalactámicos de acuerdo con su espectro e impacto ecológico (tabla 1). A través de una encuesta a 28 médicos considerados expertos (intensivistas, microbiólogos e infectólogos), utilizando metodología Delphi, construyeron una clasificación de seis categorías que puede resultar de utilidad para comprender el concepto de reducción de espectro y estandarizar nuevos estudios18.
Clasificación de los betalactámicos de acuerdo con su espectro e impacto ecológico
| Categoría | Molécula | Proporción acuerdo (%)* |
|---|---|---|
| 1 | Amoxicilina | 100 |
| 2 | Amoxicilina/clavulámico | 88 |
| 3 | Cefalosporinas 3a generación | 81 |
| 4 | Piperacilina/tazobactam, cefalosporinas 4a generación, cefalosporinas antipseudomónicas | 71 |
| 5 | Ertapenem | 81 |
| 6 | ImipenemMeropenem | 85 |
Indica la proporción de los miembros del Panel de Expertos que estuvieron de acuerdo con las moléculas incluidas en cada categoría de la clasificación. Modificado de Weiss 201518.
De esta forma, se entiende de-escalamiento como el proceso que permite, tan pronto como la información microbiológica esté disponible, ajustar el espectro y el número de antimicrobianos al mínimo indispensable para lograr el adecuado control microbiológico del cuadro infeccioso.
1.4.2¿Es frecuente de- escalar?Aunque de-escalar es imperativo en el buen manejo de antibióticos, particularmente entre pacientes graves, la frecuencia con que esto ocurre es inferior a lo esperado. Un estudio que evaluó el impacto del de-escalamiento de la terapia empírica, en este caso suspender antibacterianos acompañantes y/o reducir el espectro, estableció que, tras el análisis de 628 pacientes con sepsis o shock séptico, este proceso se llevó a efecto sólo en 219 (35%) de ellos, pese a que la información microbiológica disponible permitía hacerlo en el 76% de los casos19.
Los factores asociados con una actitud clínica tendiente al de-escalamiento son: disponer de información microbiológica consistente (hemocultivos positivos, muestras invasivas del tracto respiratorio u otros), terapia antibiótica empírica inicial apropiada19–21, uso de antimicrobianos empíricos de amplio espectro, uso de antibióticos según guías clínicas en pacientes neutropénicos, terapia empírica con múltiples antimicrobianos combinados21,22, bajas puntuaciones o variaciones favorables en scores de severidad de la enfermedad (al inicio de terapia, al de-escalar y al quinto día de tratamiento) y resolución clínica en el momento de la toma de la decisión19,21. Por el contrario, infecciones por agentes multi-resistentes, procesos polimicrobianos, múltiples infecciones concomitantes e infecciones graves sin agente identificado (por ejemplo, infecciones intra-abdominales) se asociaron a mayor probabilidad de no de-escalar o de, incluso, ampliar el espectro19,23,24 (tabla 2).
Factores asociados a de-escalar terapia antibiótica
| Que facilitan |
|---|
| Terapia empírica inicial apropiada |
| Terapia empírica de amplio espectro |
| Respetar guías clínicas |
| Tratamiento inicial con múltiples antibióticos “acompañantes” |
| Disponibilidad de cultivos positivos |
| Baja severidad de la enfermedad al: |
| -Basal |
| -Momento de de-escalar |
| -Día 5 de terapia |
| Que dificultan |
| Aislar microorganismo multi-resistente |
| Infecciones polimicrobianas |
| Infección intra-abdominal |
Tabah et al. en su revisión sistemática comparó la mortalidad para grupos con de-escalamiento versus aquellos con terapia antimicrobiana sin modificaciones. En 1688 pacientes, objetivó que el proceso de de-escalamiento se constituyó en un factor protector (RR 0.68; IC95% 0.52-0.88). Sin embargo, dada la variabilidad de su definición en los distintos estudios y a que los factores asociados con tendencia a de-escalar son marcadores de mejoría clínica y/o de menor riesgo de fracaso del tratamiento, esto no debe interpretarse como una asociación causal entre el de-escalar y reducción de mortalidad. De todas maneras, permite afirmar que su aplicación no es dañina, ya que, al analizar por separado los trabajos, ninguna publicación reportó menor sobrevida entre los pacientes sometidos a de-escalamiento15.
Otro estudio multicéntrico, aleatorizado, de no inferioridad, abierto que incluyó 9 UCIs y 116 pacientes con sepsis severa y terapia apropiada inicial, quienes fueron distribuidos aleatoriamente a continuar con la terapia antimicrobiana propuesta o a de-escalar y cuyo endpoint primario fue la estadía en UCI, mostró que entre aquellos individuos sometidos a de-escalamiento, se registró mayor duración tanto de la terapia antibiótica (14.1 vs. 9.9 días) como de su permanencia en UCI (3.4 días, IC95% 1.7 – 8.5). De igual manera, habría un incremento en la tasa de sobreinfecciones para este grupo (27% vs 11%, p=0.03). No se observó diferencia en cuanto a deterioro clínico ni en mortalidad a 90 días17.
En este escenario, la apreciación racional de los efectos beneficiosos del proceso de de-escalamiento no son respaldados, por ahora, con estudios con buen nivel de evidencia. Sin perjuicio de lo anterior, no existen fundamentos categóricos que obliguen a mantener terapias prolongadas y de amplio espectro por cuanto el de-escalamiento no resultaría una estrategia deletérea en relación con el pronóstico de los pacientes en que se aplica.
1.4.4¿Cómo impacta el de-escalamiento en resistencia antibiótica?Pocas son las publicaciones que han estudiado el impacto de la reducción del espectro antimicrobiano en la resistencia antibiótica. Uno de los estudios en los que se evaluó este tema, evidenció que la aparición de enterobacterias productoras de betalactamasas de espectro expandido (BLEE) era menos frecuente en el grupo en el que se de-escaló (1.16% versus 8.7%)25. Otros autores no lograron demostrar que el uso de esta estrategia se asocie a un número menor de aislamientos microbiológicos de agentes multi-resistentes (SAMR, Enterobacterias BLEE y S. maltophilia)26. Al concentrar nuestra mirada en UCI, uno de los trabajos que exploró este tema, tampoco relacionó el de-escalamiento con selección de multi-resistencia para el período de observación27.
De esta manera, es claro que estimar el impacto de estas medidas, particularmente a nivel individual o en espacios de tiempo abreviados, resulta especialmente difícil o al menos improbable; para lograrlo será necesario extender el seguimiento de manera de hacer evidentes los cambios de la ecología local situación que, hoy en día, no muestra iniciativas sistemáticas de estudio.
1.4.5¿Cómo impacta el de-escalamiento en costos?Otro de los elementos de alta relevancia en los cuidados intensivos son los costos que involucran las intervenciones. Al explorar este punto, los reportes muestran un resultado favorable al seguir pacientes en los cuales se procedió a de-escalar en la terapia antibiótica. El menor gasto observado no parece estar relacionado con el menor precio de fármacos de espectro más reducido, más bien correspondería a una disminución general relacionada con los mismos factores ya propuestos en relación con disposición del los clínicos a de-escalar, esto es la menor severidad de la condición de base y la mejoría clínica. Accesoriamente, el registro de estadía entre quienes fueron de-escalados, mostró estancias más cortas tanto en UCI como a nivel hospitalario global, situación que reduce ostensiblemente costos sanitarios para la cohorte observada18.
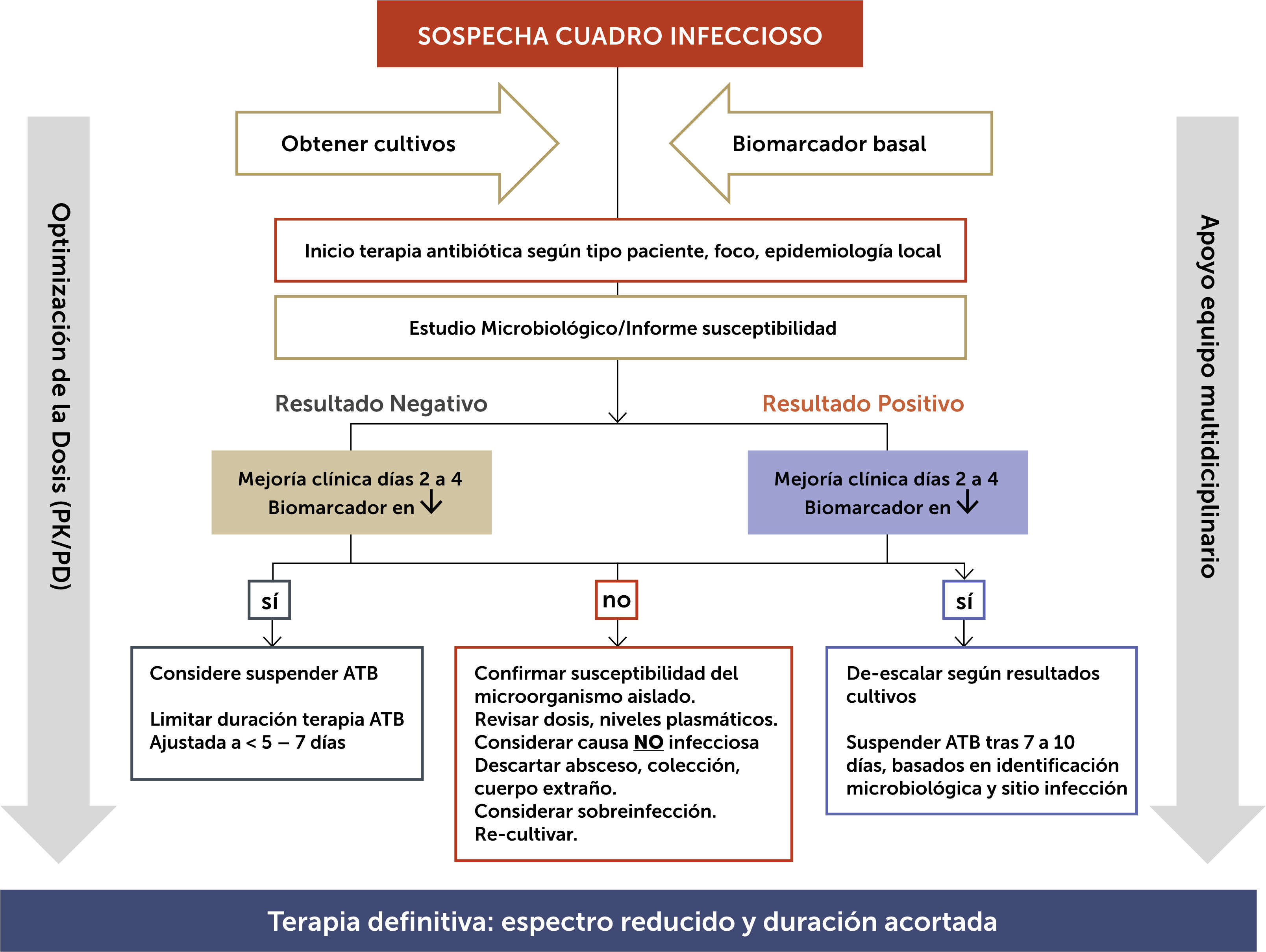
1.5Estrategia 4: Acortamiento e interrupción de la terapia antimicrobianaAsí, ya revisados los resultados del de-escalamiento, pareciera que más allá de la reducción en el espectro y la suspensión de antimicrobianos inadecuados y acompañantes, acortar las terapias y su interrupción oportuna impactaría, en mayor grado, en la reducción de la presión selectiva y el consiguiente daño ecológico, sin alterar los resultados clínicos esperados en el tratamiento de las infecciones, independiente de la condición de gravedad subyacente28,29. Una forma de implementación de este proceso se puede observar en la figura 1.
Algoritmo de decisión frente a paciente que requiere inicio de terapia antibiótica empírica
Adaptado de Kollef 201454.
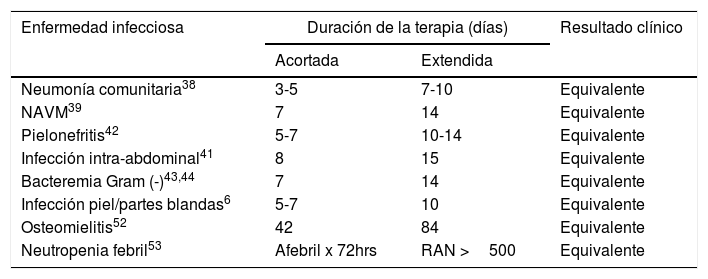
Una aproximación actual al tratamiento de las infecciones establece la necesidad de considerar la utilización de esquemas acortados que incidan favorablemente sobre la presión selectiva y la multi-resistencia a antibióticos. La evidencia disponible permite afirmar que estos enfoques terapéuticos resultan igualmente efectivos que aquellos que implican mayor duración31,31. Sin perjuicio de ello, en el enfrentamiento de pacientes críticos diseñar estudios que permitan dilucidar su utilidad, colisiona con una cultura que promueve esquemas extensos en cuanto a espectro y tiempo de uso. Para este grupo de pacientes, el seguimiento con biomarcadores, específicamente procalcitonina, ha permitido acortar significativamente la duración de la terapia antibiótica en UCI con reducción de la mortalidad32–36. Esto, más que demostrar la utilidad de los biomarcadores, ha puesto en evidencia que la menor duración posible de una terapia anti-infecciosa resulta segura incluso en pacientes severamente enfermos. El uso abreviado de antibióticos está refrendado para varias localizaciones (tabla 3). En neumonía comunitaria, la recomendación es tratar por 5 a 7 días, ya que prolongar la duración de la terapia no mejora los resultados, esto incluye pacientes severamente enfermos, con excepción de inmunosuprimidos37. Otra publicación, esta vez de un trabajo aleatorizado, de no inferioridad, no mostró diferencias en éxito clínico entre pacientes tratados por cinco días y buena evolución clínica y aquellos sometidos a duración de terapia definida por sus tratantes38.
Infecciones para las cuales la terapia antibiótica acortada ha demostrado ser equivalente, en eficacia, a las terapias extendidas
| Enfermedad infecciosa | Duración de la terapia (días) | Resultado clínico | |
|---|---|---|---|
| Acortada | Extendida | ||
| Neumonía comunitaria38 | 3-5 | 7-10 | Equivalente |
| NAVM39 | 7 | 14 | Equivalente |
| Pielonefritis42 | 5-7 | 10-14 | Equivalente |
| Infección intra-abdominal41 | 8 | 15 | Equivalente |
| Bacteremia Gram (-)43,44 | 7 | 14 | Equivalente |
| Infección piel/partes blandas6 | 5-7 | 10 | Equivalente |
| Osteomielitis52 | 42 | 84 | Equivalente |
| Neutropenia febril53 | Afebril x 72hrs | RAN >500 | Equivalente |
Abreviaciones: NAVM neumonía asociada a ventilación mecánica, RAN recuento absoluto de neutrófilos
Adaptado de Spellberg 201730.
Del mismo modo, en neumonía asociada a ventilación mecánica, la recomendación actual de la guía IDSA es 7 días de tratamiento. Esto incluye infecciones por bacilos Gram negativos no fermentadores. Al comparar el uso de esquemas de 7 días vs 10 a 15 días no se observó mayor mortalidad, recurrencia o falla terapéutica39.
En infección intra-abdominal, existen 2 trabajos aleatorizados que apoyan el uso de esquemas antibióticos acortados. El primero de ellos (STOP-IT trial), incluyó un número reducido de pacientes graves y comparó terapia antibiótica de 4 vs 8 días, sin observar diferencias ni en resultado clínico ni en recurrencia, todo ello en pacientes con adecuado control del foco40. Al revisar estudios en pacientes gravemente enfermos, para la misma localización y con control de foco, el estudio prospectivo, aleatorizado, multicéntrico, DURAPOP no mostró beneficios en seguridad y eficacia entre quienes fueron sometidos a terapias de 15 vs 8 días41.
Para otras localizaciones, como por ejemplo pielonefritis aguda42, infecciones de piel y partes blandas31 e inclusive bacteremia no complicada por bacilos Gram negativos43,44, la evidencia es similar. Sin embargo, aún existen ciertas patologías donde no es posible entregar recomendaciones basadas en la evidencia que impacten en la reducción de la duración del tratamiento antimicrobiano, así como también, existen condiciones cuyo foco infeccioso es difícil de tratar (meningitis, endocarditis, presencia de dispositivos y/o prótesis, colecciones inaccesibles a drenaje, osteomielitis, fascitis necrotizante, empiema, neumonía cavitada, bacteremia por S. aureus, entre otros) y que requieren uso de tratamientos antibióticos más extendidos (tabla 4). En estos casos, la participación e interacción con el equipo de infectología será crucial en la definición terapias antibióticas acotadas y cuyos resultados sean los mejores posibles.
Factores que influyen en la duración de la terapia antibiótica en UCI
| Terapia acortada (5-7d) | Considerar terapia extendida |
|---|---|
| Sin comorbilidad mayor | Inmunosupresión |
| Terapia inicial adecuada | Terapia inicial inadecuada |
| Patógeno bajo riesgo, CIM baja | Patógeno alto riesgo (S. aureus, cándida, BNF?, MDR?) |
| Relación PK/PD favorable | Mala llegada a tejido, foco endovascular |
| Control foco adecuado | Falla en control foco, cuerpo extraño |
| Ausencia material extraño | Respuesta clínica parcial o muy lenta |
| Mejoría clínica rápida |
Abreviaciones: CIM concentración inhibitoria mínima, BNF bacilo no fermentador, MDR multi-resistente.
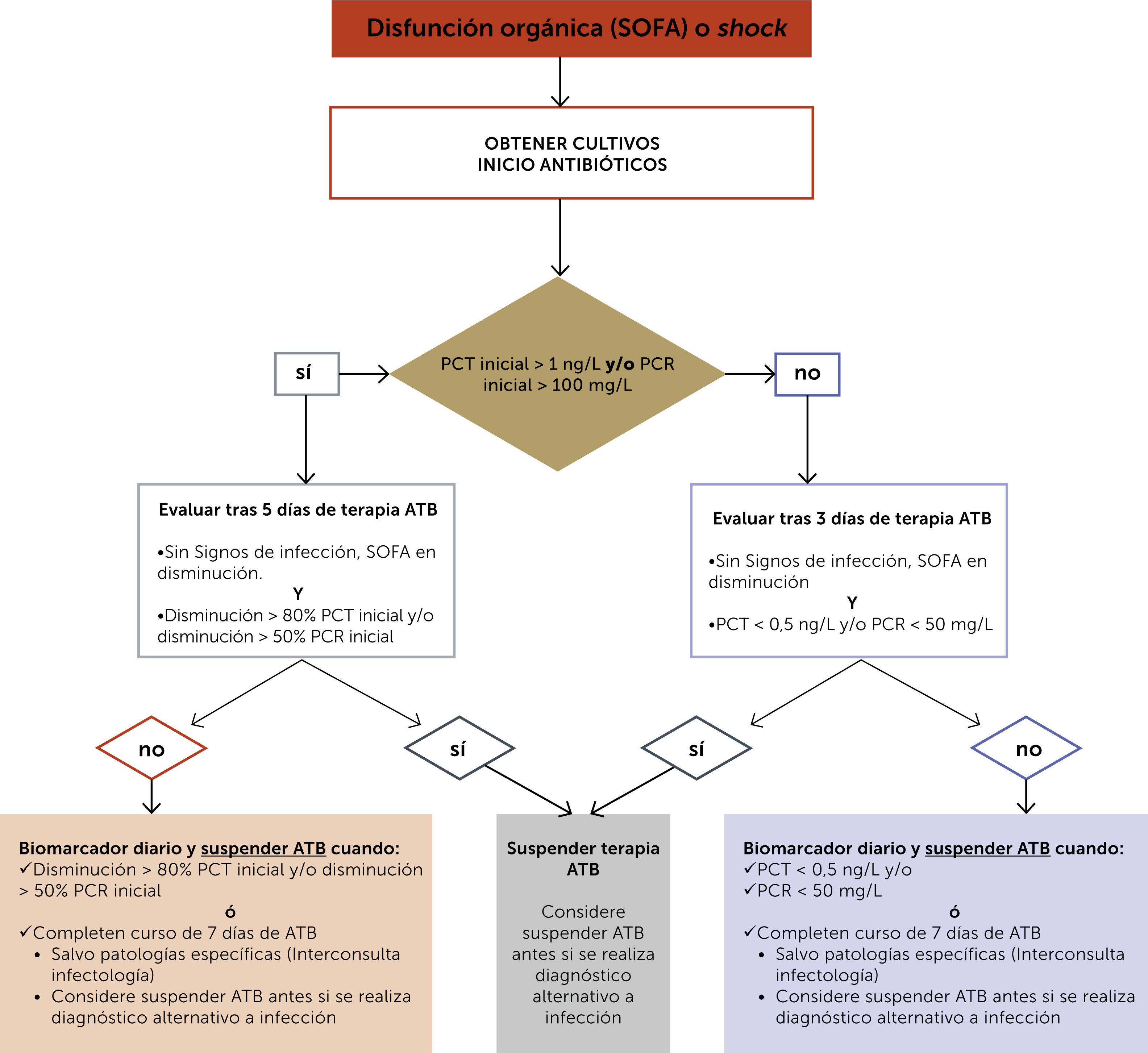
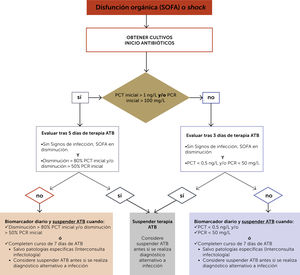
Con todo esto, es posible sugerir que la conducta esperable en el enfrentamiento de pacientes gravemente enfermos e infectados debe asegurar el balance entre una terapia efectiva y de corta duración, con las implicancias ya descritas en términos de presión selectiva y daño ecológico. Para ello, la utilización de protocolos activos de suspensión de antimicrobianos, con o sin biomarcadores, ha demostrado ser eficaz en su instauración (fig. 2)45.
Protocolo activo de suspensión de antimicrobianos basado en biomarcadores
Abreviaciones: SOFA: Sequential Organ Failure Assessment; PCT: procalcitonina; PCR: proteína C reactiva; ATB: antibiótico.
Adaptado de Oliveira 201345.
Una solución propuesta por diversos autores a este ingente problema ha sido el desarrollo de lo que actualmente conocemos como stewardship, concepto que sin una traducción literal implica la responsabilidad de cuidar y organizar algo que no es propio46.
A mayor ahondamiento que permita facilitar su comprensión, la definición de stewardship de antibióticos corresponde a un conjunto de intervenciones que contemplan múltiples dimensiones, todas ellas consideradas como “buenas prácticas en el uso de antimicrobianos”. Esta aproximación contempla dimensiones que componen un Programa de Optimización de Antibióticos (PROA), denominación que recibe, en la práctica y en su fase operativa el stewardship. Ahora bien, los PROA se componen de cuatro ámbitos esenciales: ¿qué hacer?, ¿cómo hacerlo?, ¿por qué se hace? y ¿quién lo hace? A manera de ejemplo del ¿cómo hacerlo?, podemos mencionar estrategias de cómo los profesionales de la salud adoptan estas intervenciones: en forma persuasiva (educación, retroalimentación, uso de guías terapéuticas) o de manera restrictiva (prescripción con aprobación previa u órdenes de suspensión automáticas)47. Otra de las características claves de los PROA es que corresponde a una aproximación multidisciplinaria, es este el caso la dimensión del ¿quién lo hace?, que involucra, particularmente en pacientes críticos, la comparecencia de distintos profesionales como los farmacéuticos clínicos, microbiólogos, infectólogos, epidemiólogos especialistas en control de infecciones e intensivistas48. De igual manera, es relevante a los efectos del éxito de las medidas de ajuste de la terapia antibiótica, la identificación rápida del microorganismo causal, situación que se ha visto facilitada por la incorporación de nuevas opciones diagnósticas49,50. En este punto es necesario recalcar que la comunicación eficiente entre el laboratorio de microbiología y el clínico es fundamental para mejorar los resultados clínicos.
La implementación de un PROA en cuidados intensivos implica, además de lo expuesto, reconocer los cambios fisiopatológicos que ocurren en los pacientes críticos, haciendo de la participación de los intensivistas, una pieza fundamental en su diseño.
La incorporación de estos programas logra un uso adecuado de los antimicrobianos mediante la integración de las dimensiones descritas, que resulta en un uso apropiado en tiempo, espectro e indicación y adecuada en dosis, llegada al sitio de infección y menor duración posible de la terapia propuesta. En este sentido se debe tener en cuenta también que los cambios fisiopatológicos en los pacientes graves obligan a considerar que las dosis habituales pueden resultar inapropiadas por exceso o déficit, situación que ha posicionado a conceptos farmacocinéticos y farmacodinámicos (PK/PD) y al monitoreo de niveles plasmáticos de antimicrobianos como elementos claves a considerar en relación con la prescripción de estos medicamentos51.
2ConclusionesLos antibióticos son de amplio uso en las unidades de cuidados intensivos y habitualmente su utilización estereotipada resulta en tratamientos innecesarios, inapropiados o subóptimos e implican emergencia de resistencia microbiana y daño ecológico. La individualización de la terapia es imprescindible, para ello aplicar el concepto de stewardship, mediante un programa de optimización de antibióticos (PROA), permite regular y favorecer la adecuada prescripción. El trabajo multidisciplinario, el acceso oportuno a información de buena calidad y una acabada evaluación clínica permiten, eficazmente, direccionar esquemas, ajustar dosis, de-escalar y evitar toxicidad; así como también, limitar la duración del tratamiento. Es la duración más breve posible de la terapia antibiótica la estrategia más eficiente en lograr resultados clínicamente óptimos, de plena seguridad para el paciente y con la menor presión selectiva.
[Estrategias para el uso de antibióticos en pacientes críticos-José Miguel Arancibia]
3Conflicto de InterésSin conflictos de interés que declarar.
e-ISSN: 2531-0186/ ISSN: 0716-8640/© 2019 Revista Médica Clínica Las Condes. Este es un artículo Open Access bajo la licencia CC BY-NC-ND, (http://creativecommons.org/licenses/by-nc-nd/4.0/). [REV. MED. CLIN. CONDES - 2019; 30(2) 151-159]. Revista Médica Clínica Las Condes, https://www.journals.elsevier.com/revista-medica-clinica-las-condes. https://doi.org/10.1016/j.rmclc.2019.03.001