El cáncer de cuello uterino es un problema de salud mundial, presentando una alta tasa de incidencia y mortalidad, sobre todo en países en vías de desarrollo. La historia natural del cáncer de cuello uterino es bien conocida, desde una infección por virus papiloma humano (VPH), progresión a lesiones precancerosas y posteriormente el desarrollo del cáncer invasor. Es una enfermedad que puede ser prevenible, mediante programas de vacunación y de tamizaje bien realizados, permitiendo controles adecuados y tratamientos quirúrgicos de enfermedades preinvasoras. La Organización Mundial de la Salud (OMS) en el año 2020 propuso la iniciativa global de eliminar el cáncer cervical, planteando la estrategia 90-70-90. Se requiere la vacunación del 90% de las jóvenes menores a 15 años, lograr al menos dos tamizajes de VPH antes de los 45 años y que el 90% de las pacientes con lesiones de alto grado y/o cáncer tengan tratamiento oportuno. El objetivo de esta revisión es describir la realidad nacional e internacional de la prevención del cáncer de cuello uterino, destacando los avances en prevención, tanto primaria como secundaria, para lograr disminuir su incidencia.
Cervical cancer is a global health challenge, with high incidence and mortality rates, particularly in countries with lower levels of human development. The progression of cervical cancer is well understood, from human papillomavirus infection to precancerous lesions and invasive cancer. This disease can be prevented through effective vaccination and early detection programs, which allow timely treatments, especially for pre-invasive conditions. In 2020, the World Health Organization launched a global initiative to eliminate cervical cancer, introducing the 90-70-90 strategy. This intervention seeks 90% vaccination coverage in girls under 15 years of age, at least two HPV screenings before the age of 45, and timely treatment for 90% of diagnosed patients. This paper aims to describe national and international updates in cervical cancer prevention, highlighting the progress of primary and secondary prevention with regards to decreasing its incidence.
El cáncer cervicouterino continúa siendo un problema de salud pública a nivel mundial. Según datos de GLOBOCAN 2022, se diagnosticaron 662 301 mujeres con cáncer de cuello uterino ese año y se observó una mortalidad mayor al 50%, correspondiendo a 348 874 casos. La incidencia estandarizada ajustada por edad es de 14,1 casos por 100 000 mujeres por año, con una tasa de mortalidad de 7,1 muertes por 100 000 mujeres1. Es el cuarto cáncer más frecuente en las mujeres después del cáncer de mama, pulmón y colorrectal y el noveno en mortalidad por cáncer en ambos sexos1. En países con escaso desarrollo económico es el cáncer con mayores tasas de incidencia y muerte2. Nos enfrentamos ante un cáncer en que la inequidad económica influye enormemente presentando diferencias tan abismantes como incidencias de 2,2/100 000 en Iraq vs 84,6/100 000 en algunos países en África oriental y mortalidades de 1/100 000 en Suiza y 55,7/100 000 en África oriental. En los países de altos ingresos las tasas de incidencia han ido disminuyendo y se han mantenido bajas en los últimos 15 años, en cambio, en los países de bajo y mediano desarrollo económico estas tasas se han mantenido estables e incluso han ido aumentando2.
Un estudio latinoamericano concluyó que entre el 2014 y el 2017, Paraguay, Venezuela y Brasil tuvieron las tasas más altas de mortalidad por cáncer de cuello uterino, mientras que Puerto Rico tuvo las tasas más bajas. En general, la mayoría de los países de ALC analizados (Chile, Colombia, Cuba, El Salvador, México, Nicaragua, Panamá, y Perú) mostraron tendencias a la baja en la mortalidad por cáncer de cuello uterino durante todo el período3.
En Chile, la incidencia ha disminuido pero sigue siendo un problema de salud, con tasas de incidencia de 11,3/100 000 y mortalidad de 5,2/100 0004. Es la primera causa de muerte por cáncer en mujeres entre 30 a 54 años, edad en que las mujeres trabajan y son madres de niños pequeños, esto es de una trascendencia social y pérdida económica muy importante. Presentan la mayor tasa de años de vida potencialmente perdidos (AVPP) por cáncer en nuestro país, que corresponde a127,6/100 000 en el año 2018 comparado con Inglaterra que es de 21/100 000 en ese mismo periodo5,6. Es una patología GES (Garantía Explícita en Salud), donde por ley, en Chile se garantiza la atención de la paciente desde su sospecha activa, con la toma de citología cervical o test de Papanicolau (PAP) entre los 25 y los 65 años, con una periodicidad de toma cada 3 años, tipificación VPH, diagnóstico y tratamiento definitivo, además de protección financiera. Complementariamente se suma al programa nacional de inmunizaciones, incluyéndose la vacunación contra el VPH en población infantil como parte de las estrategias de prevención del cáncer de cuello uterino7.
Prevención y detección precozEn general, la prevención primaria en cáncer es la identificación y eliminación de los agentes que causan cáncer. Estudios epidemiológicos evidencian que los factores medioambientales; tales como químicos, radiación y virus juegan un rol importante en la incidencia de cáncer. Los factores de riesgo para el cáncer cervicouterino son: edad de la primera relación sexual, número de parejas sexuales, parejas previas con infección VPH, cigarrillo, bajo nivel socio económico, deficiencia de micronutrientes y dieta insuficiente en verduras y frutas. Se torna importante entonces identificar factores de riesgo, potenciar la educación sexual en las familias, colegios y centros de atención, junto a la inclusión de la vacunación contra VPH8,9.
La prevención secundaria consiste en el diagnóstico precoz de la enfermedad, aún sin manifestaciones clínicas, y la instauración de un tratamiento oportuno y efectivo. Este cáncer es ideal para la realización de un tamizaje exitoso, ya que la historia natural de la infección viral es larga (5 a 10 años) y mediante exámenes no invasivos permite la pesquisa de enfermedad precancerosa.
Los programas de patología cervical bien implementados y con coberturas sobre 80%, como en los países nórdicos, han disminuido en forma importante la incidencia y mortalidad del cáncer cervicouterino10. No existe país que haya reducido la mortalidad de esta patología sin un programa de prevención exitoso. En Chile, desde el año 1987 existe el Programa Nacional de Cáncer de Cuello Uterino, que es similar al de otros países. Las coberturas no han logrado superar el 55% en el último decenio, perpetuando tasas altas de incidencia, diagnósticos tardíos y, por ende, mayor mortalidad11. El descubrimiento del VPH como la causa etiopatogénica de este cáncer ha permitido el desarrollo de vacunas contra los virus oncogénicos12. La vacunación contra el VPH es una de las principales estrategias preventivas contra el cáncer de cuello uterino y sus lesiones preinvasoras, incorporándose como estrategia en los programas nacionales de vacunación. El conocimiento de la infección por VPH, además, ha llevado al desarrollo de distintas técnicas para la detección del virus y seguimiento de las pacientes mejorando así la prevención secundaria. Por su parte, en la prevención terciaria es importante la oportunidad y calidad del tratamiento.
Detección mediante citologíaLa técnica de pesquisa mundialmente más utilizada para la evaluación de lesiones intrapiteliales es la citología por arrastre PAP, examen fácil de realizar, no invasivo, bien aceptado, eficaz en cuanto a costo efectividad. Desde su implementación, ha sido la principal herramienta para el desarrollo de los programas de pesquisa de cáncer cervicouterino en el mundo, logrando que al realizar la toma de PAP cada 3 años, pueda disminuir la incidencia de cáncer de cuello uterino por sobre el 80%13. Las guías chilenas e internacionales recomiendan tamizaje cada 3 años y no anual, con lo cual se logra aumentar la cobertura de la población, al tener menor periodicidad de controles y mayor disponibilidad de horas clínicas para evaluación de pacientes nuevas. Si bien la técnica clásica utilizada es la citología por arrastre (exfoliative cytology), paulatinamente se ha ido reemplazando por la citología en base líquida (liquid based cytology, LBC), que consiste en una técnica en la cual las células son recolectadas mediante un cepillo plástico desde el cuello uterino e introducidas en un medio fijador por suspensión. Esto permite, al realizar su procesamiento y análisis, remover artefactos producidos por la técnica de arrastre, glóbulos rojos, detritus, células inflamatorias, finalmente reduciendo las muestras insatisfactorias de un 9,1% a un 1,6%14,15. Permite, además, la realización de prueba de VPH. Sin embargo, no mejora la sensibilidad ni el valor predictivo positivo al compararlo con la técnica de arrastre, tampoco permite el diagnóstico de infección, disminuye la probabilidad de detección de lesiones intraglandulares cervicales y tiene un costo económico mayor16–19.
VPH: nuestro objetivoEl VPH es un virus de mucosa que se transmite principalmente a través del contacto piel a piel. Es la infección de transmisión sexual más frecuente y exclusiva de los humanos. Se estima que el 80% de la población ha presentado o presentará a lo largo de su vida una infección por VPH (riesgo acumulado), siendo la incidencia de 10%, este porcentaje se incrementa en mujeres menores de 30 años. Pueden coexistir más de un virus en el 20 a 30% de las mujeres y en hombres puede ser hasta en un 50%. Se cree que causa el 5% de todos los cánceres en hombres y el 10% en mujeres20. Es una infección autolimitada, la mayoría de las personas lo elimina entre los 12 y 18 meses postinfección y antes de los 30 años el 90% de las personas lo habrá eliminado. Sólo el 10% hará una infección persistente, menos de un tercio desarrollará una neoplasia intraepitelial (NIE) III y de éstas 30% será cáncer. Es decir, cerca del 1% de las infecciones con virus de alto riesgo se transformará en un cáncer cervicouterino. Sólo mediante infección persistente el virus puede producir cambios atípicos en la célula huésped incorporándose a su genoma. Las proteínas de la cápside viral L1 hacen que el virus se internalice en el citoplasma, haciendo que el control normal de crecimiento de la célula se pierda como resultado de la expresión de las oncoproteínas E6 y E7. Como resultado, el genoma viral se integra al genoma del huésped, desarrollando un epitelio displásico anormal. La disregulación de los pasos del ciclo celular controlados por las proteínas supresoras de tumor, p53 y pRb, permiten la acumulación de este DNA dañado y el desarrollo del cáncer. No obstante, el VPH por sí solo no es suficiente para el desarrollo de la enfermedad, necesitando cofactores moduladores, siendo la inmunidad y el consumo de cigarrillos los más importantes9,21.
Existen más de 200 genotipos de VPH diferentes, 42 afectan al aparato genital, siendo de alto riesgo los genotipos16,18,31,33,35,39,45,51,52,56,58,59,68,69,73,82. La infección persistente por VPH es responsable de aproximadamente el 99% de los cánceres de cuello uterino, 70% de los cánceres de vagina, 40% de los cánceres de vulva, 29% de los cánceres de pene, 87% de los cánceres de ano y 20% de los cánceres de orofaringe en Europa. Los genotipos 16 y 18 causan la mayoría (73 a 94%) y junto con otros 5 genotipos de alto riesgo (31/33/45/52/58) son responsables de hasta el 98% de los casos22.
VacunasLa vacuna profiláctica contiene partículas similares al virus, siendo L1, como principal compuesto de la cápside viral, el que confiere una potente acción antigénica. La vacuna no contiene material genético viral, por lo que no tiene una acción patógena en las personas inoculadas. Provocan formación de anticuerpos, los cuales alcanzan su punto máximo 1 mes después de la última dosis y niveles meseta entre los 18 y 24 meses. La seroconversión es prácticamente del 100% después de 3 dosis y comparable en todas las poblaciones y razas23,24. Tienen una alta eficacia en prevenir infecciones producida por VPH. Existen varias presentaciones, todas comparables en cuanto a nivel de inmunogenicidad, las diferencias se producen en la cantidad de cepas de alto y bajo riesgo que contienen.
El título de anticuerpos depende de la edad y es mayor en niños y adolescentes menores de 15 años, proporcionando una gran respuesta inmune en comparación a personas mayores; incluso cuando se administran menos dosis a los individuos más jóvenes25,26. Además, la vacunación a una edad temprana es óptima, porque se sabe que las vacunas son menos efectivas después del inicio de las relaciones sexuales y a la exposición al VPH, manteniéndose los niveles de inmunogenicidad en el tiempo sin ser necesario el uso de refuerzos en los años siguientes27,28.
Actualmente, existen 4 vacunas en el mercado; dos de ellas bivalente, Cervarix® y Cecolin® contra virus 16 y 18. Existe una tetravalente, Gardasil®, la cual además incluye los virus 6 y 11, que son responsables del 90% de las infecciones por verrugas genitales y también la vacuna nonavalente Gardasil 9® que incluye además los genotipos de alto riesgo 31,33,45,52,58. Todas se encuentran aprobadas por la Food and Drug Administration y la European Medicines Agency, salvo Cecolin cuya fabricación es reciente29. Las vacunas han demostrado 96% de eficacia en disminuir la infección persistente, las NIE de alto grado y el cáncer cervicouterino relacionadas con los serotipos virales vacunadas30. Todas las vacunas han sido estudiadas en esquemas de dos dosis en niñas de 9 a 14 años26,31.
La administración es mediante inyección intramuscular en esquema inicial, segunda dosis a los 2 meses y luego a los 6 meses, siendo en general bien tolerada, con efectos adversos menores al 2% y un bajo número de eventos adversos serios. Menos del 0,1% de las pacientes interrumpió el esquema de vacunación por efectos no deseados. Por otro lado, no existen diferencias en cuanto a los efectos adversos al comparar las diferentes vacunas32.
Respecto a la evidencia existente en la utilización de esquemas de monodosis, se encuentra actualmente en fase 4 el estudio ESCUDDO (EStudio Comparativo entre Una o Dos DOsis contra el VPH), que busca evaluar la no inferioridad de una dosis de vacunación en comparación con dos dosis en la prevención de nuevas infecciones por VPH 16/18 en niñas de 12 a 16 años. Como segundo objetivo, evaluará la eficacia de una dosis de la vacuna vs pacientes no inmunizados. Otros estudios en curso que trabajan líneas similares son los llevados por la NCI (estudio PRIMAVERA) y la ACIB-FUNIN (estudio PRISMA)33.
Dada la evidencia científica de la eficacia de la vacuna administrada en dos dosis y como parte de los lineamientos otorgados por la OMS; en Chile se incorporó la vacuna contra el VPH al programa nacional de inmunizaciones (PNI) el año 2014. La vacuna tetravalente se administra en un esquema de 2 dosis a niñas de 9 a 13 años, que cursen el 4° básico (1a dosis) y 5° básico (2a dosis). El 2019 se suma la vacunación de los niños en los mismos rangos etarios. La cobertura de la población objetivo para ese año fue del 92% para la primera dosis y del 72% para la segunda34.
Vacunación en mujeres mayoresUna revisión Cochrane demostró que, en población vacunada con 3 dosis, entre 15 y 26 años, hubo una reducción del riesgo de NIE de alto grado asociado a VPH 16 y 18 de hasta en un 99%, además, una disminución de riesgo de NIE III (independiente del tipo viral) entre un 63 y 79% y disminución de adenocarcinoma in situ asociado o no a VPH 16/18. Ahora, cuando se incluyen mujeres independientes de su estado basal de VPH, al recibir al menos 1 dosis de la vacuna bi o tetravalente, se redujo el riesgo de NIE II o mayor asociado a VPH 16/18 en un 48/45% respectivamente y el riesgo de NIE II o más, independiente del VPH, en un 21 y 33% respectivamente35. Estudios de costo efectividad no han demostrado ser eficientes para demostrar el beneficio de la inmunización al grupo etario entre 24 y 45 años36.
El análisis post hoc de los participantes en los ensayos CVT y PATRICIA (de 15 a 26 años) encontró que la eficacia de la vacuna era similar independientemente del número de dosis37 y con títulos de anticuerpos elevados por más de 10 años de seguimiento38. Lo mismo demostraron estudios poblacionales de Australia y EE.UU., lo que no podría explicarse por la protección de rebaño39.
Grupos particulares para vacunación contra VPHExisten personas que están fuera del programa nacional de vacunación y que deben ser inmunizadas; aquellas con trasplante de órgano sólido o progenitores hematopoyéticos, usuarias de tratamiento inmunosupresor, enfermedad inflamatoria intestinal, síndrome de inmunodeficiencia medular congénita, inmunodeficiencias primarias, supervivencia de neoplasias infantiles, papilomatosis respiratoria frecuente, hombres que mantienen relaciones sexuales con hombres e infección por VIH.
El rol de las vacunas en la reducción de NIE de alto grado y cáncerUn metaanálisis realizado por Kechagias et al. demostró que la vacunación administrada cercana a la realización del cono cervical disminuyó en un 57% el riesgo de recurrencia de NIE II o III y al analizar el subgrupo para pacientes con VPH 16/18 este porcentaje subía a 74%. Este estudio no demostró significancia estadística en la reducción de recurrencia en lesiones cervicales de bajo grado, ni en lesiones intraepiteliales vaginales, vulvares, anales y persistencia de infecciones por VPH40,41. Otro metaanálisis realizado por Di Donato et al., mostró reducciones en la recurrencia de lesiones de bajo y alto grado cervical, disminución del riesgo de desarrollar neoplasia intraepitelial anal y papilomatosis respiratoria recurrente42.
Existe evidencia actual de que las vacunas son capaces de disminuir las lesiones de alto grado y cáncer. En Suecia, donde los programas de inmunización empezaron hace 17 años, la vacunación comprobó protección eficaz contra la aparición de verrugas genitales, NIE cervical y reducción de cáncer cervicouterino hasta en un 50% en las pacientes entre los 17 y 30 años, pero si la vacuna fue antes de los 17 años la disminución del cáncer ascendía a 88%43.
Test para la detección del VPHLa prueba de VPH tiene una alta sensibilidad, con valor predictivo negativo (VPN) del 99%, pero no discrimina si existe lesión clínica, aumentando la derivación a colposcopía. Habitualmente la derivación a colposcopía es del 3% debido al PAP, alcanzando un 10% por test VPH, saturando las unidades de patología cervical. Es, por ende, importante contar con exámenes que además de su alta sensibilidad, puedan aumentar su especificidad, evitando seguimientos innecesarios en pacientes con infecciones por VPH que serán autolimitadas, maximizando el beneficio del cribado primario44. Existen diferentes estrategias de tamizaje tales como el PAP reflejo que ha sido recomendado en pacientes con cribado primario con VPH positivo, logrando detección de hasta 30% de NIE45. La genotipificación viral 16 y 18 en mujeres con infección viral persistente, tienen un riesgo acumulativo de NIE de alto grado de 21 y 11% para los genotipos 16 y 18 respectivamente46. La tinción dual con p16 y Ki67 puede ser una buena alternativa a la citología, disminuyendo la derivación a colposcopías47. La metilación del DNA viral, se ha descrito como una buena estrategia para predecir NIE de alto riesgo48.
Las pruebas o tests de VPH se pueden dividir en aquellas que no presentan amplificación de ácidos nucleicos, como la Hybrid Capture® 2 (HC2), química Invader™ (Cervista HPV) y, aquellas con amplificación de ácidos nucleicos mediante PCR (cobas® HPV y Onclarity™ HPV, Aptima™ Transcription-Mediated Amplification). Actualmente, se dispone de un gran número de pruebas de tipificación viral por lo cual es importante que estos exámenes estén validados clínicamente y sólo deben informar los genotipos de alto riesgo en donde se concentrarán todas las pacientes de riesgo. Se han publicado guías y protocolos como Mejier49, VALGENT50 y más recientemente actualizaciones de los tests vigentes51, que han establecido pautas para la validación de las pruebas de VPH de alto riesgo en la detección del cáncer de cuello uterino y el control de calidad en la detección basada en el VPH.
En el 2012 las guías de las sociedades de colposcopía, patología y cáncer en EE.UU. (ASCCP, ACS, ASCP-American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology) incorporaron la evidencia de que el test de VPH al tener mayor sensibilidad, y por lo tanto, proporcionar un mejor VPN que la citología, recomendaron que las mujeres de 30 años o más se realicen pruebas de detección cada 3 años utilizando solo citología cervical o cada 5 años, utilizando una combinación de citología cervical y prueba de VPH de alto riesgo, denominada prueba conjunta o cotest52. Estas guías recomendaban que ante PAP negativo y VPH positivo debían seguirse en 12 meses con un nuevo PAP y test de VPH. Como alternativa también se podía realizar genotipificación 16 y 18 y de resultar positivos debía enviarse a colposcopía; si el resultado era negativo, se debe realizar cotest en 12 meses53.
El estudio ATHENA HPV del año 2012, comparó 9 estrategias de cribado para evaluar la detección de lesiones de alto grado, utilizando como parámetro el número de colposcopías necesarias para lograr detectar al menos 1 lesión de alto grado y así evitar falsos positivos y sobretratamientos. Se evidenció que la incorporación de la detección de VPH y la clasificación de mujeres con VPH positivo mediante una combinación de genotipificación para VPH 16/18 con citología, proporcionó un buen equilibrio entre maximizar la sensibilidad y la especificidad, limitando el número de colposcopías54.
Desde 2019 en las guías de ASCCP ya no se utilizan algoritmos para derivación, sino que se evalúa el porcentaje de riesgo individual. Se considera la importancia de la incorporación de la genotipificación viral, dado que la infección prolongada y los tipos virales 16 y 18 son claves en la fisiopatología de las lesiones preinvasoras y el cáncer. Se consensuó que el porcentaje de riesgo de tener NIE III, y con lo cual, las mujeres deben ser derivadas a colposcopía, establecer grupos de riesgo y enfrentamiento clínico terapéutico, corresponde a un umbral sobre el 4%. Si el porcentaje es menor de 4%, dependiendo del riesgo establecido, los controles se realizarán de forma anual, cada 3 o 5 años55. Es importante resaltar que el seguimiento de las pacientes posterior a conización o vacunación, debe ser con genotipificación de VPH que permita la detección de las cepas de mayor riesgo.
Autotoma del examen de VPHPara lograr aumentar la cobertura es indispensable aumentar el número de mujeres a evaluar y poder llegar a aquellas no escrutadas o parcialmente escrutadas, ya sea por falta de información, barreras culturales, falta de acceso o rechazo de las pacientes por incomodidad o dolor del examen. Se ha implementado como alternativa factible y complementaria la autotoma de exámenes que detectan VPH, existiendo experiencia en países latinoamericanos como México y Ecuador, también en Países Bajos, Francia y China. Estas muestras se pueden obtener por vía vaginal o de orina, siendo métodos fáciles de realizar y bien aceptados, presentando buena sensibilidad y especificidad (78% y 87%), aunque es menor en un 15% al compararlo con una toma realizada por un clínico, se ha visto que en algunos exámenes de VPH basados en amplificación de ácidos nucleicos se logra sensibilidad similar a la muestra tomada clínicamente56,57. Estos exámenes son costo efectivos y pueden ser una buena opción para aumentar la cobertura mejorando la detección de lesiones preinvasoras.
SeguimientoEl seguimiento de las pacientes con diagnóstico de lesiones preinvasoras de cáncer de cuello uterino constituye un reto para las unidades de patología cervical. Si bien la conización es muy efectiva en el tratamiento de estas lesiones, aún existen algunas diferencias entre los distintos centros de salud del mundo en la periodicidad de los controles posterior a los tratamientos; supeditado por la disponibilidad de horas de especialidad, adherencia de las usuarias a sus controles y el acceso a los exámenes de apoyo (citología y VPH).
Dentro de los consensos importantes se establece que las pacientes con NIE I no requieren de entrada tratamientos escisionales ni de criocoagulación y se benefician del seguimiento y vigilancia por 2 años, evitando así sobretratamientos.
El seguimiento de las pacientes con lesiones de alto grado operadas debe ser estricto dentro de los primeros 2 años posteriores al tratamiento, integrando la citología como parte fundamental del control, apoyada de la serología del VPH que determina la periodicidad de los controles.
Las guías chilenas contra el cáncer de cuello uterinoEn Chile, el Programa Nacional de Cáncer de Cuello fue creado en 1987. En esa época, la meta era una cobertura de cribado mediante PAP del 60% de las mujeres entre 25-65 años, para lograr una disminución de mortalidad en un 60-70% por cáncer cervicouterino. Luego de casi 40 años de implementación, sigue siendo una de las estrategias sanitarias con más prioridad en el país.
En el año 2016 se inició como plan piloto en algunos servicios de salud del país la toma de la prueba de VPH mediante el uso de la prueba cobas® HPV; y se propuso como meta nacional, una cobertura vigente del 80% de mujeres entre 25-64 años con PAP en los tres últimos años o test de VPH en los últimos cinco años.
La meta del Ministerio de Salud de Chile (MINSAL) para el 2024, es identificar el número de personas con PAP vigente restante para disminuir a lo menos un 30% de la brecha entre la cobertura lograda a diciembre 2023 y la meta nacional de cobertura de 80%, comprometiendo una mejora de la cobertura equivalente a este número de personas con PAP o test VPH vigente a incrementar58.
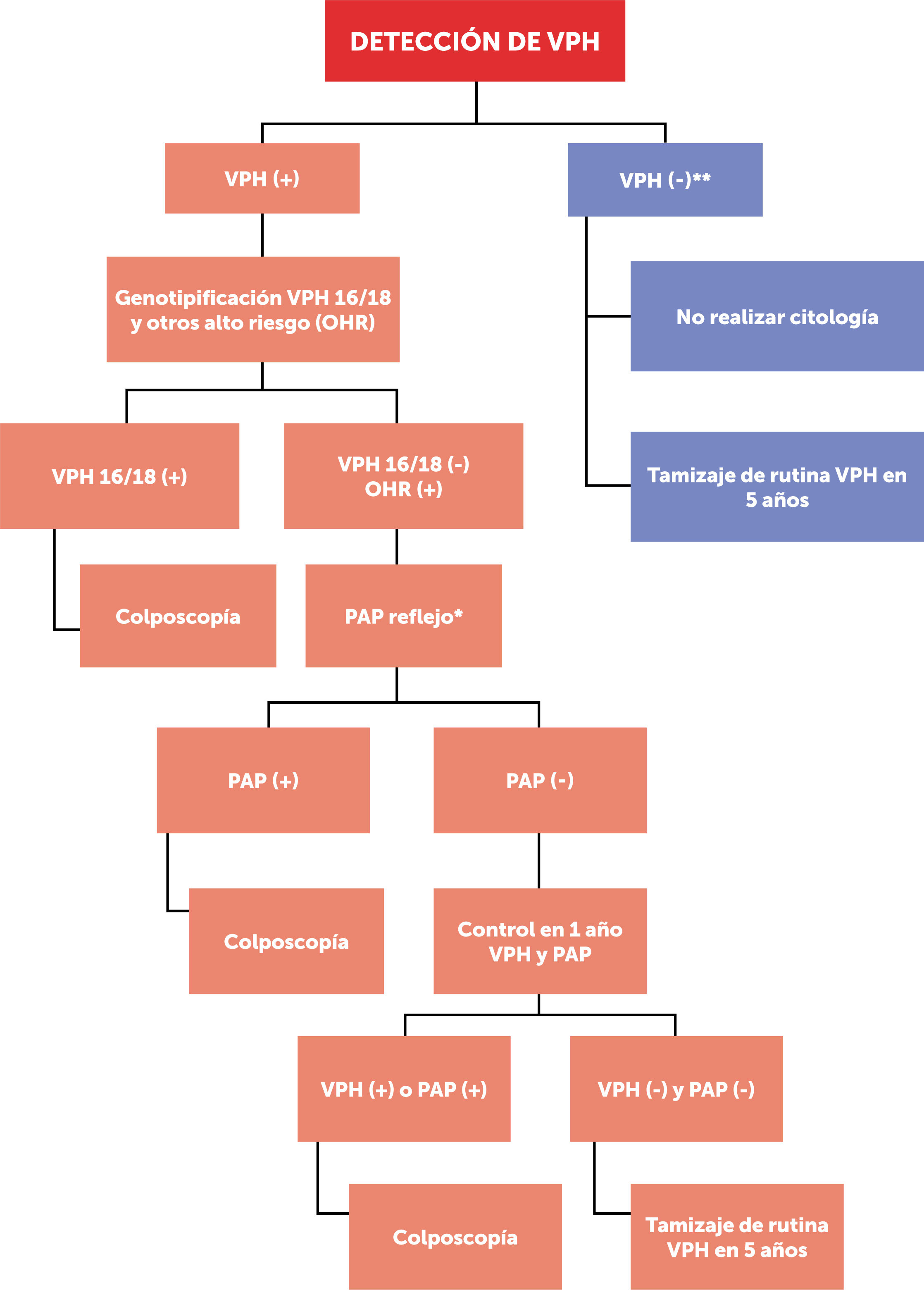
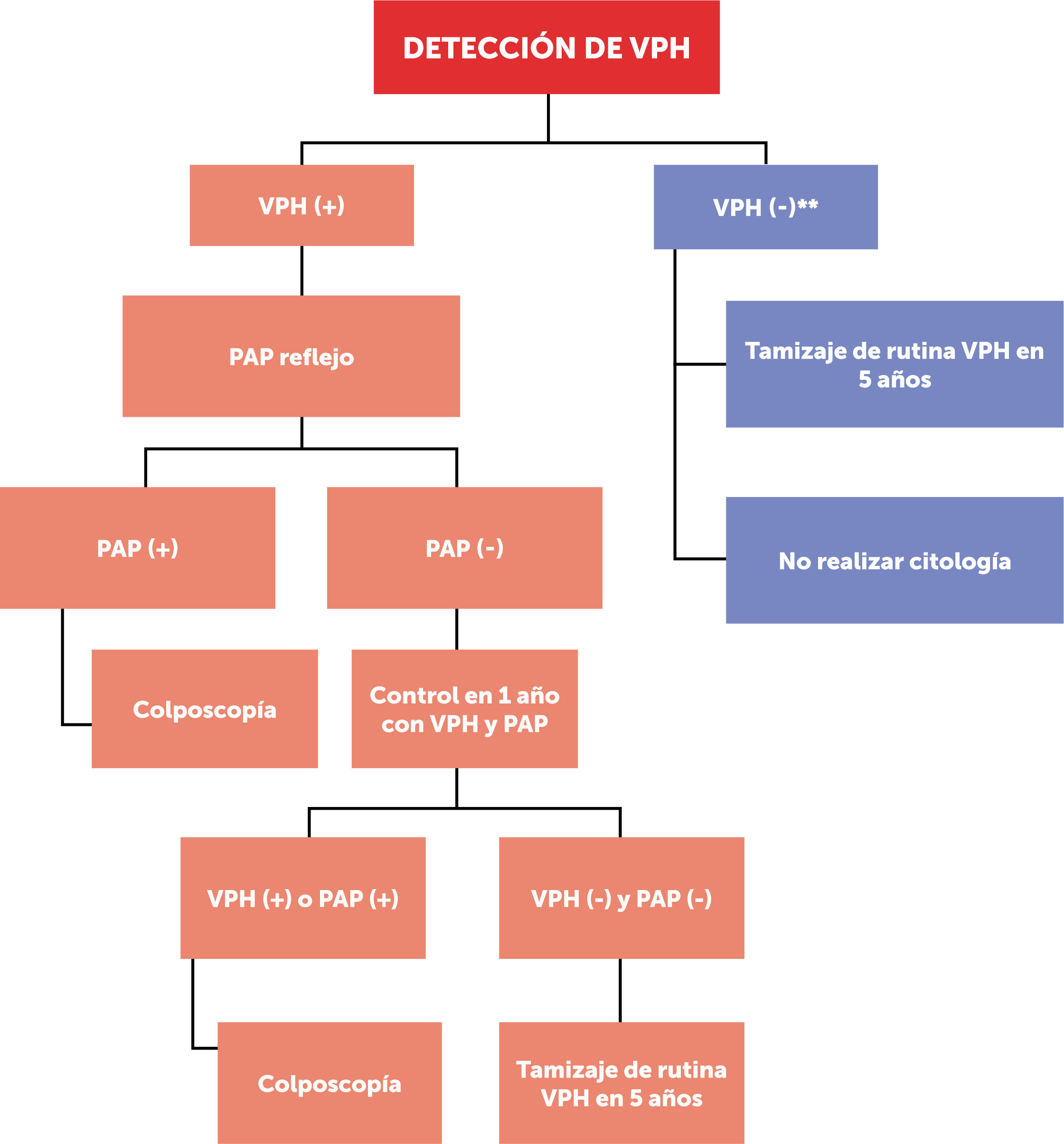
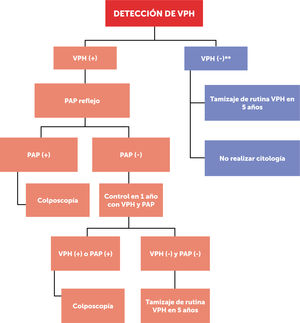
Las figuras 1 y 2 esquematizan los dos flujogramas de manejo al momento de realizar las pruebas de VPH clínicamente validadas, en mujeres desde los 30 hasta los 65 años según guía clínica MINSAL (2015) para cáncer de cuello uterino14. Cabe destacar que este examen no está disponible aún en el 100% del territorio nacional. La figura 1, muestra la toma de VPH con genotipificación viral de cepas de alto riesgo 16/18; mientras que la figura 2, muestra la toma de VPH sin genotipificación viral de cepas de alto riesgo 16/18.
Tamizaje con examen VPH, con genotipificación viral
(*): el PAP se toma conjunto con el VPH, pero se lee solamente ante un resultado VPH (+), pero 16/18 (−); el citotecnólogo/patólogo debe reconocer que muestra es VPH (+)
(**): examen VPH (−) tanto para cepas de alto riesgo 16/18 como otras de alto riesgo (OHR).
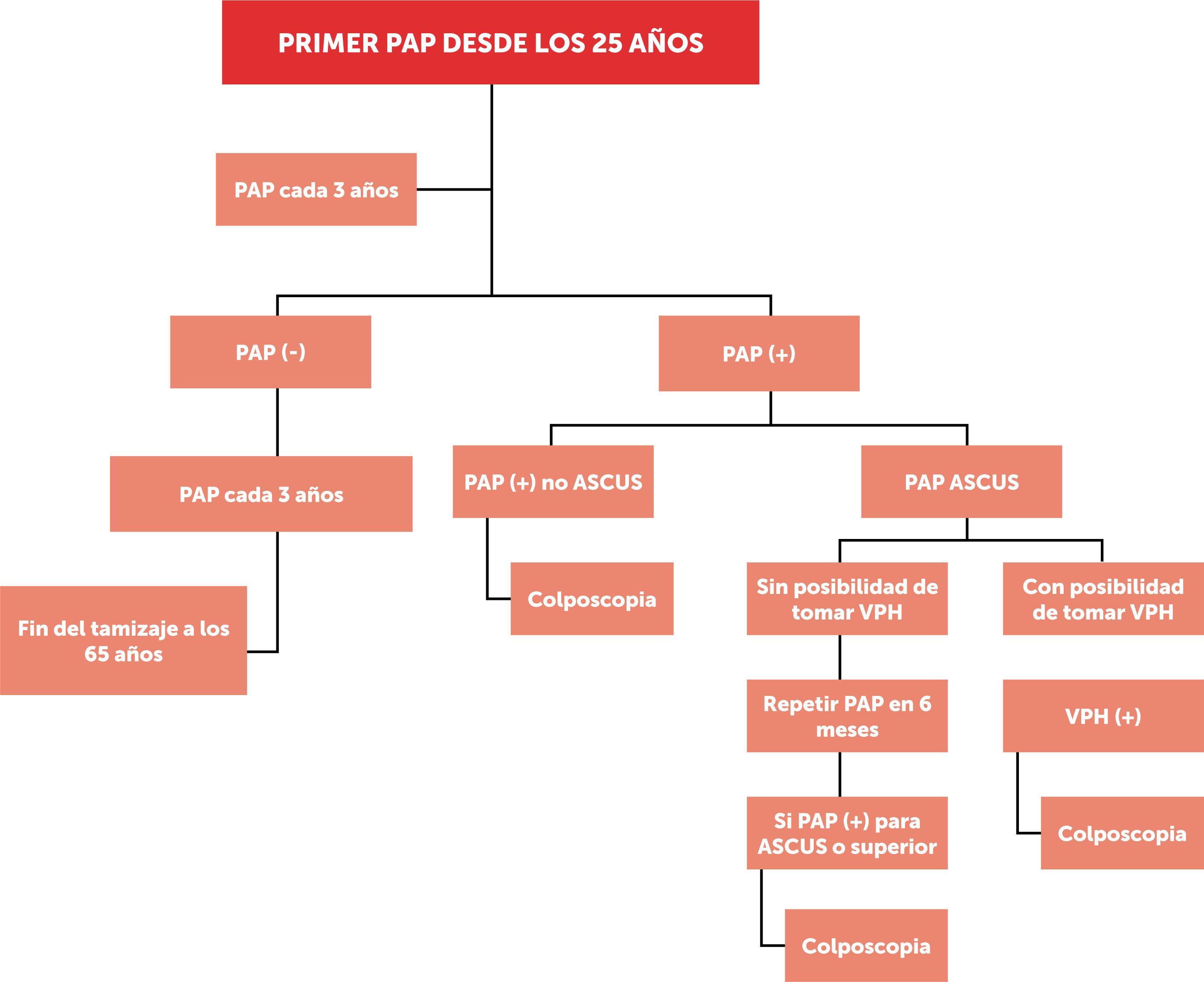
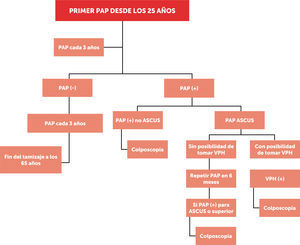
La figura 3, muestra el tamizaje de cáncer de cuello uterino mediante PAP. Se hace alcance a que, dada la fecha de publicación de la guía clínica 2015, no se hace referencia al manejo de PAP ASCUS (atypical squamous cells of undetermined significance, en inglés) (+) con estudio VPH con resultado (−). Dicho tema es abordado en la actualización 201959.
DiscusiónLos programas organizados de tamizaje con fácil acceso de la población, tratamientos oportunos y gran cobertura de vacunación contra VPH serán la clave para reducir la incidencia y mortalidad del cáncer del cuello uterino60.
La Organización Mundial de la Salud (OMS) ha definido lineamientos claros para la década 2020 al 2030 con el objetivo de acelerar la eliminación del cáncer cervicouterino. Como meta se ha propuesto lograr el 90% de la vacunación en la población objetivo antes de los 15 años, lograr cobertura de detección (idealmente por test VPH) a los 35 y a los 45 años en un 70% de las mujeres y presentar derivaciones oportunas con tratamientos adecuados incluyendo cirugía, radioterapia, quimioterapia y cuidados paliativos en un 90% de las pacientes (estrategia 90-70-90). Con esto se intenta reducir la mortalidad por cáncer de cuello uterino en 30%. La OMS cree que con estas estrategias se podrán lograr reducir la incidencia por debajo del umbral de 4 casos por 100 000 mujeres al año, lo que equivaldría a la eliminación de esta enfermedad. Lamentablemente, por la inequidad de recursos, acceso e implementación en la prevención y tratamiento de esta enfermedad habrá países que no lograrán este objetivo en este siglo61,62.
Se debe hacer hincapié en la importancia del control preventivo, mejorando la cobertura del PAP y test de VPH, logrando un trabajo intersectorial entre estamentos de salud, educación y desarrollo social, con programas educativos en colegios y centros de educación superior. Se deberán aprovechar los canales actuales de mayor difusión publicitaria, como las redes sociales, radio y televisión buscando mejorar la llegada a poblaciones con menores índices de cobertura y/o recursos, promoviendo a su vez la capacitación del personal de salud, con refuerzo en el cumplimiento de metas sanitarias asociadas a patología preinvasora. Impulsar campañas poblacionales de pruebas de autotoma de VPH validadas, para aquellas personas que, por diversas razones no acuden a los centros de salud. Es fundamental informar adecuadamente a las familias sobre la importancia de la vacunación de los escolares para mantener altas tasas de inmunización. Es muy importante fortalecer a la atención primaria con los recursos humanos suficientes y la tecnología para poder realizar las pruebas de genotipificación viral. En atención secundaria y terciaria se debe fortalecer la infraestructura de las unidades de ginecología oncológica, aumentando la dotación de colposcopios y médicos subespecialistas ante la mayor derivación de pacientes con VPH, al igual que las unidades de anatomía patológica, para lograr diagnóstico y tratamiento oportunos de las pacientes.
ConclusiónLos avances científicos han permitido conocer la etiología del cáncer de cuello uterino y desarrollar vacunas y test virales que nos permiten una adecuada prevención primaria y secundaria. En Chile existe un programa bien consolidado de patología cervical y un programa de vacunación con alta adherencia. Adicionalmente, dado que es una patología GES, los tiempos de derivación al nivel secundario, la confirmación diagnóstica y la resolución de la patología son definidos y acotados. Lo anterior nos da optimismo de que lograr el objetivo de disminuir la incidencia de cáncer cervicouterino en nuestro país es una meta alcanzable.
Conflicto de InterésLos autores no declaran conflicto de interés
FinanciamientoNo se recibió financiamiento alguno para la realización de este manuscrito