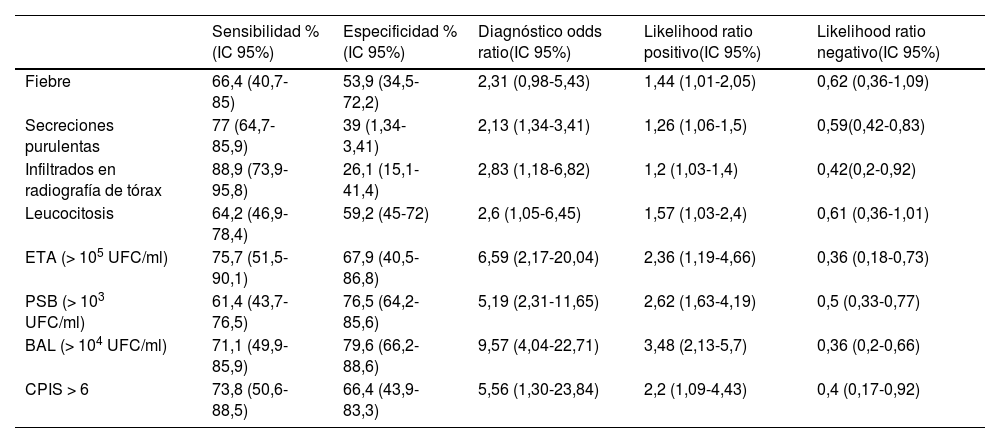
La mortalidad atribuible a la neumonía asociada al ventilador (VAP) es alrededor del 10%, y dentro de la nueva clasificación de las infecciones del tracto respiratorio inferior (LRTI), los pacientes diagnosticados con VHAP tuvieron la mayor mortalidad hospitalaria. La patogenia es multifactorial, las bacterias gramnegativas son responsables de la mayoría de los casos bacterianos de HAP/VAP (más del 60%). Los hallazgos del examen físico (fiebre, secreciones purulentas), la radiografía de tórax, los cultivos del aspirado endotraqueal, los cultivos broncoscópicos y el ínidice de infección pulmonar clínica (CPIS) tienen poca precisión para diagnosticar VAP. Las directrices recientes no recomiendan el uso de biomarcadores para el diagnóstico de VAP, aunque sugieren que pueden ofrecer orientación sobre la duración del tratamiento. Esperamos más estudios en programas de Stewardship con las nuevas herramientas moleculares para el uso de los antibióticos en VAP. Presentamos las recomendaciones para el tratamiento antimicrobiano empírico de la ERS/ESICM/ESCMID/ALAT, con los nuevos antibióticos y las recomendaciones de prevención de VAP. Se hacen necesarias las actualizaciones de las guías, tanto de la guía americana como de la la europea.
Mortality attributable to ventilator-associated pneumonia (VAP) is about 10%, and within the new classification of lower respiratory tract infections (LRTI), patients diagnosed with VHAP had the highest in-hospital mortality. Pathogenesis is multifactorial, with gram-negative bacteria responsible for the majority of bacterial cases of HAP/VAP (more than 60%). Physical examination findings (fever, purulent secretions), chest radiograph, endotracheal aspirate cultures, bronchoscopic cultures, and clinical lung infection index (CPIS) have poor accuracy for diagnosing VAP. Recent guidelines do not recommend the use of biomarkers for the diagnosis of VAP, although they suggest that they may offer guidance on the duration of treatment. We look forward to further studies in Stewardship programs with the new molecular tools for the use of antibiotics in VAP. We present the recommendations for empirical antimicrobial treatment of ERS/ESICM/ESCMID/ALAT, with the new antibiotics and recommendations for the prevention of VAP. Updates to the guidelines of both the American and European guidelines are necessary.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora