La elección del tratamiento más adecuado en el cáncer glótico en estadio precoz con afectación de la comisura anterior sigue siendo controvertida. La complejidad en su manejo terapéutico está justificada por ser un significativo indicador pronóstico de control local, con un porcentaje de recidiva del 37%, por la dificultad en establecer la extensión tumoral con una infraestadificación que llega a alcanzar el 40%, y por la comparación de resultados en series formadas por tumores de diferente comportamiento evolutivo, como son T1a, T1b y T2a con afectación comisural. A estos datos se suma la complejidad del abordaje quirúrgico mediante microcirugía transoral con láser CO2 que requiere habilidad quirúrgica, equipamiento adecuado y experiencia.
Los aspectos a revisar en este documento son: definición anatómica actualizada de la comisura anterior, progresión tumoral en función de estudios histopatológicos, utilidad de la videoestroboscopia y la NBI en la precisión diagnóstica, validez de las pruebas de imagen, resultados oncológicos publicados en revisión de series, revisiones sistemáticas y metaanálisis, tratamiento de los márgenes y evaluación de la voz.
Finalmente, y a modo de resumen, el documento incluye una serie de recomendaciones para el tratamiento de estos tumores.
The choice of the most appropriate treatment in early-stage glottic cancer with anterior commissure involvement remains controversial. Its therapeutic management is complex because it is a significant prognostic indicator of local control with 37% recurrence, due to the difficulty in establishing tumour extension with understaging of up to 40%, and due to the comparison of results in series on tumours that behave variably as they progress, such as T1a, T1b and T2a with commissure involvement. Furthermore, the complexity of the surgical approach using transoral CO2 laser microsurgery requires surgical skill, appropriate equipment and experience. Aspects to be reviewed in this document are: an updated anatomical definition of the anterior commissure, tumour progression based on histopathological studies, usefulness of videostroboscopy and NBI in diagnostic accuracy, validity of imaging tests, oncological results published in series reviews, systematic reviews and meta-analyses, tumour margin treatment and voice evaluation.Finally, by way of a summary, the document includes a series of recommendations for the treatment of these tumours.
1. Revisión bibliográfica
1.1 Anatomía de la comisura anterior
1.2. Distribución anatómica y morfológica de las lesiones glóticas.
1.3. Videoestroboscopia e imagen de banda estrecha
1.4. Pruebas de imagen
1.5. Clasificación de los tumores precoces de comisura anterior
1.6. Tratamiento
1.7. Calidad de voz
1.8. Guías clínicas y artículos de opinión
2. Recomendaciones del grupo de expertos en el manejo diagnóstico del tumor glótico precoz con afectación de la comisura anterior y el tratamiento con microcirugía transoral con láser CO2
1. Revisión bibliográficaLa elección del tratamiento más adecuado en el cáncer glótico en estadio precoz con afectación de la comisura anterior sigue siendo controvertida. La complejidad en su manejo terapéutico está justificada por ser un significativo indicador pronóstico de control local, con un porcentaje de recidiva del 37%, por la dificultad en establecer la extensión tumoral, con un infraestadiaje que llega a alcanzar el 40%, y por la comparación de resultados en series formadas por tumores de diferente comportamiento evolutivo, como son T1a, T1b y T2a con afectación comisural1,2. A estos datos se suma la complejidad del abordaje quirúrgico mediante microcirugía transoral con láser CO2 que requiere habilidad quirúrgica, equipamiento adecuado y experiencia3.
Los aspectos a revisar en este documento son: definición anatómica actualizada de la comisura anterior, progresión tumoral en función de estudios histopatológicos, utilidad de la videoestroboscopia y la imagen de banda estrecha (narrow band imaging [NBI]) en la precisión diagnóstica, validez de las pruebas de imagen, resultados oncológicos publicados en revisión de series, revisiones sistemáticas y metaanálisis, tratamiento de los márgenes y evaluación de la voz.
1.1 Anatomía de la comisura anteriorOlofsson en 1975 definió la comisura anterior como la región ventral situada entre ambas cuerdas vocales, limitada superiormente por el ángulo anterior de la unión de los ventrículos, con una extensión inferior y lateral de 2-3mm, incluyendo la mácula flava o condensación elástica del ligamento vocal4.
Posteriormente, en 1981, Andrea y Guerrier publicaron un estudio realizado con cortes seriados de laringes humanas describiendo el «plano 0», constituido por una pequeña zona encima de las cuerdas vocales, sin glándulas ni vasos que separaba la comisura anterior del ligamento tiroepiglótico. Sin embargo, al nivel de la subglotis observaron que las glándulas y los vasos se encontraban en continuidad, lo que dificultaba su identificación de forma independiente. Por lo tanto, según los autores, la parte anterior de la laringe quedaba definida por 2 regiones, una supraglótica o vestíbulo-epiglótica y otra gloto-subglótica, a la cual pertenecía la comisura anterior5.
Prades et al., en 2017, realizan un estudio comparativo de especímenes de laringe de fetos y de adultos, ampliando los trabajos de Rucci y Gammarota6 sobre embriología de la comisura anterior, que ayudan a comprender los patrones de extensión tumoral en esta área anatómica7.
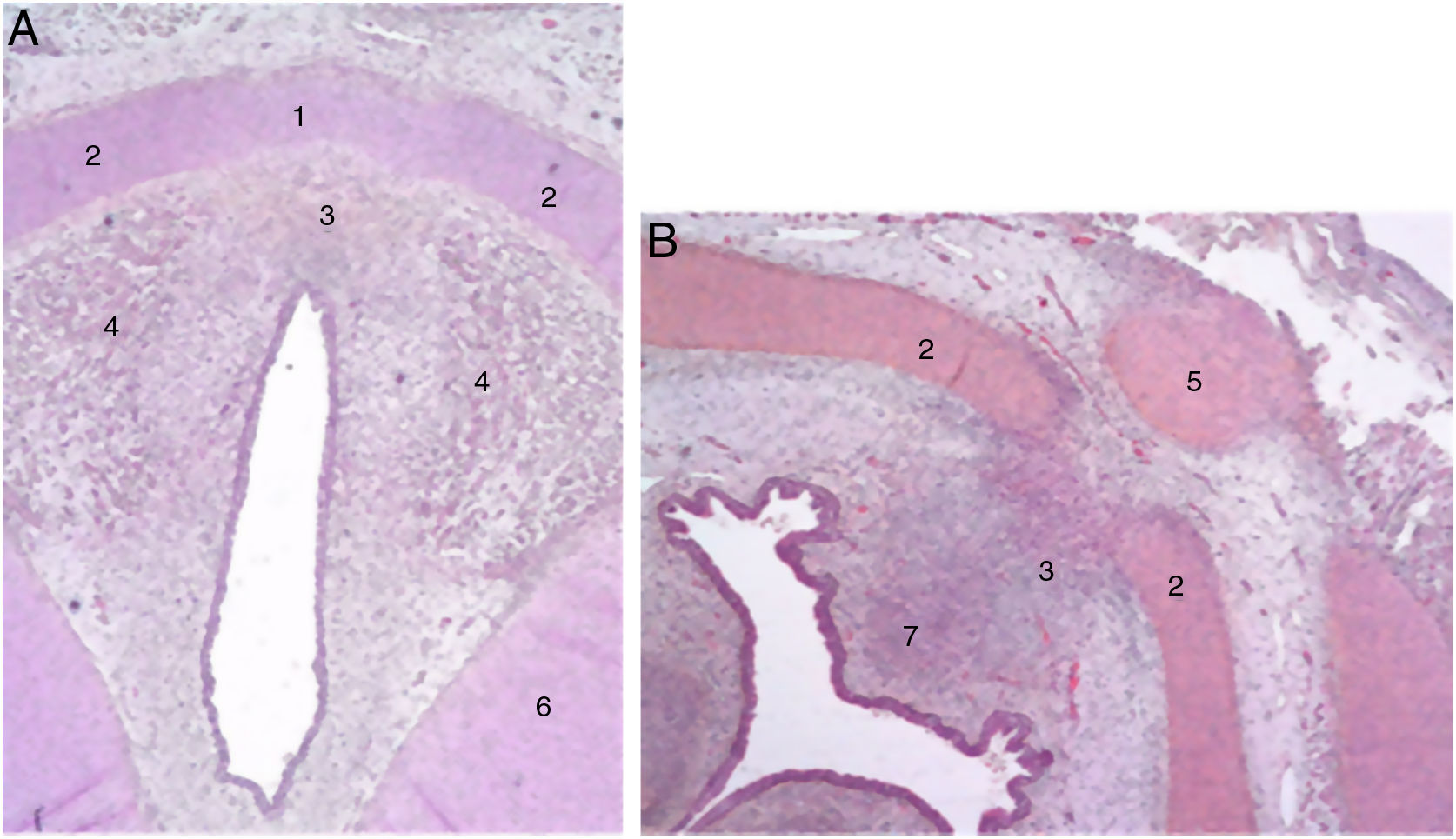
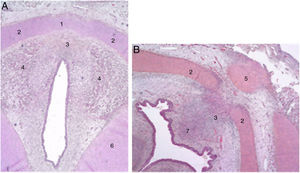
Los autores describen una banda mesenquimal en embriones humanos entre las 2 láminas laterales del cartílago tiroideo y una acumulación de tejido conjuntivo en la zona media situada dorsalmente (fig. 1).
Secciones transversales de un feto de 11 semanas (hematoxilina-eosina) cerca del plano glótico (A) y del hueso hioides (B). 1. Lámina intermedia del cartílago tiroides; 2. lámina lateral del cartílago tiroides; 3. proceso en zona media; 4. fibras musculares del plano glótico; 5. hueso hioides; 6. cartílago cricoides; 7. futuro espacio preepiglótico (reproducción de imágenes con permiso del autor).
Al final del periodo embriológico, dentro de este tejido conjuntivo, se entrecruzarán unas fibras paralelas a la lámina intermedia que formarán el ligamento de Broyles cranealmente y el ligamento conoide caudalmente, y otras en dirección perpendicular que corresponden a la inserción de las cuerdas vocales (fig. 2). Esta área de fibras desprovista de vasos conforma una especie de quiasma llamado «el espacio x de Bagatella y Bignardi»8 o «el punto o plano 0 de Guerrier».
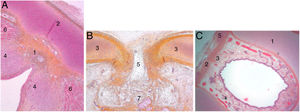
Secciones transversales de un feto de 25 semanas (hematoxilina-eosina) cerca del plano glótico (A), en el borde superior del cartílago tiroides (B) y cerca del borde superior del cartílago cricoides (C). A y B. 1. Malla de haces de fibras de colágeno en la comisura anterior; 2. Lámina intermedia del cartílago tiroides; 3. Lámina lateral del cartílago tiroides; 4. Mácula flava; 5. Escotadura del cartílago tiroides; 6. Fibras musculares glóticas; 7. Espacio preepiglótico futuro. C. 1. Cartílago cricoideo; 2. membrana cricotiroidea; 3. Malla de fibras de colágeno verticales; 4. Fibras de colágeno circulares; 5. Músculo cricotiroideo (reproducción de imágenes con permiso del autor).
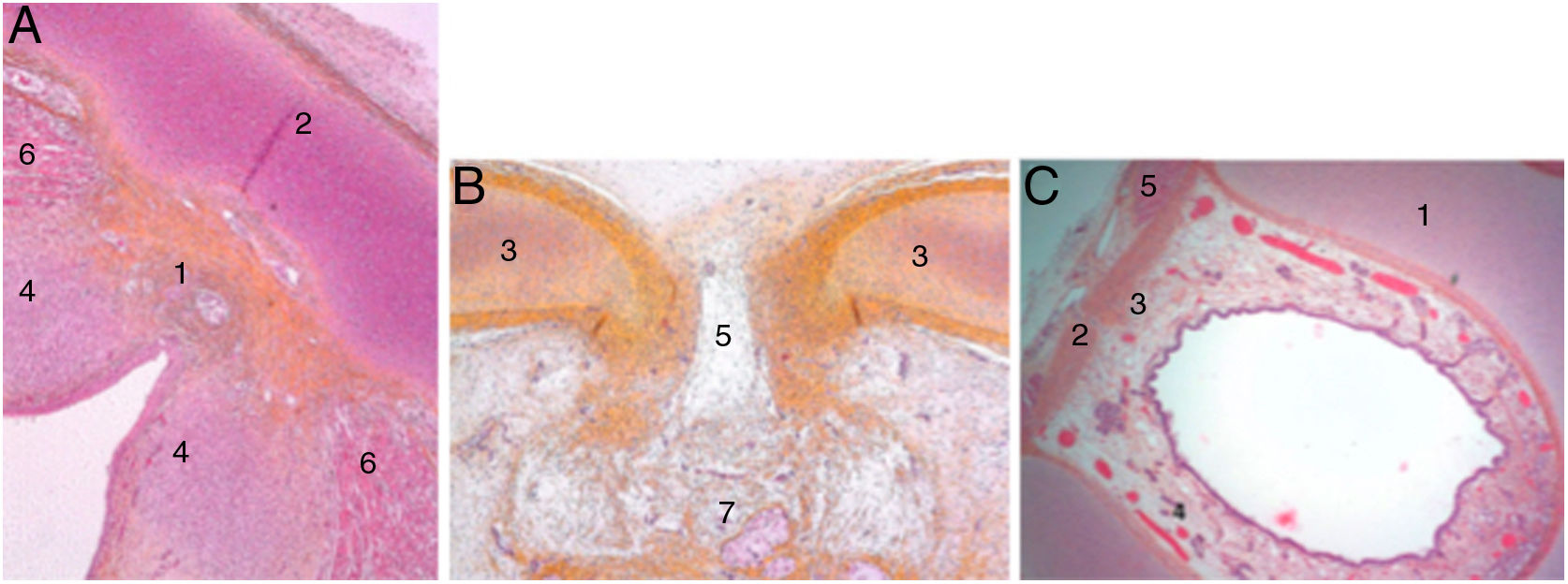
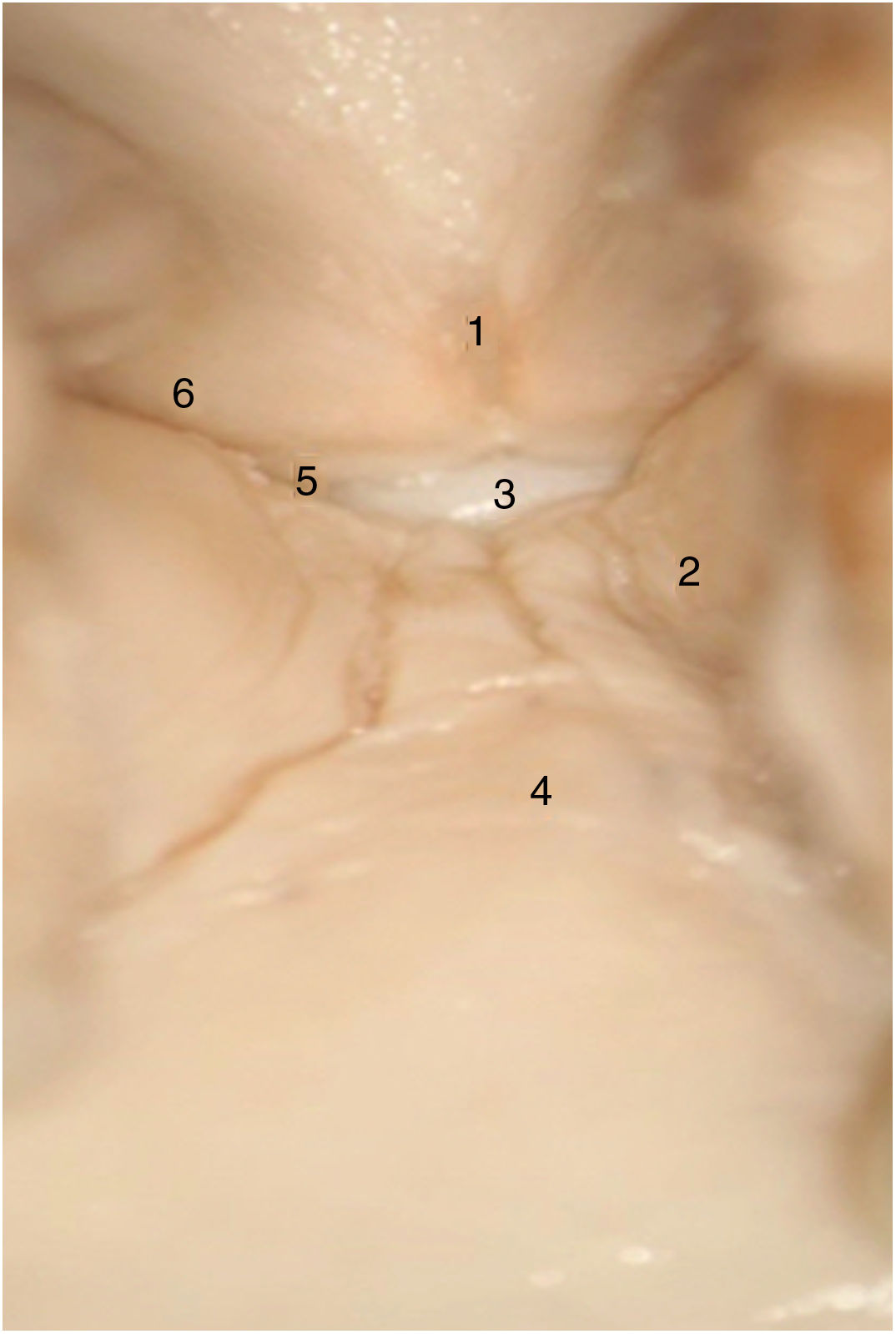
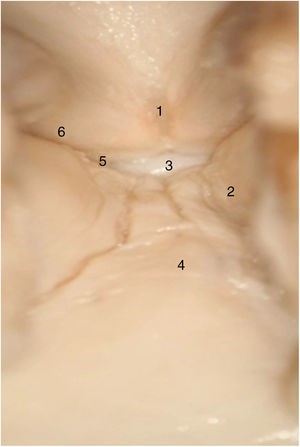
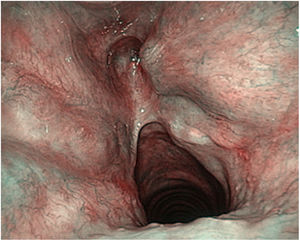
En las laringes adultas, endoscópicamente, la comisura anterior aparentemente semeja un área de transición entre la supraglotis y la subglotis. En el medio de la comisura, y situado ventralmente, se observa un espacio horizontal por encima del plano glótico de 3,9mm de ancho por 2,3mm de alto en continuidad con los ventrículos y separado del cartílago tiroides tan solo por un tejido fibroso muy fino y mucosa. El borde superior de este espacio está en el medio de la inserción inferior del tendón de Broyles, hecho que puede hacer difícil la visión de esta área (fig. 3).
Vista endoscópica de la comisura anterior de la laringe (espécimen adulto). 1. Tendón de Broyles epiglótico; 2. cuerda vocal derecha; 3. hueco medio supraglótico; 4. nivel subglótico; 5. ventrículo laríngeo; 6. banda ventricular izquierda (reproducción de imágenes con permiso del autor).
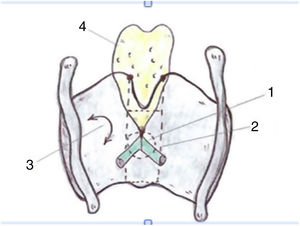
Teniendo en cuenta la organogénesis de la laringe y los hallazgos en el adulto, Prades et al. concluyen que la comisura anterior «desarrollada» vendría definida ventralmente por la lámina intermedia del cartílago tiroides inmediatamente inferior a la escotadura tiroidea, y dorsalmente por la inserción de las cuerdas vocales, el ligamento de Broyle y el ligamento conoide. El límite vertical estaría definido por la altura del cartílago tiroides y la anchura de la escotadura definiría el borde lateral. El límite posterior se definiría en la glotis por un plano parasagital a nivel de la mácula flava, en la supraglotis por el borde inferior de la epiglotis y en la subglotis por el borde inferior del cartílago tiroides (fig. 4).
Definición de la comisura anterior (AC) de la laringe propuesta (vista posterior). 1. «Clásica» AC: inserción del nivel glótico excluyendo el cartílago tiroides; 2. «Desarrollada» AC: 3 niveles de inserción (supra, glótico y subglótico) incluyendo la lámina intermedia del tiroides. 3. lámina lateral del tiroides; 4. cartílago epiglótico (reproducción de imágenes con permiso del autor).
En los patrones de expansión del carcinoma que afecta a la comisura anterior el papel del ligamento vocal, el ligamento de Broyle y el ligamento conoide ha sido ampliamente debatido. Podría pensarse que la escasa vascularización y la ausencia de tejido glandular en esta área favorecería que el tumor quedara confinado dentro de una estructura fibrosa. Sin embargo, la realidad es que estos tumores invaden el espacio que rodea al plano glótico rico en vasos sanguíneos y glándulas, y que pueden extenderse inferiormente hacia el ligamento conoide y la membrana cricotiroidea, y superiormente hacia el ventrículo laríngeo y el espacio preepiglótico6.
Este hecho, junto con la distancia de pocos milímetros que existe entre la mucosa de la comisura anterior y el cartílago tiroides, hace posible que pequeños tumores puedan alcanzar e invadir el cartílago, transformándose rápidamente de T1 a T3-T4. Hay una serie de hallazgos histopatológicos que permiten conocer con mayor profundidad cómo se produce esta invasión.
El ligamento de Broyle actúa como barrera efectiva a la extensión tumoral, ya que aunque puede observarse en algunos tumores la afectación de la zona dorsal de dicho ligamento, no se observa invasión de la lámina intermedia del cartílago tiroides siguiendo una dirección dorsal-ventral. Es más, cuando se observa una afectación anterior del cartílago tiroides, el tumor rodea al ligamento en forma de anillo. En este caso la propagación del tumor hacia el plano subglótico es más frecuente que hacia el plano supraglótico.
La expansión tumoral puede realizarse también a partir de la cuerda vocal. En la glotis la localización de las fibras de colágeno que atraviesan el pericondrio en los puntos de inserción del ligamento y músculo vocal dan lugar a una interrupción natural de dicho pericondrio, siendo estas áreas especialmente vulnerables a la invasión tumoral. El tumor en su crecimiento separa las fibras de colágeno del ligamento vocal, llegando directamente al cartílago. Este hecho da lugar a una osificación focal cuando el cartílago entra en contacto con células neoplásicas. Esta osificación, que conlleva un incremento de la vascularización, favorece la difusión tumoral. La infiltración del músculo vocal, rico en vasos sanguíneos y glándulas, facilita también la afectación del cartílago tiroides sin atravesar el ligamento. Esta invasión se ve más intensificada si la afectación del músculo vocal es bilateral9.
1.2. Distribución anatómica y morfológica de las lesiones glóticasSe han realizado varios trabajos intentando establecer la relación de algún factor con el desarrollo del tumor glótico en un área anatómica concreta. La posibilidad de que en los pacientes fumadores exista una localización específica en las neoplasias de la cuerda vocal frente a los no fumadores ha sido estudiado por algunos investigadores.
Shoffel et al. establecen en su trabajo que el área de transición entre la zona medial y superior de la cuerda vocal es la más frecuentemente afectada por displasias y carcinoma in situ, sin relación clara con el hábito tabáquico. La extensión de las lesiones hacia la zona superior y anterior parece más frecuente en pacientes fumadores, aunque no se han podido establecer diferencias significativas10.
Con respecto a la diferente morfología que adoptan los cánceres glóticos, los tumores de la zona superior son tumores planos, irregulares, con una mayor extensión hacia la comisura anterior y mayor porcentaje de recidiva. Por el contrario, los tumores de la zona medial son más voluminosos, con forma polipoidea y con un límite mejor definido entre tumor y tejido sano11. Por otra parte, los pushing carcinoma y los carcinomas infiltrantes tienen un patrón diferenciado de expansión con múltiples nidos tumorales que crecen rodeados por fibrosis, y que en los tumores de esta área en concreto pueden conducir a un infradiagnóstico12.
La expresión del receptor del factor de crecimiento epidérmico y del p53 en relación con tumores de la comisura anterior y posterior ha sido también objeto de estudio. Los hallazgos indicaron que la expresión del receptor del factor de crecimiento epidérmico era mayor en la comisura posterior que en la anterior, hecho que podría contribuir a peores resultados obtenidos con el tratamiento con radioterapia en este tipo de tumores. No se observaron diferencias significativas en la expresión del p5313.
1.3. Videoestroboscopia e imagen de banda estrechaLa videoestroboscopia es considerada como un instrumento útil en la evaluación diagnóstica de las lesiones glóticas con afectación de la mucosa. La alteración de la onda mucosa o su ausencia es observada en presencia de carcinomas, cicatrices o procesos inflamatorios.
No hay trabajos específicos sobre el valor de la videoestroboscopia en el diagnóstico de los tumores de la comisura anterior. Este hecho se debe probablemente a que la dificultad en el diagnóstico y tratamiento de estos tumores no está asociada tanto a diferenciar la alteración en la movilidad de la cuerda como a conocer la infiltración ventral en una dirección craneocaudal. No obstante cabe señalar que, en el diagnóstico del cáncer glótico precoz, la videoestroboscopia presenta una sensibilidad elevada, pero con una especificidad variable y en general baja, que da lugar a una sobrevaloración de lesiones no infiltrativas14.
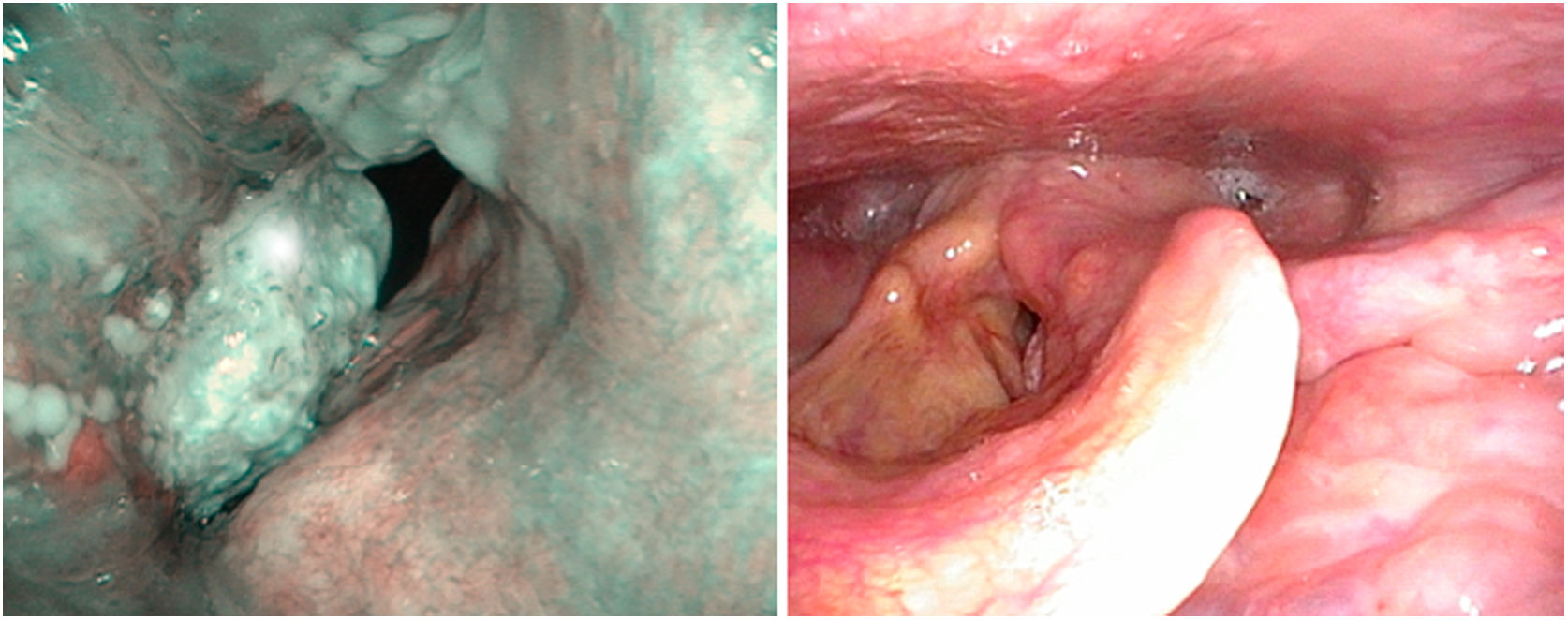
Los sistemas de NBI se utilizan actualmente para mejorar la precisión diagnóstica de lesiones neoplásicas y no neoplásicas. Para distinguir la naturaleza de los hallazgos se aplican los patrones de los cambios vasculares observados en la mucosa laríngea y su relación con cambios histopatológicos establecidos por Ni en 201115. Estos patrones se han completado con la guía descriptiva de cambios vasculares en la cuerda vocal, publicados por la Sociedad Europea de Laringología en 2018, estableciendo que cambios en la dirección perpendicular de los bucles vasculares están asociados a las neoplasias glóticas16. Su utilidad en el diagnóstico clínico ha sido señalada en series retrospectivas por varios autores17–19.
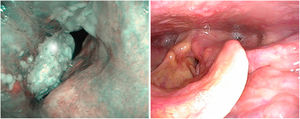
No hay estudios específicos en tumores con afectación de la comisura anterior, aunque sí una revisión sistemática y metaanálisis que analiza el punto de corte entre lesiones premalignas y malignas y los patrones iv y v de la clasificación de Ni. Ambos patrones predicen la presencia de neoplasia con diferencias en la especificidad, mayor en el patrón v y en la sensibilidad mayor en el patrón iv. De tal forma, que en ocasiones el patrón iv corresponde a displasia leve o moderada20 (fig. 5)
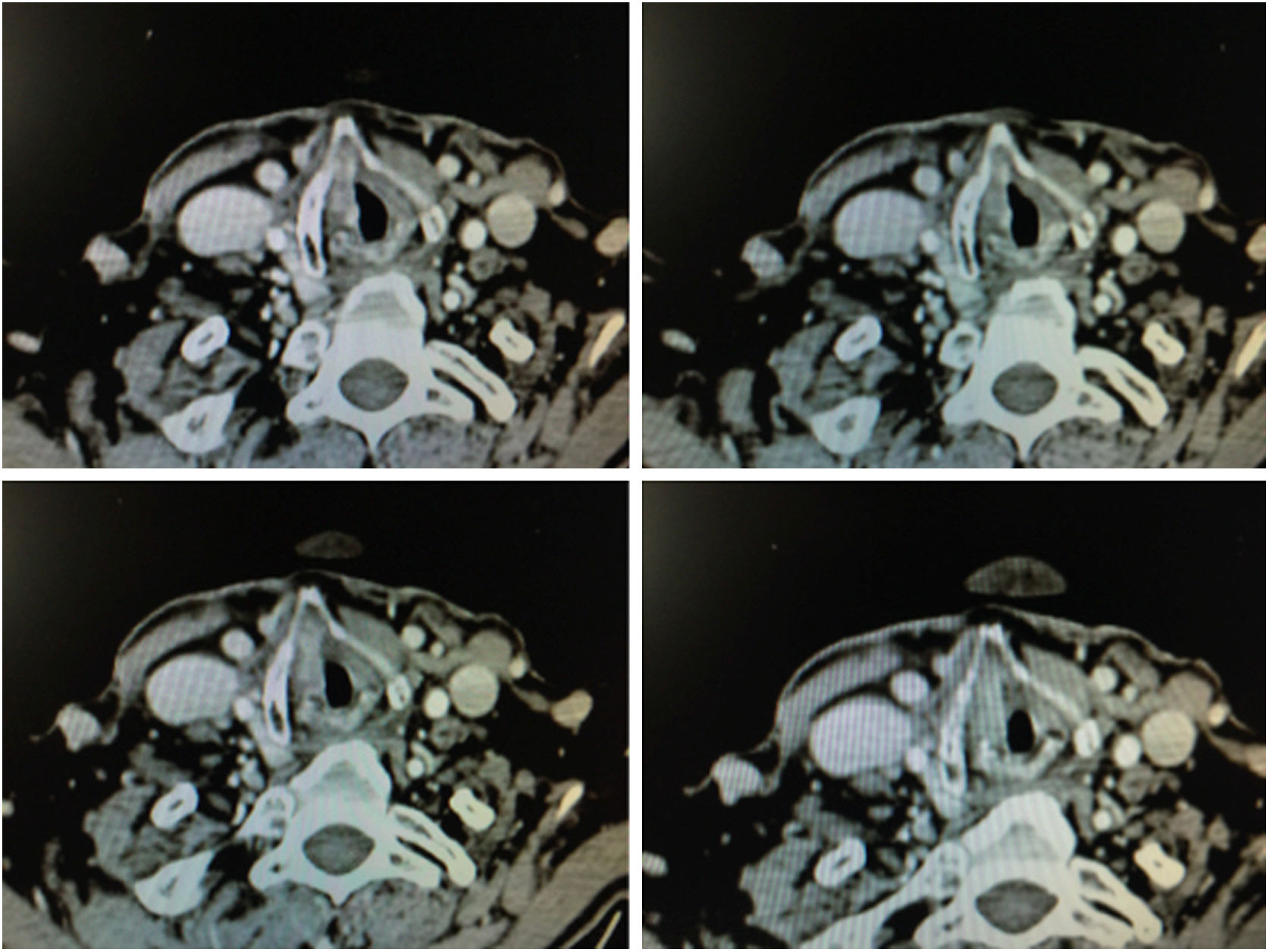
1.4. Pruebas de imagenLas imágenes obtenidas mediante cortes de tomografía computarizada helicoidal de 1mm de grosor mejoran la precisión diagnóstica con respecto a la imagen endoscópica en tumores en estadios precoces con afectación de la comisura anterior21.
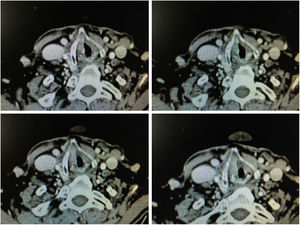
Los criterios radiográficos para considerar la presencia de una afectación de la comisura son: engrosamiento de la comisura anterior mayor de 1mm en al menos 2 cortes tomográficos consecutivos en un plano horizontal, o en un plano vertical (reconstrucción sagital) la presencia de un engrosamiento en la comisura que avanza hacia el espacio preepiglótico superiormente, hacia el cartílago tiroides anteriormente o hacia el cartílago cricoides inferiormente (fig. 6).
La resonancia magnética utilizada para el estudio de la invasión de la comisura anterior es más sensible que la tomografía computarizada, aunque menos específica. La presencia de inflamación peritumoral puede confundir los límites del tejido afecto, y como resultado se puede realizar una sobreestadificación de la neoplasia22. Por otro lado, aunque la afectación del cartílago tiroides en los estadios precoces es inferior al 9%, es necesario dentro del proceso diagnóstico poder discernir si el cartílago se encuentra afecto.
La sensibilidad de la tomografía computarizada es del 91% y la especificidad del 68% en presencia de esclerosis, erosión o lisis del cartílago tiroides, todos ellos signos indirectos de su afectación. Si no se tiene en cuenta la presencia de esclerosis la especificidad alcanza unas cifras del 92%, aunque la sensibilidad disminuye al 61%. En el caso de la resonancia magnética la sensibilidad alcanza valores del 86-94% y la especificidad entre el 74% y el 88%23.
Hartl et al. intentan establecer qué características de los tumores de la comisura anterior ayudan a predecir la invasión del cartílago tiroideo. Entre las estudiadas se encuentran la extensión supraglótica y subglótica, lesiones bicordales o alteración de la movilidad cordal. Solo en presencia de paresia o parálisis de la cuerda vocal se observa un incremento del riesgo en la invasión del cartílago24.
1.5. Clasificación de los tumores precoces de la comisura anteriorLa clasificación de la AJCC de los tumores malignos de la glotis establece 3 áreas anatómicas diferenciadas: cuerdas vocales, comisura anterior y comisura posterior. El T1 glótico viene definido por un cáncer limitado a la cuerda vocal con movilidad normal y que puede afectar la comisura anterior o la posterior, T1a en el caso de tumor limitado a una cuerda vocal y T1b cuando afecta a ambas cuerdas vocales. El T2 se define como un tumor que afecta a la glotis y se extiende a la supraglotis y/o subglotis y/o afectación de la movilidad de la cuerda vocal. En el caso de afectación de la movilidad se clasifica en T2b25. Por lo tanto, los tumores de la comisura anterior no tienen una clasificación específica.
Se han publicado diferentes artículos que establecían subclasificaciones con el objetivo de establecer grupos homogéneos que permitan predecir mejor su evolución y su respuesta a los diferentes tratamientos. Rucci et al., en 1996, realizan una propuesta de clasificación basada en sublocalizaciones con mejor predicción pronóstica: tumor confinado exclusivamente en la comisura anterior (AC0), tumor que afecta una cuerda y la comisura anterior (AC1), tumor que afecta la comisura anterior y una parte de ambas cuerdas vocales (AC2) y tumor que afecta la mayor parte de una cuerda vocal, la comisura anterior y cruza afectando una parte variable de la cuerda contralateral (AC3)26. Por otro lado, Peretti et al. también clasifican los tumores T2 glóticos en 4 tipos en función de su localización y profundidad. El T2 (iii) está definido por la extensión anterior supracomisural o subcomisural27. A pesar de estas propuestas su uso no se ha generalizado.
1.6. TratamientoLas opciones de tratamiento para el tumor glótico en estadio precoz (T1-T2) con afectación de la comisura anterior son radioterapia, microcirugía transoral con láser CO2 y laringectomía parcial mediante abordaje externo28. La radioterapia conlleva unos resultados funcionales de voz mejor que la microcirugía transoral con láser CO2, si bien el porcentaje de pacientes con preservación final de la laringe es menor.
Dentro de las opciones quirúrgicas la microcirugía transoral con láser CO2 (TLMS CO2/TOLMS CO2)29 no está exenta de dificultad en la exposición laríngea y requiere experiencia y habilidad del cirujano. La laringectomía parcial abierta es una opción terapéutica con excelentes resultados oncológicos, aunque el impacto en la deglución y la fonación es mayor que en la TLMS CO2. Por último, la laringectomía total mejora el control local, pero reduce de forma significativa la calidad de vida.
Radioterapia y comisura anteriorLa influencia de la comisura anterior en los resultados oncológicos posterior al tratamiento con radioterapia sigue siendo controvertida. Varias publicaciones sugieren que su afectación es un factor predictivo de menor respuesta en comparación con tumores glóticos sin afectación de la comisura anterior30–32.
El control local a los 5 años en pacientes con tumor en estadio precoz extendido a la comisura anterior y tratados con radioterapia se sitúa entre el 55% y el 80%, inferior al obtenido en tumores sin afectación de la comisura, que oscila entre el 82% y el 90%33. En la misma línea, en las últimas revisiones sistemáticas y metaanálisis publicados sobre los factores de riesgo de persistencia tumoral o recidiva en cáncer glótico tratado con radioterapia, la comisura anterior es identificada como un factor desfavorable (RR: 0,904)34. Sin embargo, en otros estudios la comisura anterior no se identifica como un parámetro de peor control local35. Así, en un análisis multivariante sobre factores predictores de resultados oncológicos a largo plazo en T1-T2N0 glóticos tratados con radioterapia, donde se incluye la afectación de la comisura anterior, el mantenimiento del hábito tabáquico durante y después del tratamiento y los tumores T2 son las únicas variables en relación con un peor control local36.
Las causas de la discrepancia entre estos resultados no parecen claras. Algunos autores indican que las dosis por sesión o la realización de hiperfracionamiento podrían tener influencia en el control local37. Este hecho ha conducido a proponer dosis de 2,25Gy con hiperfraccionamiento en T1 glótico y protocolos de radioterapia y quimioterapia en T2 glótico con afectación de la comisura anterior para mejorar el control local33,38. Con respecto a este último esquema de tratamiento no hay evidencia clara de la mejora de los resultados oncológicos con respecto a la radioterapia en monoterapia, si bien es una línea de investigación actual.
Cirugía abierta y comisura anteriorAunque las publicaciones sobre resultados oncológicos de la laringectomía parcial por vía externa como opción terapéutica en tumores glóticos con afectación de la comisura anterior han disminuido en los últimos años, la laringectomía parcial horizontal supracricoidea se sigue considerando una opción de tratamiento excelente, sobre todo en aquellos casos en que existe una limitación en la exposición laríngea y extensión subglótica menor de 5mm. No solo en este supuesto es aconsejada por diferentes autores, sino también en T2b glótico con extensión a la comisura anterior. Los argumentos esgrimidos se basan en que son tumores con peor control local, con peores resultados en la supervivencia y con mayor número de hallazgos adversos (infiltración del pericondrio, invasión del cartílago, infiltración perineural y metástasis prelaríngeas) en relación con los T2a. Su evolución es comparable a los T339. Este último argumento es compartido por Blanch et al., aunque no ven contraindicación en indicar microcirugía transoral con láser CO2 siempre que sea realizada por un cirujano experto40. La laringectomía parcial vertical ha caído en desuso frente a la horizontal supracricoidea debido principalmente al mejor control oncológico y a los mejores resultados funcionales.
Las tasas publicadas de supervivencia global, supervivencia específica por enfermedad y supervivencia sin recidiva a los 5 años en T1-T2 con afectación de la comisura anterior, tratados con laringectomía parcial supracricoidea con cricohioidoepiglotopexia, son del 93,7%, 95,6% y 87,7% respectivamente41. La última serie publicada por Pescetto et al., en 2018, que incluye T1, T2 y T3 con afectación de la comisura anterior obtiene unos resultados de supervivencia global, supervivencia específica por enfermedad y supervivencia sin recidiva del 86%, 95% y 75% respectivamente a los 5 años42.
Teniendo en cuenta que los resultados oncológicos obtenidos en general son excelentes, es el impacto sobre la deglución y la fonación la principal limitación en esta opción terapéutica. La valoración de la disfagia mediante la escala de Pearson y la Dysphagia Outcomes and Severity Scale en los trabajos de Schindler et al. y Pescetto et al. son similares, con un 96% de pacientes que consiguen alimentarse por vía oral y un 19% de pacientes que presentan falsa vía para la ingestión de líquido de forma intermitente42,43. La edad mayor de 70 años y la resección de aritenoides se consideran factores de riesgo que predicen la dificultad de la deglución44.
Microcirugía transoral con láser CO2 y comisura anteriorExposición laríngeaLa exposición adecuada de la comisura anterior es determinante para poder realizar una apropiada resección con márgenes libres si la opción terapéutica elegida es la microcirugía transoral con láser CO2. La incidencia de la dificultad en la exposición laríngea puede encontrarse en un rango desde un 1% a un 24%45.
Los parámetros clínicos que pueden predecir la dificultad en la exposición laríngea de forma independiente, estudiados en un análisis multivariante por Pinar et al. son una circunferencia de cuello mayor de 40cm, una distancia hioides mentón en extensión completa menor de 6,05cm y una distancia esternón mentón en extensión completa menor de 13,9cm. El índice de masa corporal era un factor influyente, pero no independiente45.
Con el objetivo de conocer las dificultades previas a la realización de la cirugía Piazza et al. definen en 2014 una serie de parámetros a valorar en la exploración clínica del paciente que ayudan a predecir la dificultad en la exposición laríngea. Estos son: el espacio entre los incisivos, la distancia tiroides mentón, la presencia de trismus, la valoración del prognatismo mandibular, la existencia de macroglosia o micrognatia, el grado de flexión-extensión del cuello, la existencia de tratamientos previos quirúrgicos, el índice de Mallampati modificado y el índice de masa corporal46.
Con respecto a la comisura anterior establece 4 clases de exposición laríngea en relación con el diámetro del laringoscopio, la posición y la presión externa. La clase 0 donde se visualiza la comisura anterior con un laringoscopio de diámetro amplio y la posición de Boyce-Jackson sin presión externa, la clase i donde además de los requisitos anteriores es necesario presión externa, la clase ii donde hay que modificar la posición en flexión-flexión (barbilla-tórax), la clase iii que precisa un cambio a un laringoscopio de pequeño diámetro, posición de flexión-flexión y presión externa correspondiendo a una puntuación de 6 en la escala de valoración clínica y la clase iv, donde no es posible visualizar la comisura y corresponde a una puntuación de 9. Los diferentes grados de dificultad en la exposición de la comisura anterior se correlacionan con la afectación de márgenes en la resección tumoral47.
A pesar de que no es una escala de valoración que se utilice de forma general, sí existe consenso en que la flexión de la cabeza y la presión externa laríngea son maniobras que permiten mejorar la visualización del tumor y ayudan a dirigir el rayo láser en un eje coaxial con respecto a la comisura anterior40,48.
Curva de aprendizajeLa experiencia en microcirugía transoral con láser CO2 se considera un factor importante a la hora de abordar este tipo de tumores. Bernal-Sprekelsen et al. relacionan los niveles de experiencia del cirujano con la frecuencia de complicaciones, los márgenes afectos, el porcentaje de recidiva, el tipo de cirugía de rescate y la supervivencia específica por enfermedad, tanto en tumores en estadios precoces como en avanzados. Los autores consideran que la realización de la cordectomía tipo v requiere ser realizada por un cirujano experto que haya realizado al menos sesenta procedimientos de cirugía transoral con láser CO249.
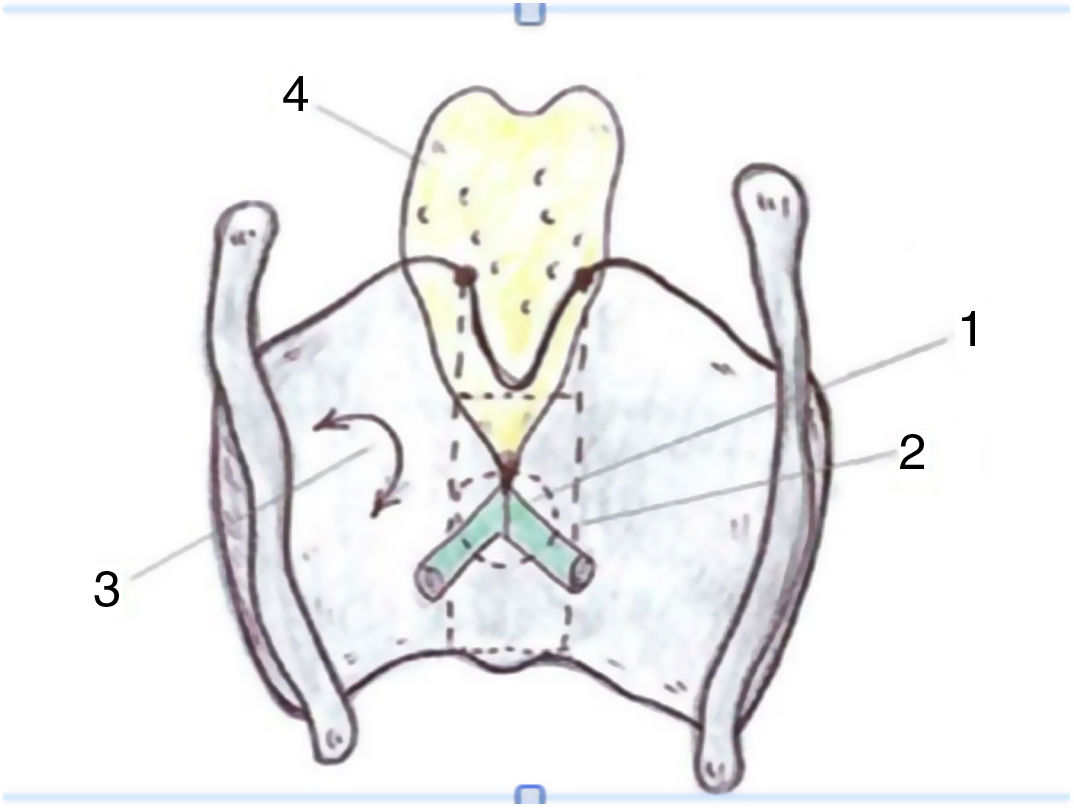
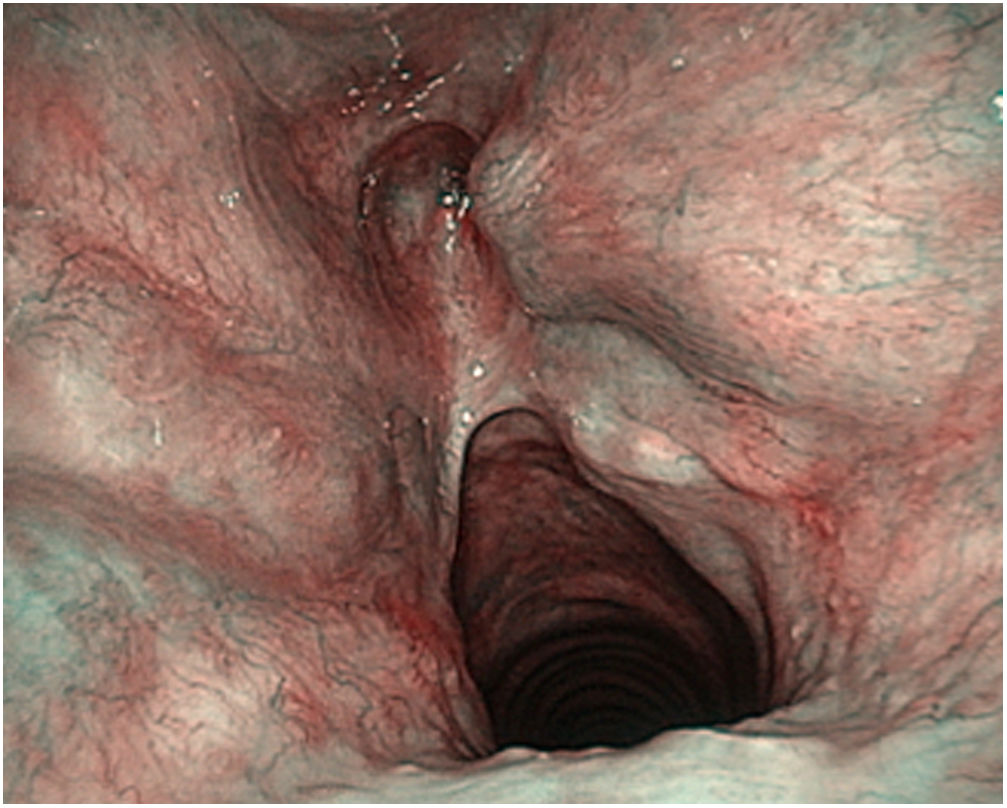
Estos autores ponen de manifiesto la importancia de la curva de aprendizaje en el tratamiento de los tumores T2 con expansión vertical craneocaudal. En estas circunstancias el porcentaje de recidiva local disminuye cuando la experiencia del cirujano es mayor, pero sobre todo si se realiza una resección adecuada del tercio anterior de las bandas, del peciolo de epiglotis y de la grasa inferior del espacio preepiglótico en forma de agujero de cerradura o keyhole40 (fig. 7).
Clasificación de cordectomíasLa European Laryngological Society clasifica las cordectomías en 6 tipos, dividiendo el tipo 5 en 4 subtipos. La cordectomía tipo Va está indicada en neoplasia de cuerda vocal que afecta superficialmente la comisura anterior. La resección incluye la comisura anterior y la cuerda vocal de forma parcial o completa. La cordectomía tipo VI se define por una resección de la comisura anterior y de tercio anterior de ambas cuerdas vocales. Se acompaña de la resección del peciolo de la epiglotis, de las bandas ventriculares en su tercio anterior y de la mucosa subglótica50.
La diferencia entre tipo Va y tipo vi es el origen del tumor. En el tipo Va el tumor se desarrolla en la cuerda y afecta la comisura anterior, siguiendo el plano horizontal, mientras que en el tipo vi el tumor se origina en la comisura anterior y crece siguiendo un plano vertical.
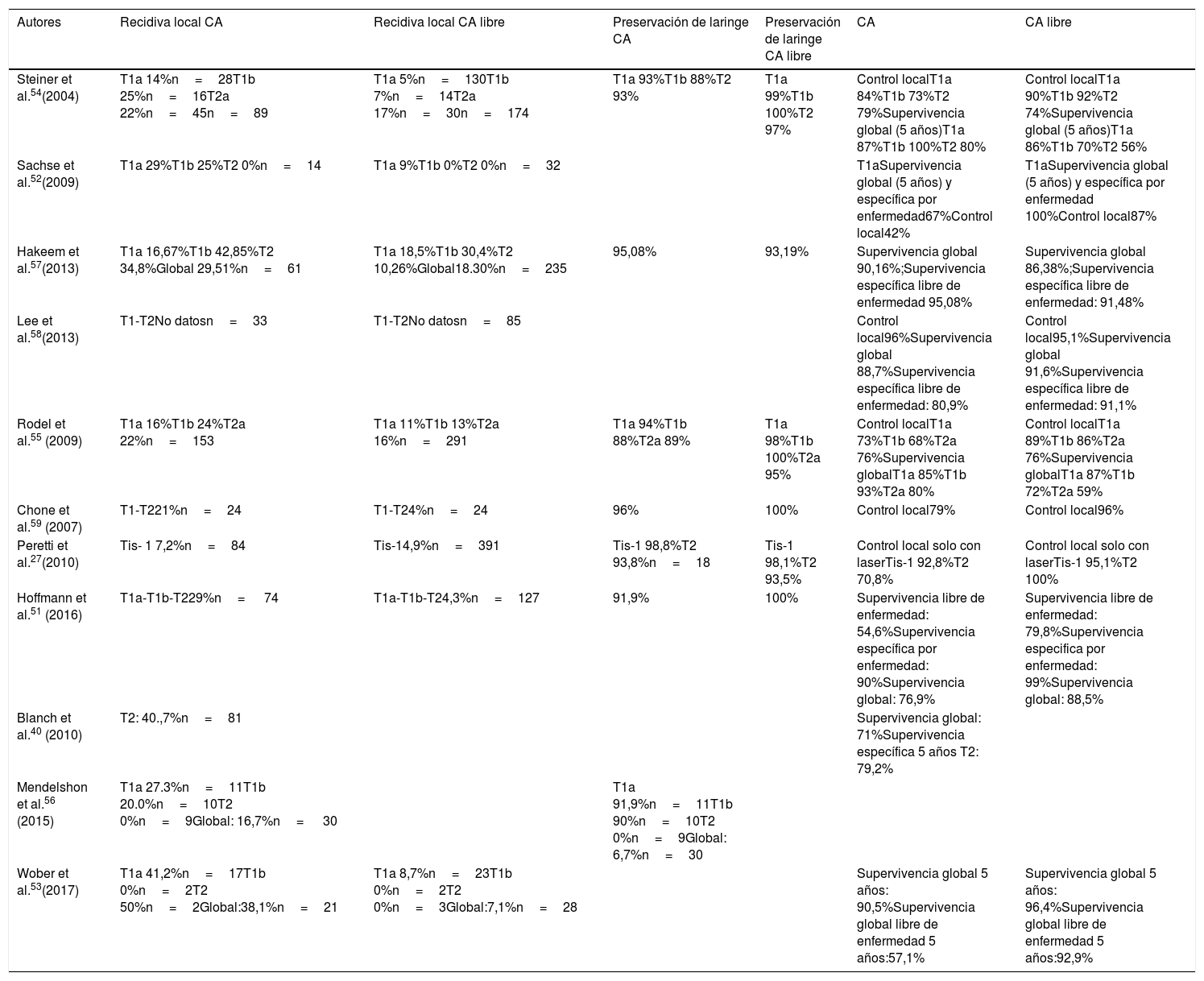
Resultados oncológicosLa diferencia de los resultados en el control local observados en las publicaciones analizadas puede ser consecuencia de la diferente experiencia del cirujano, de la clasificación no homogénea de los diferentes subgrupos y de la heterogeneidad en la selección de pacientes (tabla 1).
Series representativas de tumores con afectación de la comisura anterior tratados con cirugía transoral con láser CO2
| Autores | Recidiva local CA | Recidiva local CA libre | Preservación de laringe CA | Preservación de laringe CA libre | CA | CA libre |
|---|---|---|---|---|---|---|
| Steiner et al.54(2004) | T1a 14%n=28T1b 25%n=16T2a 22%n=45n=89 | T1a 5%n=130T1b 7%n=14T2a 17%n=30n=174 | T1a 93%T1b 88%T2 93% | T1a 99%T1b 100%T2 97% | Control localT1a 84%T1b 73%T2 79%Supervivencia global (5 años)T1a 87%T1b 100%T2 80% | Control localT1a 90%T1b 92%T2 74%Supervivencia global (5 años)T1a 86%T1b 70%T2 56% |
| Sachse et al.52(2009) | T1a 29%T1b 25%T2 0%n=14 | T1a 9%T1b 0%T2 0%n=32 | T1aSupervivencia global (5 años) y específica por enfermedad67%Control local42% | T1aSupervivencia global (5 años) y específica por enfermedad 100%Control local87% | ||
| Hakeem et al.57(2013) | T1a 16,67%T1b 42,85%T2 34,8%Global 29,51%n=61 | T1a 18,5%T1b 30,4%T2 10,26%Global18.30%n=235 | 95,08% | 93,19% | Supervivencia global 90,16%;Supervivencia específica libre de enfermedad 95,08% | Supervivencia global 86,38%;Supervivencia específica libre de enfermedad: 91,48% |
| Lee et al.58(2013) | T1-T2No datosn=33 | T1-T2No datosn=85 | Control local96%Supervivencia global 88,7%Supervivencia específica libre de enfermedad: 80,9% | Control local95,1%Supervivencia global 91,6%Supervivencia específica libre de enfermedad: 91,1% | ||
| Rodel et al.55 (2009) | T1a 16%T1b 24%T2a 22%n=153 | T1a 11%T1b 13%T2a 16%n=291 | T1a 94%T1b 88%T2a 89% | T1a 98%T1b 100%T2a 95% | Control localT1a 73%T1b 68%T2a 76%Supervivencia globalT1a 85%T1b 93%T2a 80% | Control localT1a 89%T1b 86%T2a 76%Supervivencia globalT1a 87%T1b 72%T2a 59% |
| Chone et al.59 (2007) | T1-T221%n=24 | T1-T24%n=24 | 96% | 100% | Control local79% | Control local96% |
| Peretti et al.27(2010) | Tis- 1 7,2%n=84 | Tis-14,9%n=391 | Tis-1 98,8%T2 93,8%n=18 | Tis-1 98,1%T2 93,5% | Control local solo con laserTis-1 92,8%T2 70,8% | Control local solo con laserTis-1 95,1%T2 100% |
| Hoffmann et al.51 (2016) | T1a-T1b-T229%n= 74 | T1a-T1b-T24,3%n=127 | 91,9% | 100% | Supervivencia libre de enfermedad: 54,6%Supervivencia específica por enfermedad: 90%Supervivencia global: 76,9% | Supervivencia libre de enfermedad: 79,8%Supervivencia especifica por enfermedad: 99%Supervivencia global: 88,5% |
| Blanch et al.40 (2010) | T2: 40.,7%n=81 | Supervivencia global: 71%Supervivencia específica 5 años T2: 79,2% | ||||
| Mendelshon et al.56 (2015) | T1a 27.3%n=11T1b 20.0%n=10T2 0%n=9Global: 16,7%n= 30 | T1a 91,9%n=11T1b 90%n=10T2 0%n=9Global: 6,7%n=30 | ||||
| Wober et al.53(2017) | T1a 41,2%n=17T1b 0%n=2T2 50%n=2Global:38,1%n=21 | T1a 8,7%n=23T1b 0%n=2T2 0%n=3Global:7,1%n=28 | Supervivencia global 5 años: 90,5%Supervivencia global libre de enfermedad 5 años:57,1% | Supervivencia global 5 años: 96,4%Supervivencia global libre de enfermedad 5 años:92,9% |
CA: comisura anterior.
Hoffman et al. en el estudio de una cohorte amplia de 201 pacientes tratados con microcirugía transoral con láser CO2 encuentran que el único factor predictivo de resultados desfavorables en la tasa de supervivencia libre de enfermedad y control local es la afectación de la comisura anterior51. Estos resultados concuerdan con la serie publicada por Sachse et al., donde la afectación de la comisura anterior es un factor que disminuye el control local, y por Wober et al., donde la afectación de la comisura anterior aumenta las tasas de recidiva52,53.
El trabajo de Steiner y Ambrosch en 2004 representa una de las series más amplias sobre tumores glóticos con afectación de la comisura anterior. En el desglose por subgrupos el T1a es el que presenta mayor diferencia en el control local en función de la afectación de la comisura anterior. Teniendo en cuenta todos los estadios T1a, T1b y T2 los autores no encuentran diferencias significativas en el control local con o sin afectación comisural, si bien es cierto que presenta limitaciones, ya que la potencia estadística del estudio es menor del 80%54.
En la serie de Rodel et al., publicada 4 años después, la diferencia en el control local afecta tanto al T1a como al T1b55. En la misma línea Mendelshon et al. encuentran que las recidivas locales afectan fundamentalmente a T1a y T1b56. Sin embargo, en la serie de Hakeem et al. las diferencias en el control local afectan fundamentalmente a T2. Teniendo en cuenta todos los casos los autores no encuentran diferencias significativas en la supervivencia global, supervivencia específica por enfermedad y en la preservación de la laringe entre neoplasias con o sin afectación de la comisura anterior57.
Estos resultados del control local en T1a y T1b hacen reflexionar sobre la dificultad del tratamiento quirúrgico, incluso en pequeñas lesiones que afectan superficialmente a la comisura. No obstante, los resultados no son similares en todas las series. Así, Lee et al. no encuentran un efecto significativo de la extensión tumoral a la comisura anterior en el control local o en la supervivencia, hecho que asocian a una adecuada selección de pacientes, exposición del tumor y experiencia del cirujano58.
Chone et al. tampoco encuentran diferencias en el control local entre neoplasia con afectación de la comisura o no, aunque observan una tendencia a la recidiva local en los T1 con extensión comisural. El número pequeño de la serie constituye una limitación para establecer diferencias significativas59.
Peretti et al., con el objetivo de poder observar el diferente comportamiento de los T2 glóticos tratados con cirugía transoral con láser CO2, los clasifica en 4 subcategorías. El pT2 (iii) incluye una extensión supracomisural y/o subcomisural. Los pacientes de este subgrupo tienen peor control local, que no se ve afectado en la tasa de conservación de la laringe si se realiza rescate con cirugía parcial abierta ante la presencia de recidiva precoz27. Blanch et al. analizan los resultados en T2 y T3 con afectación de la comisura anterior, no encontrando diferencias entre ambas categorías y la probabilidad de recidiva local. Estos resultados sustentan la agresividad del T2 con un comportamiento biológico similar a T340. En la serie de Canis et al. los autores también concluyen que los pT2b glóticos tienen un comportamiento biológico similar a los pT360.
No existen series publicadas sobre tratamiento en tumores de la comisura anterior mediante cirugía transoral utilizando fibra de laser CO2.
Márgenes quirúrgicosLa National Comprehensive Cancer Network Guideline define como un margen adecuado en microcirugía transoral con láser CO2 una distancia de 1,5-2mm entre el frente invasivo del tumor y el borde de la pieza, considerando un borde próximo una distancia entre 0 y 1mm61. En la mayoría de las series se considera 2mm como margen adecuado.
En ocasiones el límite entre margen afecto o próximo es difícil de establecer por el daño térmico producido en los bordes, el reducido tamaño del tumor y su disminución en el proceso de fijación de la pieza.
Los márgenes positivos de las diferentes series oscilan desde el 9% hasta el 25,9%62–64. No obstante, los márgenes considerados positivos histológicamente no siempre se corresponden con persistencia tumoral. En la revisión de Jackel et al. solo el 18% de los pacientes a los que se realizó una segunda cirugía por márgenes dudosos o positivos lo fueron65. Canis et al. también apoyan estos datos considerando por encima del 80% los falsos positivos de márgenes próximos o positivos66.
Estos hechos, junto con la indefinición en los trabajos sobre si los márgenes positivos corresponden al margen superficial o profundo, o si la positividad es en un punto o en varios, hacen más complejo valorar su impacto en el control local y la tasa de supervivencia libre de enfermedad.
Los trabajos de Charbonnier et al. relacionan el margen profundo positivo del músculo vocal en T2b con tasas menores de supervivencia libre de enfermedad. No encuentran en su serie un porcentaje elevado de márgenes positivos en tumores con afectación de la comisura, ya que en caso de afectación en profundidad optan por realizar laringectomía parcial abierta67.
Con el objetivo de limitar el riesgo de márgenes positivos algunos cirujanos utilizan el análisis de secciones congeladas intraquirúrgicas. Remacle et al. consideran de utilidad esta propuesta por su valor predictivo negativo68. Fang et al. también encuentran relación entre los márgenes positivos intraquirúrgicos en pieza congelada, la recidiva local y la supervivencia global en el primer año de seguimiento. Si bien aporta un dato desconcertante, ya que se mantiene esta relación, aunque se hayan realizado ampliaciones del campo quirúrgico. Este hecho lo justifica en la dificultad de identificar con claridad el tumor en una extensión submucosa o la existencia de una zona más amplia de cancerización no definida69.
No obstante, el uso generalizado de muestras intraoperatorias no es sencillo, puesto que la precisión en el diagnóstico a partir de las muestras congeladas intraquiúrgicas es dependiente de la experiencia y del soporte técnico70.
El estudio de Fiz et al. aporta mayor claridad sobre la importancia de los márgenes afectos. Los estratifica en negativos, positivos o próximos, superficial o profundo y afectación en un punto único o múltiple. En su serie los márgenes próximos superficiales no tienen impacto en la supervivencia libre de enfermedad. Por el contrario, en todos los demás supuestos aumenta la posibilidad de recidiva71. Gallet et al. confirman también estos resultados en un análisis multivariante sobre factores de riesgo relacionados con el control local y el riesgo de recidiva. Los márgenes positivos o dudosos y la afectación de la comisura son factores de riesgo independientes con peores resultados72.
En el trabajo de Jackel et al., ya mencionado, los márgenes afectos que pueden tratarse con una nueva resección afectan al control local, pero no a la supervivencia global. En caso de márgenes afectos en la segunda reescisión sí se ve comprometida la supervivencia global65. La realización de una reescisión en márgenes dudosos obtiene unos resultados oncológicos finales similares a los obtenidos con márgenes libres en la primera resección en los trabajos de Wilkie y Karatzanis70,73.
Los trabajos de Valletti et al. consideran que los márgenes profundos positivos y multifocales se relacionan con una tasa de conservación laríngea menor, mientras que el margen afecto superficial en una cordectomía tiene impacto en el control local, pero no en las tasas de supervivencia74. En esta misma línea Lucioni et al. asocian una tasa más elevada de recidiva y menor supervivencia específica por enfermedad en caso de afectación de margen profundo75.
Por lo tanto, sigue existiendo cierta controversia sobre la actitud más adecuada si los márgenes no son claramente negativos, ¿observación clínica o reescisión de márgenes? No hay que olvidar que una segunda reescición conlleva una pérdida de tejido con un incremento de la cicatriz y peor calidad de voz. En esta situación la experiencia del cirujano y la valoración intraoperatoria parecen aspectos relevantes que influirán en la decisión final76.
La imagen con luz de banda estrecha, tanto intraoperatoriamente como durante el seguimiento de los pacientes, mejora la precisión en el diagnóstico de márgenes afectos o de recidivas precoces77,78. La Sociedad Europea de Laringología y la Sociedad Coreana de Tiroides y Cirugía de Cabeza y Cuello recomiendan su utilización, si bien la evidencia que sustenta esta sugerencia es de baja calidad79,80.
La utilización de la vaporización del lecho quirúrgico mediante fotocoagulación también ha sido motivo de estudio y de opiniones diversas. En la serie publicada por Lucioni et al. los autores concluyen que la utilización de la fotocoagulación mejora el control local en márgenes superficiales cercanos o positivos, y no parece influir si la afectación es en el margen profundo62.
Aunque no existen grandes series sobre el papel que desempeña la radioterapia en caso de bordes dudosos o positivos en el tumor extendido a la comisura anterior, en el trabajo realizado por Stephenson et al. sí se encuentra utilidad a la radioterapia adyuvante en este tipo de lesiones, ya que se relaciona con un buen control local y elevadas tasas de conservación de la laringe en el seguimiento. El estudio tiene limitaciones al no identificar si los márgenes afectos son superficiales o profundos81. Peretti et al. también comentan en su trabajo que en caso de márgenes profundos positivos después de una reescisión endoscópica la cirugía abierta o radioterapia es una opción prudente para mejorar la tasa de preservación laríngea27.
Por el contrario, en el trabajo publicado por Ansarin et al., comparando la utilización de radioterapia adyuvante en márgenes positivos y seguimiento clínico sin radioterapia, no se obtuvieron diferencias significativas en el porcentaje de pacientes que recidivaron64.
En general, la terapia multimodal para tumores glóticos en estadios precoces no está aconsejada, y parece razonable que si hay dudas sobre la resección con márgenes adecuados podría tratarse desde el principio con radioterapia, evitando costes biológicos para el paciente.
Comparativa de seriesLos estudios comparativos entre las diferentes opciones terapéuticas para tumor glótico en estadio precoz con extensión a la comisura anterior se basan, en general, en series retrospectivas con ausencia de estudios prospectivos aleatorizados comparativos.
Se expondrán las series y revisiones sistemáticas más interesantes.
Cirugía versus radioterapiaEn los años noventa empiezan ya a publicarse algunas series comparativas entre laringectomía parcial abierta y radioterapia con resultados variables.
Así, en la serie de Zohar et al. el control local era mejor en los pacientes tratados inicialmente con la opción quirúrgica82. Sin embargo, en la serie de Rucci et al. el control local era superior en los pacientes tratados inicialmente con radioterapia en tumores de la comisura anterior. No obstante, el rescate quirúrgico posterior a las recidivas de los pacientes tratados inicialmente con cirugía tenía mejores resultados oncológicos que el rescate quirúrgico posterior a la recidiva de pacientes tratados con radioterapia83. Más tarde, Bron et al. comparando cirugía (cordectomía endoscópica con o sin láser, cordectomía por laringofisura y cricohioidoepiglotopexia) con radioterapia observan un mejor control local y preservación laríngea final en los pacientes tratados quirúrgicamente que en los tratados con radioterapia84.
La comparativa de T1b tratados con radioterapia y con microcirugía transoral con láser CO2 en el estudio multicéntrico de Canadá no demuestra diferencias estadísticamente significativas en el control local ni en la tasa de preservación laríngea. Los autores achacan estos resultados al pequeño tamaño de la serie, aunque apuntan que sí hay diferencias clínicas con mejores resultados a favor de TLMS CO2 en ambos parámetros33.
Recientemente, el estudio comparativo de pacientes T1a y T1b tratados con radioterapia o con microcirugía transoral con láser CO2 de Alkan et al. no encuentra diferencias estadísticamente significativas en el control local ni en la supervivencia global. Sin embargo, la tasa de recidiva es mayor y la supervivencia libre de enfermedad es más baja en pacientes tratados con TLMS CO2. La ausencia de prueba de imagen previa y el mayor porcentaje de pacientes tratados con la opción de radioterapia puede ser un sesgo para los resultados del estudio85.
En relación con las revisiones sistemáticas, la ausencia de distinción clara entre T1b y T2 con extensión a la comisura anterior, la heterogeneidad de las tasas de resultados oncológicos valorados y la falta de estudios aleatorizados comparativos son las mayores limitaciones para realizar un análisis de resultados con calidad metodológica.
La revisión sistemática en T1a y T1b glótico realizada por ÓHara et al., comparando TLMS CO2 versus radioterapia, no encuentra diferencias demostrables entre las tasas de control local en T1a, aunque sí observa una tendencia de mejor control local en T1b en pacientes tratados con radioterapia. El propio autor ve limitaciones a la revisión en estos tumores por el escaso número de casos86.
En 2018 se publica un metaanálisis sobre resultados oncológicos y de la calidad de voz comparando microcirugía transoral con láser CO2 y radioterapia en pacientes con Tis y T1a glótico. Los resultados de supervivencia global, supervivencia específica por enfermedad y preservación laríngea son mejores en los pacientes tratados inicialmente mediante cirugía transoral con láser CO287. Estos resultados concuerdan con los obtenidos por Huang et al. en su metaanálisis con respecto a la preservación de la laringe. Sin embargo, nada aportan para los tumores con extensión a la comisura anterior88.
La última revisión sistemática publicada en 2018 sobre resultados oncológicos y funcionales de tumores T2 glóticos tratados con cirugía versus radioterapia incluyen los estudios de Hoffmann et al., Peretti et al., Blanch et al., Canis et al. y Rodel et al. de T2 con afectación de la comisura anterior ya citados anteriormente. En esta revisión se concluye que la preservación laríngea para tumores T2 es superior en pacientes tratados con TLMS CO2 que con radioterapia. La afectación de la comisura anterior no conlleva peores resultados oncológicos si la estadificación y el tratamiento han sido correctos89.
Laringectomía parcial abierta versus TLMS CO2La comparación de resultados oncológicos entre técnicas quirúrgicas parciales abiertas y TLMS CO2 se ha modificado a lo largo del tiempo. La laringectomía parcial frontolateral y la cordectomía por vía externa ha ido dando paso a la laringectomía supracricoidea.
Sachse et al. realizan un estudio retrospectivo comparando cirugía abierta (cordectomía externa o laringectomía parcial frontolateral) y microcirugía transoral con láser CO2 en pacientes T1a-T2 con afectación de la comisura anterior sin encontrar diferencias significativas en la tasa de recidiva local52. Mantsopoulos et al. tampoco encuentran diferencias significativas en el control local y la supervivencia específica por enfermedad entre laringectomía parcial frontolateral y TLMS CO2 en T2 glóticos extendidos a la comisura anterior90.
Wolber et al. realizan un estudio comparativo entre los resultados de TLMS CO2 y de cirugía abierta en tumores con afectación de la comisura anterior. Encuentran diferencias significativas con mayor número de recidiva local en pacientes tratados con láser CO2 sin diferencias en la supervivencia global ni en la supervivencia libre de enfermedad. Entre las limitaciones del estudio destaca el tamaño pequeño de la serie y la variedad en las técnicas de cirugía abierta utilizadas53.
Laringectomía parcial abierta versus radioterapia versus TLMS CO2Existen pocos estudios que comparen las 3 modalidades terapéuticas en tumores glóticos, y menos aún específicamente en tumores con extensión a la comisura anterior.
En 2011 Hartl et al. publican una revisión sobre la evidencia existente hasta esa fecha de las diferentes opciones de tratamiento en el cáncer glótico. En concreto, en el apartado sobre tumores glóticos con afectación de la comisura anterior llegan a la conclusión de que no hay evidencia de alta calidad que indique la superioridad de un tratamiento frente a otro91.
Giocchini et al. publican una revisión sistemática sobre 2.360 pacientes comparando las 3 opciones de tratamiento en T1b glótico, aunque no diferencian si existía o no extensión a la comisura anterior. Los autores concluyen que la TLMS CO2 presenta tasas de recidiva más elevadas en comparación con la radioterapia y las técnicas abiertas. Sin embargo, no hay diferencias en las tasas de supervivencia global entre las 3 modalidades terapéuticas92.
Cirugía robótica transoralLa cirugía robótica transoral (TORS) para tumores glóticos de la comisura anterior actualmente no aporta beneficios claros con respecto a la microcirugía transoral con láser CO2. El tamaño de los brazos del robot que deben trabajar en un espacio reducido, la dificultad en la exposición que precisa retractores adaptados y la utilización del cauterio monopolar son los mayores hándicaps.
La TORS permite una visión de ángulos del campo quirúrgico en 3D con diferentes grados de rotación del instrumento. Los endoscopios de 8mm y 30° permiten un campo de visión amplio. Por eso, podría aportar mejoras con respecto a la TLMS CO2 en casos donde la visión directa no es posible, como en los espacios limítrofes angulados around the corner93.
En un estudio preliminar de 6 pacientes con cáncer glótico y extensión a la comisura anterior T1b y T2 tratados mediante TORS 2 pacientes recidivaron (33%)94. El papel que desempeñará en un futuro la TORS en el tratamiento de los tumores glóticos con afectación de la comisura está todavía por definir95,96.
1.7. Calidad de vozAunque existen numerosos instrumentos de medida en la valoración de la voz, no se ha establecido el método estándar para valorar el impacto en la voz del paciente tratado con TLMS CO2. Un análisis multidimensional incluiría cuestionarios que reflejan el impacto en la calidad de vida del paciente como el Voice Handicap Index (VHI), el Voice Related Quality of Life Measure o el Voice Symptom Scale, la valoración perceptual de la calidad de voz con la escala GRABS y el análisis acústico. Ambas dimensiones objetivas y subjetivas son recomendadas por el Comité de Foniatría de la Sociedad Europea de Laringología97.
No obstante, la mayoría de los estudios no ofrecen una valoración completa de todas las dimensiones.
Se han publicado metaanálisis que incluyen los resultados de la voz en pacientes tratados con radioterapia versus los pacientes tratados con TLMS CO2 en T1a glóticos, sin especificar su posible extensión a la comisura. Los autores concluyen que, si bien no hay diferencias significativas en el VHI, jitter y shimmer entre ambas opciones terapéuticas, la radioterapia mantiene mejores parámetros en la calidad de voz por tener mayor tiempo máximo de fonación y menor frecuencia fundamental que los pacientes tratados con TLMS CO298,99.
En 2012 se publica una revisión sistemática que intenta comparar los resultados funcionales de voz y deglución en tumores T1a extensos y tumores T2 limitados tratados con TLMS CO2 versus radioterapia. Los autores se encuentran con varias limitaciones para establecer unas conclusiones claras. La comparación entre 2 tipos de tratamiento en ocasiones no es homogénea, comparando resecciones de diferente profundidad y extensión, las series a veces son de pequeño tamaño y las medidas utilizadas para la valoración de los resultados son heterogéneas100.
En relación con el tumor que afecta a la comisura anterior Peretti et al. realizan un análisis de resultados funcionales de voz en pacientes tratados con cordectomía tipo v con ampliación a ventrículo y área subglótica. La puntuación media del VHI, un año posterior a la cordectomía, fue de 20, lo que indicaba una percepción subjetiva de una disfonía leve. En la evaluación perceptual de GRABS se observó que una mayoría de pacientes tenía una disfonía leve (82%) y menos del 20% disfonía moderada. El jitter medio fue de 7,87%, el shimmer de 24,8% y la relación ruido-armónico de 0,37. La edad se relacionó con peores resultados en los parámetros estudiados de calidad de voz101.
El impacto de la rehabilitación con logopedia posterior al tratamiento, ya sea quirúrgico o con radioterapia en tumores con afectación de la comisura anterior, tampoco ha sido suficientemente estudiado. De forma general para tumores glóticos el estudio de Tuomi et al. sobre la rehabilitación de la voz en pacientes tratados con radioterapia concluye que un programa estructurado temprano puede mejorar la función vocal. En su estudio el grupo de rehabilitación con programa estructurado individual mejoró el tiempo máximo de fonación y la relación armónico-ruido102.
La presencia de sinequia anterior laríngea es una de las causas de la disminución de la calidad de voz en los pacientes. Se han utilizado diferentes tipos de técnicas para corregirla: resecciones con láser, colgajos de piel o mucosa, quillas de silastic o teflón y mitomicina. No hay series amplias que permitan establecer cuál es la más efectiva en resultados funcionales103.
1.8. Guías clínicas y artículos de opiniónLas preferencias en las opciones de tratamiento del cáncer glótico con afectación de la comisura anterior dependen en gran medida del desarrollo de las diferentes técnicas en los países. De forma general la radioterapia es una elección de predominio en Canadá, Europa del Norte, Australia, Sudáfrica y en algunos centros de Estados Unidos, mientras que la cirugía es preferida en el Sur de Europa104.
El American College of Radiology considera como primera opción terapéutica para un tumor T1b que afecta al tercio anterior de ambas cuerdas vocales radioterapia a dosis de 2,25Gy, y solo considera la opción de TLMS CO2 adecuada si es realizada por un cirujano con experiencia y siempre que sea posible transformar el abordaje inicial en cirugía abierta si las circunstancias de la extensión tumoral lo requieren105.
En esta misma línea, la guía para el tratamiento quirúrgico del cáncer de laringe de la Sociedad de Cirugía de Cabeza y Cuello y Tiroides Coreana recomiendan cirugía transoral con láser CO2 para cáncer glótico T1-T2 con afectación de la comisura anterior, siempre que los márgenes de resección sean adecuados (débil recomendación y evidencia de calidad moderada)80.
La Guía de práctica clínica sobre la opción terapéutica en tumores glóticos T1, realizada por el Cancer Care Ontario de Canadá, concluye que en caso de tumor de la comisura anterior la afectación de la voz puede ser uno de los factores a considerar para recomendar radioterapia en lugar de cirugía106.
De igual forma, en la guía clínica multidisciplinar del cáncer de laringe del Reino Unido se considera la radioterapia como la opción terapéutica más adecuada, en lugar de cirugía transoral con láser CO2 en aquellos tumores que infiltran difusamente la mucosa de la cuerda vocal y que afectan a la comisura anterior con un gran volumen tumoral107.
Peretti et al. publican en 2016 un artículo de opinión sobre los límites razonables de TLMS CO2 en el cáncer de laringe. En él realizan una reflexión sobre la importancia de distinguir entre tumor de las cuerdas que afecta a la comisura en un plano horizontal de aquel que se extiende y crece en un plano craneocaudal, de tal forma que la dificultad inesperada en la visualización de las lesiones que afectan a la comisura anterior puede conducir a una resección transoral incompleta, siendo un factor pronóstico de resultados oncológicos y funcionales insuficiente. Es por lo tanto necesario una programación precisa del abordaje quirúrgico que haga posible la obtención de márgenes de resección adecuados. Los autores opinan que la indicación es clara para lesiones superficiales de la laringe, con limitada invasión en profundidad de la región lateral y anterior, y que no sería aconsejable en lesiones que afectan al espacio paraglótico posterior y en tumores que infiltran los cartílagos laríngeos108.
2. Recomendaciones del grupo de expertos en el manejo diagnóstico del tumor glótico precoz con afectación de la comisura anterior y el tratamiento con microcirugía transoral con láser CO2Las recomendaciones realizadas se fundamentan en la literatura revisada y en la opinión de expertos.
Recomendación 1
Exploración clínica
La utilización de ópticas rígidas de 0°, 30° y 70° puede mejorar la precisión de la extensión en los tumores de la comisura anterior en caso de bandas hipertróficas y dudas sobre extensión a la subglotis. No obstante, los videoendoscopios flexibles actuales que incorporan cámaras con magnificación de la imagen han disminuido su uso de forma habitual.
La exploración con NBI mejora la precisión diagnóstica en tumores planos e irregulares que afectan el tercio anterior de las cuerdas vocales y la comisura anterior, facilitando la localización de nidos tumorales en estadios precoces. Se valorarán los cambios vasculares perpendiculares de la lesión, y en el caso de leucoplasia las alteraciones microvasculares submucosas del tejido que la rodea.
La videoestroboscopia no mejora la precisión diagnóstica de la extensión en la comisura anterior. Puede ser de utilidad en la valoración de la movilidad de la cuerda con afectación comisural para establecer la diferencia entre T1a y T2.
Recomendación 2
Pruebas de imagen
Se aconseja realizar TC helicoidal multicorte de 1mm con reconstrucción en los 3 planos en tumores glóticos con extensión a la comisura como primera opción.
Se aconseja complementar el estudio con RM ante imágenes dudosas sobre erosión del cartílago que puedan modificar la actitud terapéutica.
La ecografía cervical no es una prueba de imagen electiva.
La PET-TC no es una prueba de imagen recomendada para la valoración inicial.
Recomendación 3
Estadificación y descripción
Se aconseja complementar la clasificación de los estadios de la AJCC glótico T1a, T1b y T2 con la descripción de la afectación de la comisura anterior en función de su extensión.
- •
Tumor confinado exclusivamente en la comisura anterior (AC1).
- •
Tumor que afecta una cuerda y la comisura anterior (AC2).
- •
Tumor que afecta la comisura anterior y una parte de ambas cuerdas vocales (AC3).
- •
Tumor que afecta la mayor parte de una cuerda vocal y cruza la comisura anterior afectando la otra cuerda vocal (AC4).
Se considera de gran importancia reflejar si el crecimiento es en el plano horizontal de la glotis o en el plano vertical.
Recomendación 4
Decisión terapéutica
La decisión en la elección del tratamiento se realizará de forma individualizada en función de los hallazgos endoscópicos y de imagen que definen su extensión y profundidad, de los deseos del paciente teniendo en cuenta las expectativas personales, de la edad, del estado general y funcional y de la experiencia del equipo multidisciplinar.
Se informará al paciente de las diferentes opciones terapéuticas, incluyendo las secuelas y resultados oncológicos. En profesionales de la voz se informará de forma precisa sobre las secuelas funcionales previsibles que afectarán a la voz en los diferentes tratamientos posibles.
Recomendación 5
Microcirugía transoral con láser CO2como opción terapéutica
Límites
Siempre que se utilice TLMS CO2 para cáncer glótico T1-T2 con afectación de la comisura anterior es necesario que se garanticen márgenes de resección adecuados.
De forma general se considera la afectación del espacio paraglótico posterior y la infiltración de los cartílagos laríngeos una limitación a la TLMS CO2.
Recomendación 7
Microcirugía transoral con láser CO2como opción terapéutica
Exposición laríngea
Es recomendable conocer la dificultad de la exposiciónpreviamente a la cirugía valorando los siguientes parámetros: espacio entre incisivos, la distancia tiroides mentón, el estado dentario, la presencia de trismus, prognatismo mandibular, macroglosia, micrognatia, el grado de flexión-extensión del cuello, tratamientos previos quirúrgicos, la clasificación de Mallampati modificada y el índice de masa corporal.
La exposición laríngea de la comisura anterior se facilita con la utilización de endoscopios rígidos de diferentes tamaños y formas (menor tamaño a mayor dificultad de exposición), la maniobra de flexión-flexión y la presión externa a nivel del área cricotiroidea que mejora la dirección coaxial del rayo láser y la glotis anterior.
Se aconseja la evaluación intraoperatoria mediante ópticas anguladas de 30° y 70° y filtros de luz para determinar la extensión superficial. Si existen dudas razonables sobre la posibilidad de resección del tumor con márgenes adecuados se optará por otra terapia alternativa.
Recomendación 8
Microcirugía transoral con láser CO2como opción terapéutica
Resección tumoral
Se aconseja la utilización de filtros de luz (NBI) para establecer con mayor precisión los márgenes de resección superficiales y minimizar la extirpación de tejido sano.
En los T2 con afectación de la comisura anterior en el plano vertical, la extensión tumoral suele realizarse en dirección craneocaudal, por lo que se aconseja resección vertical incluyendo el área infrapeciolar de la epiglotis, grasa preepiglótica inferior, tercio anterior de bandas y comisura anterior glótica con extensión a la subglotis y hasta la exposición del cartílago (imagen de ojo de cerradura).
Es necesario registrar el subtipo de cordectomía realizada Va o tipo vi y los detalles de su ampliación.
La vaporización del lecho quirúrgico se realizará a criterio del cirujano teniendo en cuenta que no mejora los resultados oncológicos si en la pieza quirúrgica los márgenes profundos están afectos.
En T1b no se aconseja la realización de la reseción tumoral en 2 tiempos con el objetivo de disminuir la posibilidad de sinequia anterior.
Recomendación 9
Microcirugía transoral con láser CO2como opción terapéutica
Márgenes quirúrgicos
Es necesario la orientación de la pieza o piezas quirúrgicas estableciendo con claridad el margen superficial y el profundo. Siempre que sea posible se recomienda realizar el análisis intraquirúrgico de los márgenes.
Ante resultados histopatológicos que indiquen márgenes próximos la experiencia del cirujano y la valoración intraoperatoria se tendrán en cuenta para recomendar observación clínica o reescisión de márgenes.
Ante resultados histopatológicos que indiquen margen positivo se recomienda ampliación en un segundo tiempo quirúrgico. Si el margen profundo es positivo y no es posible la ampliación del margen se recomienda valorar otras opciones terapéuticas como laringectomía parcial supracricoidea o laringectomía total si la extensión a la subglotis contraindica las técnicas parciales o radioterapia.
Recomendación 10
Microcirugía transoral con láser CO2como opción terapéutica
Seguimiento
El seguimiento de los pacientes tendrá en cuenta si los márgenes obtenidos han sido cercanos y si se ha realizado o no una segunda reescisión.
En márgenes quirúrgicos adecuados en T1a-T1b se aconseja control clínico cada 3 meses durante el primer año.
En márgenes quirúrgicos cercanos donde se ha decidido observación clínica se aconseja seguimiento más estrecho durante el primer año.
Se recomienda TC o RM cervical de control (según sea el estudio diagnóstico inicial) cada 6 meses en T2 y en caso de márgenes quirúrgicos dudosos independientemente del T. Si las imágenes no son concluyentes puede valorarse la realización de PET-TC.
Recomendación 11
Microcirugía transoral con láser CO2como opción terapéutica
Voz
El tratamiento quirúrgico de la sinequia anterior se realizará en función de los resultados de la evaluación de la voz, las preferencias del paciente y las expectativas reales de mejora, teniendo en cuenta el grosor y la longitud.
En general, no se aconseja tratamiento quirúrgico de la sinequia anterior antes de los 6 meses posteriores al tratamiento oncológico.
No existe un tratamiento quirúrgico estándar para mejorar los resultados funcionales de la voz en la sinequia anterior.
La aplicación de mitomicina C no ha demostrado mejores resultados en la prevención de sinequia anterior ni eficacia de forma aislada para evitar su recidiva.
Se aconseja tratamiento rehabilitador de logopedia a todos los pacientes tratados con un programa individual adaptado.
Recomendación 12
Microcirugía transoral con láser CO2como opción terapéutica
Bases de datos
Es aconsejable y necesario disponer de una base de datos específica para los tumores glóticos con extensión a la comisura anterior que permita conocer la evolución de los resultados oncológicos y su comparación con los obtenidos en las series publicadas.
Recomendación 13
Microcirugía transoral con láser CO2como opción terapéutica
Cuestionario de calidad de vida
Aunque no están definidos los cuestionarios específicos de valoración de la voz en pacientes tratados con TLMS CO2 se aconseja evaluar el impacto en la voz antes y después del tratamiento quirúrgico según las recomendaciones de la ELS.
Se recomienda realizar el cuestionario VHI, evaluación perceptual de la calidad de voz con la escala GRABS (especialmente en sinequia anterior evaluación de R), medidas aerodinámicas que incluyan el tiempo máximo de fonación y cociente de fonación y parámetros acústicos que incluyan la frecuencia fundamental y el rango de frecuencias.
La Sociedad Española de Otorrinolaringología y Cirugía de Cabeza y Cuello (SEORL-CCC) ha financiado la traducción y publicación de este suplemento
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.