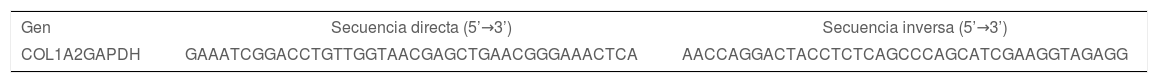La colagenasa ii ha sido utilizada para inducir queratocono experimental en modelos animales. Sin embargo, no ha sido estudiado su efecto cuando se administra por inyección intraestromal, por lo que el propósito de este estudio fue estudiar los efectos de la inyección intraestromal de colagenasa ii sobre la superficie corneal y la morfología de la córnea.
MétodoSe trabajó con 6 conejos Nueva Zelanda, se administró colagenasa ii por inyección intraestromal (5μL de 2,5mg/mL) en los ojos derechos y solución salina balanceada en los ojos izquierdos. Se realizaron queratometrías para evaluar la alteración de la curvatura, también al séptimo día se obtuvieron las córneas y se realizó tinción hematoxilina-eosina para examinar los cambios morfológicos. Asimismo, se investigaron los cambios en la expresión de colágeno tipo i por tinción rojo sirio y PCR semicuantitativa.
ResultadosK1, K2 y Km presentaron diferencias en los promedios con cambios estadísticamente significativos. Los cambios morfológicos que se demostraron fueron degradación y disposición irregular del estroma corneal, incremento en la densidad celular de queratocitos y ligera infiltración celular. Finalmente se demostró que hay mayor expresión de fibras de colágeno tipo i en el grupo experimental a diferencia de los controles y el grosor de las fibras también aumentó por acción de la colagenasa ii; sin embargo, en cuestión génica no hubo cambios en la expresión de colágeno tipo i a nivel molecular entre el grupo control y experimental.
ConclusionesLa colagenasa ii administrada por inyección intraestromal es capaz de inducir cambios en la superficie corneal y el estroma, pudiendo simular un modelo de queratocono.
Collagenase II has been used to induce experimental keratoconus in animal models. However, its effect when administered by intrastromal injection has not been studied, so the purpose of this study was to study the effects of intrastromal injection of collagenase II on corneal surface and corneal morphology.
MethodSix New Zealand rabbits were used, collagenase II was administered by intrastromal injection (5μL of 2.5mg/mL) in the right eyes and balanced salt solution in the left eyes. Keratometry was performed to evaluate curvature alteration, also at day 7 corneas were obtained and hematoxylin–eosin staining was performed to examine morphologic changes. Likewise, changes in type I collagen expression were investigated by Sirius Red staining and semi-quantitative PCR.
ResultsK1, K2, and Km presented differences in the means with statistically significant changes. The morphological changes that were demonstrated were degradation and irregular arrangement of the corneal stroma, increase in the cellular density of keratocytes and slight cellular infiltration. Finally, it was demonstrated that there is greater expression of type I collagen fibers in the experimental group as opposed to the controls and the thickness of the fibers also increased due to the action of collagenase II, however, in terms of genetics there were no changes in the expression of type I collagen at molecular level between the control and experimental groups.
ConclusionsCollagenase II administered by intrastromal injection is able to induce changes in the corneal surface and stroma, being able to simulate a model of keratoconus.
El queratocono es una ectasia corneal caracterizada por el adelgazamiento y protrusión cónica de la córnea con desarrollo de miopía y astigmatismo1,2. Se ha clasificado como una enfermedad no inflamatoria, sin embargo, recientes investigaciones han demostrado la expresión de citocinas proinflamatorias en lágrimas de pacientes con queratocono e infiltrado de células inflamatorias3–5. Generalmente se presenta en la adolescencia, a partir de la segunda década de la vida, es posible posterior a cirugía refractiva. Se calcula que la prevalencia a nivel mundial es de 138/100.000 habitantes2,6. Algunos de los factores de riesgo para su desarrollo son atopia, frotamiento de ojos, enfermedades congénitas, desórdenes del tejido conectivo y expresión de genes como VSX1 y SOD11,7–12. Hay diversas alteraciones fisiológicas en el estroma y epitelio corneal, lo que ocasiona desbalance en la producción de moléculas proinflamatorias, antiinflamatorias, proteasas y sus inhibidores, estrés oxidativo e hipersensibilidad celular13. Literatura publicada recientemente describe distintas proteínas encontradas en lágrimas y en córneas con queratocono, como la IL-1, IL-6, TNF-α, algunas metaloproteinasas, TGF-β, especies reactivas de oxígeno14–16, lo cual indica la activación simultánea de diferentes vías de señalización lo que podría establecerlo con un perfil inflamatorio.
El tratamiento depende de la severidad y tiene como objetivo atender alteraciones estructurales de la córnea, no se pretende un tratamiento directo hacia a la fisiopatología de la enfermedad14,17–19. Desarrollar un modelo animal con la aplicación de colagenasa para ocasionar la evolución de queratocono en ratones genera conocimiento para en un futuro desarrollar mecanismos de tratamiento desde la atención a su fisiopatología20. Hay modelos desarrollados con gotas oftálmicas de colagenasa tipo ii en conejo y varios estudios han demostrado inflamación en la fisiopatología del queratocono21. El objetivo de este estudio fue desarrollar un modelo animal en conejo mediante la inyección intraestromal de colagenasa tipo ii que simule la alteración en la curvatura, la expresión de factores inflamatorios, estrés oxidativo e histopatología del queratocono.
Material y métodosAnimales y colagenasa tipo iiEn este estudio se utilizaron 6 conejos Nueva Zelanda de 3,0-4,0kg, se obtuvieron del Bioterio de Ciencias Básicas de la Universidad Autónoma de Aguascalientes (Aguascalientes, México). El protocolo experimental fue aprobado por el Comité de Ética para el uso de Animales en la Docencia e Investigación de la Universidad Autónoma de Aguascalientes (CEADI-UAA-001/003/2021). Los conejos se mantuvieron en un entorno controlado de 12h luz/12h oscuridad. Alimento y agua estuvieron disponibles ad libitum. Se proporcionó atención los 7 días del estudio. Los animales fueron anestesiados vía intraperitoneal 6mL/kg de pentobarbital sódico 1:10, para anestesia tópica se usó gotas oftálmicas de clorhidrato de tetracaína (Lab. Sofia, Guadalajara, México) 5mg/mL. Los animales fueron tratados de acuerdo con el protocolo de directrices de guías ARRIVE (V 2.0), (National Center for the Replacement, Refinement & and Reduction of Animals Research) para el uso de animales en investigación experimental. La colagenasa tipo ii (Sigma-Aldrich) obtenida en polvo se disolvió en solución salina balanceada en dextrano (15%) a una concentración de 2,5mg/mL.
IntervenciónSe dividieron 12 ojos de 6 conejos en 2 grupos. Los ojos derechos grupo experimental, los izquierdos grupo control. Una vez anestesiados, se procedió a inyectar la córnea utilizando una aguja ultrafina con microscopio invertido por debajo del epitelio corneal. En el grupo experimental se inyectaron 5μL de colagenasa tipo ii 2,5mg/mL a temperatura ambiente. Posteriormente, se administró antibiótico cloranfenicol oftálmico para evitar una posible infección. Se realizó el mismo procedimiento en los ojos controles, administrando solución salina balanceada con dextrano 4%.
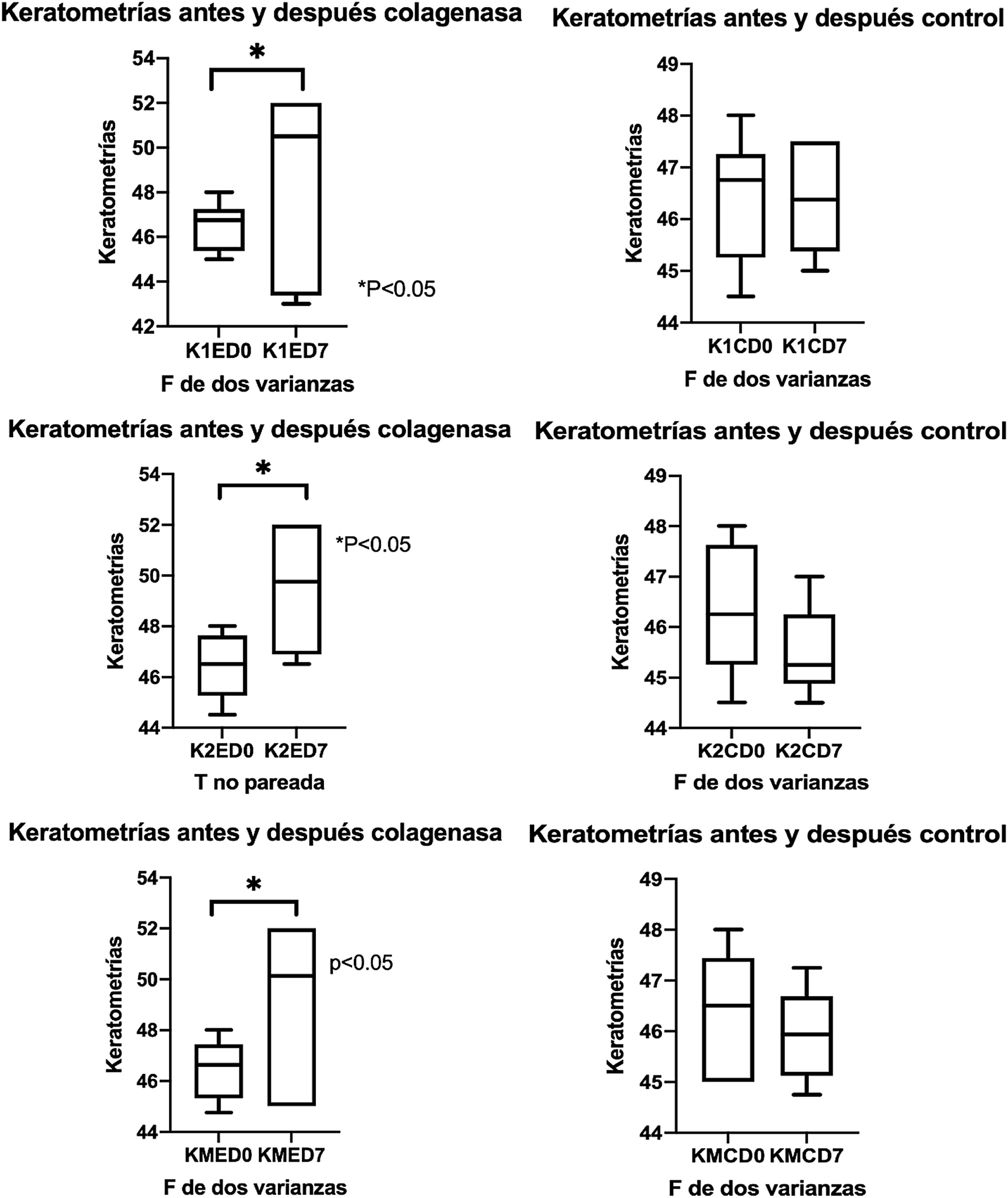
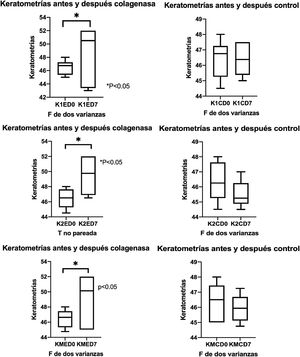
QueratometríasCon un queratómetro (one-position) (Bausch and Lomb, NY, EE: UU.), se obtuvieron los meridianos principales en 3mm centrales de córnea un día antes de la aplicación de la colagenasa intraestromal y 7 días después de la intervención. Se registró el promedio de las queratometrías de los 2 meridianos principales, curva menor (K1), curva mayor (K2) y el promedio de los 2 meridianos (Km), los resultados son expresados en dioptrías (D).
HistologíaLas córneas se fijaron en paraformaldehído 4% durante 3 días y embebidas en parafina. Se realizaron cortes de 8μm de grosor de limbo a limbo para tinción de hematoxilina-eosina y rojo sirio. Las córneas teñidas con hematoxilina-eosina se observaron en campo claro y las teñidas con rojo sirio con luz polarizada. Para no inducir sesgo en la evaluación, un investigador realizó la técnica de histoquímica hasta culminar la fase de tinción y otro investigador con mayor experiencia en valoración en microscopia de luz y patología evaluó los cortes histológicos, sin conocer su procedencia, a fin de evitar una influencia en la exploración.
Extracción de ARN y RT-PCREl ARN total se extrajo mediante un kit de purificación (cat. no. 12183555; Thermo Fisher, Inc., California, EE.UU.). La concentración y pureza del ARN se cuantificó con espectrofotómetro NanoDrop 2000. La síntesis de ADNc se realizó con el kit iScript (cat. 1708891; Bio-Rad Laboratories, Hércules, California, EE.UU.) y un termociclador (Thermo Fisher, Inc., California, EE.UU.). Para la PCR se utilizó Taq DNA Polymerase, Recombinant (cat. no. 11615-050; Thermo Fisher Scientific, Inc., California, EE.UU.). Se trabajó con 1μg/μL de ADNc en volumen final de 25μL. Los oligonucleótidos se muestran en tabla 1. La expresión relativa de ARNm de colágeno i fue normalizada contra la expresión de GAPDH. Se analizó mediante el software ImageJ de Fiji. Los experimentos fueron repetidos por duplicado.
Análisis estadísticosLos valores fueron expresados en media±error estándar. El análisis de los datos se realizó mediante el software GraphPad Prism 8 (GraphPad Software, Inc., La Jolla, CA, EE. UU.). Los resultados de los grupos fueron comparados mediante una t de Student para muestras pareadas. Se consideró p<0,05 para diferencia estadísticamente significativa.
ResultadosAlteración de la superficie corneal por acción de colagenasa iiSe midieron las queratometrías antes de administrar la colagenasa ii por inyección intraestromal o en caso del control solución salina balanceada, y 7 días después de la aplicación se vuelve medir las queratometrías en ambos meridianos y en el promedio de los 2 meridianos. A continuación se describen valores de córneas con colagenasa ii, en K1, K2 y KM, respectivamente, (K1ED0=46,50±1,08; K1ED7=48,58±4,29); (K2ED0=46,42±1,28; K2ED7=49,50±2,75); (KMED0=46,60±1,17; KMED7=49,04±3,45); todas las diferencias fueron estadísticamente significativas (p<0,05); con respecto a los controles, se presentan en el mismo orden; (K1CD0=46,42±1,23; K1CD7=46,38±1,09); (K2CD0=46,33±1,29; K2CD7=45,50±0,89); (KMCD0=46,38±1,20; KMCD7=45,94±0,95), (p>0,05) (fig. 1).
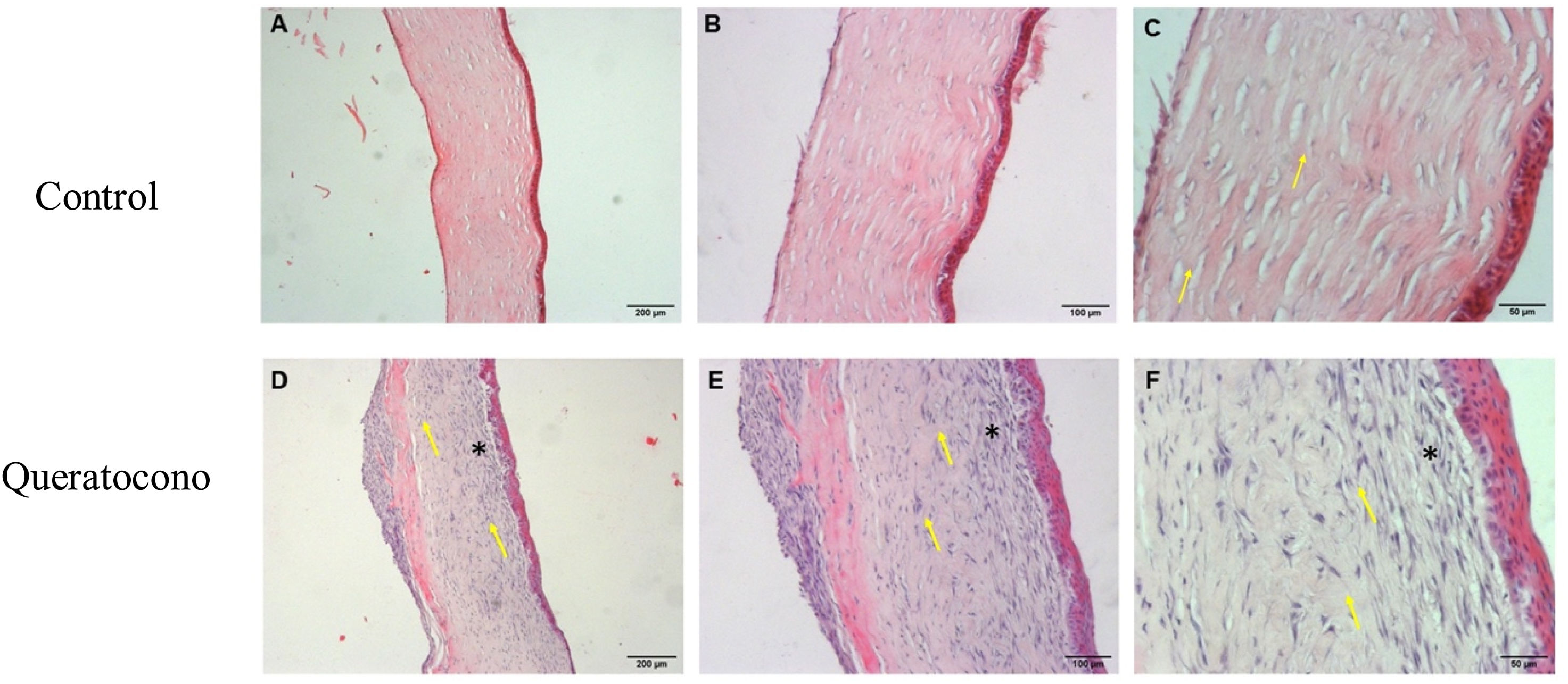
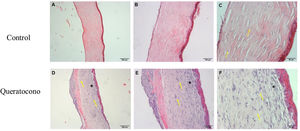
Cambios morfológicos en la córnea por acción de la colagenasa iiLos resultados obtenidos de la tinción hematoxilina-eosina indican que las córneas de controles a los 7 días mantuvieron morfología normal manifestada por el paralelismo de las fibras de colágena respecto al epitelio (flechas) (fig. 2A-C). Sin embargo, en el grupo con queratocono se observó una disposición irregular del epitelio y pérdida del paralelismo de las fibras de colágeno respecto al epitelio (flechas) en la capa de Bowman. Se presentó una reacción ligera de inflamación, con una alta densidad de queratocitos lo que generó un incremento en el grosor del estroma debido a la formación de la matriz extracelular (fig. 2D-F), lo cual indicaría un proceso de activación de queratocitos y regeneración del estroma (cicatrización estromal).
Alteraciones morfológicas después de la administración de colagenasa ii. Los cambios morfológicos de las córneas expuestas a colagenasa ii muestran cambios característicos de un proceso inflamatorio y de regeneración, además de pérdida de integridad en la capa de Bowman, en comparación con los controles. (A-C) Controles. (D-F) Queratocono. Ambos con los objetivos 5x, 10x y 20x, respectivamente (aumento 500, 1000 y 2000, barra de escala 200μm, 100μm y 50μm, respectivamente).
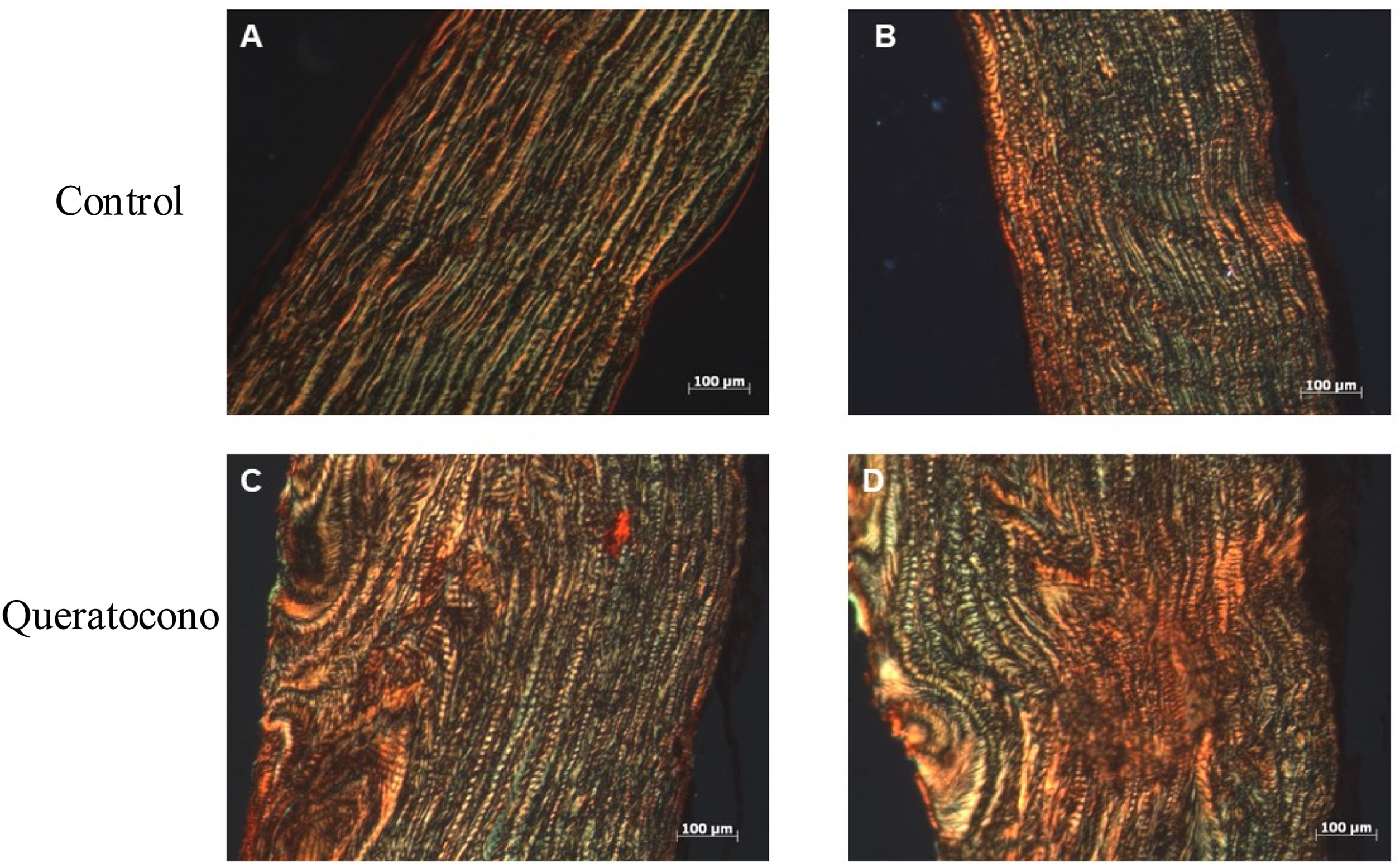
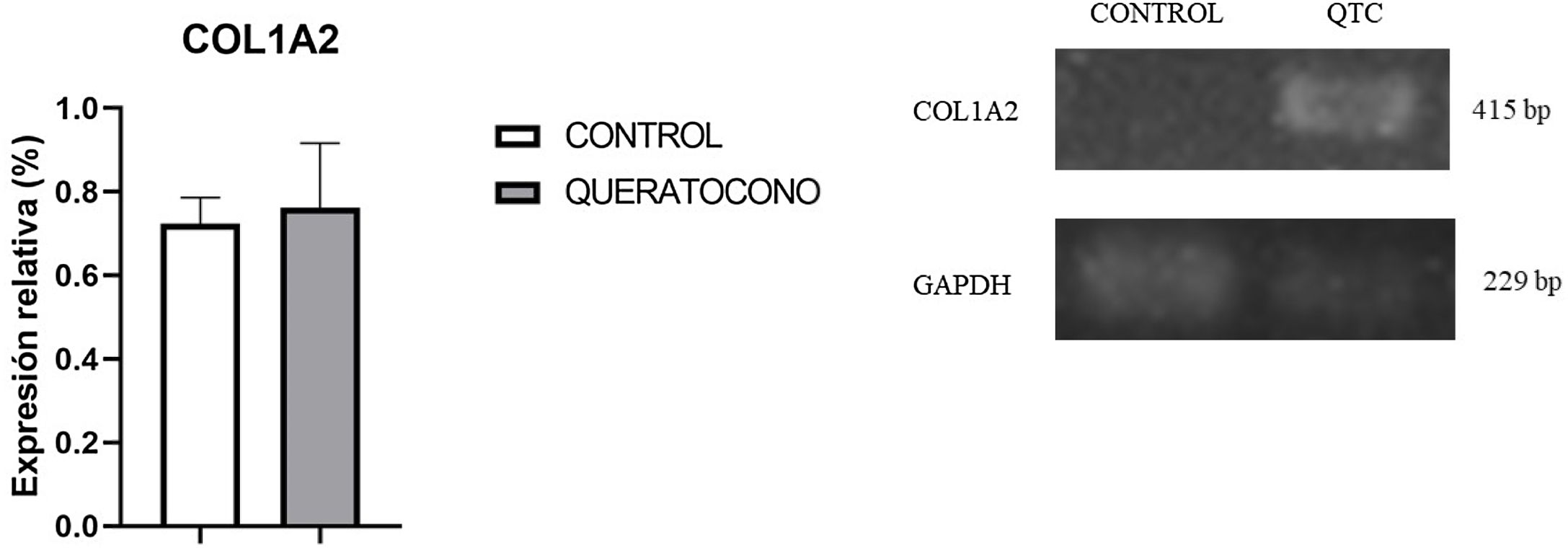
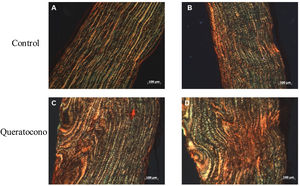
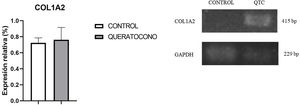
Para evaluar la expresión de colágeno tipo i se realizó la tinción de rojo sirio en tejido y PCR semicuantitativa. Con tinción rojo sirio, se observaron cambios en disposición de fibras de colágeno en el grupo experimental, en comparación con el grupo control; y en córneas control se observa la presencia de colágeno tipo i por las fibras rojas y colágeno tipo iii por las fibras verdes (fig. 3A-B). En cambio, en las córneas experimentales demuestran una mayor presencia de colágeno tipo i y iii en la lesión y estas fibras tienen un mayor grosor, lo cual indica el desarrollo de regeneración del estroma por la síntesis de la matriz extracelular (fig. 3C-D). Con respecto a la expresión génica de colágeno tipo i, no se observaron cambios significativamente estadísticos entre el grupo control y el grupo experimental (p=0,77) (fig. 4). No obstante, la tendencia en la gráfica demuestra un ligero incremento en la expresión de colágeno tipo i en el grupo experimental sobre el grupo control, que de contar con una muestra mayor de córneas se podría aumentar la diferencia entre los grupos.
Cambio en las fibras de colágeno en el modelo animal de queratocono. La alteración en las fibras de colágeno de las córneas con colagenasa ii indican un proceso de regeneración del estroma corneal por acción de la colagenasa ii, principalmente la síntesis de colágeno tipo i. (A-B) Controles. (D-E) Queratocono. Ambos con los objetivos 10x (aumento 1000, barra de escala 100μm).
Expresión génica de colágeno I en el modelo animal de queratocono. Aunque no hay cambios significativos, se observa una tendencia al incremento en la expresión de colágeno tipo I en el grupo con queratocono. Los datos se presentan como media+error estándar; n=6 por grupo. bp: pares de bases; COL1A2: colágeno tipo I cadena alfa 2; QTC: queratocono.
De acuerdo con los antecedentes descritos de modelos animales de queratocono, se desarrolló este trabajo destacando los siguientes hallazgos: 1) la colagenasa ii tiene la capacidad de alterar la curvatura de la córnea y el estroma corneal, 2) hay un proceso de regeneración del estroma corneal en el sitio de lesión.
La colagenasa ii es una proteasa usada en modelos animales de queratocono para degradar el colágeno tipo i y producir el adelgazamiento y alteración en la superficie de la córnea. Previamente Qiao reportó un modelo animal de queratocono por administración de colagenasa ii en gotas oftálmicas a una concentración de 5mg/mL, previo desbridamiento corneal21, sin embargo, aunque esta metodología ya estaba publicada también por otros autores, en nuestros resultados no se logró replicar el efecto encontrado por ellos. Qiao reportó en las queratometrías un incremento en las 3 mediciones en el día 7 y 14 con respecto al control, sin embargo, nosotros no encontramos cambios en las córneas de los conejos con el mismo procedimiento de gotas oftálmicas. En cambio, con el procedimiento de inyección intraestromal sí obtuvimos diferencias numéricas en los 3 valores de queratometrías (K1, K2 y Km), siendo estadísticamente significativa en las 3 medidas, el cual es un resultado similar al encontrado en el modelo de queratocono en humano, por lo que atribuimos este resultado a que la respuesta que evaluamos se debe al efecto de la colagenasa8. La disposición del ingreso de la colagenasa en la dirección donde se dirige podría estar ocasionando modificación en las láminas del estroma, causando que se debilite el meridiano que se vuelve más curvo, ocasionando que las fuerzas biomecánicas de las fibras posteriores perpendiculares ejerzan mayor presión en el meridiano más curvo22. Con respecto a la disminución de fibras de colágeno, disposición irregular de las fibras y hendiduras en el estudio de Qiao, nosotros encontramos en contraste un patrón diferente, es decir, un incremento en el número de queratocitos con posible activación en un proceso de regeneración del estroma con formación de una cicatriz estromal por activación de los queratocitos, coincidiendo con Song et al.23. En el estudio de Moghadam en rata utilizó colagenasa por inyección intraestromal, reportando opacidad y deformidad en la córnea y daño severo en las fibras de colágeno, adelgazamiento epitelial y en estroma corneal20. Nosotros, al replicar este modelo de inyección obtuvimos resultados similares, principalmente opacidad y deformidad de la córnea lo cual confirmó la alteración de la superficie a través de las queratometrías con daño severo en las fibras de colágeno e irregularidad en el epitelio corneal. Estos cambios se atribuyen a un proceso de cicatrización de la córnea por la colagenasa ii y después de 3 días la opacidad desapareció.
La córnea esta formada por colágeno tipo i y v, y pueden encontrarse colágeno iii, iv y vii en menores cantidades. Durante la regeneración de la córnea los queratocitos quiescentes se activan y se transdiferencian a miofibroblastos, con la finalidad de restituir la matriz extracelular mediante la síntesis de colágeno tipo i, iii, iv y v23. El colágeno iii es expresado en la regeneración y en la pérdida de organización de fibras de colágeno tipo i, y es un marcador de fibrosis24,25. Los resultados encontrados en la tinción de rojo sirio demuestran que las córneas control presentan fibras de colágeno iii y dispuestas de manera regular, el colorante rojo sirio se une específicamente a las fibras de colágeno i, ii y iii, y por sus efectos birrefringentes se puede analizar bajo el microscopio de polarización; este procedimiento permite hacer análisis cuantitativos del contenido tisular de las fibras de colágeno mediante el software Fiji, siendo más específico que las técnicas histológicas tricrómicas, lo cual indica que el daño ocasionado por la aguja al inyectar la solución salina balanceada se regenera con fibras de nuevo colágeno. Con respecto, a las córneas con queratocono, hay mayor presencia de fibras de colágeno tipo i y dispuestas de manera irregular, indicando que está en proceso de regeneración. Nuestros resultados contrastan con la investigación de Lorenzo-Martín et al. donde evaluaron la composición del estroma durante la regeneración mediante la técnica de rojo sirio; ellos demuestran una menor presencia de colágeno tipo iii en la córnea lesionada. Es importante mencionar que existe controversia en la interpretación de los resultados con esta técnica, ya que algunos autores refieren que el color se debe al tipo de colágeno y otros refieren el color a la disposición y grosor del colágeno, indicando que es una prueba únicamente para determinar la regularidad de las fibras de colágeno. En el estudio de Lorenzo-Martín et al. encontraron la sobreexpresión génica de colágeno i y iii, coincidiendo con nuestros resultados en la expresión génica de colágeno iI26.
En el presente estudio no evaluamos el efecto de diversas concentraciones de la colagenasa ii, ni se estudió el modelo a largo plazo, los cuales fueron limitantes. Es importante evaluar diferentes concentraciones con la finalidad de desarrollar un proceso de degradación más moderado, también hay que evaluar el tiempo de regeneración de la córnea a largo plazo con pruebas histológicas de inmunohistoquímica y la expresión génica en forma longitudinal para determinar la duración del modelo animal y determinar su viabilidad. Por ello, sugerimos que se realicen más investigaciones partiendo de este modelo para determinar el tiempo de duración, así como, entender más en profundidad el proceso de daño inducido por esta enzima.
ConclusionesNuestro estudio presenta un modelo animal de queratocono con un método menos invasivo y rápido, sin embargo, también presentamos los efectos degradativos que produce la colagenasa ii en el tejido. Es necesario seguir investigando para determinar si este modelo es viable para estudiar la fisiopatología y posibles tratamientos del queratocono.
FinanciaciónProyecto financiado por la Universidad Autónoma de Aguascalientes: DGIyP- PIBB18-1.
Conflicto de interesesNinguno.