(r = 0,72) y a las 2 h de la sobrecarga oral de glucosa (r = 0,43). El 30% de los pacientes con glucemia basal entre 110 y 125 mg/dl presentaó valores de A 1c superiores a los límites de referencia. Una técnica combinada de diagnóstico basada en una glucemia basal > 125 mg/dl o de 110-125 mg/dl con una A 1c >= 3 DE (5,94%) demostró una sensibilidad del 92% y una especificidad del 95%. Conclusiones. En sujetos con una determinación de glucemia basal no concluyente (110-125 mg/dl), los valores de A 1c por encima de la media +3 DE (> 5,94%) son útiles para orientar el diagnóstico de diabetes e identificar a los que requieren tratamiento.
Introducción
Los criterios diagnósticos de diabetes mellitus tipo 2 (DM2) (entidad clínica) se basan en diversos estudios poblacionales en los que se constató una bimodalidad en la distribución poblacional de las cifras de glucemia plasmática (variable analítica continua), con una prevalencia mayor de las complicaciones propias de la DM en el subgrupo poblacional con glucemias más elevadas1. Mediante el procedimiento estadístico se realizó una dicotomización artificial de la glucemia y se instauró una cifra de corte para el diagnóstico de DM2. Los criterios diagnósticos para la diabetes fueron desarrollados por el National Diabetes Data Group (NDDG)2 y la Organización Mundial de la Salud (OMS)3. Posteriormente, la Asociación Americana de Diabetes (ADA)4, dadas la incomodidad, la variabilidad y la naturaleza no fisiológica del test de la sobrecarga oral de glucosa (SOG), recomendó el abandono de dicha prueba sistemática en favor de rebajar el límite diagnóstico de la glucemia basal (GB) (>= 126 mg/dl), que parecía predecir mejor el riesgo de desarrollar complicaciones macrovasculares5,6. En 1999, la OMS incluyó estas recomendaciones en sus nuevos criterios diagnósticos7.
A partir del descubrimiento del incremento de una fracción de la hemoglobina del hematíe (hemoglobina glucosilada [A1c]) en presencia de hiperglucemia mantenida durante 4-8 semanas, la A1C se ha convertido en la principal herramienta para el seguimiento del control metabólico en individuos diabéticos. La importancia de este parámetro ha sido reforzada por estudios como el DCCT8 o el UKPDS9, que han demostrado que un mejor control glucémico reduce el riesgo de desarrollar complicaciones a largo plazo.
Entonces, si la DM se diagnostica a partir de los valores de la glucemia y la A1c es un fiel reflejo del valor glucémico mantenido en las últimas semanas, ¿por qué no utilizar la A1c para el diagnóstico de la DM2? La posibilidad es atractiva, ya que obviaría el uso de la incómoda y poco reproducible SOG y, por otro lado, se correlaciona muy bien con la posibilidad de presentar complicaciones crónicas. Desde que se planteó esta posibilidad se han efectuado estudios con resultados dispares6,10. Hay impedimentos importantes: la falta de estandarización de los distintos métodos de laboratorio utilizados para cuantificar la A1c, su elevado coste (difícilmente asequible a los países del tercer mundo) y la falta de estudios que correlacionen la validez clínica de un punto diagnóstico de corte (tradicionalmente se ha alegado una baja sensibilidad diagnóstica)11-15.
Un conjunto de 18 metaanálisis16 concluye que, a pesar de que la A1c no puede ser utilizada como única herramienta para el diagnóstico de diabetes, es más útil que la SOG para la toma de decisiones de tipo terapéutico. Uno de estos artículos17 propone que no debería diagnosticarse DM en sujetos con una concentración plasmática de glucosa en ayunas inferior a 140 mg/dl a menos que presenten una glucosilación excesiva evidente. Los pacientes con elevaciones moderadas de la GB (110-139 mg/dl) sin glucosilación excesiva deberían ser diagnosticados de glucemia basal alterada (GBA) y tratados mediante una dieta apropiada y ejercicio físico.
El objetivo de nuestro estudio fue valorar la utilidad de la determinación de la A1c como método diagnóstico de DM2 en la población con factores de riesgo de desarrollar DM2 en el ámbito de la atención primaria española.
Material y métodos
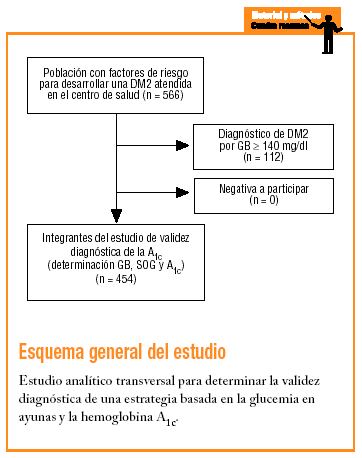
El estudio se realizó en el Centro de Atención Primaria Raval Sud de Barcelona, que atiende a una población con escasez de recursos económicos, un elevado índice de inmigración (20%) y una alta tasa de morbimortalidad para distintas enfermedades. Es, además, una población muy envejecida (el 29% es mayor de 65 años). Se observa una prevalencia de DM registrada del 6,6%, una de las más altas de España18.
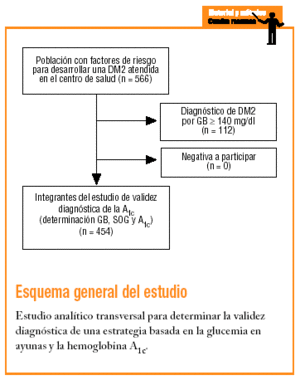
En 1992 se inició el Estudio Raval Sud del tipo de cohortes dinámicas destinado a conocer la epidemiología de los trastornos del metabolismo de la glucosa y la aparición de las complicaciones crónicas específicas. Para cumplir el objetivo de este trabajo se analizan los datos correspondientes al momento de la inclusión de los pacientes en el mencionado estudio. Se trata, por tanto, de un diseño analítico transversal para validar un test diagnóstico.
Como criterios de inclusión, los sujetos debían presentar alguno de los factores de riesgo descritos por la ADA-97 para desarrollar una DM2 (antecedentes familiares de DM2, antecedentes personales de intolerancia a los hidratos de carbono o diabetes gestacional, consumo prolongado de fármacos con capacidad hiperglucemiante, obesidad con un índice de masa corporal [IMC] > 30, hipertensión arterial, colesterol unido a lipoproteínas de alta densidad [cHDL] < 35 mg/dl y/o triglicéridos > 250 mg/dl)4. Se excluyó a los sujetos que no quisieron participar en el estudio.
En cada sujeto se analizaron distintas variables sociodemográficas (como la edad y el sexo) y clínicas (como el IMC y la presión arterial [mmHg] según las normas del JNC-VI28). Asimismo se realizó una analítica general en la que se determinaron la GB en plasma venoso, la SOG con 75 g de glucosa (si la glucemia era < 140 mg/dl) con la medición de la glucemia a los 30, 60 y 120 min, y la hemoglobina A1c analizada por cromatografía automatizada en columna líquida de alta presión (HPLC) con un autoanalizador Menarini HA8141 (rango normal, 3,8-5,5%; media ± desviación estándar, 4,65 ± 0,43%). Posteriormente, con el fin de estandarizar los resultados, se recalcularon los valores absolutos de la A1C en términos de desviaciones estándar (DE) por encima de la media (p. ej., un valor de hemoglobina A1c del 7,23% equivale a la media + 6 DE).
En función de los valores de la glucemia basal y la SOG, los participantes fueron clasificados según los criterios de la OMS de 1999: a) normoglucemia, cuando la GB < 110 mg/dl y < 140 mg/dl a las 2 h de la administración de glucosa (G2h); b) glucemia basal alterada (GBA) cuando la GB era de 110-125 mg/dl; c) intolerancia a la glucosa (ITG) cuando la GB era < 126 mg/dl y la G2h de 140-199 mg/dl, y d) DM2 cuando la GB era > 125 mg/dl o la G2h > 199 mg/dl.
El tamaño de la muestra estudiada fue de 454 sujetos. Para este tamaño de muestra y con las condiciones del estudio (p = 0,066 y * = 0,05), el coeficiente de error absoluto (e) es del 2,3%.
Para el análisis estadístico se utilizan distintos parámetros descriptivos (media ± DE, intervalo de confianza del 95% [IC del 95%]). La normalidad de las variables numéricas se analiza mediante la prueba de Kolmogorov-Smirnov. La estadística analítica bivariable se basa en las pruebas de la *2, test de ANOVA (F), coeficiente de correlación de Pearson (r) y sus homónimos no paramétricos.
El valor diagnóstico se analiza mediante el cálculo de la sensibilidad (S), la especificidad (E), los valores predictivos positivo (VPP) y negativo (VPN), y el valor global o eficacia (VG) de los distintos puntos de corte. La «eficacia» se define como la proporción de sujetos correctamente clasificados respecto al total de los casos. Los valores predictivos se calcularon para una prevalencia del 6,6%.
Resultados
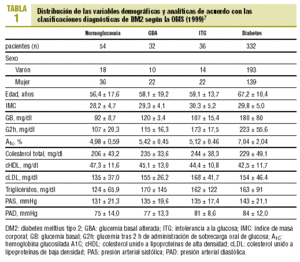
El estudio incluyó a 454 individuos, de los cuales 235 eran varones y 219 mujeres. La media de edad de la muestra fue de 64,6 ± 13,2 años y el 20% de los pacientes era mayor de 75 años. La media encontrada de IMC fue 29,63 ± 4,97, con un 3% de los casos clasificados como afectados de obesidad mórbida (IMC > 40).
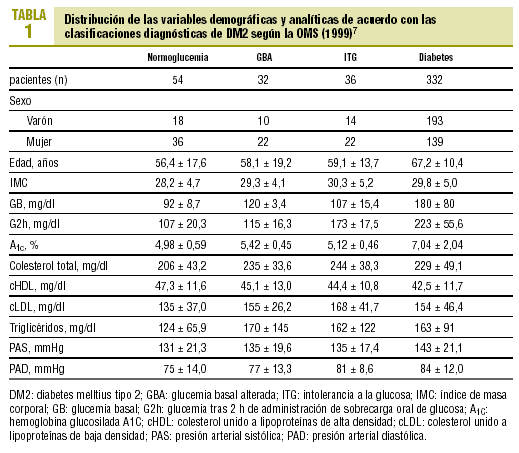
La distribución de las características demográficas y analíticas de los pacientes según los distintos grupos diagnósticos se expone en la tabla 1. En este análisis descriptivo de la muestra se observa que las cifras de glucemia en los sujetos normales fueron significativamente inferiores a las de los disglucémicos (GBA o ITG) y en éstos con respecto a los diabéticos (p < 0,001). La media de A1c fue superior en los diabéticos, con significación estadística respecto la del resto a de categorías: el 7,04 frente al 4,98% (normoglucemia), 5,42% (GBA), 5,12% (ITG); p < 0,001. Los pacientes con GBA presentaron valores ligeramente superiores de A1c que los del grupo con ITG, aunque las diferencias no alcanzaron la significación estadística.
La A1C se correlacionó de forma significativa con la GB (r = 0,72; p < 0,001) y con la concentración de glucosa a los 30 min (r = 0,27; p = 0,01), a los 60 min (r = 0,39; p < 0,001) y a las 2 h (r = 0,43; p < 0,001) de la SOG.
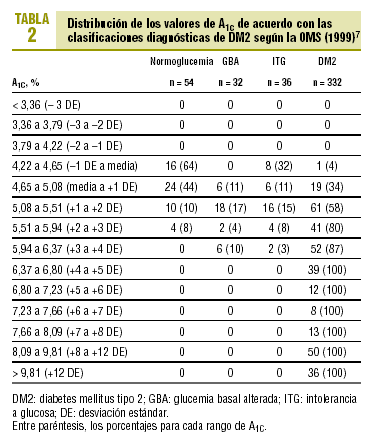
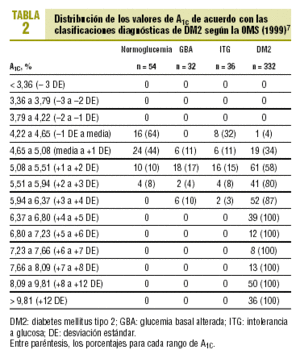
En la tabla 2 se muestra la distribución de las cifras de A1c obtenidas en los distintos casos según el grupo diagnóstico. Todos los casos observados con valores de A1c superiores al 6,37% (media + 4 DE) tenían DM2, mientras que no se detectó ningún caso de diabetes con A1C inferior al 4,22% (media 1 DE). Los casos con GBA presentaban valores de A1C del 4,65-6,37% (entre la media y +4 DE). En el grupo de ITG se detectaron valores de A1C de 4,22-6,37% (entre 1 y +4 DE), destacando el hecho de que ocho de los 36 casos con ITG (22%) tenían valores más bajos que la media (4,22-4,65%).
El diagnóstico de DM2 en los pacientes con una GB < 110 mg/dl (pero con SOG patológica) fue excepcional y sólo representó el 1,2% del total de casos de DM2. De los 80 pacientes con GB de 110-125 mg/dl, el 30% tenía valores de A1C que superaban el rango de la normalidad (A1C > 5,5%), el 15% tenía una A1C > 5,94% (+3 DE) y no se observó ningún caso con A1C > 6,8% (+5 DE).
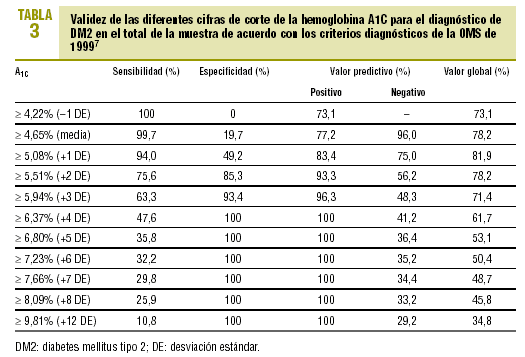
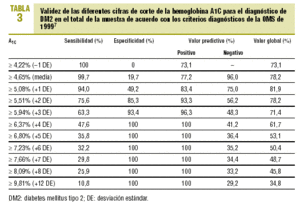
En la tabla 3 se expone la validez de las distintas cifras de corte de A1C en el total de la muestra, para establecer el diagnóstico de DM2.
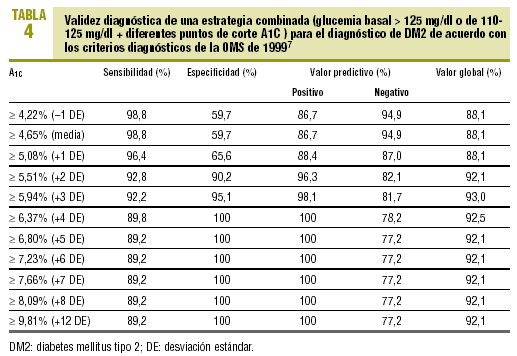
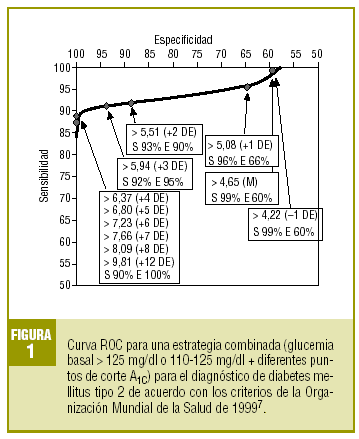
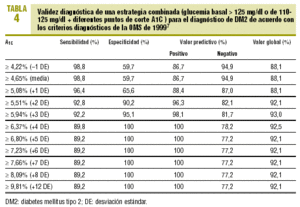
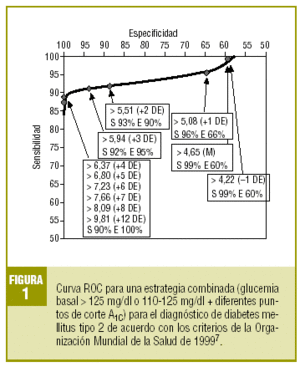
En la tabla 4 se expresa la validez diagnóstica de una estrategia basada en los valores de la GB y la A1C, de forma que se considera «diabéticos» a los sujetos que presentan una GB > 125 mg/dl o una GB >= 110 mg/dl con glucosilación excesiva (A1C >= determinado punto de corte). Observamos que se incrementa espectacularmente la validez de todos los puntos de corte de la A1C, alcanzando su máxima eficacia (VG del 93%) para la A1C >= 5,94% (media + 3 DE), con una sensibilidad del 92,2% y una especificidad del 95,1%. La representación gráfica de la curva ROC se muestra en la figura 1.
Discusión
Nuestro estudio fue llevado a cabo en un centro de atención primaria localizado en el Raval, un barrio de Barcelona con unas características demográficas particulares. El bajísimo nivel sociocultural de la población podría influir en que haya un infradiagnóstico previo de la enfermedad. Además, en la muestra estudiada se observó una edad media avanzada (de 64,6 años, con un 20% mayor de 75 años) y un alto porcentaje de obesidad (IMC medio, 29,6). El diagnóstico estándar mediante GB y SOG se realizó sobre una población seleccionada con un elevado riesgo de desarrollar diabetes. Por estos motivos, la prevalencia de DM2 detectada en la muestra es mucho mayor que la de la población general, pero es la esperada para una muestra de las características antes descritas. Creemos que este hecho puede favorecer la sobrestimación de los valores predictivos positivos y negativos, pero no afecta a los valores de la sensibilidad y especificidad de los puntos de corte del test diagnóstico.
Diversos estudios prospectivos han confirmado la relación entre los valores de la glucemia y la génesis de las complicaciones crónicas19-21. Por tanto, es lógico que el diagnóstico de la DM2 se base en la situación glucémica. El principal problema estriba en intentar establecer un punto de corte en una variable cuantitativa continua.
El segundo gran problema es saber cuál de las distintas formas de medir la glucemia es la que mejor puede diagnósticar la enfermedad (es decir, predecir la presencia de las complicaciones crónicas): la GB, la glucemia posprandial, la SOG, el perfil glucémico de todo el día, etc. Algunas de ellas son muy poco reproducibles y tienen una gran variabilidad (como la SOG)22, y otras tienen poca capacidad predictiva (una glucemia aislada)23,24. Si la hiperglucemia es tóxica25, lo lógico es que utilizáramos una medida que cuantificase su intensidad y el tiempo de duración, como lo hace la A1C.
Se ha demostrado ampliamente la relación de la A1C con las demás formas de medir la glucemia5,6,17. En nuestro trabajo, la relación más intensa de la A1C se ha advertido con la GB (r = 0,72). También hemos observado que, mientras que la GB y la A1C parecen más útiles para detectar la diabetes, la G2h parece más adecuada para detectar a los sujetos normales (valores significativamente inferiores en este grupo).
Para una primera aproximación a la utilidad de la A1C en el diagnóstico de la DM2, analizamos el valor de distintos puntos de corte en el total de la muestra de pacientes con riesgo de padecer una DM2. Si decidimos que los sujetos con A1C >= 5,51% (media + 2 DE) son diabéticos, este hecho lleva aparejadas una sensibilidad y una especificidad aceptables (el 76% y el 85%, respectivamente). Si elevamos el punto de corte, aumentaremos la especificidad, pero a costa de reducir la sensibilidad. Si intentamos comparar estos valores con los obtenidos en otros estudios, observamos que los resultados son similares, a pesar de las diferencias en las poblaciones de referencia. Así, Engelgau et al6 obtienen, con un valor de A1C >= 6,7%, una sensibilidad del 68% y una especificidad del 99%. En el metaanálisis de Peters et al16 se obtienen sensibilidades del 66 y 36%, con especificidades del 98 y el 100% para los puntos de corte del 6,3% (media + 2 DE) y del 7,3% (media + 4 DE). Ambos estudios se han realizado exclusivamente sobre el grupo que tuvo SOG diabéticas. Nosotros hemos preferido utilizar como población de referencia a todos los casos de la muestra (SOG diabéticas o GB diagnósticas con criterios de la OMS de 1999), porque se corresponde más con la realidad de la práctica diaria. Un estudio realizado por Rohlfing et al26 en una población norteamericana obtuvo una sensibilidad del 63,2% y una especificidad del 97,4% con una cifra de corte de A1C >= 6,1 (+2 DE). Otros autores27 han obtenido resultados similares. La Sociedad Japonesa de Diabetes28 recomienda utilizar como criterio diagnóstico de DM2 una A1C >= 6,1% (+2 DE).
Sin embargo, uno de nuestros objetivos era encontrar una estrategia diagnóstica fácil y fiable. La práctica de una SOG no lo es. En nuestra realidad, se solicita de manera excepcional y casi nunca o nunca basamos nuestras decisiones terapéuticas en su resultado. Por otro lado, la DM2 es excepcional cuando la GB es repetidamente inferior a 110 mg/dl (el 1,2% de los casos de DM2 en nuestro estudio).
En el trabajo de Ko et al29 se valoró el grado de importancia de la SOG para la confirmación del diagnóstico de DM2. Los resultados apuntaron a que sólo era necesario realizarla en los individuos que presentaran una GB de 110-140 mg/dl y una A1C >= 5,5% (con un 84% de sensibilidad y especificidad).
Diversos estudios demostrado que, para el diagnóstico de diabetes, la determinación de A1C o de la GB resulta, por lo menos, tan útil como la cuantificación de la glucosa plasmática a las 2 h de la SOG5,16,17,22,23. Tsuji et al27 exponen que la determinación conjunta de GB y A1C aumenta de forma estadísticamente significativa el número de diagnósticos de diabetes en comparación con la utilización de sólo uno de estos parámetros.
Con todo ello, diseñamos una estrategia diagnóstica lógica, basada en los valores de la GB recomendados en la actualidad (GB > 125 mg/dl) y en la validez de la A1C, que permita obviar la SOG cuando la GB no es diagnóstica (entre 110 y 125 mg/dl). En esta última situación, si la A1C resulta ser >= 5,94% (media + 3 DE), el diagnóstico de DM2 es muy fiable y permite acertar en el 93% de los casos.
Conclusiones
A pesar de las limitaciones del estudio, nos gustaría extraer algunas consideraciones prácticas acordes con las efectuadas por otros autores5,10,16,17,22,26-29. Creemos que una combinación de los valores de la GB y la A1C puede resultar de extraordinaria utilidad para establecer el diagnóstico de la enfermedad diabética:
Si la GB es repetidamente superior a 125 mg/dl, debe establecerse el diagnóstico de DM2, y será necesaria una determinación de la A1C para valorar su estado metabólico y orientar el tratamiento.
Si la GB es repetidamente inferior a 110 mg/dl, es probable que el paciente deba ser considerado como normal.
Si la GB oscila entre 110-125 mg/dl, es posible que haya una alteración de la tolerancia a los hidratos de carbono y, por tanto, parece recomendable efectuar una determinación de la A1C. Si los valores son inferiores a la media + 3 DE (< 5,94% en nuestro caso), está indicado realizar un seguimiento periódico del enfermo con un especial abordaje de los factores de riesgo para desarrollar la DM2 (obesidad, sedentarismo, etc.). Si la A1C es superior a esa cifra, el enfoque práctico es que debe ser considerado como un diabético y se instaurarán medidas higiénico-dietéticas más agresivas; asimismo, es probable que se deba valorar el tratamiento farmacológico a corto plazo.
Esperemos que en un futuro no muy lejano se unifiquen y estandaricen las técnicas de laboratorio para determinar la A1C y así poder identificar con mayor facilidad a los individuos que requieren alguna intervención para prevenir el desarrollo y la progresión de la enfermedad y sus complicaciones crónicas.