Introducción
La indicación de la vacuna antineumocócica en las personas de 65 o más años no está exenta de debate por la discordancia existente entre los distintos estudios realizados1-4, habiéndose observado una importante disparidad en las recomendaciones internacionales para su uso en este grupo de edad2,5,6. Esta polémica se originó a principios de los años ochenta ante la dificultad para demostrar la efectividad de la vacuna en ancianos de grandes ensayos clínicos7. Se argumentó que el poder estadístico necesario para demostrar la eficacia protectora de la vacuna sólo podría conseguirse con ensayos clínicos con un número de participantes tan elevado que los hacía impracticables8. A partir de finales de la década de los ochenta, las recomendaciones de uso de la vacuna en mayores de 65 años se apoyan en los resultados de estudios observacionales. Por ello es oportuna una revisión sistemática y exhaustiva de la bibliografía, que incluya ensayos clínicos y estudios observacionales, y que, tras aplicar criterios de calidad metodológica, garantice una estimación no sesgada de la efectividad de la vacuna neumocócica en el anciano.
Metodología
Con el objetivo de estimar la efectividad de la vacuna antineumocócica de 23 polisacáridos capsulares para evitar la enfermedad producida por el neumococo en individuos mayores de 65 años, se llevó a cabo una revisión sistemática de la bibliografía, incluyendo tanto ensayos clínicos como estudios observacionales. Se realizó una búsqueda bibliográfica de los artículos publicados en castellano, inglés y francés, en el repertorio MEDLINE, del año 1964 al 2000; en EMBASE, de 1988 a 2000; se revisó la base de datos de la Cochrane Library en soporte CD-ROM9, hasta la primera entrega del año 2001; se buscaron referencias no identificadas con anterioridad tanto en las citas bibliográficas de los estudios identificados como en 4 revisiones, tres de ellas sistemáticas, sobre la efectividad de la vacuna de polisacáridos1-4, y se contactó con otros autores para solicitar información no publicada u otras referencias no identificadas.
Se utilizaron dos estrategias de búsqueda, una sensible, con los términos pneumoc* AND vaccin* AND elderly, y otra específica, con los términos pneumoc* AND vaccin* AND elderly AND (effectiv* OR effica*). Se recuperaron aquellos artículos, tanto ensayos clínicos como estudios de cohortes o de casos y controles, que describieron resultados sobre el efecto de la vacuna en el riesgo de enfermedad neumocócica, definida como neumonía neumocócica o enfermedad invasora, ambas originadas por neumococos de los serotipos incluidos en la vacuna e identificados mediante cultivo, en poblaciones de adultos de 65 años o más. La enfermedad invasora fue definida como el aislamiento del neumococo de una localización anatómica normalmente estéril.
Criterios de inclusión, exclusión y valoración de los estudios
Los estudios fueron valorados independientemente por 4 investigadores con criterios de validez predefinidos10-13, y las diferencias se resolvieron por consenso del grupo investigador. Los criterios de inclusión para la selección de los estudios fueron: a) que incluyeran información sobre la administración de la vacuna en adultos de 65 años o más; b) que midieran el riesgo de neumonía o enfermedad invasora originadas por neumococos de los serotipos incluidos en la vacuna estudiada; c) que incluyeran información sobre la comparabilidad entre casos y controles o expuestos y no expuestos, definida como la pertenencia a una misma base de estudio de los dos grupos de comparación14; d) que la asignación al azar fuera oculta en el caso de los ensayos clínicos15; e) que tuvieran tasas de respuesta superiores al 80% en los estudios observacionales, o pérdidas inferiores al 10% en ensayos clínicos16; f) ausencia de sesgos de clasificación o violaciones graves del enmascaramiento15; g) que realizaran un control adecuado de las variables de confusión, y h) que existiera información suficiente para rehacer el análisis17. El incumplimiento de cualquiera de los dos primeros criterios (a y b) implicó la exclusión del estudio. El resto de criterios se consideraron parámetros para valorar la calidad de los estudios; una vez valorados, se clasificaron según la siguiente matriz12:
Se eliminaron del análisis cuantitativo los estudios clasificados como C y se incluyeron los clasificados como A o B.
Análisis
Se realizó un análisis descriptivo del año de publicación, los grupos de edad incluidos, tipo de población, diseño del estudio, número de serotipos incluidos en la vacuna estudiada, tipo de resultados estudiados y efectivos incluidos, así como las estimaciones del riesgo relativo (RR) y su intervalo de confianza (IC). Dada la baja frecuencia de los sucesos de interés, la odds ratio (OR) se consideró como estimador no sesgado del RR. También, para cada uno de los estudios, se describieron los factores que comprometieron la validez de sus estimaciones y la probabilidad de resultados sesgados.
Posteriormente, y como paso previo a la estimación del efecto protector de la vacuna, se valoró la homogeneidad de los estudios mediante gráficos en los que se visualizaron las estimaciones puntuales del RR de enfermedad neumocócica y sus intervalos de confianza, así como su solapamiento o divergencia. Se puso a prueba la hipótesis de homogeneidad mediante la estimación del estadístico18 χ2, se consideró la existencia de un grado de heterogeneidad significativo para valores de p < 0,10. Se exploró la posibilidad de un sesgo de publicación mediante la prueba de Egger19. Se estimó hasta qué punto características de los estudios como el diseño, el número de serotipos incluidos en la vacuna, el año de realización o la presencia de sesgos influyeron en la heterogeneidad observada de las estimaciones, para lo cual se realizó una regresión (metarregresión) de las características mencionadas sobre el logaritmo del RR20. Sólo cuando se cumplieron los criterios de inclusión y de validez y no pudo rechazarse la hipótesis de homogeneidad se estimaron el RR agregado y su intervalo por el método de efectos aleatorios de DerSimonian y Laird18, con un nivel de confianza del 95%. Cuando el intervalo de confianza del RR estimado incluyó el 1, se interpretó que la vacuna no confirió una protección significativa frente a la enfermedad neumocócica. La efectividad agregada de la vacuna se calculó como (1 RR) × 10021. También se estimó el número necesario de sujetos a vacunar (NNV) para evitar los desenlaces de interés22,23.
Los cálculos se llevaron a cabo con Excel, Access, Epi Info v. 6.04b y STATA v5.
Resultados
Se identificaron 25 publicaciones que estudiaron la efectividad de la vacuna neumocócica comparada con un grupo control para evitar enfermedad neumocócica7,24-47. Cuatro fueron excluidas al referirse a adultos jóvenes o población infantil24,27,28,34 y una quinta por incluir población a partir de 10 años de edad sin aportar información por grupos de edad y realizarse en un contexto difícilmente aplicable al mundo occidental26. De las 20 publicaciones restantes (tabla 1), 11 fueron ensayos clínicos7,25,29,31,33,35,36,38,44-46, y 9, estudios observacionales30,32,37,39-43,47.
De los 11 ensayos clínicos recuperados, en 8 se analizó la eficacia de la vacuna para evitar enfermedad neumocócica producida por serotipos incluidos en la misma7,25,29,31,33,35,45,46; en 6 (tabla 2) no se llevó a cabo una asignación aleatoria adecuada de los participantes a un grupo control y otro experimental, ni existió enmascaramiento de los investigadores, de los sujetos sometidos a la intervención o ambos25,29,31,33,44,46; para los 5 restantes se concluyó la existencia de una posibilidad baja o moderada de estimaciones sesgadas al haberse realizado una asignación aleatoria de los participantes y existir un enmascaramiento de investigadores y participantes7,35,36,38,45.
De los 9 estudios observacionales recuperados, cuatro analizaron la efectividad de la vacuna para evitar enfermedad neumocócica producida por serotipos incluidos en ella32,37,41,42; 6 presentaron posibilidades altas de estimaciones sesgadas (tabla 3). Los pacientes descritos en el estudio de Bolan et al32 fueron incluidos en el estudio publicado por Butler et al42 y, mientras que en el primero no se aportaron datos sobre la exhaustividad en la información sobre la exposición, en el segundo se careció de información sobre la exposición del 39% de los sujetos susceptibles de ser incluidos, por lo que fue posible considerar insuficiente la validez de las estimaciones. En el estudio de Sims et al39 fueron descartados 107 sujetos (46%) de los 229 identificados por carecer de información sobre la exposición. Los dos estudios de Shapiro et al30,41, publicados en 1984 y 1991, presentaron características que concordaron con criterios compatibles con estimaciones moderadamente válidas, junto con estimaciones que cambiaron de sentido, por una parte al rehacer el análisis, tras obviar el apareamiento en un estudio de casos y controles apareado30, o al prescindir de la información disponible de 122 casos precisamente vacunados con la vacuna de 23 polisacáridos41. El estudio de Gable et al40 se realizó a partir de datos administrativos y con un análisis inadecuado. Por último, en el estudio de Nichol et al47 los expuestos y no expuestos a la vacuna no pudieron ser considerados miembros de una misma experiencia poblacional de riesgo.
Efecto de la vacuna sobre la neumonía neumocócica por serotipos incluidos en ella
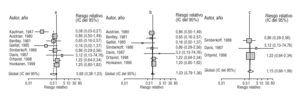
Ocho de los ensayos clínicos recuperados (tabla 1; fig. 1a) estimaron el riesgo relativo de padecer neumonía neumocócica de los vacunados frente a los no vacunados7,25,29,31,35,36,45,46. Tres36,45,46 no realizaron estimaciones sobre neumonías neumocócicas originadas por serotipos incluidos en la vacuna (tabla 2). Sólo en el estudio de Kaufman et al25, con una vacuna compuesta por tres serotipos capsulares (tabla 1), se efectuó una estimación favorable de la eficacia protectora de la vacuna. Como se observa en la figuras 1a y b, este estudio difícilmente puede considerase similar al resto de los realizados entre 1980 y 1998. Ninguno de los ensayos clínicos restantes estimó un RR significativamente protector de la vacuna (fig. 1b). En la figura 1c se representan las estimaciones de los tres ensayos (de los 8 iniciales) que cumplieron los criterios de validez de las estimaciones (tabla 2). Fue excluido el ensayo de Austrian7, ya que en éste se obtuvieron muestras para la identificación del serotipo causante en menos del 75% de los pacientes con neumonía, aunque, como se observa en la figura 1 y tabla 1, sus estimaciones no indicaron en ningún caso una eficacia protectora de la vacuna. Por último, sólo el ensayo clínico de Simberkoff et al35, llevado a cabo en 1986, cumplió los criterios de inclusión, tanto de validez de sus estimaciones como en la especificidad en nuestra definición de caso, al realizar estimaciones sobre el riesgo de neumonía neumocócica por serotipos incluidos en la vacuna. La mejor estimación disponible situó el RR de neumonía neumocócica de los vacunados, frente a los no vacunados, en el 0,86, con un IC del 95% de 0,24 a 2,99. La efectividad para evitar neumonías neumocócicas producidas por los serotipos incluidos en la vacuna fue del 14%, con un IC del 95% de 199 al 76%.
Figura 1. Gráfico de los riesgos relativos de neumonía neumocócica. En la primera figura (a) se incluyen todos los estudios que midieron la efectividad de la vacuna para evitar este desenlace; la prueba de homogeneidad resultó en una χ2 = 191,63; con 7 grados de libertad, y p < 0,001. En la segunda figura (b), tras excluir el estudio de Kaufman25, la prueba de homogeneidad de la χ2 fue de 2,69; con 7 grados de libertad y p = 0,85. La tercera figura (c) incluye los tres estudios que valoraron el riesgo relativo (RR) de neumonía neumocócica de los vacunados frente a los no vacunados y que cumplieron los criterios de calidad metodológica; sin embargo, en dos (Davis et al36 y Ortqvist et al45) no se valoraron los serotipos causantes. Las áreas de los rectángulos reflejan la precisión de las estimaciones de los distintos estudios.
El número necesario de sujetos a vacunar (NNV) para evitar un caso fue de 1.197, con un IC que incluyó la posibilidad de originar un caso de neumonía neumocócica por cada 85 vacunados o más, o de evitar un caso por cada 242 individuos vacunados o más; este intervalo incluyó el valor infinito (tabla 4).
Efecto de la vacuna sobre la enfermedad invasora por serotipos incluidos en ella
Diez estudios realizaron estimaciones de la efectividad de la vacuna sobre la enfermedad invasora producida por serotipos incluidos en ella (fig. 2a) y sólo tres (Kaufman25, Bolan et al32 y Butler et al42) concluyeron que la vacuna fue significativamente superior al placebo (fig. 2a). El estudio de Kaufman25 presentó importantes limitaciones en cuanto a la asignación aleatoria de los participantes o el enmascaramiento de los investigadores; los estudios de Bolan et al32 y Bultler et al42 publicaron los resultados de la misma serie de pacientes y no aportaron información sobre la exposición en un alto porcentaje de casos. Los estudios de Bentley et al29, Klastersky el al33 y Honkanen et al46 tampoco reunieron los criterios requeridos por deficiencias en la asignación aleatoria de los sujetos a las intervenciones y ausencia de enmascaramiento de investigadores o participantes (tabla 2).
Figura 2. a) Gráfico de las estimaciones del riesgo relativo (RR) de enfermedad invasora por neumococos de los serotipos incluidos en la vacuna y de su intervalo de confianza del 95% (IC del 95%), de todos los estudios recuperados. La prueba de homogeneidad resultó en una χ2 = 16,12, con 9 grados de libertad; p = 0,06. La escala del eje de las x ha sido truncada a derecha e izquierda con objeto de mejorar la visualización; b) gráfico de las estimaciones del RR y su IC del 95% de los estudios que cumplieron los criterios de inclusión. El RR global fue de 0,68; IC del 95% de 0,39 a 1,18; p = 0,17; la prueba de homogeneidad χ2 fue de 2,09; con 3 grados de libertad y una p = 0,55. Las áreas de los rectángulos reflejan la precisión de las estimaciones de los distintos estudios.
De los 10 estudios reseñados, dos ensayos clínicos (Simberkoff et al35 y Ortqvist et al45) y dos estudios observacionales (Forrester et al37 y Shapiro et al41) reunieron los criterios de calidad metodológica suficientes para confiar en la validez de sus resultados (tablas 2 y 3). El RR agregado de enfermedad invasora fue de 0,68, con un IC del 95% de 0,39 a 1,18 y un valor de p = 0,17 (fig. 2b). La prueba de la χ2 para el contraste de hipótesis de homogeneidad entre los distintos estudios fue de 2,09, con 3 grados de libertad, y una p = 0,55. En cuanto a la prueba de Egger, para valorar la posibilidad de sesgos de publicación, el resultado no fue significativo (p = 0,79). La efectividad de la vacuna fue del 32%, con un IC del 95% de 18 al 61%, incluyendo una estimación negativa de su efecto.
El NNV para evitar un caso de enfermedad invasora fue de 785, con un IC que incluyó la posibilidad de originar un caso de enfermedad invasora por cada 1.399 vacunados o más, o de evitar un caso por cada 412 vacunados o más. De nuevo, este intervalo incluyó el valor infinito (tabla 4).
Análisis de sensibilidad
En cuanto a la efectividad de la vacuna en la prevención de la neumonía neumocócica, y tal como se observa en la figura 1a, el estudio de Kaufman25 explicó la heterogeneidad en las estimaciones del riesgo de neumonía neumocócica, extremo que se comprobó en el análisis de metarregresión, en el que ni el número de serotipos incluidos en la vacuna ni el año de realización o la presencia de sesgos alteraron significativamente los resultados tras la exclusión del estudio mencionado.
Tal como se observa en la figura 2a, los resultados de los trabajos que estudiaron la efectividad de la vacuna para evitar enfermedad invasora presentaron un alto grado de heterogeneidad. En el análisis de metarregresión sobre el logaritmo del RR, y al tener en cuenta el año de realización del estudio, el diseño, los serotipos incluidos y la presencia de sesgos, fue este último factor el que mejor explicó (p = 0,009) la variabilidad de los resultados observados (fig. 3), hasta el punto de que la estimación puntual de la efectividad de la vacuna fue 2,6 veces superior en aquellos estudios en los que se consideró comprometida la validez de sus estimaciones comparada con la efectuada por los estudios no sesgados (clasificados como A o B), pasando el RR de 0,26 a 0,68 e incluyendo el IC, en este último caso, la nulidad del efecto.
Figura 3. Resultado de la metarregresión del efecto del sesgo sobre las estimaciones de la efectividad de la vacuna para evitar enfermedad invasora. Las estimaciones de los estudios clasificados AB fueron significativamente distintas (p = 0,004) de las obtenidas en los estudios clasificados como C. La interpretación de los valores representados en el eje de la x es: A, baja posibilidad de resultados sesgados; B, posibilidad moderada de resultados sesgados; C, posibilidad alta de resultados sesgados (véase el apartado «Metodología»).
Discusión
Veinticinco años después de la primera autorización de la vacuna de polisacáridos capsulares frente al neumococo, todavía persiste la incertidumbre sobre su eficacia y algunos autores advierten que es preciso revisar, a la luz de los conocimientos actuales, las recomendaciones a favor de su uso sistemático en las personas de 65 años o más4. A ello ha contribuido que los defensores de la vacuna apoyaran la posición de impracticabilidad de los ensayos clínicos y de la suficiencia de los estudios observacionales8. La presente revisión sistemática de la bibliografía y metaanálisis incluye estudios observacionales y ensayos clínicos, y obtiene estimaciones de la efectividad de la vacuna en las que el límite inferior del intervalo de confianza es negativo, esto es, no se encontraron pruebas de la efectividad de la vacuna neumocócica para reducir o evitar enfermedad neumocócica en el anciano. Estos resultados concuerdan con los hallazgos de Fine et al1 y de Moore et al4, que solamente incluyeron ensayos clínicos en su revisiones.
Son varios los factores que pueden comprometer los resultados de una revisión sistemática de la bibliografía19. Un sesgo posible deriva de la falta de inclusión de estudios, sea por el predominio de las publicaciones en inglés, y por tanto, a una menor probabilidad para ser citadas y recuperadas publicaciones en otros idiomas; porque las bases de datos utilizadas en la búsqueda sean selectivas en las citas que contienen, o también por no recuperar trabajos no publicados, la mayoría de las veces por presentar resultados negativos. En el presente estudio no se restringió la búsqueda al idioma inglés, se realizaron búsquedas tanto en MEDLINE como en EMBASE, o en la Cochrane Library, y se realizaron los esfuerzos necesarios para recuperar los trabajos no publicados, como el estudio de Austrian7, un ensayo clínico con asignación aleatoria oculta, doble enmascaramiento y con un número de participantes elevado (13.600). Se contactó con otros autores a fin de recabar información sobre publicaciones adicionales y se escrutaron las referencias bibliográficas de los trabajos recuperados. De hecho, el resultado de la prueba de Egger, practicada sobre los estudios que valoraron la enfermedad invasora, estuvo a favor de la ausencia de resultados sesgados por la falta de inclusión de estudios19.
También cabe la posibilidad de error al realizar una elección y aplicación sesgada de los criterios de inclusión y exclusión, en la extracción de los datos o en la aplicación de los criterios de calidad. Con objeto de evitar esta posibilidad los objetivos y los criterios de inclusión se definieron antes del inicio del estudio12. Además, se incluyeron tanto ensayos clínicos como estudios observacionales. Los estudios fueron revisados y valorados de forma independiente por los autores del presente trabajo utilizando el mismo método de análisis.
En cuanto a los estudios incluidos, las posibles fuentes de heterogeneidad se redujeron al adecuar nuestra selección a la pregunta que motivó el presente trabajo. Así, la aplicación de la edad como criterio de inclusión motivó la exclusión de aquellos estudios realizados sobre población infantil o adultos jóvenes, con respuestas a la vacuna distintas de las observadas en ancianos1; además, se optó por incluir sólo estudios con desenlaces clínicos no ambiguos, que valoraron la protección conferida frente a la neumonía neumocócica o enfermedad invasora originadas ambas por Streptococcus pneumoniae de los serotipos incluidos en la vacuna. Otra fuente de heterogeneidad entre los estudios incluidos pudo derivarse de la agregación de los resultados de ensayos clínicos y estudios observaciones. Sin embargo, cuando concurren en su diseño elementos suficientes de rigor y realización, los resultados de ensayos clínicos y estudios observacionales son coincidentes48,49. La heterogeneidad de los resultados, tanto de los estudios incluidos como de los no incluidos (fig. 2a), se explicó fundamentalmente por la presencia o ausencia de factores que comprometieron la validez de los resultados estimados (fig. 3), frente a otros factores como el tipo de diseño, el año de publicación o el número de serotipos incluidos en la vacuna, que no afectaron significativamente a las estimaciones.
Por otra parte, cabe considerar adecuado el modelo estadístico de efectos aleatorios para agregar los datos de los distintos estudios, frente a un modelo de efectos fijos. Mientras éste asume que las diferencias en las estimaciones se deben únicamente a un error de muestreo, el modelo de efectos aleatorios tiene además en cuenta que los estudios incluidos estiman diferentes magnitudes de la efectividad de la vacuna, al haberse llevado a cabo sobre grupos de participantes de características no homogéneas. Éste fue el caso en la presente revisión, al realizarse los estudios recuperados, con independencia de la edad, sobre poblaciones con distintos perfiles de riesgo18.
La discrepancia entre los resultados obtenidos con los de la revisión sistemática de Hutchinson et al3 se explica porque dichos autores agregaron los resultados obtenidos a partir de estudios realizados en distintos grupos de edad, hecho que al ser tenido en cuenta anuló la significación estadística de las estimaciones.
Por último, y siguiendo la nomenclatura propuesta por Altman23, los resultados se presentan como la estimación del número necesario de sujetos a vacunar y su intervalo de confianza. Extrapolados éstos a la incidencia de casos de enfermedad invasora más plausible en la comunidad50, 50 por 100.000 mayores de 65 años, y suponiendo que el 90% podría ser originado por alguno de los serotipos incluidos en la vacuna, el número estimado de sujetos a vacunar para evitar un caso de enfermedad invasora se situaría en 6.947, con un intervalo de confianza que incluiría la posibilidad de originar un caso de enfermedad invasora por cada 12.352 vacunados o más, hasta la de evitar un caso por cada 3.644 vacunados o más. Estas estimaciones implican la imposibilidad de afirmar la existencia de pruebas suficientes a favor de la vacuna, y sitúa la estimación en un abanico de valores que incluyen, además del efecto nulo, la posibilidad de que la vacuna contribuya a que se produzcan casos de la enfermedad que se pretende evitar.
En conclusión, en la revisión realizada no se encontraron pruebas de la efectividad de la vacuna neumocócica de polisacáridos capsulares no conjugados de S. pneumoniae para reducir o evitar la enfermedad neumocócica en el anciano. A la luz de los hallazgos de la presente revisión y el metaanálisis, es necesario concluir que la indicación sistemática de esta vacuna a la población mayor de 65 años no puede realizarse sin contar con resultados de ensayos clínicos que demuestren de forma inequívoca su eficacia protectora.
Agradecimientos
A la Dra. Soledad Márquez Calderón, Escuela Andaluza de Salud Pública, Granada; al Dr. Juan B. Bellido, Sección de Epidemiología, Centro de Salud Pública de Castellón, y al Dr. Vicente Palop, Unidad de Geriatría, Servicio de Medicina Interna, Hospital de la Ribera, Alzira (Valencia), por sus comentarios y aportaciones a las distintas versiones de este manuscrito.
Correspondencia: Joan Puig-Barberà. Avda. Ferrandis Salvador, 50. 12100 Castellón. España. Correo electrónico: jpuigb@terra.es
Presentado como comunicación oral en XXI Congreso de la Sociedad Española de Medicina de Familia y Comunitaria, San Sebastián, 14 a 17 de noviembre de 2001.
1.er Premio PAPPS-semFYC/Almirall Prodesfarma, XXI Congreso de semFYC.
Manuscrito aceptado para su publicación el 20-II-2002.