Los recientes descubrimientos en genética médica basados en el conocimiento del genoma humano, de la detección de las mutaciones relacionadas con enfermedades comunes, y de los tratamientos genéticos, añadido a la posible demanda futura de información por parte de la población sobre los riesgos de sufrir determinadas enfermedades relevantes, como cánceres, por ejemplo, hacen que los médicos de familia debamos plantearnos al menos nuestro papel en este tema, siendo éste el fin del presente escrito.
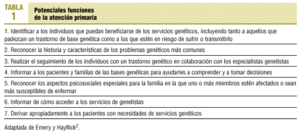
Comienza a publicarse cada vez un mayor número de artículos relacionados con la genética, así como con su utilidad práctica, tanto terapéutica como para prevención de determinadas enfermedades. Se pueden encontrar estudios sobre la identificación de mutaciones relevantes1, sobre los retos de integrar la genética médica en el primer nivel de salud2 (tabla 1) y las tensiones que pueden crearse3 sobre las reacciones de los médicos de familia ante estos nuevos conocimientos4, sobre el impacto que supondría en nuestro trabajo, e incluso se pueden encontrar en Internet recomendaciones al público general sobre cuándo dirigirse al médico de familia para solicitar la realización de pruebas genéticas (www.family doctor.org/handouts/). Es discutible si la genética revolucionará la medicina5, pero lo que parece evidente es que influirá en el futuro próximo, que su conocimiento modificará el curso de la enfermedad, su diagnóstico temprano, su prevención y su tratamiento.
Podemos realizar ya pruebas genéticas en personas asintomáticas para predecir el futuro riesgo de enfermar1.
¿Debemos los médicos de familia desempeñar algún papel en todo esto? Parece evidente que no nos podremos abstraer de la realidad ni aislarnos de las nuevas tecnologías, y éstas utilizarán los conocimientos genéticos. Tan sólo para poder comprender artículos médicos publicados en cualquier revista médica, deberemos conocer el nuevo lenguaje; términos como mutación y sus tipos, penetrancia, alelos, loci, pares de bases, oncogén, reacción en cadena de la polimerasa (PCR), clonación, polimorfismos, farmacogenética o terapia génica serán comunes.
Pero es que además nuestra responsabilidad como «porteros» (gatekeepers) del sistema sanitario nos obliga a orientar, a derivar a nuestros pacientes adecuadamente en cada caso para prevenir/tratar su actual o posible futuro problema de salud, de la manera más eficiente, proporcionándoles los servicios adecuados. Ya en este momento existen organizaciones como el National Institute of Health, el National Human Genome Research Institute6, el UK Cancer Family Study Group o el American College of Medical Genetics, entre otras7, que recomiendan el cribado del cáncer de mama y ovario en población de riesgo mediante la deteccion de BRCA1 o BRCA2, a los que se puede unir el gen CHEK28 según un muy reciente trabajo publicado en Nature Genetics, recomendaciones muy discutidas en el Congreso Europeo sobre Cáncer de Mama celebrado en Barcelona en marzo de 2002, por lo que dentro de nuestra labor preventiva descubriríamos portadores sanos antes de que algunos desarrollen la enfermedad, lo que nos obligaría a realizar su seguimiento, y en algunos casos implicaría cambios conductuales en su vida, donde también nuestra función puede ser importante. ¿Quién mejor que nosotros para realizar la imprescindible historia familiar que habrá que hacer a estas familias? ¿Quién mejor que nosotros para coordinar las múltiples especialidades a las que la genética implicará? (tabla 1).
Las preguntas más pertinentes parecen ser, no si implicarnos, sino cuándo y cómo. Mi opinión particular es que cuanto antes. ¿O es que debemos esperar a que los servicios de genética (donde y cuando existan) se saturen como es previsible?, ¿o debemos esperar a que el servicio de turno decida pasarnos esta responsabilidad y mantener una actitud pasiva, algo sobre lo que ya tenemos experiencias previas? Parece más oportuno trabajar desde el principio conjuntamente (tengamos en cuenta que es nuevo para todos) definiendo nuestra función, consensuando protocolos de derivaciones, de actuación, investigación, etc. ¿Y cómo? Esto parece ser lo más discutible. Corremos el riesgo, como se comenta en un reciente editorial sobre genética publicado el British Medicine Journal, de una medicalización excesiva, de «demasiada medicina»9, y es que por la diferente penetración genética los valores predictivos de estas pruebas son bajos y para este autor no dejarían de ser un factor de riesgo más. Crearíamos una incertidumbre y la angustia reactiva al paciente y su familia. Tampoco está claro que tener una prueba positiva suponga un cambio de conducta en los pacientes10. Para considerar su utilidad clínica deberemos también valorar la gravedad de la enfermedad que consideremos, la disponibilidad de tratamiento efectivo y de medidas preventivas, estableciéndose rangos amplios entre un extremo que podría ser la neoplasia endocrina múltiple tipo 2 hasta la enfermedad de Alzheimer1.
Tampoco sabemos cómo será la respuesta de los médicos de atención primaria a esta nueva posible tarea, con la masificación de nuestras consultas, ni cómo considerar los posibles problemas éticos que aparecerán, la intimidad, confidencialidad, el uso subsecuente de una información tan valiosa para aseguradoras y mutuas.
Para concluir, debemos reconocer los continuos avances en genética, entendida ésta como el estudio de caracteres hereditarios, tanto en terapia génica (los muy recientes éxitos en el tratamiento de la inmunodeficiencia grave combinada11, por ejemplo) como en el descubrimiento e identificación del 90% del mapa genético humano, de su relación con la patogenia de enfermedades comunes y de la posibilidad de realizar tests genéticos. Pero debemos asimismo reconocer el desconocimiento de cómo se produce esta relación, que su valor predictivo es bajo y que para algunos estas pruebas no tienen más valor que el convencional de los marcadores de riesgo9, precisándose más estudios epidemiológicos y ensayos clínicos para objetivar acciones futuras. Es de esperar que tarde o temprano nos veamos obligados a incorporar la genética en nuestro quehacer cotidiano, por lo que creo necesario que nos formemos lo antes posible, prestando atención a las publicaciones en estos temas, proponiendo a la semFYC la creación de grupos de trabajo (intervenciones educacionales)12 para nuestra formación y colaborando, según nuestras posibilidades, con los servicios más sensibles a este tema. No debemos olvidar que en un cupo de 2.000 personas habrá aproximadamente unas 40-50 con un familiar de primer grado con cáncer de mama, ovario, endometrio, colorrectal o con varios a la vez. Para empezar, y pendiente de cómo se desarrollen las investigaciones, quizá sea suficiente con que al historiar se nos encienda la luz de alerta de estar ante una posible enfermedad hereditaria o que vayamos haciendo registro de personas con posible riesgo familiar para trabajar con ellos en un futuro en el que, probablemente, hagamos historias familiares (ya existen softwares13 y cuestionarios14), conozcamos mejor los patrones de transmisión de la herencia, comuniquemos riesgos, realicemos algún tipo de consejo genético, comprendamos mejor las pruebas genéticas (su significado y sus limitaciones), identifiquemos personas a riesgo, etc.; en definitiva, integremos el conocimiento genético dentro de nuestro enfoque biopsicosocial que caracteriza nuestra atención.
Correspondencia: Josu Ibarra Amarica. C/ San Antonio, 31, 5.º. 01005 Vitoria. España. Correo electrónico: josu@infonegocio.com