Determinar los predictores clínicos y ecocardiográficos de regurgitación aórtica periprotésica ≥grado 2 tras el implante percutáneo de una prótesis valvular aórtica.
MétodosDe 88 pacientes tratados con la prótesis CoreValve se seleccionaron 79 pacientes consecutivos que tenían un ecocardiograma completo basal y al alta. El grado de regurgitación aórtica se valoró por ecocardiograma transtorácico según las guías de práctica clínica.
ResultadosLa edad media fue 77±5 años. El grado de regurgitación aórtica al alta fue: ausente, 28%; grado 1/4, 37%; grado 2/4, 29%, y grado 3/4, 6%. La presencia de regurgitación aórtica ≥2/4 se relacionó con: sexo (64% varones vs. 36% mujeres, p=0,02), mayor diámetro de la unión sinotubular (25±5 vs. 23±3mm; p<0,05), sinosinusal (31±4 vs. 29±4; p<0,05) y presencia de calcio anular asimétrico (61% vs. 39%; p<0,05).
ConclusiónLa regurgitación aórtica periprotésica tras el implante de la prótesis aórtica percutánea CoreValve en grado ≥2/4 fue más frecuente en hombres con raíz aórtica grande y presencia de calcio asimétrico.
The purpose of this study was to determine the clinical and echocardiographic predictors of aortic regurgitation of at least of grade 2 after transcatheter aortic valve implantation (TAVI).
MethodsFrom a total of 88 patients with severe aortic stenosis treated with TAVI with the Medtronic CoreValve® bioprosthesis, we analysed 79 consecutive procedures in which we obtained comprehensive echocardiographic examinations at baseline and at discharge. Aortic regurgitation (AR) was assessed by transthoracic echocardiography according to current echocardiography guidelines.
ResultsAt discharge, paravalvular AR was absent in 22 patients (28%), grade 1/4 in 29 (37%), 2/4 in 23 (29%), and 3/4 5 (6%). Occurrence of AR ≥2/4 was related to gender (64% males vs. 36% females, P=.02), larger sino-tubular junction (25±5 vs. 23±3mm; P<.05), aortic sinus diameter (31±4 vs. 29±4; P<.05) and asymmetric calcification of the aortic annulus (61% vs 39%; P<.05).
ConclusionsThe occurrence of aortic regurgitation ≥2/4 was more frequent in males, with a large aortic root and asymmetric calcification aortic annulus.
El implante percutáneo de una prótesis aórtica percutánea es una alternativa de tratamiento para los pacientes con estenosis aórtica severa sintomática y alto riesgo quirúrgico. En las series publicadas este procedimiento está asociado a una alta tasa de éxito y una baja mortalidad hospitalaria1,2. Como es obvio, en toda nueva técnica existen muchos interrogantes, tanto en la indicación como en la evolución y el pronóstico a largo plazo. La regurgitación aórtica (RA) periprotésica, debida a una incompleta aposición de la prótesis al anillo, es frecuente tras el implante transcatéter de la prótesis aórtica CoreValve de Medtronic y esta es leve en la mayoría de los casos1. Se han documentado grados de RA en grado moderado o severo relacionados con una inadecuada selección del tamaño protésico o de su posicionamiento en relación con el anillo aórtico3,4. La RA moderada o severa tras el implante puede ocurrir y recientemente ha demostrado ser un predictor independiente de mortalidad a partir del mes de la intervención5. Sin embargo, los predictores clínicos y ecocardiográficos de esta complicación no han sido ampliamente estudiados. El objetivo de este estudio es determinar los predictores clínicos y ecocardiográficos de RA periprotésica ≥2/4 tras el implante percutáneo de una prótesis valvular aórtica.
MétodosDiseño y definicionesEl estudio diseñado corresponde a una serie de casos. Se analizaron parámetros clínicos y ecocardiográficos en pacientes tratados mediante la implantación de la prótesis aórtica percutánea CoreValve® de Medtronic. Se clasificó el grado de regurgitación protésica de 1 (leve) a 4 (severa). La relación entre la raíz aórtica y el anillo aórtico se definió como el ratio: diámetro sinosinusal/anillo aórtico, ambos obtenidos mediante ecocardiograma transesofágico.
PacientesDe un total de 88 pacientes con estenosis aórtica severa y alto riesgo quirúrgico tratados mediante la implantación percutánea de la válvula aórtica CoreValve® de Medtronic se seleccionó para el análisis a 79 pacientes consecutivos que dispusieran de un ecocardiograma transtorácico y transesofágico en situación basal y transtorácico al alta hospitalaria tras el implante. De todos los pacientes se obtuvo un consentimiento informado.
Mediciones con ecocardiogramaLos estudios ecocardiográficos se realizaron con el mismo ecocardiógrafo (Philips iE33). Se valoró la función ventricular por Teicholtz. La severidad de la estenosis aórtica se definió según el gradiente transvalvular medio y el área valvular aórtica, calculada mediante ecuación de continuidad. El grado de RA se determinó según lo recomendado por otros autores y las guías de ecocardiografía y se clasificó en 1/4 para la insuficiencia trivial o leve, 2/4 para la moderada, 3/4 para la moderada-severa y 4/4 para la severa. Las mediciones de los diámetros ventriculares y el grosor septal y de pared posterior de ventrículo izquierdo se hicieron en modo M en telediástole. El anillo valvular aórtico, con diámetros sinosinusal y sinotubular, fue medido mediante ecocardiograma transesofágico en la visión de eje largo. La calcificación de la válvula aórtica se evaluó por ecocardiograma transesofágico y se clasificó como asimétrica cuando existía discordancia de más de un grado según la clasificación de Rosenhek entre las sigmoideas. Se definió la presencia de mamelón septal cuando existía hipertrofia del septo interventricular a nivel subaórtico (>13mm) con protrusión en tracto de salida de ventrículo izquierdo. En el ecocardiograma al alta hospitalaria, la presencia, el grado y el tipo de regurgitación se determinaron en todos los pacientes usando el ecocardiograma transtorácico.
Análisis estadísticoLos datos cuantitativos se presentan como media±desviación estándar. Los datos cualitativos se expresan en porcentajes. La comparación de las características basales y tras el implante de los pacientes en relación al grado de regurgitación ≥2/4 o <2/4 se realizó utilizando la prueba de la t de Student o Chi-cuadrado, según lo apropiado, y una vez comprobada la normalidad de la muestra. Se consideró resultado estadísticamente significativo el valor de p<0,05.
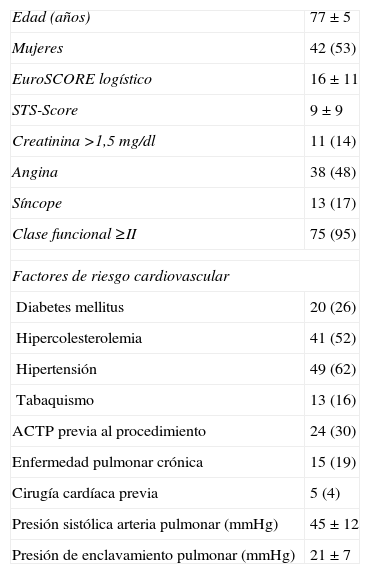
ResultadosLa edad media de nuestra serie es de 77±5 años, y todos presentaban estenosis aórtica severa. Las características clínicas basales de la población se muestran en la tabla 1.
Características basales de la población de estudio (n=79)
| Edad (años) | 77±5 |
| Mujeres | 42 (53) |
| EuroSCORE logístico | 16±11 |
| STS-Score | 9±9 |
| Creatinina >1,5mg/dl | 11 (14) |
| Angina | 38 (48) |
| Síncope | 13 (17) |
| Clase funcional ≥II | 75 (95) |
| Factores de riesgo cardiovascular | |
| Diabetes mellitus | 20 (26) |
| Hipercolesterolemia | 41 (52) |
| Hipertensión | 49 (62) |
| Tabaquismo | 13 (16) |
| ACTP previa al procedimiento | 24 (30) |
| Enfermedad pulmonar crónica | 15 (19) |
| Cirugía cardíaca previa | 5 (4) |
| Presión sistólica arteria pulmonar (mmHg) | 45±12 |
| Presión de enclavamiento pulmonar (mmHg) | 21±7 |
ACTP: angioplastia coronaria transluminal percutánea; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección del ventrículo izquierdo.
Los datos se expresan media±desviación estándar en el caso de variables continuas, y en n (%) en caso de variables categóricas.
En el 69% de los casos se implantó una prótesis pequeña de 26mm y en el 31% restante una prótesis de 29mm.
El grado de regurgitación aórtica residual tras el implante de la prótesis aórtica CoreValve fue: ausente en 22 pacientes (28%), grado 1/4 en 29 pacientes (37%), grado 2/4 en 23 pacientes (29%) y grado 3/4 en 5 pacientes (6%).
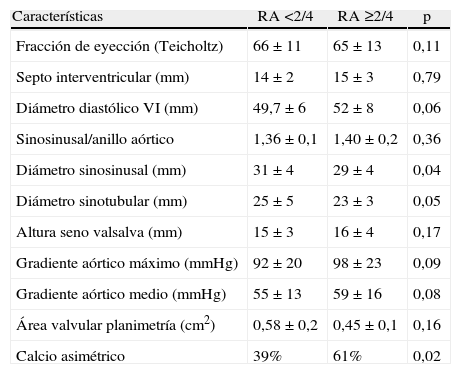
La presencia de regurgitación aórtica ≥2/4 fue más frecuente en varones (64% hombres frente a 36% mujeres, p=0,02) con mayor diámetro sinosinusal (31±4 vs. 29±4; p<0,05), de la unión sinotubular (25±5 frente a 23±3mm; p<0,05) y presencia de calcio anular asimétrico (61% vs. 39%; p<0,05) (tabla 2). No se observaron diferencias en la fracción de eyección por Teicholtz, severidad de la estenosis aórtica, tamaño de la prótesis implantada ni diámetro del anillo aórtico.
Predictores ecocardiográficos de regurgitación aórtica periprotésica
| Características | RA <2/4 | RA ≥2/4 | p |
| Fracción de eyección (Teicholtz) | 66±11 | 65±13 | 0,11 |
| Septo interventricular (mm) | 14±2 | 15±3 | 0,79 |
| Diámetro diastólico VI (mm) | 49,7±6 | 52±8 | 0,06 |
| Sinosinusal/anillo aórtico | 1,36±0,1 | 1,40±0,2 | 0,36 |
| Diámetro sinosinusal (mm) | 31±4 | 29±4 | 0,04 |
| Diámetro sinotubular (mm) | 25±5 | 23±3 | 0,05 |
| Altura seno valsalva (mm) | 15±3 | 16±4 | 0,17 |
| Gradiente aórtico máximo (mmHg) | 92±20 | 98±23 | 0,09 |
| Gradiente aórtico medio (mmHg) | 55±13 | 59±16 | 0,08 |
| Área valvular planimetría (cm2) | 0,58±0,2 | 0,45±0,1 | 0,16 |
| Calcio asimétrico | 39% | 61% | 0,02 |
RA: regurgitación aórtica; VI: ventrículo izquierdo.
Los datos expresan en media±desviación estándar en el caso de variables continuas y en n (%) en caso de variables categóricas.
La presencia de regurgitación aórtica grado 3/4 se relacionó con un mayor diámetro diastólico ventricular izquierdo (58±11 vs. 50±6mm; p<0,02), diámetro sinosinusal (35±3 vs. 29±4mm; p<0,01), unión sinotubular (30±5 vs24±4mm, p<0,01), relación sinosinusal/anillo aórtico (1,6±0,1 vs. 1,4±0,1; p<0,01) y protrusión septal subaórtica (80% vs. 20%; p<0,01).
DiscusiónLa RA paravalvular, tras el implante de una prótesis percutánea CoreValve, es una complicación inmediata tras el procedimiento, y su tratamiento es vital para un resultado final satisfactorio. La aparición de RA tras el implante es frecuente, y cuando aparece suele ser leve o moderada en la mayoría de los casos, al igual que lo publicado en otras series1,6–8.
Según nuestros resultados, el mayor tamaño de la raíz aórtica, la presencia de calcio asimétrico, así como la mayor desproporción del anillo valvular aórtico con la raíz aórtica, se relacionan con el grado de RA. Estos datos no han sido estudiados en otras series, pero parece lógico que al presentar mayor diámetro la raíz aórtica, el contacto de la prótesis con la pared no sería óptimo y provocaría mayor grado de regurgitación periprotésica. Se ha documentado que a mayor angulación entre el tracto de salida de ventrículo izquierdo y la raíz aórtica, el grado de regurgitación aórtica es mayor9, por lo que este dato podría explicar nuestros resultados, ya que el aumento del diámetro de la raíz aórtica puede modificar el grado de angulación entre esta y el tracto de salida ventricular izquierda.
La posición de la prótesis aórtica en relación con el anillo valvular nativo también se relación con el grado de RA. Se ha publicado en otras series que un implante protésico muy bajo o muy alto influyen en el grado de regurgitación aórtica4,10. En nuestra serie se documentaron 2 casos de implante muy bajo con RA severa que fueron solucionados mediante la tracción de la prótesis con lazo, pero no tuvimos ningún caso de implante demasiado alto.
El hecho de que los varones presenten mayor grado de RA periprotésica podría estar explicado por la presencia de mayor diámetro de la raíz aórtica.
La desproporción entre el tamaño protésico elegido y el anillo aórtico se asocia a mayor grado de regurgitación9. Este dato no ha sido confirmado en nuestra serie y es explicado por el protocolo exhaustivo preimplante que realizamos para obtener una buena medida del anillo y la raíz aórtica mediante ecocardiograma transtorácico, transesofágico, angiografía y tomografía multicorte.
En nuestra serie también se relaciona la presencia de regurgitación aórtica mayor o igual a grado 2/4 con la presencia de calcio asimétrico en el anillo y sigmoideas aórticas. La explicación que damos a este dato es que la presencia de mucho calcio y de disposición asimétrica hace que la prótesis no se expanda adecuadamente y por tanto la adaptación de esta a la raíz no sea la adecuada. En el 26% de la serie fue necesaria la posdilatación con balón por una inadecuada expansión de la prótesis, con una disminución en el grado de RA periprotésica tras el procedimiento. Efecto similar provocaría una hipertrofia septal subaórtica que no permitiría la expansión adecuada de la prótesis.
Consideramos que estos datos pueden ser de gran ayuda en la práctica clínica diaria para el grupo de pacientes con anillo limítrofe (23mm) para decidir si se implanta una prótesis pequeña o grande. En estos casos no solo habría que tener en cuenta el diámetro del anillo, sino también el diámetro de la raíz aórtica y el diámetro ventricular para una correcta elección del tamaño de la prótesis a implantar.
LimitacionesSe trata de un estudio con tamaño muestral reducido para obtener conclusiones de peso. La no realización de un análisis multivariable es una limitación importante de nuestro estudio y consideramos necesario la recopilación de un mayor número de casos para la eliminación de posibles factores de confusión. Sería necesario incluir otro tipo de variables para la mayor comprensión del mecanismo de regurgitación periprotésica y poder predecir mejor en qué casos el resultado del implante será más óptimo.
ConclusionesLa regurgitación aórtica ≥2/4 fue más frecuente en hombres con raíz aórtica grande y presencia de calcio asimétrico.
Conflicto de interesesNo existen conflictos de intereses.