En el presente documento se describe el posicionamiento de la Sociedad Española de Cirugía Tórácica y Cardiovascular en relación con la valvulopatía aórtica y su abordaje médico-quirúrgico. En concreto, se establece la plasmación asistencial de las guías de práctica clínica europeas y americanas al contexto concreto de la enfermedad valvular aórtica en España. De forma específica se explicitan los criterios de indicación y requisitos estructurales, técnicos y profesionales necesarios para la realización de procedimientos de implante de válvula aórtica transcatéter con objeto de alcanzar la máxima calidad asistencial y seguridad para el paciente.
The present document describes the position of the Spanish Society of Thoracic and Cardiovascular Surgery as regards aortic valve disease and its medical-surgical approach. In particular, it establishes the embodiment of the european and american clinical practice guidelines in the particular context of aortic valve disease in Spain. Specifically, they explain the indication criteria and structural requirements, as well as the techniques and professionals needed to perform transcatheter aortic valve implantation, with the aim of achieving maximum quality and safety for the patient.
La estenosis aórtica degenerativa calcificada, relacionada con la edad, es la causa más frecuente de estenosis aórtica en adultos. Se puede estimar que entre el 2% y el 5% de las personas mayores de 65 años sufren una estenosis aórtica calcificada significativa, y el 29% de ellos presentan una esclerosis valvular aórtica sin compromiso hemodinámico1,2. La enfermedad degenerativa calcificada de la válvula aórtica, incluso sin la presencia de estenosis significativa, se asocia a un riesgo combinado de muerte cardiovascular e infarto agudo de miocardio un 50% superior a la media poblacional3. Por su parte, la supervivencia media de los pacientes que sufren estenosis aórtica significativa es de dos a cinco años, dependiendo, entre otros factores, de los síntomas que presenten4.
En el momento actual, la estenosis aórtica degenerativa adquiere rangos epidémicos en cuanto a su distribución, impacto en años de vida ajustados por calidad de vida y en cantidad de vida.
Desde el punto de vista asistencial, las distintas estrategias terapéuticas dirigidas a los pacientes con estenosis valvular aórtica dependen de un adecuado diagnóstico etiológico, del compromiso hemodinámico que generan y del estadio de la enfermedad producida. La cirugía de sustitución valvular aórtica es el tratamiento estándar para la estenosis aórtica severa, siendo un procedimiento sencillo y rápido con excelentes resultados contrastados. Datos actuales de la STS reportan que el recambio valvular aórtico tiene una mortalidad global por debajo del 3%, estando muy relacionada con la severidad o estadio de la enfermedad y las comorbilidades de los pacientes intervenidos5. De hecho, en pacientes seleccionados con escasas comorbilidades, la mortalidad y morbilidad esperada se sitúa por debajo del 1%. En España la mortalidad global descrita para la sustitución valvular aórtica aislada fue del 3,7% en 2015 (Euroscore I 8,4%, Euroscore II 3,5%) y del 4,07% en 2016 (Euroscore I 7,94%, Euroscore II 3,15%)6.
Junto a los excelentes resultados quirúrgicos de nuestros centros, asistimos al crecimiento exponencial de los procedimientos de cirugía mínimamente invasiva, experimentando un gran desarrollo técnico y metodológico en los últimos años. La progresiva instauración de programas de cirugía aórtica miniinvasiva ha conducido a incrementar la calidad asistencial, proporcionando una mejor y más pronta recuperación postoperatoria, una reducción de las tasas de infecciones quirúrgicas, una disminución del dolor postoperatorio y minimizar la necesidad perioperatoria de hemoderivados, especialmente en pacientes de edad avanzada7. Ventajas que han sido muy potenciadas por el uso de prótesis valvulares de liberación rápida y válvulas sin sutura. Debemos destacar también que la mejora en el diseño de las válvulas mecánicas y biológicas ha reducido la necesidad de anticoagulación, permitiendo una menor tasa de sangrado, eventos tromboembólicos y la necesidad de reoperación por fallo estructural en las prótesis biológicas8–11.
Por todo ello, podemos afirmar que, en la actualidad, la cirugía es el «gold estándar» en el tratamiento de la estenosis valvular aórtica. Es importante señalar que la evolución en la asistencia sanitaria debe encuadrarse dentro de los parámetros de la medicina basada en la evidencia, ya que los cambios tecnológicos no siempre llevan aparejados un aumento de la eficacia, eficiencia y seguridad en el tratamiento de las enfermedades. Nuestra práctica clínica habitual debe mejorar con el progreso tecnológico y no someterse a la tecnolatría sin fundamento12. La Sociedad Española de Cirugía Torácica y Cardiovascular (SECTCV), a través de este documento, pretende ayudar a los profesionales implicados en el tratamiento integral de la valvulopatía aórtica a elegir la técnica quirúrgica más apropiada para cada paciente y a implementar una dinámica de equipo multidisciplinar en su desarrollo y aplicación.
Implante de válvula aórtica transcatéter. Procedimiento TAVILa introducción de las válvulas transcatéter (TAVI), balón-expandible y autoexpandible, ha permitido abordar con resultados excelentes la estenosis valvular aórtica severa de aquellos pacientes considerados inoperables por su elevado riesgo quirúrgico13–15. En unos pocos años y basados en los resultados de varios ensayos clínicos, los procedimientos TAVI se han convertido en un tratamiento de primera línea de los pacientes inoperables y en una alternativa real para los pacientes de riesgo quirúrgico elevado, expandiéndose su potencial utilización a los pacientes catalogados de riesgo intermedio (STS Score 4-8%; EuroSCORE II 4-9%; EuroSCORE I 10-20%). En nuestro país se ha observado un crecimiento exponencial en los últimos dos años de las técnicas transcatéter para el tratamiento de la estenosis aórtica severa. Así, según el Registro de Intervenciones de la SECTCV 2016, se realizaron ese mismo año un total de 4.986 procedimientos de recambio valvular aórtico mediante cirugía abierta, y 2.370 procedimientos TAVI (1978 Registro de SEC Hemodinámica y 392 Registro SECTCV). Ello supone que este año el 32,2% de los procedimientos sobre válvula aórtica se realizaron mediante técnicas transcatéter (señalamos que solo se contabilizaron en el registro aquellos procedimientos de sustitución valvular aórtica aislada, excluyendo los pacientes de cirugías polivalvulares o valvular aórtico+revascularización miocárdica).
Las evidencias actuales muestran que la TAVI presenta un mayor beneficio en mortalidad frente a la cirugía o al tratamiento médico en pacientes de alto riesgo. Además, el estudio SURTAVI y los resultados previamente obtenidos por el PARTNER IIA muestran un resultado de no inferioridad en los objetivos combinados de muerte por cualquier causa o accidente cerebrovascular incapacitante en pacientes de riesgo intermedio, por lo que la utilización del procedimiento TAVI en estos pacientes es una realidad presente16–18.
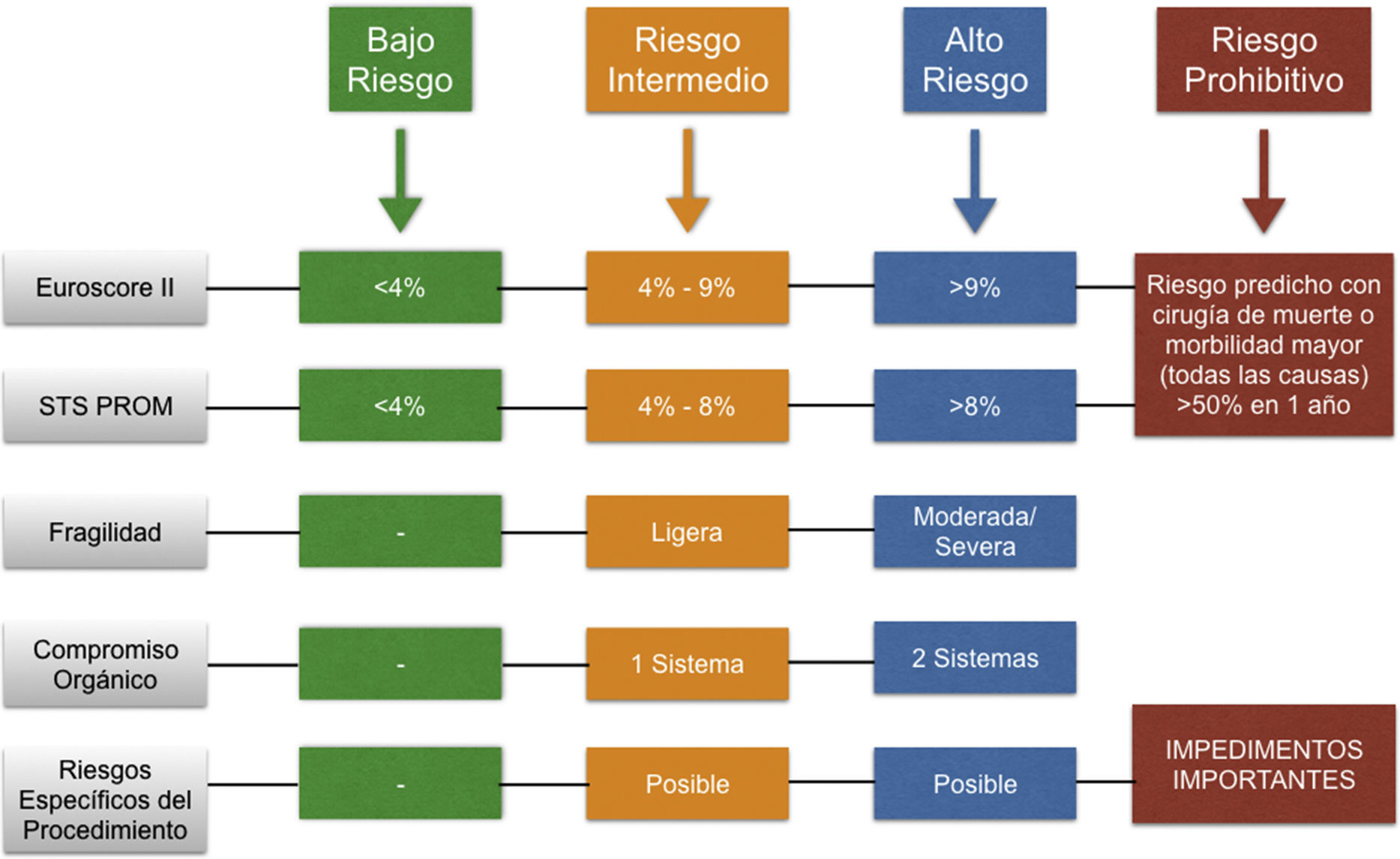
Evaluación del riesgo perioperatorioSobre la base de lo expuesto, comprobamos que la determinación precisa del riesgo que un paciente tiene ante una cirugía de sustitución valvular aórtica es esencial para poder establecer una correcta indicación terapéutica y realizar una apropiada evaluación riesgo-beneficio19–21 (tabla 1).
El STS-PROM score y el EuroSCORE logístico (I y II) son los métodos más frecuentes de estimación de riesgo, construidos sobre la base de un modelo estadístico de regresión multivariante predictivo. Ambos sistemas son suficientemente consistentes y precisos en pacientes de bajo riesgo, aunque presentan una tendencia a la sobreestimación en los enfermos de mayor riesgo. A pesar de disponer de estos instrumentos de fácil aplicabilidad, la evaluación del riesgo real de un paciente concreto puede ser una tarea compleja, incluso para cirujanos experimentados, ya que la aplicación automática de un score matemático, en numerosos casos, no es suficiente. Así, los scores de riesgo habituales, como el STS-PROM, el EuroScore I o el EuroScore II, pueden complementarse con otros factores de riesgo menos convencionales y aparentemente menos objetivos, tales como la fragilidad22–24, el grado de discapacidad, la presencia de comorbilidades no puntuables o no bien evaluadas, aorta de porcelana, etc. Este hecho queda plasmado en las Guías de la AHA y ACC, recomendando llevar a cabo la evaluación del riesgo quirúrgico mediante la combinación de la puntuación del STS score, la fragilidad del paciente, la disfunción de sistemas orgánicos mayores y la dificultad técnica relativa al procedimiento en un paciente concreto25. En este sentido, clasifica a los pacientes en pacientes de bajo riesgo, riesgo intermedio, riesgo elevado y riesgo prohibitivo o inoperables.
De un modo similar, las Guías de Práctica Clínica Europeas (2017)26 precisan que la elección del tipo de intervención debe realizarse en función de las características del paciente, cardiacas y extracardiacas, del riesgo individual del paciente relativo a la puntuación de los scores, de la factibilidad del procedimiento TAVI, de la experiencia del equipo y de los resultados del centro. Siguiendo el esquema de sus recomendaciones, se establecen dos categorías: pacientes de bajo riesgo quirúrgico (STS/EuroScore II<4% o EuroSCORE I<10%) y pacientes con riesgo quirúrgico incrementado (STS/EuroSCORE II ≥4% o EuroSCORE I ≥10%) o que presenten factores de riesgo significativos no incluidos en los scores.
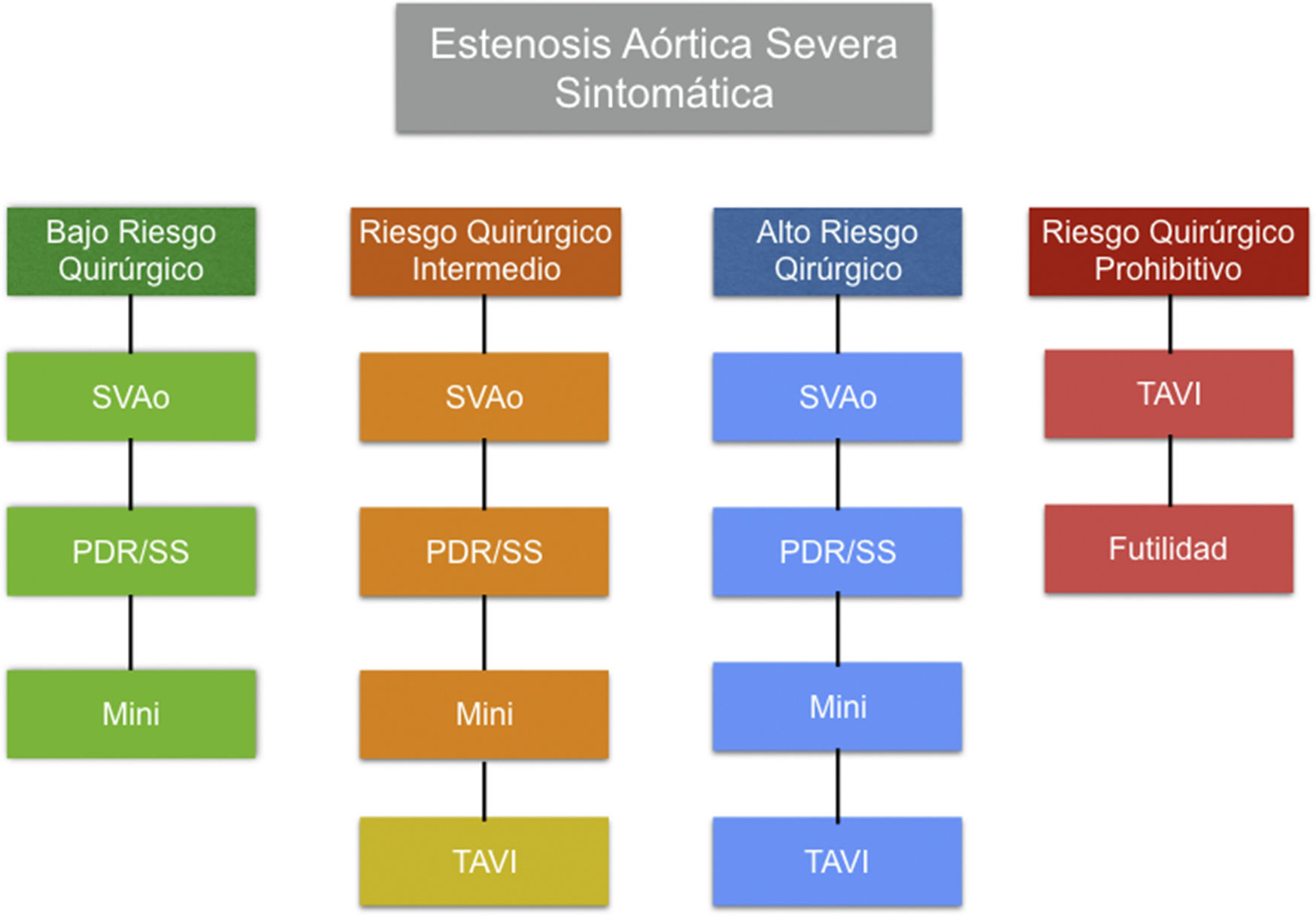
Procedimiento TAVI. IndicacionesLa AHA y la ACC en su actualización de guías de práctica clínica de 201725,26, recomienda que la elección entre el reemplazo valvular quirúrgico y el implante transcatéter debe basarse en una aproximación multidimensional, que incluya el riesgo quirúrgico, la fragilidad del paciente, la presencia de comorbilidades y las preferencias y valores de los mismos. De ahí la gran importancia de la evaluación preprocedimiento y de la necesidad de hacer una indicación individualizada de cada paciente, alejándonos de una aplicación indiscriminada de la técnica basada en un criterio exclusivamente numérico y al margen del enfermo concreto (tabla 2).
En este sentido, si atendemos al riesgo quirúrgico como principal criterio de clasificación, se explicitan las siguientes recomendaciones.
Pacientes de bajo riesgo- •
El reemplazo valvular quirúrgico (AVR) está recomendado en pacientes sintomáticos (estadio D) o asintomáticos (estadio C) que cumplan criterios de cirugía. Recomendación clase IB.
- •
El AVR está recomendado en pacientes con EAo severa sintomática (estadio D) o asintomáticos (estadio C) que cumplan criterios de cirugía. Recomendación clase IB.
- •
El reemplazo valvular transcatéter (TAVR) es una alternativa razonable al reemplazo quirúrgico en pacientes con EAo severa sintomática (estadio D) y riesgo intermedio, dependiendo del riesgo específico del paciente, sus preferencias y valores. Recomendación clase IIa.
- •
El AVR está recomendado en pacientes con EAo severa sintomática (estadio D). Recomendación clase IA.
- •
El TAVR está recomendado en pacientes con EAo severa sintomática (estadio D) y elevado riesgo quirúrgico, dependiendo del riesgo específico de cada paciente, sus preferencias y valores. Recomendación clase IA.
- •
El TAVR está recomendado en pacientes con EAo severa sintomática (estadio D) y riesgo quirúrgico prohibitivo con una expectativa media de vida posprocedimiento superior a 12 meses.
Como elemento principal de selección, incluido en esta actualización de 2017 de las Guías de la AHA, encontramos la presencia de los «síntomas»como criterio de recomendación27. Así, destacamos que la población de pacientes recomendada para la AVR abarca tanto individuos sintomáticos como asintomáticos. Por el contrario, en la población de pacientes recomendada para TAVR la presencia de síntomas es un requisito (no disponemos de evidencias suficientes del implante TAVI en pacientes asintomáticos).
Las recientes guías europeas recomiendan:
- •
Realizar sustitución valvular quirúrgica en pacientes de riesgo bajo (STS/EuroSCORE II<4%, EurosSCORE I log.<10% y ausencia de otros factores de riesgo no incluido en los scores). Clase IB.
- •
Por el contrario, en los pacientes inoperables, no candidatos a cirugía, se recomienda valorar implante TAVI. Clase IB. Es necesario considerar, entre otros elementos, la potencial supervivencia del paciente a un año.
- •
En aquellos pacientes quirúrgicos con riesgo incrementado (STS/EuroSCORE II ≥4%, EurosSCORE I log. ≥10% o presencia de otros factores de riesgo significativos no incluido en los scores), la decisión entre sustitución valvular aórtica o TAVI debe realizarse teniendo en cuenta las características individuales de cada paciente, estando el implante transcatéter favorecido en pacientes ancianos, principalmente si la vía transfemoral es factible. La Guía aporta también, para ayudar en esta decisión, una relación de características clínicas, anatómicas, técnicas, cardiacas y de necesidad de intervención concomitante, que nos orientan más hacia un procedimiento u otro. Clase IB.
- •
Los pacientes dirigidos a la vía tranfemoral en los diferentes estudios en los que se fundamentan las GPC tienen estadísticamente menor riesgo periprocedimiento que los pacientes a los que se realiza procedimiento no transfemoral. Este hecho es debido a que, de forma preferente, las otras vías de acceso, tanto transtorácicas (transapical/transaórtica) como transvasculares (destacando la vía axilar-subclavia), se contemplan como alternativa cuando la vía femoral no es factible. Situación que generalmente conlleva un contexto de morbilidad muy superior en el enfermo. Por su parte, la vía transubclavia ha demostrado ser un abordaje transcatéter excelente, no solo como alternativa a la vía transfemoral, sino como una opción de primera elección a tener en cuenta en numerosos casos. De hecho, varios trabajos, como el de Fröhlich et al. no encuentran diferencias estadísticamente significativas entre ambas vías de abordaje transvascular (transfemoral vs. subclavia)27,28, siendo un acceso vascular seguro y con óptimos resultados29,30.
- •
Destacamos que, en los dos grandes estudios con pacientes de riesgo intermedio, la edad media de los enfermos incluidos fue de 80 y 82 años (Partner II y SURTAVI respectivamente). Lo que muestra la escasa evidencia clínica de la TAVI en pacientes más jóvenes, en pacientes de bajo riesgo y en valvulopatía aórtica no trivalva.
- •
Nuevamente, los pacientes asintomáticos quedan fuera de las recomendaciones para TAVI.
Como podemos apreciar, las recomendaciones europeas26 van un paso más, apoyadas en el reciente estudio SURTAVI, ya que elevan el grado de recomendación de la TAVI en pacientes de riesgo intermedio a IB. Se produce una similitud de indicación entre pacientes de riesgo intermedio y pacientes de alto riesgo. Esta aparente igualación de pacientes que son claramente diferentes es necesario llevarla a la práctica clínica con verdadera prudencia. Además, todavía existen problemas clínicos no bien resueltos de los dispositivos TAVI y que se relacionan principalmente con las complicaciones vasculares del acceso, la elevada necesidad de marcapasos postimplante, la tasa de leak paravalvular, el riesgo de ictus, la trombosis de los neosenos31, el todavía elevado coste económico y la incertidumbre respecto a su durabilidad.
FutilidadEl reemplazo valvular transcatéter no está recomendado en pacientes en los que la presencia de comorbilidades y situación clínica excluirían el beneficio esperado tras la corrección de la estenosis aórtica y/o la expectativa de vida sea inferior a 12 meses. A pesar de la intensa investigación y desarrollo de los procedimientos TAVI, cada vez se evidencian más pacientes en los que este tratamiento no va a generarles una mejoría postimplante, ni en términos de supervivencia, reducción de morbilidad o incremento de funcionalidad. La identificación precisa de los pacientes en los que la TAVI pueda ser considerada un acto de futilidad es una prioridad actual. Aunque no hay una definición uniforme de futilidad, desde la perspectiva TAVI puede considerarse como aquella situación en la que el paciente presenta una expectativa de vida menor de un año o se estima una ausencia de mejoría funcional durante un corto periodo de seguimiento posprocedimiento (6 meses o un año)26,32.
En síntesis, las evidencias actuales muestran la clara superioridad del procedimiento TAVI frente al tratamiento médico en pacientes con EAo severa inoperables, y es equivalente a la cirugía convencional de sustitución valvular aórtica en el paciente de alto riesgo quirúrgico.
Del mismo modo, asistimos a un progresivo esfuerzo por generar evidencias científicas que permitan expandir las indicaciones del implante TAVI a una población de pacientes más jóvenes y/o de más bajo riesgo quirúrgico. Es en este punto donde es necesario llevar a cabo un doble abordaje: por un lado, una aproximación metodológica apropiada, intentando encontrar evidencias de mayor consistencia que las obtenidas actualmente por los estudios de no inferioridad. Por otro lado, y debido a las graves implicaciones que el fallo del procedimiento puede tener, la necesidad de generar un entorno seguro, en el que se pueda realizar el procedimiento, llevar a cabo una cirugía de rescate o incluso disponer de dispositivos de asistencia ventricular (hecho que justifica que el colectivo cardiológico, quirúrgico e institucional no permita que se realicen procedimientos TAVI en centros sin cirugía cardiovascular efectiva y que forme parte del Equipo Multidisciplinar del Corazón).
Cirugía mínimamente invasiva y válvulas de despliegue rápido/sin suturaEn la evaluación de la evidencia disponible y en su concreción en las recientes guías de práctica clínica no se incluye el análisis y, por lo tanto, la aplicación concreta de la cirugía mínimamente invasiva ni de las prótesis biológicas de liberación rápida y aquellas tipo «sin sutura» en el tratamiento de la valvulopatía aórtica. Sin duda, la aparición de las válvulas «sin sutura» implica la obligatoriedad de incorporarlas al algoritmo terapéutico. Así, la plasmación de las evidencias relativas a estos procedimientos y tecnología frente a la cirugía convencional y la TAVI es necesaria para llevar a cabo un correcto «abordaje integral de la valvulopatía aórtica». Las actuales guías, tanto americanas como europeas establecen las indicaciones entre cirugía y TAVI sin tener en cuenta la información disponible sobre estas prótesis, ni su utilización mediante cirugía mínimamente invasiva.
Los resultados reportados en trabajos como el de D’Onofrio et al.33 (2016) encuentran en más de 2.000 pacientes que las válvulas «sin sutura» presentan una mayor tasa de éxito, con similar mortalidad a 30 días que los procedimientos TAVI, con una menor tasa de implante de marcapasos y de insuficiencia perivalvular residual. De igual forma, Santarpino et al.34 (2014), encuentran una menor mortalidad en los pacientes tratados con sutureless, con una tasa significativamente inferior de leaks periprotésicos, siendo además un procedimiento más coste-efectivo35. Los resultados descritos por Biancari et al. (2016) evidencian que la TAVI se asocia a una mayor tasa de insuficiencia perivalvular ligera y moderada-severa, una mayor tasa de implante de marcapasos y mayor mortalidad hospitalaria36. Este beneficio clínico se potencia si se combinan estrategias quirúrgicas mínimamente invasivas con el implante de válvulas «sin sutura», como demuestra el grupo de Glauber37. Del mismo modo, existen también trabajos que cuestionan el beneficio de la TAVI en pacientes de riesgo intermedio en comparación con la cirugía convencional e implante de válvulas «sin sutura»38.
Uno de los elementos diferenciadores de la cirugía frente a la TAVI en pacientes de riesgo intermedio (SURTAVI) es la mayor tasa de sangrado importante y de insuficiencia renal aguda. Precisamente es en este punto donde la cirugía mínimamente invasiva reduce significativamente la incidencia de transfusión frente a la cirugía convencional, disminuye la tasa de insuficiencia renal y acorta la estancia en la unidad de cuidados intensivos y los días de hospitalización39, reduciendo además el dolor postoperatorio y presentado una mejoría de la función respiratoria40,41.
Además, las prótesis sin sutura producen unos gradientes transvalvulares más bajos que las prótesis convencionales, acercándose a la excelente hemodinámica de las TAVI (es necesario seguimientos a largo plazo para determinar el efecto clínico de esta mejora hemodinámica).
Por todo ello, en el análisis de los pacientes y en su dirección hacia un procedimiento u otro, debemos contemplar también la potencial utilización de las técnicas de cirugía miniinvasiva y de estas válvulas biológicas mejoradas.
Centro TAVILa calidad asistencial, la eficiencia clínica y la seguridad del paciente vertebran el sentido práctico del presente documento, subrayando la experiencia del cirujano/operador y el volumen del centro hospitalario como elemento esencial para asegurar un resultado óptimo en el tratamiento de los pacientes seleccionados para TAVI.
Los procedimientos transcatéter deben realizarse en hospitales con equipos TAVI estables, en el contexto sanitario que las actuales Guías Europeas de Práctica Clínica denominan «Centro Hospitalario de Valvulopatías Cardiacas». Dicho esquema organizativo permite una reducción significativa en el número de complicaciones periprocedimiento y eleva la seguridad de la terapia. Además, este modelo, garantiza una toma de decisiones adecuada en la elección del procedimiento TAVI, aportando eficiencia clínica y facilitando una atención clínica de alta calidad en la derivación del enfermo, durante fase de hospitalización y en el seguimiento postalta.
Por lo tanto, el programa TAVI debe establecerse en hospitales que dispongan de cardiología intervencionista y servicio de cirugía cardiovascular con una actividad clínica significativa.
Siguiendo este esquema y tomando como marco básico de desarrollo las características necesarias para poder catalogar un centro como «Centro Hospitalario de Valvulopatías Cardiacas»26 (tabla 3), establecidas en las recientes Guías Europeas de Práctica Clínica, consideramos que un centro con programa TAVI debe cumplir los siguientes requisitos asistenciales41–44:
- -
Disponer de, al menos, 2 cardiólogos intervencionistas y 2 cirujanos cardiovasculares con experiencia en procedimientos TAVI.
- -
Mantener con rigurosidad los correspondientes registros de actividad TAVI de la Sociedad Española de Cirugía Torácica y Cardiovascular y de la Sociedad Española de Cardiología.
- -
Disponer de laboratorio de hemodinámica, quirófano híbrido o quirófano equipado con sistema de fluoroscopia, mesa radiotransparente y sistemas de monitorización de presión.
- -
La sala de implante TAVI, independientemente de la vía de abordaje utilizada, debe tener suficiente espacio para que todo el personal implicado pueda desarrollar su trabajo de forma óptima. Además del cardiólogo intervencionista y del cirujano, debemos contemplar la actividad del anestesiólogo o del ecocardiografista, y la presencia de equipamiento completo para realizar bypass cardiopulmonar, con objeto de poder instaurar circulación extracorpórea durante el implante en caso de ser necesario.
- -
La sala de implante TAVI de tener el equipamiento necesario para tratar las potenciales complicaciones del procedimiento que generan riesgo vital: perforación/disección vascular, taponamiento cardiaco, perforación cardiaca, disección aórtica, shock cardiogénico, shock hipovolémico, alteraciones del ritmo cardiaco, etc.
- -
Debe existir un equipo de ECMO rápidamente disponible, con personal quirúrgico entrenado en el implante y manejo de situaciones de riesgo vital.
- -
La sala de implante TAVI debe estar certificada y preparada para el implante de sistemas de marcapasos definitivos y sistemas DAI/DAI+CRT.
- -
Para aumentar la calidad asistencial, se recomienda que la sala disponga de flujo laminar y ventilación integrada, así como de un sistema de iluminación de alta intensidad.
- -
Disponer de laboratorio de imagen, con capacidad de realizar ecocardiografía transtorácica y transesofágica, y con personal entrenado en patología estructural cardiaca.
- -
Capacidad de realizar angio-TC de fácil acceso.
- -
Capacidad de realizar pruebas de imagen vascular.
- -
Unidad de Cuidados Intensivos especializada en patología estructural cardiaca.
- -
Terapia renal sustitutiva disponible (hemofiltración y hemodiálisis).
Requerimientos de los centros hospitalarios especializados en cardiopatías valvulares
El principal propósito de un «Centro Hospitalario de Valvulopatías Cardiacas» (GPC 2017), como centro de excelencia, es proporcionar la mejor calidad asistencial disponible. Este objetivo se consigue a través de grandes volúmenes de actividad asistencial y alta especialización clínica, con programas específicos de entrenamiento, formación continuada e infraestructura apropiada. Para ello, es necesario que cuenten con amplia experiencia en procesos cardioquirúrgicos y procedimientos de cardiología intervencionista.
La relación de requisitos se ha establecido siguiendo los principios de eficiencia clínica y seguridad del paciente, basándose en los criterios establecidos en los documentos de consenso, guías de práctica clínica y la evidencia científica disponible. Destacamos la utilidad del trabajo de Parma et al. (2017) para la plasmación sintética de los elementos exigibles más relevantes44.
Equipo Multidiscilinar del CorazónDebemos resaltar y enfatizar la posición central del Equipo Multidisciplinar del Corazón en la óptima evaluación de pacientes, en la ejecución del procedimiento y en la valoración de los resultados. Los candidatos a TAVI deben ser determinados de forma conjunta por cirujanos y cardiólogos en un hospital con un programa estable de cardiopatía estructural valvular. Esta recomendación de participación conjunta en cada una de las fases del proceso asistencial de implante de válvula aórtica transcatéter es un requisito recogido no solo en las guías de práctica clínica (europeas y americanas), sino también de los documentos de consenso de expertos en este campo desde 2012 a 2017. Grado de Recomendación Clase I41,45.
Podemos distinguir, de forma ideal, dos dimensiones específicas del Equipo Multidisciplinar del Corazón46:
Equipo Multidisciplinar del Corazón como Grupo de Decisión Clínica. El equipo deberá trabajar conjuntamente para la correcta indicación de la terapia a seguir, basándose sobre todo en el balance riesgo-beneficio de cada técnica, así como en el impacto socio-sanitario y económico de los distintos tratamientos. Este Equipo Multidisciplinar del Corazón debe incluir a especialistas capaces de valorar técnicamente la viabilidad de los procedimientos posibles para el recambio valvular aórtico, evaluando los posibles riesgos y resultados de los mismos. El equipo debe estar constituido, al menos, por un cirujano cardiovascular, un cardiólogo clínico y un cardiólogo intervencionista, siendo muy adecuada la participación de otros profesionales que puedan ayudar en la toma de decisiones (internista, geriatra, rehabilitador, anestesiólogo, enfermería especializada, especialista en imagen, etc.). Las tareas específicas del Equipo Multidisciplinar del Corazón en este primer paso deben incluir:
- •
Revisar la situación clínica del paciente y el grado de severidad de la valvulopatía aórtica.
- •
Determinar cuál es el procedimiento más indicado y su viabilidad técnica.
Equipo Multidisciplinar del Corazón como Grupo Técnico de Intervención, integrado por los profesionales cualificados para decidir la vía de abordaje más adecuada para el implante transcatéter (transfemoral, transaxilar, transapical, transaórtica, etc.), concretar todos los aspectos técnicos de la intervención y llevarla a cabo. Las decisiones técnicas, el proceso de implante transcatéter y la resolución de las potenciales complicaciones solo pueden situarse en el plano de la excelencia si este Grupo Técnico está constituido por un cirujano cardiovascular y un cardiólogo intervencionista, expertos en los procedimientos TAVR. En el momento actual ambos profesionales están entrenados en las técnicas transcatéter, tanto de válvulas autoexpandibles como balón-expandibles, realizando su actividad de manera independiente. Sin embargo, la participación conjunta es imprescindible para asegurar los mejores resultados y aportar al procedimiento un nivel de seguridad adecuado y similar al de otros procedimientos cardiovasculares47.
Con objeto de mantener la máxima seguridad y beneficio para el paciente, tanto el cirujano cardiovascular como el cardiólogo intervencionista deberán tener un papel activo y por igual durante el procedimiento, independientemente de la vía de abordaje de la TAVI. Así, deberán participar de forma conjunta en los diferentes pasos que configuran el proceso completo: acceso anatómico, cruce de la válvula aórtica estenótica (retrógrada, anterógrada), realización de valvuloplastia, liberación de la prótesis, cierre de los accesos vasculares e identificación y tratamiento de las posibles complicaciones vasculares, de estructuras cardiacas, arterias coronarias, trastornos del ritmo, o necesidad de asistencia circulatoria o cardiopulmonar en caso de colapso circulatorio. La necesidad de un equipo real, integrado por cardiólogos y cirujanos que participen de forma conjunta en los procedimientos transcatéter es una exigencia metodológica actual. De hecho, los procedimientos TAVI no deben realizarse en centros hospitalarios donde no exista un Servicio de Cirugía Cardiovascular (indicación IC)26. Además, se exige plena colaboración entre cardiología y cirugía para llevar a cabo un abordaje integral de la valvulopatía aórtica. Requisito que las consejerías de sanidad de diversas comunidades autónomas están llevando inclusive a rango normativo (Avalia-T, Consejería de Salud de Andalucía)48,49. La finalidad de esta condición estratégica para llevar a cabo un procedimiento TAVI va dirigida a alcanzar un nivel adecuado de calidad asistencial, mejorar la efectividad del tratamiento en el contexto clínico que representa el día a día y establecer un adecuado nivel de seguridad para el paciente. Esto se consigue con la doble dimensión del Equipo Multidisciplinar del Corazón: la capacidad de tomar decisiones colegiadas, caso a caso, entre los profesionales más cualificados a tal efecto. Y, la ejecución conjunta del procedimiento por un equipo compuesto por cardiólogos y cirujanos.
Esta última dimensión va implícita en la obligatoriedad de que los procedimientos TAVI se realicen en un hospital con Cirugía Cardiovascular; ya que si el Equipo Multidisciplinar del Corazón solo tuviera como objetivo el llevar a cabo una depurada selección de enfermos y una adecuada indicación quirúrgica o transcatéter, se obviaría la necesidad de presencia física de cirugía en el mismo centro donde se realiza el procedimiento. En el momento actual, las nuevas tecnologías de la información y comunicación permiten establecer sesiones clínicas virtuales, «online», con visualización simultánea de las pruebas diagnósticas y acceso a la historia clínica de los pacientes, haciendo posible la comunicación y la toma de decisiones sin estar físicamente en la misma sala. Del mismo modo, la presencia de cirugía con objeto de poder realizar procedimientos de rescate emergentes en caso de complicación grave durante el implante tampoco es realista en nuestro medio sin la existencia de un Equipo Multidisciplinar del Corazón que realice de forma conjunta los procedimientos TAVI. Por ese motivo, si surge una complicación grave que precise intervención inmediata18, resulta muy complicado que un grupo quirúrgico completo (cirujanos, enfermería especializada, perfusionista, anestesiólogo, etc.) pueda desplazarse con el paciente a un quirófano equipado con todo lo necesario para llevar a cabo una cardiocirugía emergente (incluyendo bomba de circulación extracorpórea). Destacando los excelentes resultados obtenidos en el estudio SURTAVI, sin embargo, las complicaciones periprocedimiento suponen un importante problema a tener en cuenta. Las complicaciones que implican riesgo vital o un sangrado mayor se produjeron en el 12,2% de los pacientes. Entre las complicaciones más graves, que implican una verdadera urgencia cardioquirúrgica, destacamos la perforación cardiaca (1,7%), las complicaciones vasculares mayores (6%) y el shock cardiogénico (1,1%).
El verdadero objetivo de los requisitos incluidos en las Guías de Práctica Clínica es que ambos grupos de profesionales, cirujanos y cardiólogos intervencionistas realicen juntos el procedimiento TAVI para alcanzar la excelencia asistencial, altas cotas de efectividad y reducir la morbimortalidad de una eventual complicación. La presencia del equipo quirúrgico y cardiológico ya sea en un quirófano híbrido, sala de hemodinámica acondicionada o quirófano, permite dar una respuesta rápida y apropiada al paciente que lo necesite. Lo que resulta especialmente obligatorio cuando los pacientes que sean sometidos al procedimiento TAVI no sean exclusivamente pacientes inoperables. La forma de trabajo en equipo planteada es la utilizada habitualmente en gran parte de Europa, Estados Unidos y Australia, que han consolidado desde hace tiempo una forma de trabajar basada en un «abordaje integral de la valvulopatía aórtica». De otro modo, no existiría argumento alguno para prohibir la realización de TAVI en centros hospitalarios sin cirugía cardiovascular. Es el Equipo Multidisciplinar del Corazón, de Decisión y de Intervención lo que justifica esta reorganización de la actividad clínica dirigida a conseguir la máxima calidad asistencial y seguridad para el paciente.
Aspectos técnicos del implante valvular aórtico transcatéterLos diferentes pasos e ítems que constituyen el procedimiento de implante TAVI habitualmente necesitan múltiples habilidades técnicas, aportadas por el trabajo conjunto de cirujanos cardiovasculares y cardiólogos intervencionistas. Sin ánimo de ser exhaustivo podemos agruparlos y concretarlos en 3 fases (tabla 4)41:
Fase preprocedimiento
- •
Abordaje integral de la valvulopatía aórtica. Evaluación del caso concreto y decisión por el Equipo Multidisciplinar del Corazón del procedimiento más apropiado para el paciente.
- •
Paciente candidato a TAVI: se procede al análisis técnico de las características anatómicas y estructurales del paciente, prestando especial atención al Complejo Valvular Aórtico. Dentro de los elementos a evaluar, destacamos:
- •
Estructuras:
- •
Anillo aórtico.
- •
Tracto de salida de ventrículo izquierdo.
- •
Senos de Valsalva.
- •
Unión sinotubular.
- •
Aorta ascendente tubular.
- •
Arterias coronarias (>10mm.).
- •
Características anatómicas:
- •
Excentricidad del anillo (anillo elíptico).
- •
Grado de calcificación del anillo, aorta, TSVI, etc.
- •
Distribución del calcio.
- •
Geometría de los velos.
- •
Angulación de la aorta y ventrículo izquierdo.
- •
Válvula no tricúspide (bicúspide, etc.).
- •
Evaluación anatómica de procedimientos Valve-in-Valve.
- •
Vía de abordaje: evaluación del eje iliofemoral (tamaño, calcificación, tortuosidad), axilar-sublclavio, carotídeo, aorta ascendente, ápex, etc. Prevención de Riesgo Vascular.
- •
Elección del tipo de prótesis, tamaño de prótesis. Evaluar grado de Oversizing del dispositivo y la potencial insuficiencia aórtica posprocedimiento.
La técnica de elección para llevar a cabo la evaluación preoperatoria es el angio-TC50 ya que es una técnica tridimensional, permite un estudio anatómico completo de la raíz aórtica y disposición de las arterias coronarias, al mismo tiempo que permite estudiar el lecho vascular arterial de forma completa. En definitiva, nos permite una correcta planificación del procedimiento y es una técnica muy reproducible. El angio-TC debe disponer, al menos, de 64 detectores, estar sincronizado, tener un grosor de corte de 0,5-0,6mm con una superposición de 0,3mm, y ser preferiblemente retrospectivo.
Fase intraprocedimiento
Entre otros aspectos, destacamos:
- •
Preparación y realización de la vía de implante transcatéter:
- •
Acceso al lecho vascular arterial (transfemoral, transaxilar, transcarotídeo, etc.).
- •
Acceso transtorácico (transapical/transaórtico).
- •
Cruce la válvula aórtica estenótica (vía retrógrada o vía anterógrada).
- •
Valvuloplastia aórtica con balón.
- •
Posicionamiento correcto y despliegue de la prótesis transcatéter.
- •
Cierre óptimo de las estructuras vasculares o cardiacas de acceso.
- •
Detección, evaluación y manejo de complicaciones, relacionadas con:
- •
El acceso vascular.
- •
Las estructuras cardiacas.
- •
Las arterias coronarias.
- •
Alteraciones del ritmo cardiaco.
- •
Etc.
- •
Detección, evaluación y manejo de la insuficiencia aórtica periprocedimiento (tipos y potenciales tratamientos).
- •
Valoración de llevar a cabo soporte mecánico circulatorio o circulación extracorpórea si procede.
Antes de empezar cada procedimiento debe definirse un responsable, director/coordinador del equipo, cirujano o cardiólogo intervencionista, que llevará la supervisión del procedimiento. La elección del director/coordinador del procedimiento depende de la experiencia profesional y de las especiales características del caso concreto. El implante TAVI debe realizarse por equipos estables de profesionales. Es importante que todos los miembros del equipo estén presentes en todas las fases del procedimiento y que sus funciones estén completamente delimitadas y no limitadas por la especialidad médica sino basadas en su experiencia. El trabajo en equipo precisa la identificación del profesional que va a dirigir el procedimiento, una comunicación constante, y la preparación y anticipación de las potenciales complicaciones.
Dado que disponemos de profesionales bien cualificados en procedimientos transcatéter procedentes de cirugía y cardiología, lo ideal es que la integración en equipos permita un liderazgo compartido, con alternancia en la coordinación de cada implante, independientemente de la vía de abordaje. Este requisito de funcionalidad debe estar matizado por las características del paciente y las competencias específicas de los profesionales. De forma lógica, existen casos en los que sería recomendable la coordinación por el cirujano cardiovascular (inestabilidad hemodinámica, acceso axilar, etc.) y otros en las que el coordinador sería preferible que fuera el cardiólogo intervencionista (necesidad de protección de arteria coronaria, procedimiento de angioplastia concomitante, etc.). Esta alternancia en la coordinación no debe vincularse con la vía de abordaje, ya que la labor de dirección y despliegue de las prótesis transcatéter es similar en todas las vías y es potencialmente realizable por cualquiera de los dos profesionales de forma independiente. Así, el cirujano cardiovascular con experiencia debe participar activamente y poder coordinar el implante valvular transcatéter, no solo en los abordajes transtorácicos (transapical/transtorácico), sino también en la vía transvascular periférica (femoral, axilar, carotídea, etc.).
La experiencia acreditada en cualquier actividad, y especialmente en procedimientos de alta complejidad tecnológica o quirúrgica es extraordinariamente importante para conseguir altas cotas de seguridad y calidad asistencial. Estos procesos de acreditación constituyen un mecanismo de protección del ciudadano ante prácticas no adecuadas o ante personal que no dispone de los conocimientos o las habilidades suficientes para realizar los procedimientos. Por ello, la SECTCV hace una importante recomendación a través de este documento: se debe de realizar los procedimientos TAVI según los criterios de calidad que este documento expone.
El procedimiento TAVI debe realizarse en un ámbito estricto de máxima asepsia y seguridad. La SECTCV recomienda realizar los procedimientos TAVI en aquellas instalaciones que presenten la máxima seguridad para el paciente, y que dependerá del centro hospitalario en cuestión. El quirófano híbrido, siempre que el centro disponga de estas instalaciones es un entorno ideal para el desarrollo de los procedimientos TAVI. Sin embargo, si el centro no dispone de quirófano híbrido, el acondicionamiento específico de la sala de hemodinámica o del quirófano de cirugía cardiovascular debe cumplir los apropiados niveles de calidad asistencial y seguridad exigidos por la SECTCV, recogidos en el presente documento.
Fase posprocedimiento
El objetivo principal del procedimiento TAVI es producir en el paciente una ganancia de cantidad de vida y/o de calidad de vida. No debemos olvidar que un elemento esencial de esto es la funcionalidad del paciente al alta. Resulta esencial establecer una dinámica de comunicación directa con Atención Primaria y con el Cardiólogo Clínico del paciente. Sabemos que, tras el alta, el 40% de estos pacientes reingresan durante el primer año, a pesar de que el 60% de estos reingresos se deban a causas no cardiacas. Además, la mortalidad a 3 años es del 30%.
Por ello, es preciso señalar que una tecnología tan costosa no genera beneficio poblacional si no estructuramos un programa de trabajo transversal en el que cobren protagonismo la rehabilitación cardiaca, atención primaria y el cardiólogo que va a realizar los seguimientos del paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.