El ventrículo neumático Berlin-Heart Excor® es actualmente el único sistema disponible en niños pequeños, lactantes y neonatos para proporcionar asistencia hemodinámica de larga duración hasta un trasplante cardíaco. Su técnica de implante está estandarizada en el corazón septado y con válvulas ventriculoarteriales competentes. La insuficiencia aórtica y/o pulmonar y las situaciones de ventrículo único o de ventrículo y medio constituyen un problema añadido, precisando soluciones imaginativas.
Presentamos una cirugía tipo ventrículo y medio fracasada en la que se implantó un BH doble previa reconversión a corazón biventricular, y un intento fallido de septación de situación Fallot con origen anómalo de arteria coronaria descendente anterior y comunicaciones interventriculares múltiples que se transformó en un ventrículo único al que se implantó otro doble BH, previo cierre de las válvulas aórtica, pulmonar y tricúspide del receptor.
The Berlin-Heart Excor® is currently the only system available for small children, infants and neonates to provide long-term hemodynamic assistance when the therapeutic option is a heart transplant. The BH standard implant technique is done for biventricular hearts with competent ventricle-arterial valves. Aortic and/or pulmonary regurgitation and situations of single ventricle or one and half ventricle repair are added problems, which require imaginative solutions. We present two cases. A failed one and a half ventricle repair in which we decided to implant a double BH previous reconversion to biventricular heart.
A failed repair of a Fallot situation with anomalous origin of anterior descending coronary artery and multiple ventricular septal defects, that was finally transformed into a single ventricle in which a double BH was implanted, after closure of the aortic, pulmonary and tricuspid valves of the recipient.
Hoy en día el 50% de los pacientes pediátricos listados para trasplante cardíaco llegan al mismo con algún dispositivo de asistencia hemodinámica1. El ventrículo neumático tipo Berlin-Heart (BH) Excor® es actualmente el único sistema disponible en niños pequeños, lactantes y neonatos para proporcionar asistencia hemodinámica de larga duración cuando la única opción terapéutica es un trasplante cardíaco2.
La técnica de implante está estandarizada en el corazón septado con las válvulas ventriculoarteriales competentes, tanto para implantes uni- como biventriculares. Implica circulación extracorpórea con canulación de aorta y bicava e hipotermia leve-moderada, realizándose habitualmente el procedimiento con el corazón latiendo o fibrilando, evitando el pinzado aórtico, con drenado opcional de aurícula izquierda, como se describe a continuación.
Implante de cánula apical en ventrículo izquierdo (VI) con resección de trabéculas±válvula mitral para evitar obstrucción al llenado, que se tuneliza a hipocondrio izquierdo. Implante de cánula aórtica mediante pinzado lateral de la arteria, arteriotomía y sutura de la extensión de Dacron de la cánula arterial. Esta ha podido tunelizarse antes o después de la sutura. Se conectan ambas cánulas al ventrículo neumático, rellenando previamente el VI para evitar embolismos sistémicos.
Si se precisa un BH derecho se coloca primero la cánula de salida en la arteria pulmonar de modo similar a como se hizo en la aorta y después la cánula de drenaje en la porción central de la aurícula derecha (AD), tunelizándola hasta hipocondrio derecho y conectando ambas cánulas a la bomba derecha. Si la decisión de asistencia doble es inequívoca desde el inicio, el orden de implante de las cánulas puede modificarse, de más lejana a más cercana al cirujano principal: ápex, pulmonar, aorta y AD.
Las situaciones de ventrículo único o de ventrículo y medio constituyen un problema añadido. Se han descrito el implante de BH izquierdo y el mantenimiento de la perfusión pulmonar mediante una fístula sistémico-pulmonar o mediante un Glenn en primer y segundo estadio de la vía univentricular respectivamente3,4. En los pacientes con un Fontan fallido por disfunción ventricular con resistencias pulmonares normales, la asistencia del ventrículo único con cánulas en el ápex y en la aorta manteniendo el flujo pulmonar con el Fontan5. Si el fracaso es de la circulación Fontan por elevación de las resistencias vasculares pulmonares se puede establecer una asistencia derecha fabricando un reservorio venoso que reciba la sangre de las cavas a la que se conecta la cánula de «AD» y como salida se aprovecha el conducto del Fontan, previamente desmontado, para llevar sangre hacia las arterias pulmonares6.
ObjetivosDescribimos dos soluciones para dos casos con necesidad de doble BH que permitiera la recuperación de los pacientes hasta el trasplante (ambos en insuficiencia renal y hepática por severa elevación de la presión de llenado de la AD). En ambos la asistencia funcionó correctamente hasta que se trasplantaron, con éxito el primero, y falleciendo el segundo consecuentemente a limitación de esfuerzo terapéutico por aspergilosis cerebral de pronóstico ominoso en la tercera semana postrasplante.
Caso 1Niño de 5 años y 19 kg, portador de miocardiopatía no filiada con tabique interauricular multiperforado y afectación predominante de corazón derecho.
Primera cirugía con 2 años: implante de marcapasos (MP) VVI por bloqueo auriculoventricular completo espontáneo. A los 4 años insuficiencia cardíaca de predominio derecho, insuficiencia tricúspide severa y cianosis moderada por cortocircuito derecha-izquierda. Se intenta cierre de tabique interauricular multiperforado con Amplatzer, que se disloca. Se interviene para realizar cirugía tipo ventrículo y medio (Glenn y septación auricular) y plastia tricúspide con anillo, retirando el Amplatzer y trasformando el sistema de MP en DDD epicárdico.
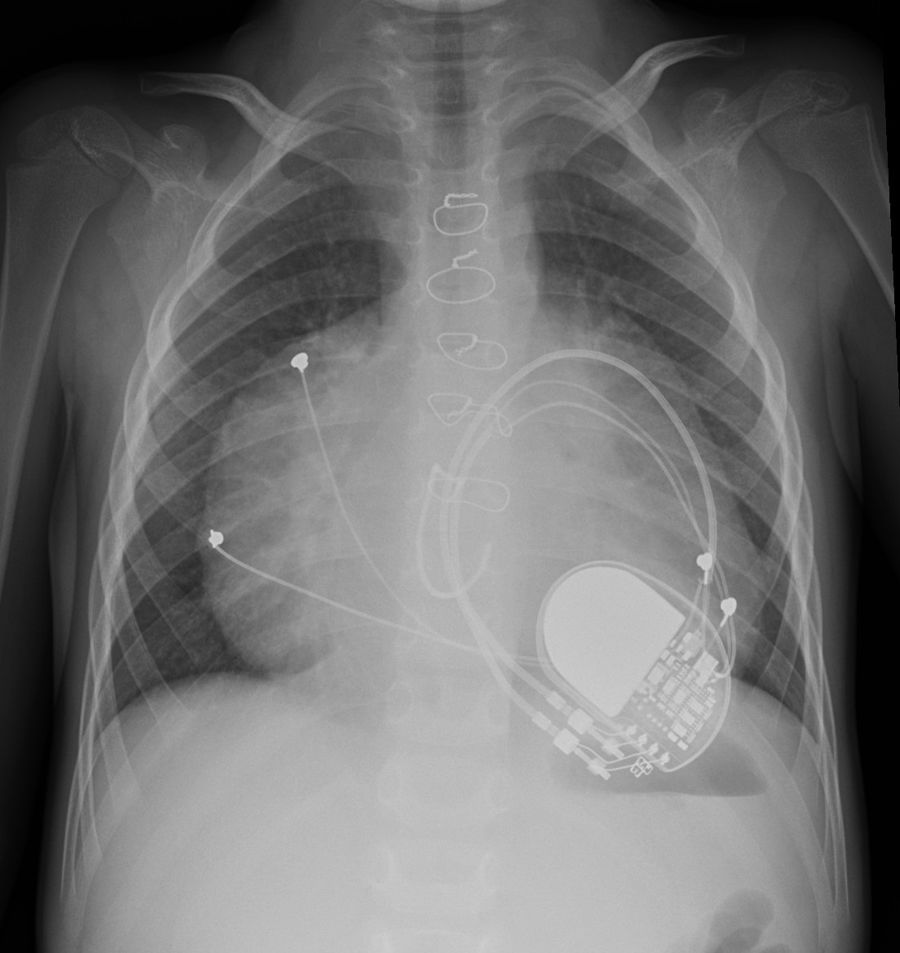
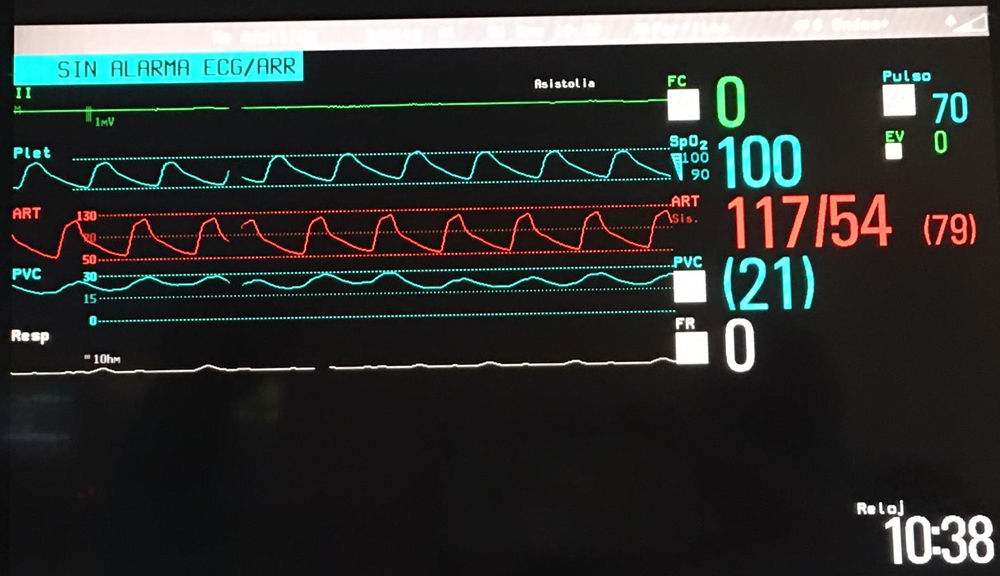
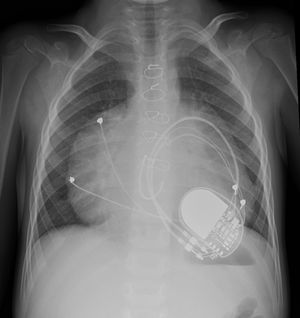
Mejoría durante un año y posterior reingreso hospitalario por insuficiencia cardíaca con anasarca no controlable con diuréticos intravenosos, vasodilatadores pulmonares y ventilación no invasiva con presión positiva (fig. 1).
Ecocardiograma: disfunción leve de VI y severa de ventrículo derecho (VD), con insuficiencia tricúspide masiva. Mínimo flujo anterógrado en válvula pulmonar y Glenn normofuncionante. El cateterismo (tabla 1) demostró presión muy elevada de AD, presión pulmonar, capilar pulmonar y resistencias pulmonares arteriolares moderadamente elevadas (2,9 unidades wood m2). Bajo gasto sistémico con desaturación venosa, principalmente en hemicuerpo inferior.
Descartado el Fontan, se indicó implante de doble BH con bombas de 25ml, como puente a trasplante, barajándose 2 opciones técnicas:
Mantener la reparación ventrículo y medio.
Desmontar el Glenn, volviendo a corazón biventricular previamente al implante.
Se optó por desmontar el Glenn, razonando que la precarga de la bomba derecha (y el funcionamiento global de la asistencia) sería más favorable recibiendo el aporte de ambas venas cavas. Se retiró también el sistema de MP epicárdico. La cirugía se realizó con el corazón fibrilando.
La asistencia funcionó sin incidencias hasta que se trasplantó el día postoperatorio+5. Alta hospitalaria el día+40 postrasplante.
Caso 2Niña de 16 meses y 8 kg, con diagnóstico inicial de doble salida de ventrículo derecho tipo Fallot y origen anómalo de arteria coronaria descendente anterior desde coronaria derecha cruzando infundíbulo, a la que se había realizado una fístula sistémico-pulmonar (Blalock-Taussig modificado derecho de 4mm) con apoyo de extracorpórea al mes de vida por crisis cianótica.
Prerreparación, estudio con ecocardiograma y tomografía computerizada: infundíbulo casi obliterado (2-3mm), gradiente máximo transpulmonar 90mmHg, con comunicación interventricular (CIV) subaórtica grande y mínima CIV muscular apical de 2mm. Arterias pulmonares de diámetro apropiado (6,5mm). Fístula sistemicopulmonar normofuncionante.
Reparación completa a los 15 meses mediante cirugía transauricular, transaórtica y transanular pulmonar hasta el límite con la descendente anterior anómala. Sin incidencias en quirófano. Postoperatorio complejo: bloqueo auriculoventricular completo desde el día+2, oliguria y el día+8 fallo hepático agudo. Necesidad de hemofiltro. Extubación el día+10 fracasando a las 48 h. Sin signos de bajo gasto izquierdo. En ecocardiogramas posquirúrgicos hay insuficiencia pulmonar sin estenosis residual y aparición de CIV múltiples previamente no descritas, medio ventriculares y de la punta, además de insuficiencias mitral, aórtica y tricúspide moderadas. VI con función conservada, VD no dilatado y disfuncionante, AD muy dilatada. Presión pulmonar al 50% de la sistémica.
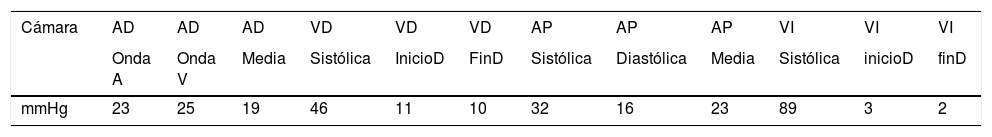
Se realizó un cateterismo cardíaco (tabla 2), demostrándose CIV residual pequeña subaórtica, al menos 2 CIV medioventriculares grandes y CIV en la punta pequeñas.
Datos del cateterismo del caso 2
| Cámara | AD | AD | AD | VD | VD | VD | AP | AP | AP | VI | VI | VI |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Onda A | Onda V | Media | Sistólica | InicioD | FinD | Sistólica | Diastólica | Media | Sistólica | inicioD | finD | |
| mmHg | 23 | 25 | 19 | 46 | 11 | 10 | 32 | 16 | 23 | 89 | 3 | 2 |
AD: aurícula derecha; AP: arteria pulmonar; FinD: telediástole; InicioD: protodiástole; VD: ventrículo derecho; VI: ventrículo izquierdo.
La paciente se reintervendría el día+15, cerrándose CIV residual subaórtica y las 2 CIV medioventriculares e implantándose sistema de MP definitivo DDD epicárdico. Persistió imposibilidad de extubación, necesidad de hemofiltro y mezcla de fisiología restrictiva derecha junto con cortocircuito izquierda derecha significativo, con presión pulmonar al 50% de la sistémica y presiones medias de AD alrededor de 25mmHg, con persistencia de una CIV medioventricular y aparición ahora de CIV significativas de la punta.
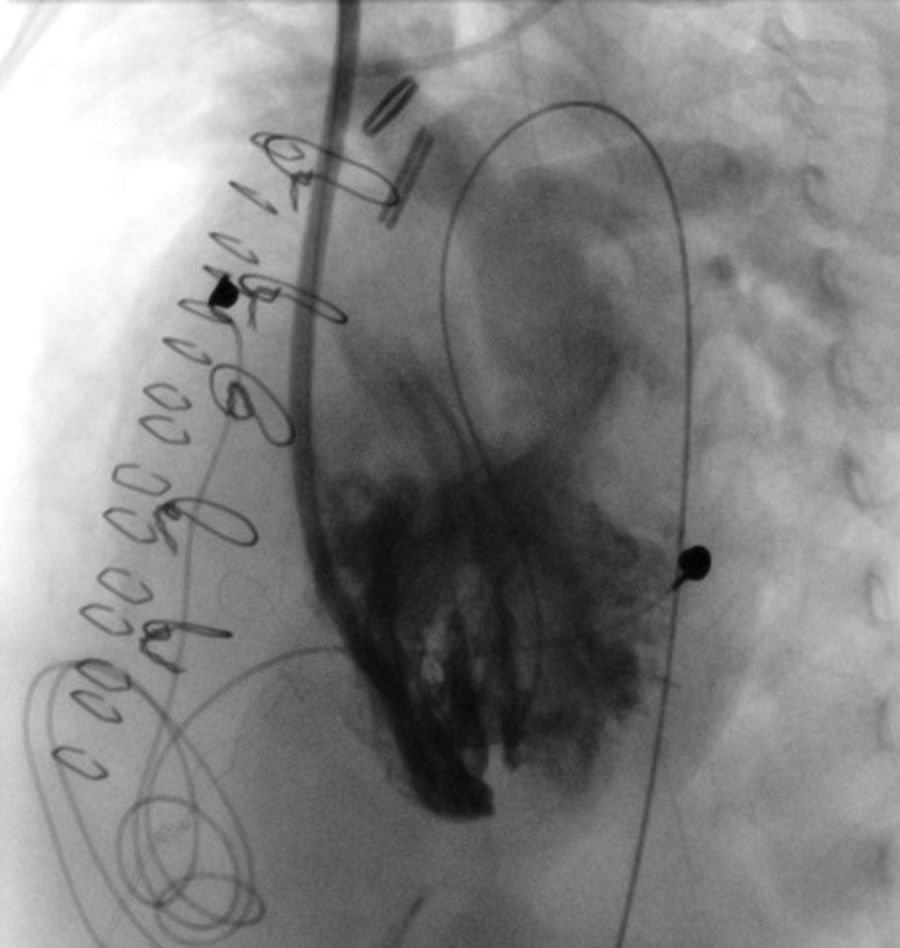
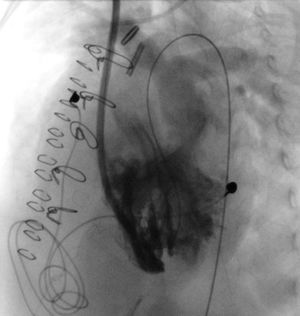
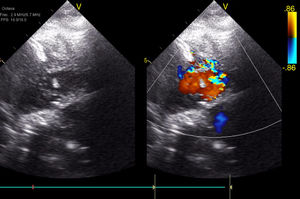
El día+25 nuevo cateterismo intervencionista (fig. 2) para intentar ocluir las CIV de la punta, con aparente buen resultado angiográfico, pero sin cambios en las presiones de las cámaras cardíacas ni mejoría clínica.
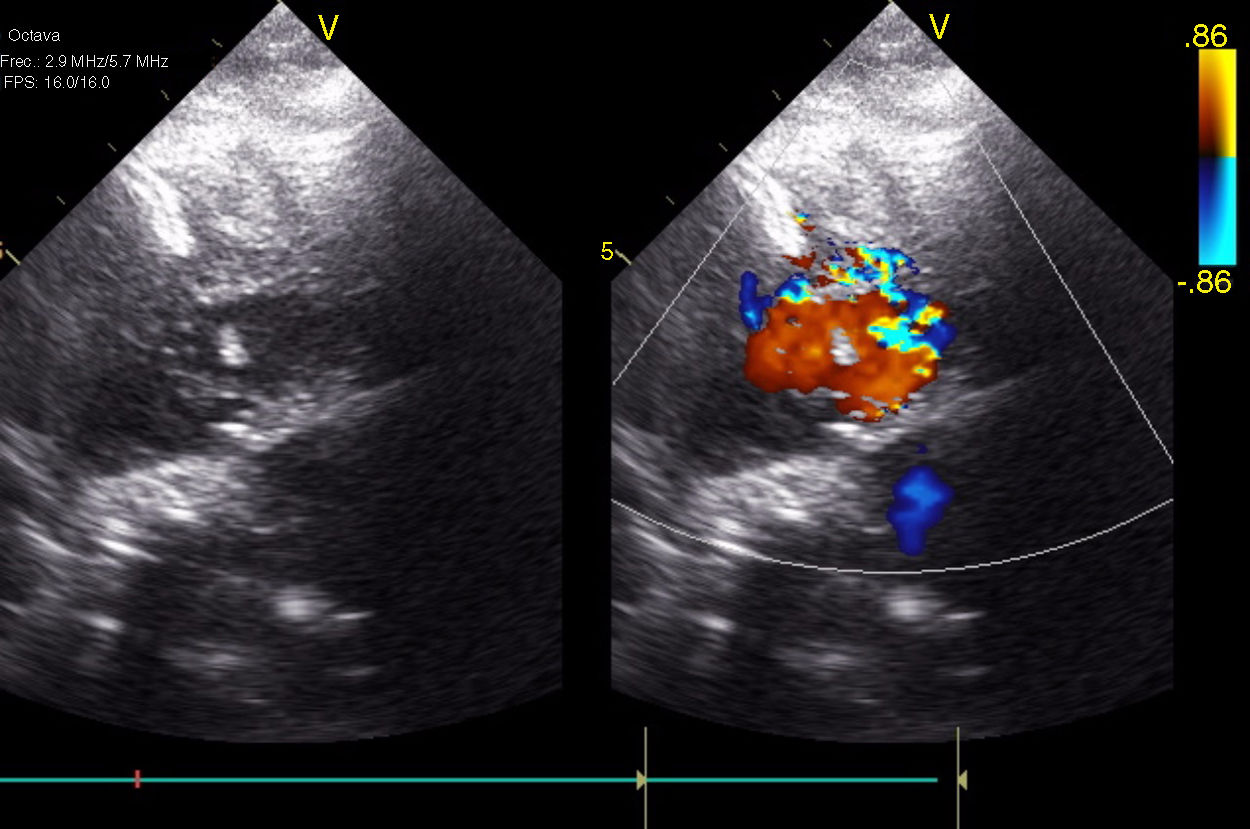
El día+30 lactoacidemia de 11 mlm/l y signos de bajo gasto sistémico, hasta entonces no evidenciado. Sospechando predominio de patrón restrictivo derecho se reinterviene de forma urgente para implante de prótesis pulmonar y asistencia derecha, que se programa con un apoyo del 40% del flujo total teórico correspondiente para su superficie corporal. Disminuyó la presión de llenado de AD, se produjo mejoría tensional, pero sin reversión del bajo gasto sistémico. El ecocardiograma demostró múltiples CIV en todo el septo con cortocircuito izquierda derecha (fig. 3). Se consideró definitivamente el corazón no septable, trasformándose la asistencia derecha en ECMO, programándose la paciente para implante de BH biventricular como puente a trasplante cardíaco el día+34. Hasta entonces la exploración neurológica era normal.
Al existir defectos septales e insuficiencia al menos moderada de todas las válvulas menos la prótesis pulmonar mecánica, se plantearon dos alternativas técnicas:
- –
Cardiectomía «fabricando dos neoaurículas» izquierda y derecha a las que implantar las cánulas de entrada a los ventrículos, anastomosando las de salida a las arterias aorta y pulmonar.
- –
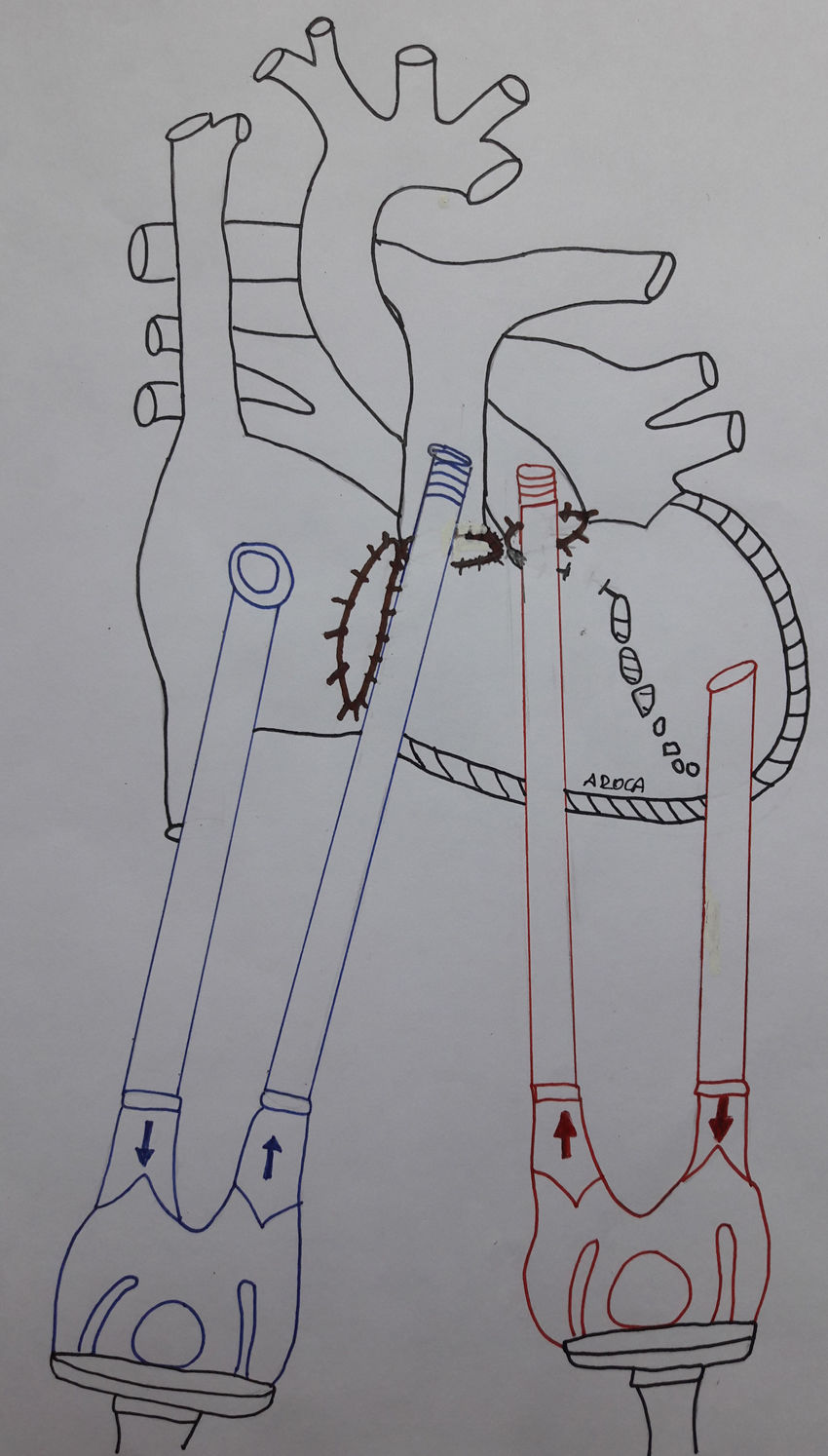
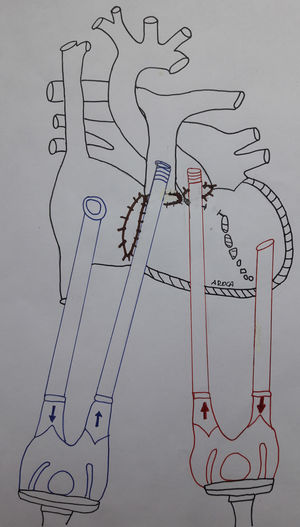
Trasformación de ambos ventrículos en un ventrículo único sistémico con comunicación no restrictiva entre el derecho y el izquierdo para intentar evitar formación de trombos (mediante la retirada del parche de cierre de CIV grande subaórtica y la retirada del dispositivo oclusor de la punta) y cierre con parche de pericardio heterólogo de todas las válvulas a excepción de la mitral, explantándose también la prótesis pulmonar por su potencial tromboembólico y el MP epicárdico (fig. 4).
Figura 4.Esquema de implante del Berlin-Heart® doble del caso 2. Se han retirado el Amplatzer y el parche de cierre de la comunicación interventricular grande subaórtica. Se han cerrado con parches de pericardio los anillos valvulares tricúspide, aórtico y pulmonar (este último tras el explante de la prótesis mecánica).
(0.13MB).
Se optó por esta última. La cirugía se realizó mediante pinzado aórtico y protección miocárdica con medio Celsior. La asistencia (bombas de 10ml, cánulas de ápex y AD de 9mm y arteriales de 5mm sobre Dacron de 8mm) transcurrió sin incidencias, recuperándose la función renal y hepática hasta el trasplante, que se llevó a cabo el día+13 tras el implante del BH. El día+18 postrasplante, brusco deterioro neurológico diagnosticándose abscesos cerebrales múltiples con hemocultivos (+) para Aspergillus. Se limitó esfuerzo terapeútico el día+20 (+67 desde el intento de reparación inicial) falleciendo la enferma.
DiscusiónLa insuficiencia cardíaca avanzada subsidiaria de trasplante cardíaco en el ámbito pediátrico supone un reto terapéutico por el escaso número de donaciones (media de 15-18/año en nuestro país), que implica elevada mortalidad en lista de espera. El uso de dispositivos de asistencia ventricular diferentes a la ECMO ha mejorado la supervivencia previa al trasplante cardíaco, si bien el panorama es más sombrío cuando el diagnóstico basal es una cardiopatía congénita y especialmente si se trata de ventrículos únicos7,8.
Tampoco existe evidencia científica si la supervivencia es mayor con asistencia izquierda o biventricular, estando el empleo de esta última en ocasiones limitado por la pequeña superficie corporal de algunos pacientes.
Nuestra experiencia con los dispositivos de larga duración son 24 implantes de BH Excor®, con una supervivencia global del 62,5% (64% en los 14 izquierdos y 60% en los 10 dobles), todos por trasplante cardíaco, sin diferencias estadísticamente significativas entre los BH izquierdos y los BH dobles, y solo 2 en situación de ventrículo único (un Fontan con fracaso de función ventricular y el caso 2 de este artículo). En consonancia con nuestra tendencia clínica, intentamos en los casos límite el mantenimiento con un BH izquierdo hasta el trasplante, salvo en situaciones de severa disfunción derecha o fallo hepático por incremento de las resistencias vasculares pulmonares y/o la presión venosa, en las que sin la bomba derecha no se consigue revertir el bajo gasto.
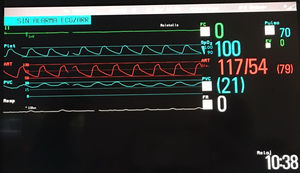
Hasta nuestro conocimiento no está descrito el implante de un BH biventricular sobre una cirugía ventrículo y medio previa. Se podría haber mantenido la reparación, pero optamos por trasformar de nuevo en biventricular el corazón del receptor del caso 1 debido a una experiencia previa negativa en otro paciente con enfermedad de Uhl y un severo cuadro vasopléjico, en el que no se logró correcta precarga de la bomba derecha a pesar de múltiples cambios de programación y del volumen de ambos ventrículos. Aconsejamos dejar obligatoriamente electrodos de MP, error que cometimos no dejando electrodos transitorios tras la retirada del sistema epicárdico definitivo. El corazón permaneció siempre en asistolia (fig. 5), lo que obligó a aumentar la antiagregación/anticoagulación para tratar de evitar la formación de trombos. Tuvimos la fortuna de una donación precoz, pues nuestra mortalidad con el BH se debe básicamente a complicaciones hemorrágicas y/o tromboembólicas mayores, muy dependientes de un tiempo de asistencia prolongado.
Tampoco creemos descrito, como ocurría en la segunda paciente, el tener que aislar de la masa ventricular no septada el retorno venoso sistémico mediante el cierre con parche de la válvula tricúspide. A esto se añadieron los problemas existentes en las válvulas ventriculoarteriales (insuficiencia aórtica significativa además de posible comportamiento trombogénico y/o insuficiencia protésica pulmonar por falta de sincronía de la sístole de las bombas neumáticas con los latidos del corazón nativo) en situación de «ventrículo único», como ocurría en la segunda paciente. Optamos por explantar la prótesis pulmonar y cerrar también mediante sendos parches de pericardio los anillos aórtico y pulmonar. La asistencia biventricular funcionó sin problemas hasta el día del trasplante.
Responsabilidades éticasLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes, preservando en todo momento su anonimato, y que cuentan con el consentimiento informado de los tutores legales de los pacientes (padres) en ambos casos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.