El trasplante en cardiopatías congénitas supone alrededor de un 10% del total. Aunque básicamente se trata de un procedimiento similar al de un trasplante convencional en un adulto, incluye peculiaridades técnicas propias de la cirugía infantil. Indicaciones, tamaños y estrategias son más variados. Presentamos un repaso donde detallamos aspectos específicos, con algoritmos de decisión y esquemas que facilitan la evaluación de los pacientes. Finalmente, apuntamos las tendencias previsibles de aumento de re-intervenciones, así como trasplantes en menores de un año y congénitos adultos.
Congenital heart disease accounts for 10% of overall transplants. Unlike in adults procedures, childreńs transplants may become a real challenge. Indications, sizes and strategies are wide enough. This paper gathers several tips, decisión-making trees and simple drawings which enable patients handling. The authors foresee an increase in re-do procedures, as well as a rise in infants and grown-up transplant candidates in the future.
El primer trasplante cardiaco infantil se llevó a cabo en 1967 (Kantrowitz), poco después del realizado por Barnard en Sudáfrica. Pero fue más adelante, en el año 1985, cuando se hizo el primer trasplante cardiaco neonatal con éxito en un paciente con síndrome de corazón izquierdo hipoplásico en Loma Linda por el equipo del Dr. Leonard Bailey. Fue en los ochenta y tras la introducción de la ciclosporina cuando se incrementó el número y mejoraron los resultados. Tras un aumento progresivo inicial, en la actualidad las cifras se mantienen estables, practicándose no más de 500 trasplantes infantiles anuales en todo el mundo, de los que un 20-30% corresponde a menores de un año.
El trasplante cardiaco infantil se diferencia del adulto en varios aspectos1,2. La escasez en el número de donantes (especialmente en los menores de un año) obliga a un tiempo de espera prolongado y a aceptar, en ocasiones, donantes subóptimos. Sin embargo, la inmadurez del sistema inmune en este grupo determina una mejor tolerancia inmunológica del injerto, condicionando una menor tasa de rechazo agudo y menor necesidad de inmunosupresión.
La técnica clásica de Lower y Shumway (4 suturas) se ha visto desplazada por la modificación de 5 anastomosis (ambas cavas por separado3 en lugar de sutura de aurícula derecha). Debido a las peculiaridades de las cardiopatías congénitas, numerosos pacientes precisan variantes técnicas en el momento del trasplante con objeto de facilitar las anastomosis entre donante y receptor. Estas modificaciones consumen tiempo (de isquemia) y precisan con frecuencia de hipotermia profunda con breves periodos de parada circulatoria. Todo ello implica una planificación detallada en cada caso con objeto de evitar improvisaciones técnicas, así como una exquisita coordinación entre los equipos extractor e implantador.
Por otro lado, el espectro de pacientes trasplantados está cambiando siendo numerosos los que fueron sometidos a cirugía paliativa o correctora previamente. Esto significa que debemos manejar situaciones que incluyen: hipersensibilización, reesternotomía, adherencias previas, circulación colateral (cianóticos), etc.
En las próximas páginas, describiremos aspectos generales y particularidades de los trasplantes cardiacos infantiles. Un análisis morfológico, basado en la anatomía quirúrgica de las anastomosis secuenciales del trasplante, nos ayudará a establecer la estrategia individualizada para cada paciente.
El presente trabajo cumple con la normativa vigente en investigación bioética y se obtuvo la autorización del comité de ética de la institución. Se solicitó a los pacientes el consentimiento informado para recibir el tratamiento. No existe posibilidad de que se reconozca o identifique a los pacientes a través de las imágenes o datos del artículo. El autor considera que no es necesario consentimiento informado para las imágenes porque se ha preservado el anonimato.
IndicacionesIndicamos un trasplante en situaciones de fallo de uno o de ambos ventrículos refractario al tratamiento convencional o el riesgo prohibitivo de la cirugía de reparación frente a la opción del trasplante (situación cada vez más frecuente en pacientes congénitos multioperados). Generalmente, las cardiopatías congénitas suponen la indicación más frecuente en menores de un año, y la disfunción ventricular lo es en niños mayores4,5.
Destacamos las cardiomiopatías por disfunción tardía de ventrículo sistémico. Incluso tras una adecuada corrección o paliación inicial, puede aparecer insuficiencia cardiaca que precise trasplante posteriormente.
- i.
Ventrículo izquierdo: Fallot, «switch» arterial, canal, etc.
- ii.
Ventrículo derecho en posición sistémica: Senning/Mustard, trasposición congénitamente corregida (doble discordancia)
- iii.
Corazón univentricular. La disfunción puede aparecer tras cualquier estadio quirúrgico (Norwood/Glenn/Fontan). Asistimos a un incremento paulatino en el número de trasplantes tras cirugía de Fontan (tanto en niños como en adultos, que incluye variantes auriculopulmonar, túnel lateral y conducto extracardiaco). No solo la disfunción ventricular es indicación de trasplante en el Fontan6–10; también lo son arritmias, la enteropatía pierde-proteínas, la bronquitis plástica y la enfermedad hepática (manifestaciones de ausencia de ventrículo subpulmonar)
Los pacientes con fisiología de Fontan son difíciles de evaluar. El flujo pulmonar disminuido y no pulsátil sumado a la presencia de colaterales (fístulas arteriovenosas) y microembolias tienden a infravalorar tanto el gradiente transpulmonar como la resistencia pulmonar. En la práctica, asumimos cierto grado de «hipertensión pulmonar» que predispone a un fallo derecho en el postoperatorio inmediato del trasplante en un Fontan.
ABO mismatchLa escasez de donantes, particularmente en neonatos y menores de un año, es causa de una mayor mortalidad en lista de espera en esta franja de edad. Dado que los niveles de isohemaglutininas son bajos hasta los 12-14 meses, la posibilidad de un rechazo hiperagudo al realizar un trasplante sin compatibilidad ABO por debajo del año de vida es menor. En tal caso, los protocolos establecen la necesidad de una plasmaféresis intra- o postoperatoria, descrito inicialmente en Edmonton, Canadá, hace 10 años11 y en España en enero de 201812.
ManejoLos controles preoperatorios no difieren de los de otros pacientes en lista de espera de cirugía convencional, con visitas periódicas y control ecográfico según protocolos. Conviene disponer de estudio hemodinámico cada 6 meses, con objeto de evaluar posibles cambios con los vasodilatadores pulmonares. De manera anecdótica, algún paciente puede quedar excluido de lista de espera de trasplante por mejoría clínica y hemodinámica.
Un aspecto diferencial respecto a adultos es el calendario de vacunaciones. No deben administrarse vacunas con virus vivos atenuados por temor a una reactivación tras la inmunosupresión postrasplante.
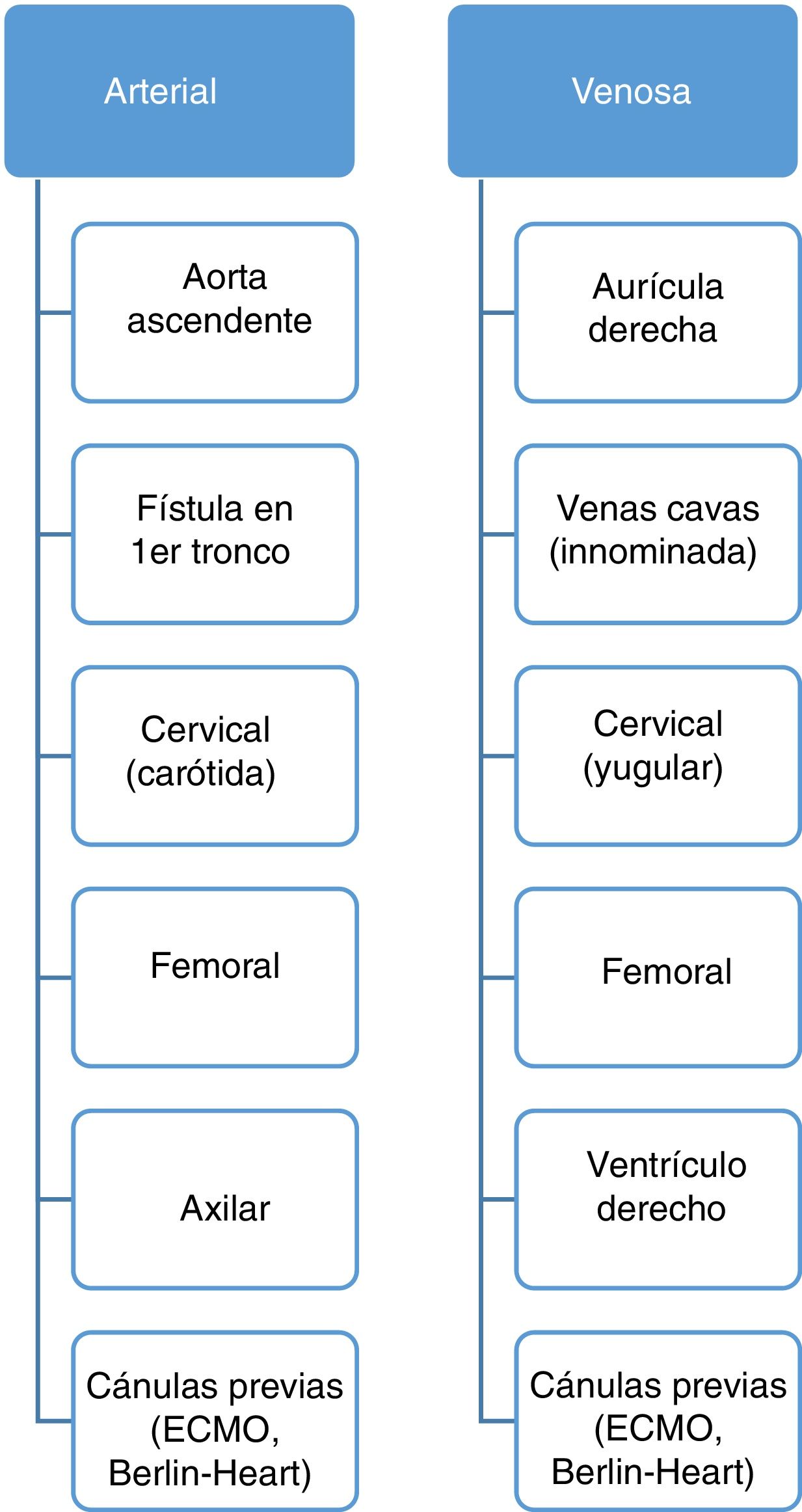
Estrategia vías y canulaciónMuchos de los niños pendientes de trasplante han sido operados y cateterizados en varias ocasiones. No es infrecuente que los accesos vasculares habituales (femoral, yugular, etc.) estén trombosados y no sean útiles en el momento de la intervención. Con objeto de evitar demoras en la inducción anestésica que puedan comprometer la coordinación entre extracción e implantación, realizamos estudio previo de permeabilidad de vasos. La información obtenida por Doppler junto a la reflejada en informes de cateterismo nos permite dibujar un «mapa de vías» permeables que agiliza la monitorización anestésica durante el procedimiento.
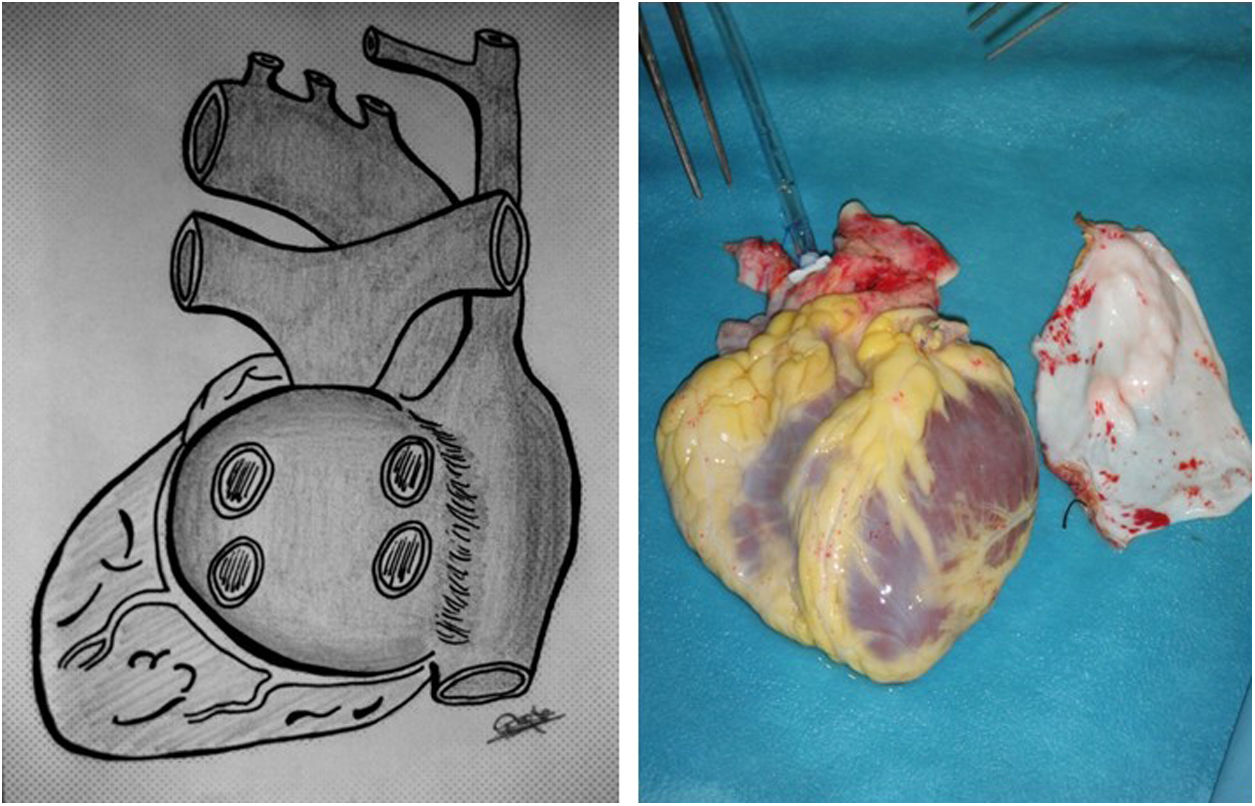
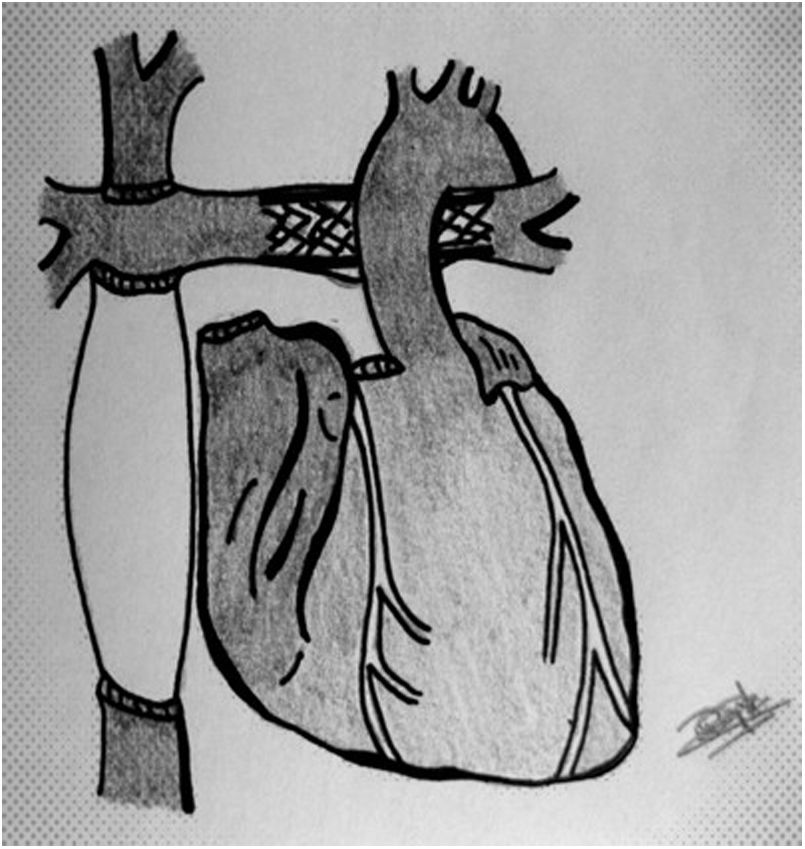
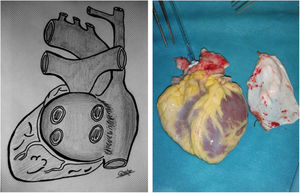
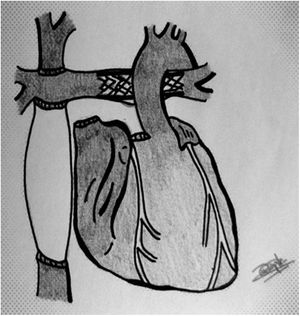
CirugíaDonanteDebido a las variantes quirúrgicas de las cardiopatías congénitas, es habitual que extraigamos más tejidos del corazón donante para la implantación posterior. Así, solicitamos al equipo extractor que el injerto contenga un «extra» de: aorta (englobando arco y origen de troncos supraaórticos), bifurcación y origen de ambas ramas pulmonares, vena cava superior e innominada, además de un parche de pericardio (fig. 1) Para ello, es necesario seccionar la vena ácigos y el ductus, en los más pequeños (estructuras no habituales en extracciones para adultos)
Por otro lado, aceptamos discrepancias de tamaño (peso) entre donante-receptor hasta de 3:1 con objeto de no restringir en exceso las posibilidades de donación.
ReceptorLos pasos iniciales de la cirugía no se diferencian de cualquier intervención convencional con circulación extracorpórea. Muchos de los pacientes pediátricos son además cianóticos y presentan multitud de adherencias y neovasos como consecuencia de pequeñas fístulas arteriovenosas. Estos factores garantizan un comienzo de la cirugía tedioso y hemorrágico.
Un problema añadido es la desproporción de tamaño del corazón donante-receptor. En ocasiones se admiten corazones sobredimensionados, existiendo algunas peculiaridades para su implantación: resección del margen pericárdico izquierdo (permitiendo la protrusión del ápex cardiaco hacia el hemitórax izquierdo), plicatura del hemidiafragma izquierdo; cierre esternal diferido (que permite la resolución del edema mediastínico asociado a la intervención) así como el uso de menores volúmenes tidal en la ventilación mecánica, para reducir el tamaño pulmonar.
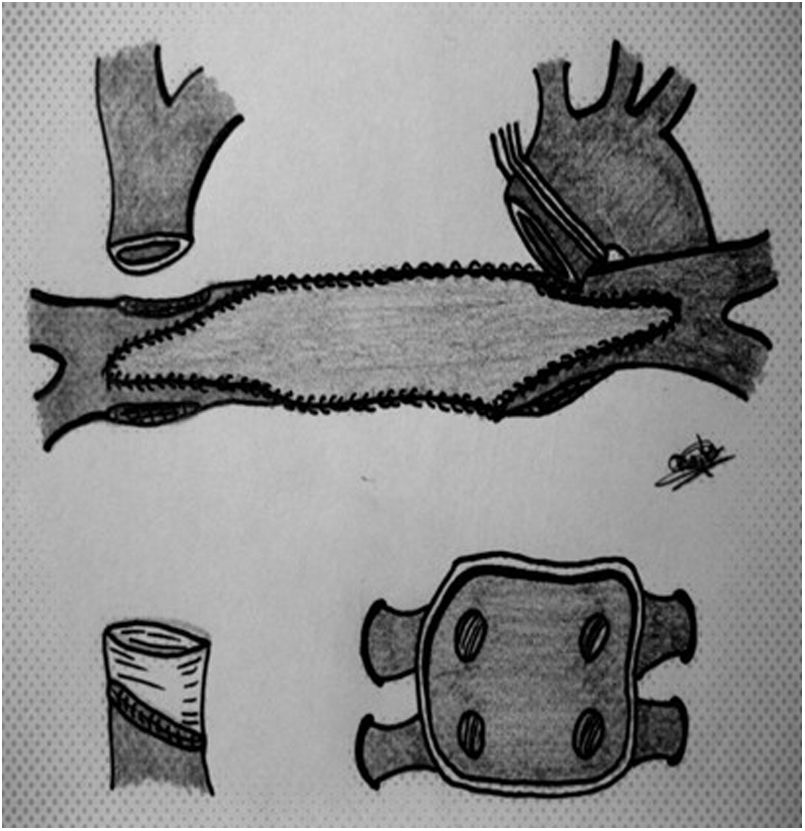
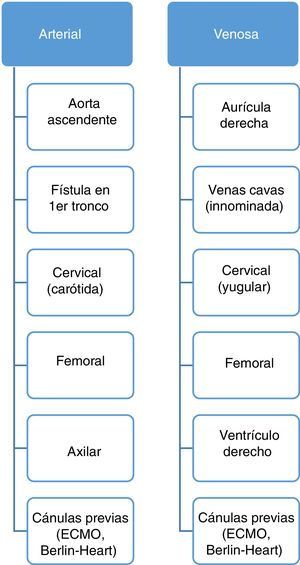
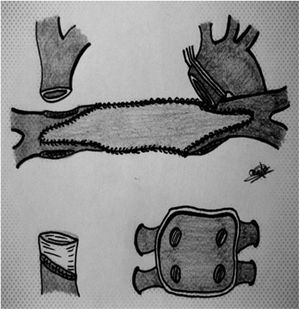
Otro aspecto que considerar es la canulación arterial y venosa. Aorta y ambas cavas son canuladas de manera electiva (fig. 2). No es infrecuente la canulación de la vena innominada en lugar de la cava superior, así como del primer tronco supraaórtico (a través de una fístula de PTFE, de manera similar a la cirugía de arco). Alternativamente, al igual que en adultos, podemos utilizar arteria y vena femoral, aunque ambos vasos son de escaso calibre en niños pequeños. En menores de un año resulta práctico el acceso cervical, a través de carótida y yugular derechas como si de un ECMO se tratara. Incluso en pacientes que acuden a quirófano con cánulas de ECMO, podemos comenzar la circulación extracorpórea conectando dichas cánulas (carótida y yugular derecha) a la máquina. Asimismo, podemos aprovechar las cánulas paracorpóreas de un Berlin-Heart® para conectarlas a la CEC antes de abrir el tórax13. De manera ocasional, o ante imprevistos durante la disección inicial, puede establecerse la circulación extracorpórea a través de una cánula en ventrículo derecho que será sustituida por ambas cavas posteriormente.
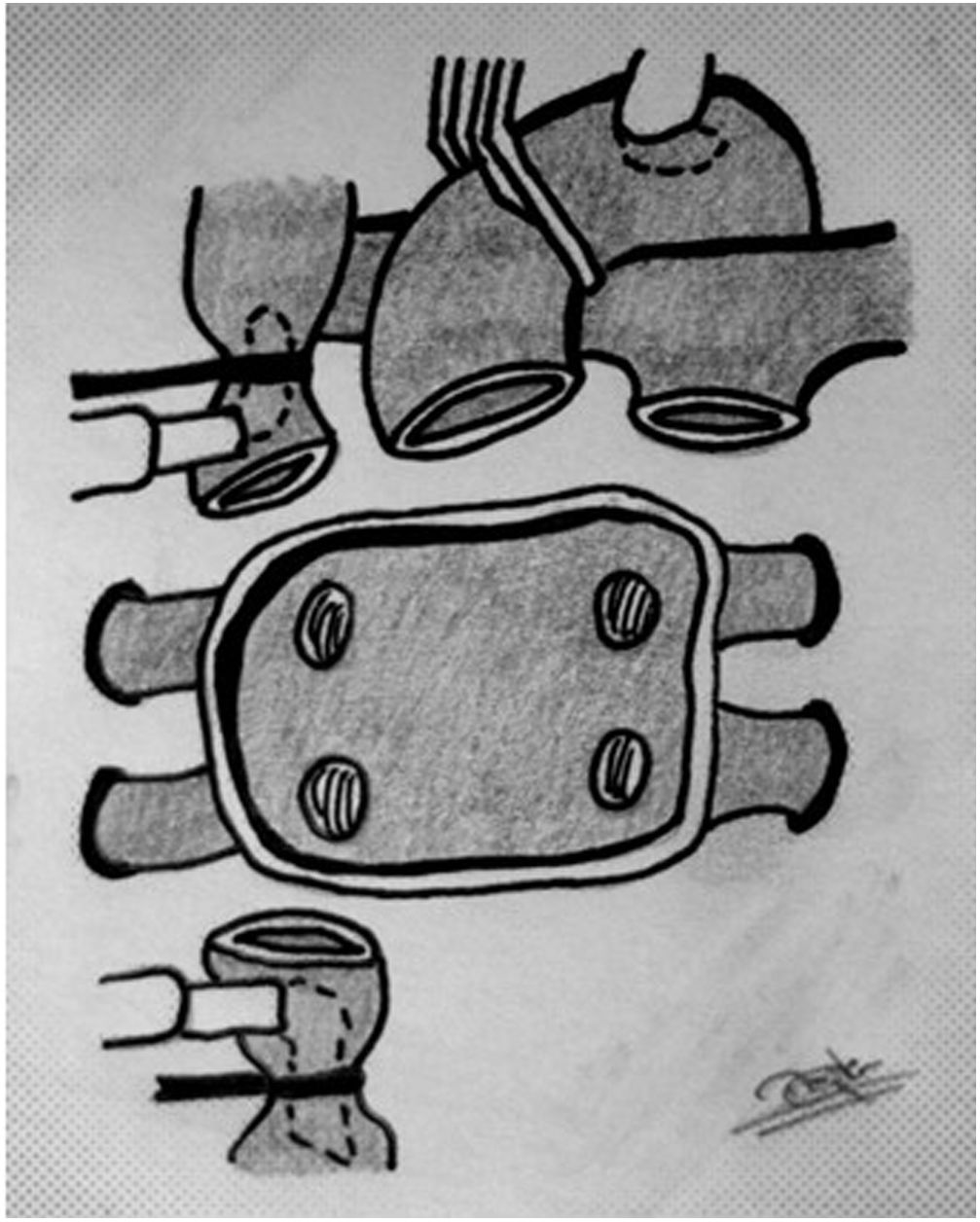
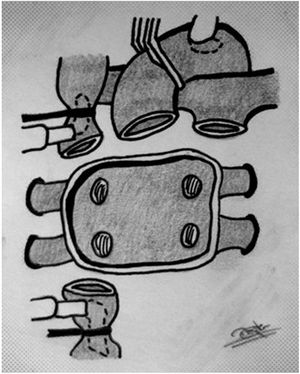
Extracción en el receptor. El resultado final tras la extracción es un casquete de aurícula izquierda con las 4 venas pulmonares, la aurícula derecha con ambas cavas, un segmento de aorta y otro de pulmonar. Para un trasplante bicava, seccionamos cava superior e inferior de manera similar a un Glenn o Fontan y retiramos el tejido adicional de aurícula derecha (fig. 3) Dejamos el seno coronario intacto si hay retorno infradiafragmático con ácigos izquierda, para trasplante tipo Lower-Shumway.
Cirugía de preparaciónAntes de comenzar la implantación del injerto (el trasplante, propiamente dicho), debemos asegurarnos que las estructuras restantes tras la extracción del corazón en el receptor coinciden con las del donante: aurícula izquierda, aurícula derecha (o ambas cavas), arteria pulmonar y aorta. Esto supone «deshacer» parte de las cirugías previas en algunos pacientes, como en un Glenn o Fontan. Esta fase de preparación del lecho en el receptor es característica de las cardiopatías congénitas14–16, debe ser perfectamente planificada y asumir que consume tiempo (incrementando la isquemia en más de una hora, frecuentemente)
Variantes técnicas en defectos congénitos complejosComo norma, aceptamos que la aurícula izquierda es una estructura posterior (dorsal) y en la línea media. Además, la aorta está situada ligeramente anterior y derecha respecto a la arteria pulmonar en la reflexión pericárdica. Sin embargo, podemos encontrar variantes en la posición de las venas cavas, normalmente en el lado derecho, y en la posición relativa de aorta pulmonar dentro del pericardio. Así, en un situs inversus17, ambas cavas discurren por la izquierda y la posición de aorta y pulmonar es especular.
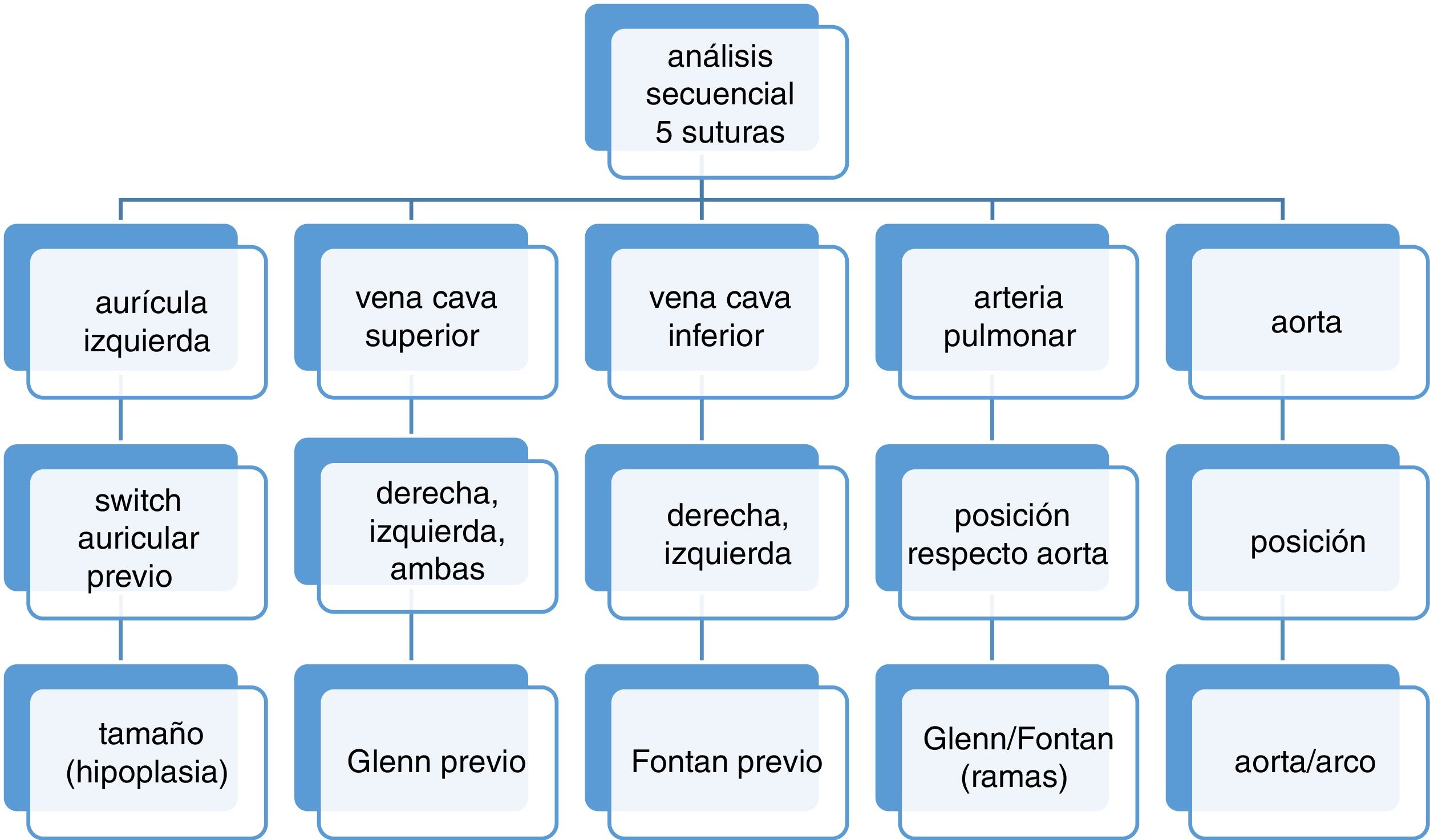
Como excepción que son las cardiopatías congénitas, en las sucesivas intervenciones realizadas a los pacientes introducimos «distorsiones» sobre las 4-5 estructuras: AI, AD (o venas cavas), pulmonar y aorta. Sirvan como ejemplo un Glenn o Fontan (venas cavas conectadas directamente a arteria pulmonar derecha) o un «switch» arterial con maniobra de Lecompte (arteria pulmonar por delate de aorta). Paradójicamente, algunas correcciones intracardiacas no suponen dificultad adicional a la hora del trasplante, siempre que respeten la anatomía quirúrgica de las 4 estructuras citadas (AI, AD, pulmonar y aorta). Es el caso de un canal AV o un Fallot, por ejemplo.
Por tanto, el intervalo entre la extracción del corazón en el receptor y el posterior implante del injerto puede requerir una serie de «reparaciones» adicionales que consumen tiempo de isquemia y deben ser planificados con antelación16,18,19. Además, la profundidad del campo y el retorno venoso (aumentado en cianóticos y reintervenciones) junto a la presencia ocasional de «stents» previos20 obliga a periodos de hipotermia profunda y, ocasionalmente, parada circulatoria (incrementando la morbilidad del trasplante). Algunos pacientes precisan técnicas adicionales en una, 2, 3, 4 o las 5 anastomosis.
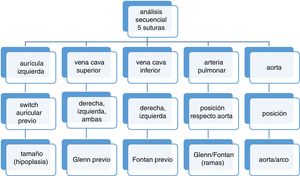
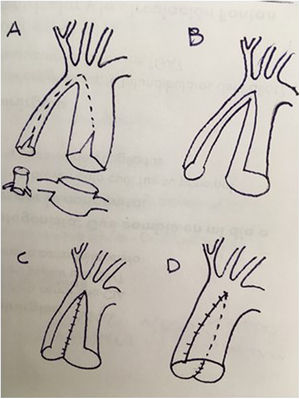
Una forma simple y didáctica de plantear dichas técnicas es un análisis morfológico (fig. 4) de las mismas 4 (o 5) estructuras por suturar, además del situs visceral. Por lo general, preferimos las soluciones extracardiacas con sutura bicava que las técnicas intracardiacas, que consumen más tiempo y dejan parches intracavitarios susceptibles de estenosis y arritmias futuras. Con objeto de compensar el tiempo adicional de isquemia requerido para estas técnicas de reparación adicionales, procuramos realizar las anastomosis derechas (pulmonar, cava inferior, cava superior) a corazón latiendo en la medida de lo posible (modificación de Yacoub).
La aurícula izquierda (casquete con las 4 venas pulmonares) es la estructura más posterior, de posición central. Apenas ofrece dudas. Si presentó un drenaje anómalo total o parcial, probablemente ya fue corregido con anterioridad. En caso contrario, se puede reconducir el flujo de las venas pulmonares hacia la aurícula izquierda con un parche autólogo de pericardio o la propia pared de la aurícula derecha. Si presenta una comunicación interauricular tipo seno venoso superior, seccionamos la cava superior por encima del drenaje anómalo e incorporamos el muñón de cava superior en la sutura de la aurícula izquierda (a continuación completamos la sutura cava-cava).
En la hipoplasia de cavidades izquierdas (tanto en fase de Norwood, como de Glenn o Fontan) no es infrecuente encontrar una aurícula pequeña. En tal caso, el perímetro de sutura puede realizarse englobando además a una parte de la pared de aurícula derecha del receptor, y posteriormente llevar a cabo 2 anastomosis bicava.
Retorno venoso sistémicoLas variantes quirúrgicas del retorno venoso sistémico pueden ser congénitas o «adquiridas», en función de las cirugías previas.
- 1.
Congénitas:
- a.
La más frecuente es la presencia de una vena cava superior izquierda, bien como sistema de doble cava superior o como cava superior única14. En presencia de una vena innominada, ligamos la conexión de la cava izquierda hacia el seno coronario y suturamos la cava superior del donante a la innominada del receptor. Si no existe vena innominada, debemos suturar la vena cava superior del donante con la izquierda del receptor (para ello se precisa longitud extra de vena cava superior del donante, o interponer un conducto entre ambas)
- b.
La presencia de una vena cava inferior izquierda es más rara. Se presenta en casos de situs inversus o ambiguus. Debemos crear un orificio en el lado derecho del tórax y para ello elaboramos un túnel con una lengüeta de pared libre de la aurícula derecha (en el lado izquierdo) y la cara diafragmática, desplazando así la sutura de cava inferior hacia la derecha.En el caso de trasplante sobre un Fontan en situs inversus, dicho túnel puede confeccionarse/sustituirse por el propio conducto extracardiaco de PTFE (tras seccionarlo de la arteria pulmonar izquierda).
- c.
Un caso excepcional supone la agenesia de vena cava inferior (segmento infrarrenal) y su continuidad a través de la vena hemiácigos hacia cava superior (derecha o izquierda). En tal situación, la cava inferior (intrapericárdica) recoge el contenido de las venas suprahepáticas y la cava superior izquierda el contenido de la cava inferior infrahepática (además del correspondiente al territorio superior). Con frecuencia se asocia a un sistema de doble cava superior (con ausencia de vena innominada) y presentan un seno coronario muy dilatado, al drenar dicho contenido. La opción más simple en esta situación consiste en un trasplante clásico de 4 suturas (aurícula derecha en lugar de bicava) pero debemos mantener el seno coronario del receptor in situ a la hora de la extracción del corazón (garantizando de este modo el retorno venoso sistémico). Curiosamente, la ecografía posterior al trasplante muestra 2 senos coronarios21: el del receptor (dilatado, recogiendo el drenaje de la cava izquierda) y el del donante (correspondiente al propio injerto)
- 2.
Adquiridas:
- a.
Aunque actualmente apenas se realizan, las cirugías de «switch» auricular (Senning, Mustard) en la trasposición de grandes vasos, dejan al ventrículo derecho en posición sistémica. Una forma sencilla de reorganizar la anatomía intraauricular consiste en eliminar el tejido septal (los «baffles» intraauriculares) con lo que obtenemos una aurícula única con las 4 venas pulmonares, y cuyo perímetro está formado por la suma de ambas aurículas. Al seccionar ambas cavas en su origen podemos completar un trasplante bicava sin más dificultad.
- b.
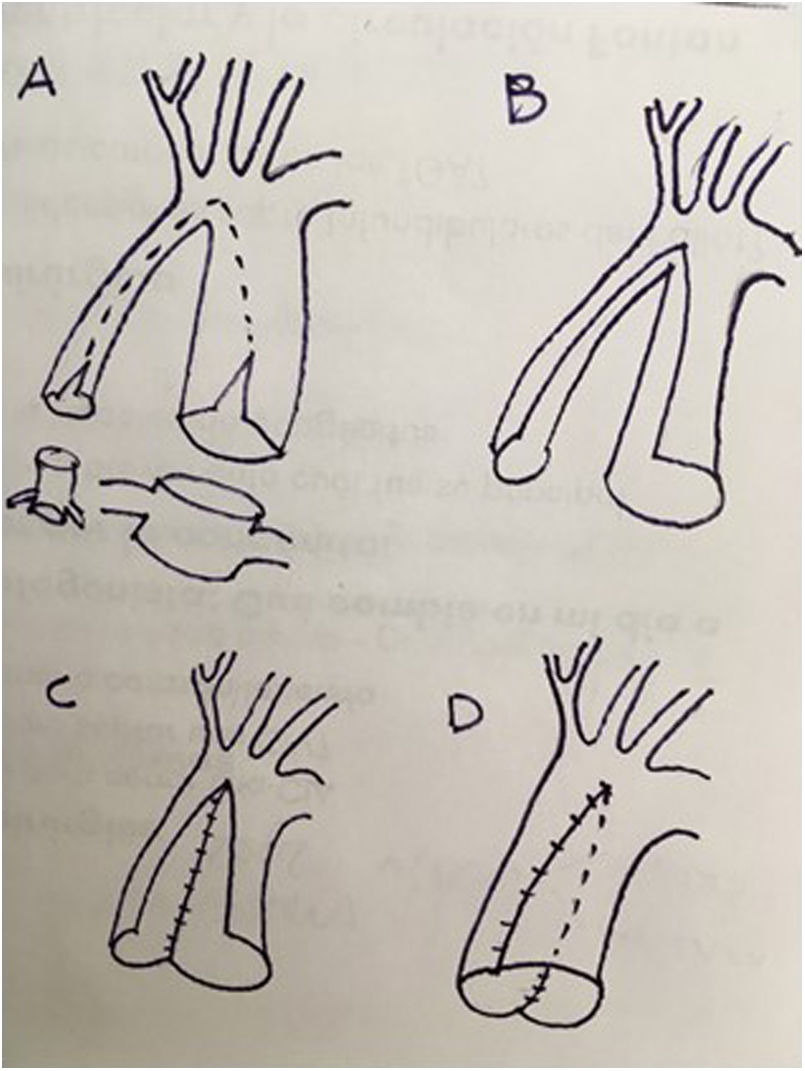
Fisiología univentricular. Los procedimientos de Glenn y Fontan para el corazón univentricular desconectan las cavas de la aurícula derecha para unirlas a la arteria pulmonar derecha, directamente en el Glenn y a través de un conducto de PTFE en el Fontan extracardiaco (fig. 5). Previo al trasplante, debemos «deshacer» ambas suturas.
- i.
Glenn. La canulación se realiza en la vena innominada, para poder disecar en su totalidad la cava superior. A continuación, seccionamos la cava superior de la arteria pulmonar para obtener un «manguito» de vena y realizamos la sutura cava-cava.
- ii.
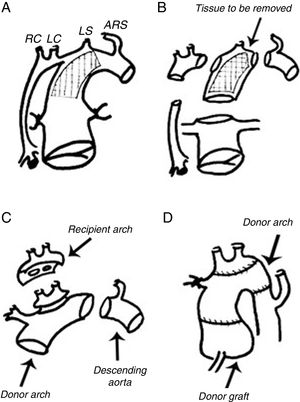
Fontan. Canulamos la cava inferior muy baja (o la vena femoral, en su defecto). Extirpamos la casi totalidad del conducto de PTFE, dejando un «manguito» de 1-2cm en su base para realizar la anastomosis de cava inferior-PTFE con el injerto (fig. 6).
Figura 6.Preparación para trasplante en Fontan previo: desconexión de Glenn y Fontan (dejamos un «manguito» de conducto en la vena cava inferior). Retirada del stent en la rama pulmonar izquierda, realizando plastia de ramas pulmonares (de hilio a hilio) con tejido del donante (aorta o pericardio) Compárese con la figura 3.
(0.09MB).
La sutura de la arteria pulmonar se realiza de manera término-terminal sobre la del receptor, bien en el tronco, bien en la bifurcación. Puede desplazarse hacia izquierda o derecha según necesidades (como en un Taussig-Bing).
En ocasiones, las ramas pulmonares aparecen distorsionadas por cirugías o intervencionismo previos15. Es el caso de un Glenn o Fontan con stents en sus ramas, por ejemplo. Si el injerto se obtuvo con la bifurcación pulmonar, puede usarse este material adicional para confeccionar un «onlay patch» o suturar independientemente ambas ramas pulmonares. Alternativamente, reconstruimos las ramas pulmonares de hilio a hilio (incluyendo retirada de stents) con un parche de aorta o pericardio del donante, sobre el que suturamos posteriormente la arteria pulmonar (fig. 6). Por la posición declive es preciso hipotermia profunda (18°C) y periodos breves de parada circulatoria.
Aorta y arcoLa aorta es la estructura más anterior en un trasplante. En teoría es la más simple, al tratarse de una sutura término-terminal. Describimos 2 situaciones particulares:
- 1.
«Switch» arterial. Tras la maniobra de Lecompte en la cirugía inicial, la pulmonar queda por delante de la aorta. La canulación directa es complicada debido al espacio limitado entre vena innominada y bifurcación pulmonar, por lo que recomendamos como alternativa la canulación femoral, axilar, cervical o del primer tronco supraaórtico (mediante fístula de PTFE). Una vez extirpado el corazón, basta con recolocar las ramas pulmonares por detrás de la aorta ascendente (deshaciendo la maniobra de Lecompte) previo a la sutura.
- 2.
Hipoplasia de cavidades izquierdas. La neoaorta tras una cirugía de Norwood (con sus variantes) puede aparecer distorsionada, resultando difícil tanto la canulación como la sección posterior9,22. Sirven las mismas pautas del párrafo anterior. Por otro lado, si se precisa reconstrucción del arco aórtico utilizamos técnicas similares a los adultos, con sutura tipo «hemiarco» (parche de Carrel) para lo que necesitamos que el donante incluya el arco aórtico en su extracción. Igualmente, se necesita de hipotermia profunda y paro circulatorio para esta técnica de reparación de arco aórtico, o canulación selectiva de troncos supraaórticos como alternativa.
- a.
Recientemente hemos incorporado la estrategia del procedimiento híbrido en neonatos con hipoplasia izquierda o ventrículos «borderline», consistente en realizar un «bi-banding» de ambas ramas pulmonares más implantación de stent en ductus. La reconstrucción posterior del arco aórtico durante el trasplante supone la retirada del stent previamente implantado con el tejido ductal residual. Para ello hemos utilizado diversas técnicas, en función del tejido disponible en el donante.
- i.
Ampliación de arco similar a Norwood, mediante parche «autólogo» (pericardio o aorta del donante) o heterólogo.
- ii.
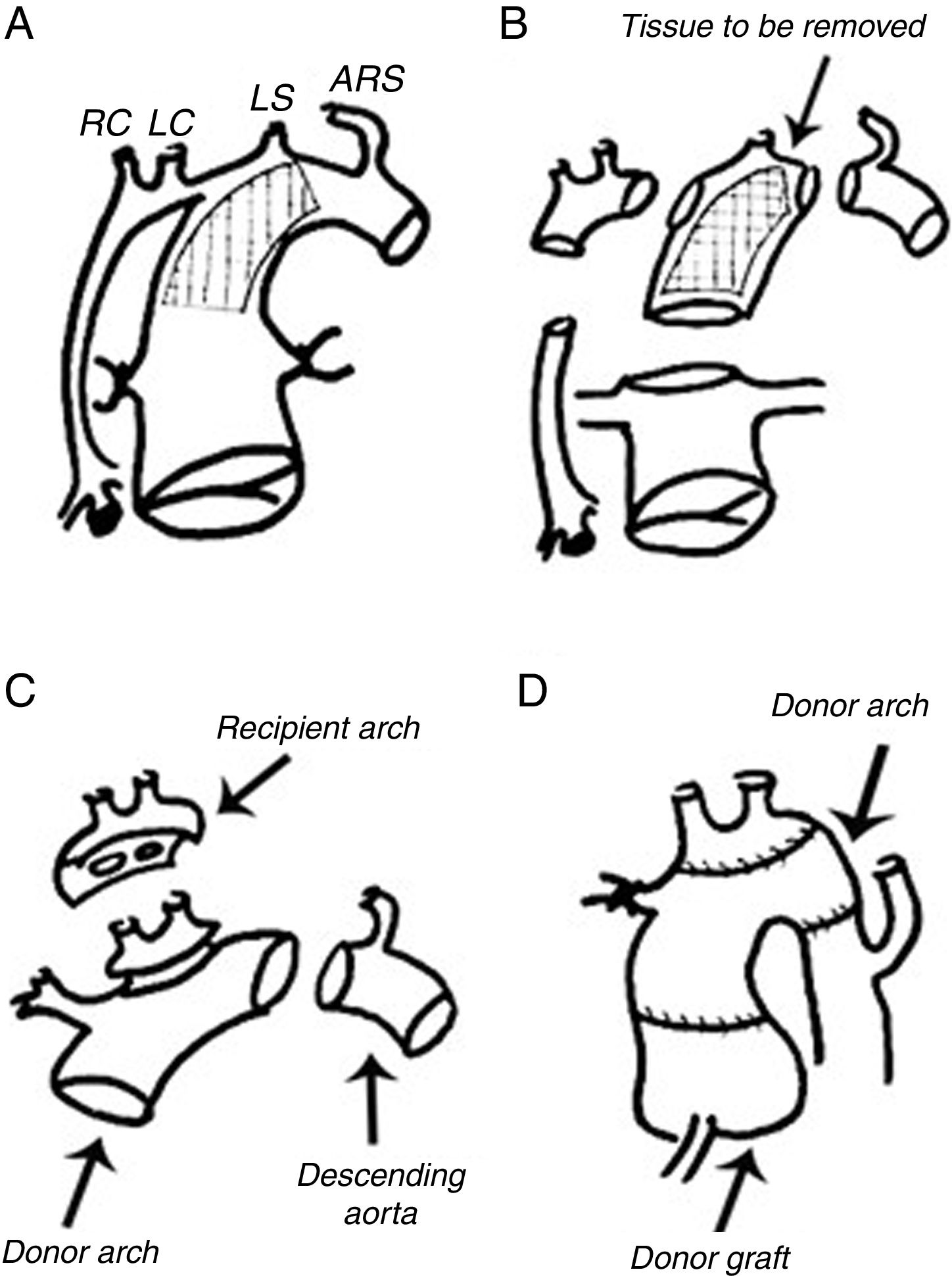
Técnica de «falda-pantalón». Descrita por Caldarone en Toronto (Canadá) consiste en la apertura lateral de arco y ductus, seguido de la sutura posterior y anterior de ambos para conseguir un solo conducto de mayor calibre. La técnica es similar a la confección de una falda a partir de un pantalón, precisando que el tejido ductal (tras retirar el stent previo) sea de una consistencia adecuada (fig. 7).
- iii.
«Split-graft». Una vez retirado todo el tejido ductal y stent del campo, la aorta (con el arco) es separada del resto del injerto(splitgraft). Dicho arco (donante) es trasplantado con 2 suturas: término-terminal en aorta descendente y con parche de Carrell los troncos supraaórticos23. Así conseguimos una neoaorta y un escenario similar a un trasplante convencional (fig. 8).
Figura 8.Reconstrucción de neoaorta tras procedimiento híbrido. Retirada en bloque de tejido ductal (incluido stent). Trasplante de arco del donante, previo al injerto propiamente dicho («split-graft technique»)23.
(0.17MB).
Desde la puesta en marcha del programa de trasplante cardiaco infantil en 1990, se han superado los 150 trasplantes en el año 20161. Tan solo en los últimos 5 años (2013-7) se han trasplantado 51 pacientes con cardiopatía congénita, de los que 11 son congénitos adultos (GUCH), 15 Fontan y 2 ABO incompatible en enero de 2018 (primeros casos en España12). Esta cifra supone cerca del 50% del total de trasplantes infantiles en todo nuestro país. La supervivencia global en el primer año es del 75%, a los 5 años del 64% y a los 10 años del 54%. Los datos son superponibles a las cifras de la ISHLT. Nuestro grupo se ha caracterizado, además, por una notable actividad científica y publicadora1,10,12,13,23–26
Retos y expectativas futurasLa cifra de trasplantes cardiacos infantiles se encuentra relativamente estabilizada. Se prevé un aumento en los 2 extremos etarios: menores de un año (gracias al programa ABO incompatible11,12 que favorece un aprovechamiento de los escasos donantes) y congénitos adultos. A su vez, un incremento en el número de trasplantes en edades tempranas puede suponer un aumento de retrasplantes futuros en dicha cohorte. Debido a la mejora de los resultados quirúrgicos y manejo postoperatorio, el número de cardiópatas operados que llega a la edad adulta se ha incrementado. Este hecho se traduce en un aumento de la cirugía en las cardiopatías congénitas del adulto27 (GUCH). Paulatinamente, un porcentaje de las mismas corresponderá a trasplante. Algunos trabajos auguran que hasta un 80% de los mismos se producirá en patología univentricular28,29, con la complejidad que esto implica10 (reintervenciones, cirugía de reconstrucción, hipotermia profunda, parada circulatoria) y unos resultados cada vez mejores6–9,30, aunque esta cohorte de pacientes aparece en «desventaja» respecto a la mayoría de adultos aguardando trasplante (aceptable clase funcional, más jóvenes, malos candidatos a asistencia circulatoria) en términos de media/mediana de estancia en lista de espera.
Precisamente es el grupo de cardiopatías con fisiología univentricular el que arroja peores resultados tras el trasplante7,9,30–32, siendo mejores tras Fontan que Glenn y Norwood, respectivamente. El grupo del Texas Heart (Houston, EE. UU.) propone un «up-grade» de Glenn a Fontan en el momento de implantar una asistencia circulatoria en un paciente con fisiología de Glenn33, con el argumento de «asistir» a un corazón no cianótico (Fontan, en lugar de Glenn) Los casos más evolucionados y con afectación hepática (fibrosis, cirrosis) como consecuencia de la falta de un ventrículo subpulmonar pueden precisar un trasplante combinado corazón-hígado34.
En relación con la asistencia circulatoria, se está produciendo una transición de la modalidad pulsátil a la continua35,36 en espera de la miniaturización de las mismas37. Al igual que en adultos, se prevé un incremento en la necesidad de asistencia pretrasplante, particularmente en fisiología univentricular. De manera anecdótica, nuestro grupo ha realizado una asistencia izquierda tipo Levitronix® pretrasplante en paciente con fisiología de Fontan canulando la aurícula derecha (sistémica, en este caso, al recibir el retorno venoso pulmonar) y la aorta, seguido de una asistencia derecha en ECMO postrasplante (por disfunción derecha más hipoxia), canulando igualmente aurícula derecha y aorta en el injerto. Paradójicamente, las mismas estructuras (AD y aorta) suponen una asistencia «izquierda» pretrasplante y «derecha» postrasplante (datos no publicados).
Finalmente, ante la dificultad de incrementar el número de donantes (independientemente de edad y peso), 2 estrategias parecen llamadas a paliar dicho déficit: la donación en asistolia (de momento aplicable a órganos abdominales) y la mejora en los medios de transporte y conservación de los órganos (facilitando las extracciones a distancia, si se disminuye la isquemia fría).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.