El uso de dispositivos de asistencia ventricular se ha extendido ampliamente en la población pediátrica afecta de cardiopatía congénita. En este conjunto de pacientes, existe una gran variabilidad de escenarios en el momento de diseñar la estrategia de asistencia ventricular, debido a la gran diversidad de cardiopatías congénitas.
Debido a la rareza y a la escasez de publicaciones encontradas en la literatura, presentamos el caso clínico y la estrategia de asistencia ventricular realizada en un niño de 11 años que se presentó en shock cardiogénico debido a una miocardiopatía idiopática ventricular izquierda grave, que asociaba una insuficiencia valvular pulmonar severa con disfunción del ventrículo derecho secundario a un debanding pulmonar realizado a los 21 meses de edad.
The use of ventricular assist devices has spread widely in the pediatric population affected of congenital heart disease. In this group of patients, there is a great variability of scenarios at the moment of designing the ventricular assistance strategy, due to the great diversity of congenital heart diseases.
Due to the rarity and scarcity of publications found in the literature, we present the clinical case and the strategy of ventricular assistance performed in an 11-year-old boy who presented with cardiogenic shock due to a severe left ventricular idiopathic myocardiopathy, which associated a severe pulmonary valve regurgitation with right ventricular dysfunction secondary to a pulmonary debanding performed at 21 months of age.
La aplicación de sistemas de asistencia ventricular ha experimentado un extraordinario auge en el tratamiento de la insuficiencia cardiaca terminal. También en el mundo de las cardiopatías congénitas estamos experimentando ese auge. Sin embargo, la gran variabilidad en las características anatómicas y fisiopatológicas de dichas cardiopatías, hace que a la hora de diseñar la estrategia de asistencia ventricular en un paciente concreto afecto de cardiopatía congénita evolucionada terminal se puedan presentar infinidad de escenarios desafiantes e infrecuentes. Así, debido a la rareza de la siguiente combinación de lesiones, presentamos el caso clínico y describimos la estrategia de asistencia ventricular planteada en un paciente de 11 años que se presentó con shock cardiogénico en el contexto de una miocardiopatía idiopática ventricular izquierda grave asociada a una insuficiencia valvular pulmonar severa con disfunción ventricular derecha.
Presentación del casoSe trata de un paciente varón de 11 años, diagnosticado al nacimiento de coartación aórtica (CoAo) ístmica severa con hipoplasia del arco aórtico distal y comunicación interventricular (CIV).
En periodo neonatal fue sometido a la reparación de la CoAo mediante resección de CoAo y anastomosis término-terminal extendida al suelo del arco aórtico, asociándose un banding pulmonar. Los controles posteriores (ecocardiografía y cateterismo) mostraron una reparación del arco aórtico sin gradiente significativo, banding pulmonar eficaz sin distorsión de ramas y buena función biventricular.
A los 21 meses se reinterviene bajo circulación extracorpórea (CEC) procediéndose al cierre de la CIV con parche y debanding pulmonar. El postoperatorio transcurre sin incidencias y los seguimientos postoperatorios ambulatorios muestran un paciente asintomático con ecocardiografía donde hay ausencia de defectos residuales salvo la detección precoz de una insuficiencia valvular pulmonar severa sin repercusión hemodinámica. La función ventricular izquierda es descrita como normal hasta el control de los 8 años de edad donde se empieza a situar en límites bajos de la normalidad.
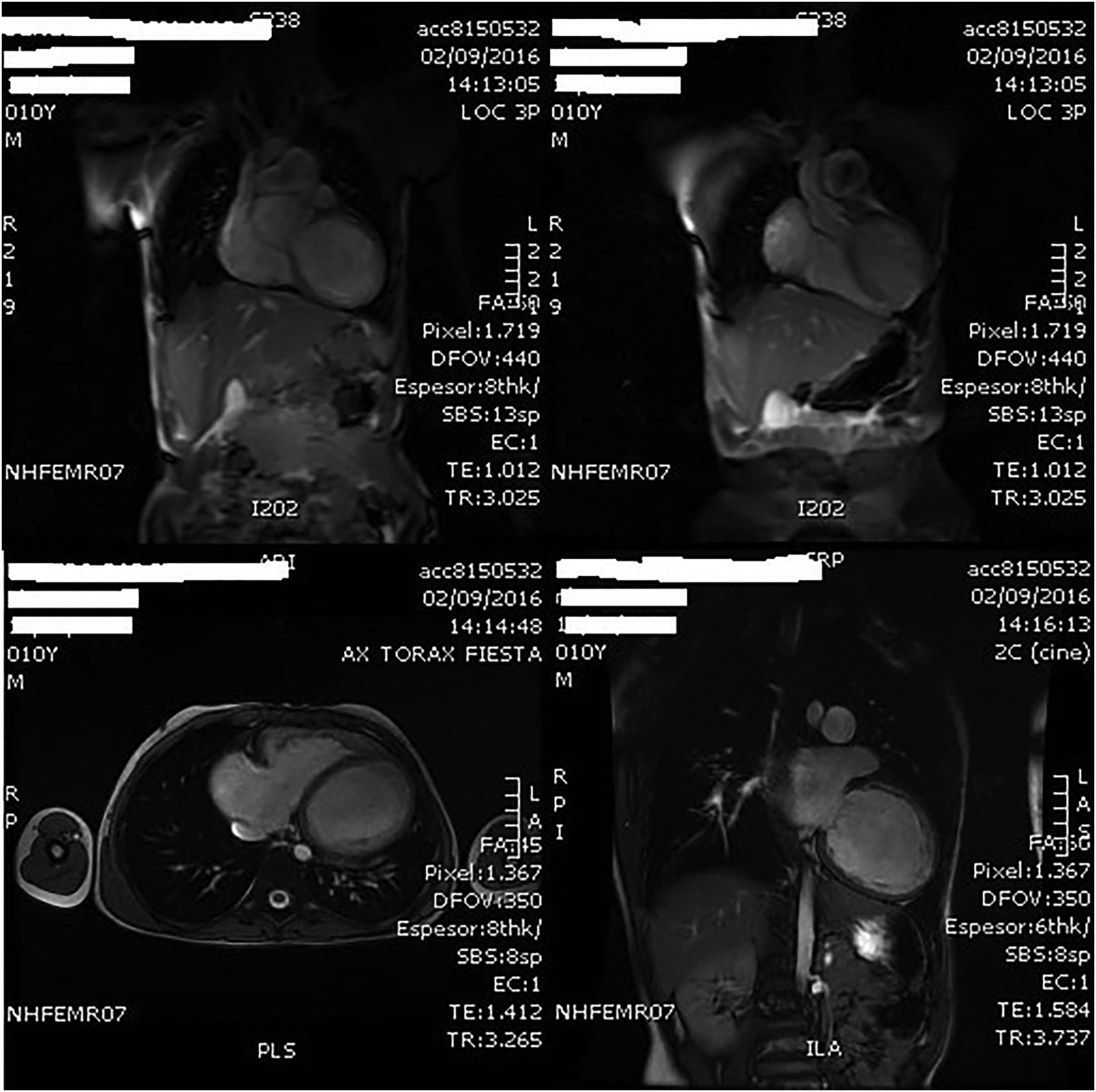
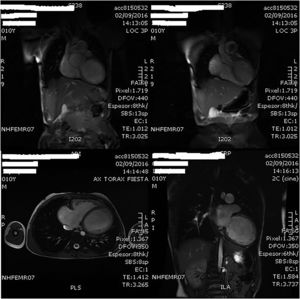
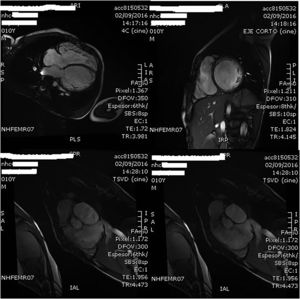
A los 10 años es ingresado en nuestro centro por cuadro de astenia y pérdida ponderal de un mes de evolución junto a franco deterioro de su clase funcional, sin intercurrentes acompañantes. Analíticamente destacaba un PRO-BNP de 27.703pg/ml, y a nivel ecocardiográfico a los hallazgos conocidos se añadía un ventrículo izquierdo (VI) ligeramente dilatado, pero con disfunción sistólica severa. El estudio se completó mediante cardio-RMN que mostró ausencia de alteraciones de la perfusión miocárdica con el VI severamente dilatado (IVTDVI: 176ml/my) con hipocinesia generalizada y FE del 18% (fig. 1); ventrículo derecho (VD) severamente dilatado (IVTDVD: 154ml/my) con FE del 34% (fig. 2). Se estableció el diagnóstico de miocardiopatía idiopática con disfunción grave del VI en paciente con insuficiencia valvular pulmonar severa post-debanding, y se inició tratamiento médico (captopril, espironolactona, furosemida, Lanacordin® y carvedilol). En sucesivos controles el paciente se encontró clínicamente estable con aceptable capacidad funcional, completándose el estudio mediante cateterismo cardiaco que confirmó los hallazgos de la cardio-RMN detectando una hipertensión pulmonar ligera (PsAP: 32mmHg), un índice de resistencias pulmonares de 2,02UW/my y un árbol coronario normal.
Imágenes de la cardio-RMN practicada a los 10 años de edad donde se aprecia la dilatación del VD. En esta exploración complementaria, la fracción de eyección del VD se estimó en un 34% y se cuantificó la insuficiencia valvular pulmonar como severa con una fracción regurgitante del 58%.
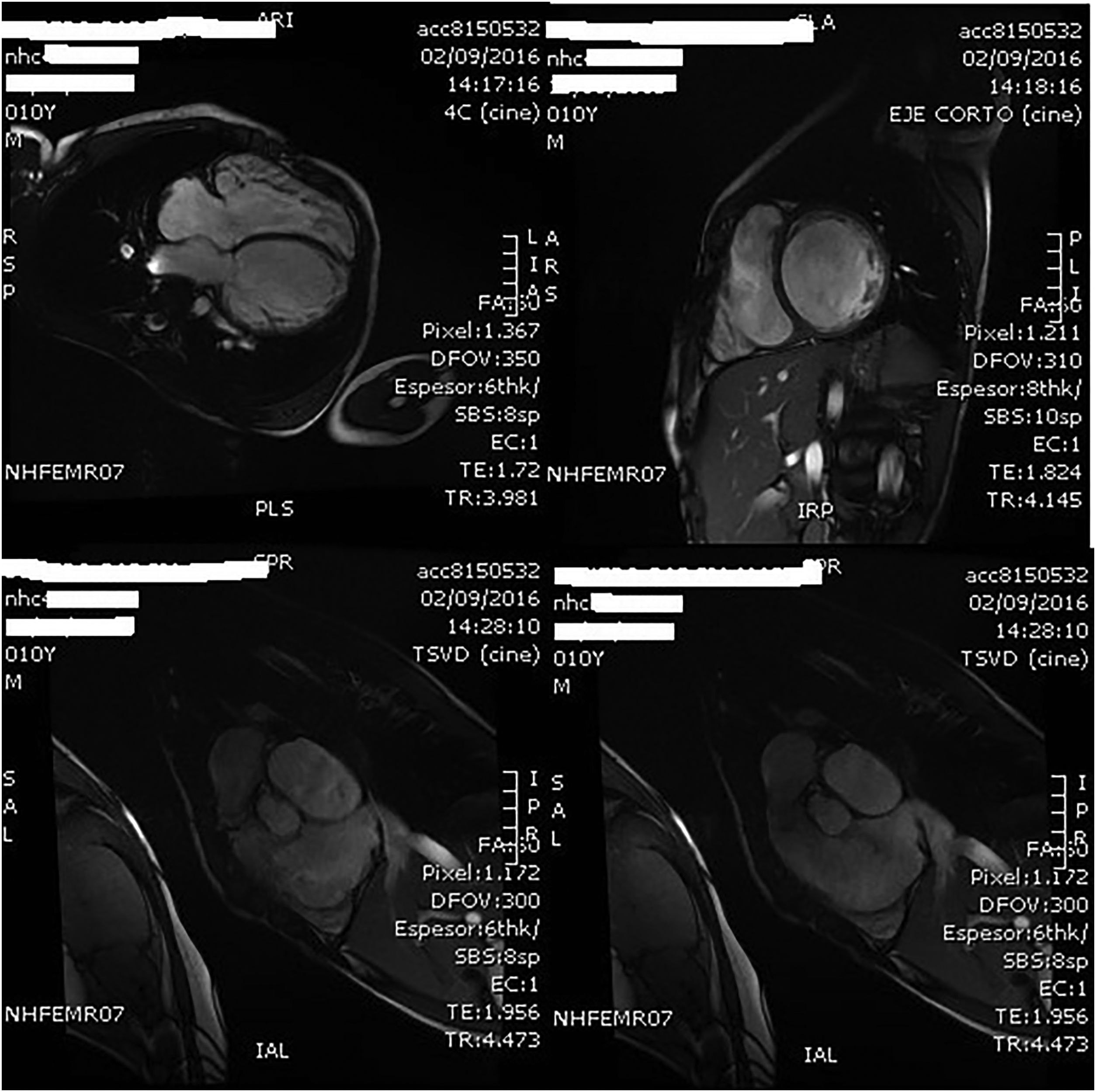
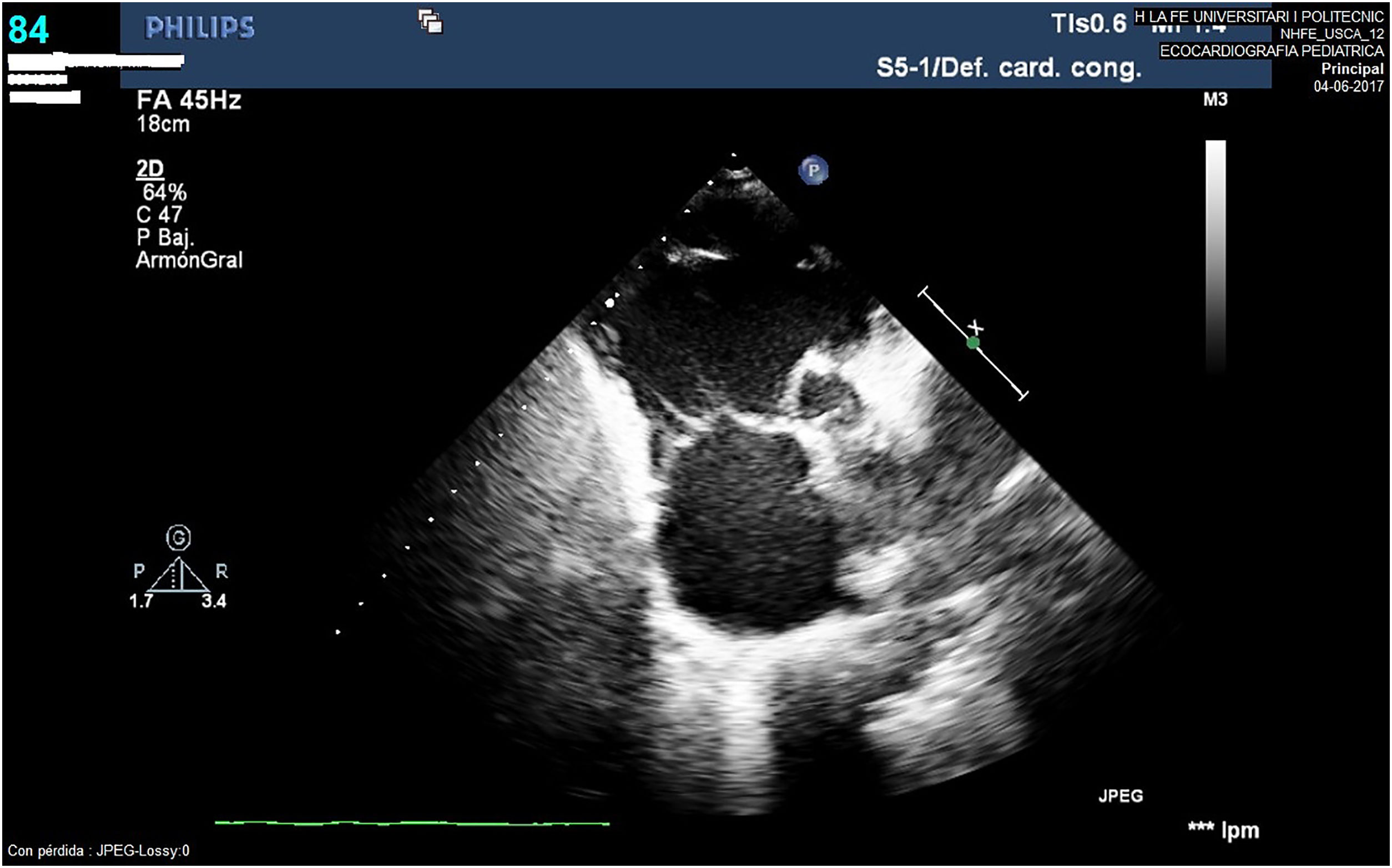
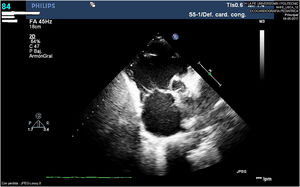
A los 11 años el paciente sufre un nuevo ingreso hospitalario por descompensación grave de su insuficiencia cardiaca que obliga a su internamiento en la unidad de cuidados intensivos pediátricos (UCIP), detectándose ecocardiográficamente la grave disfunción del VI y la dilatación severa del VD, ya conocida (fig. 3). A pesar de la intensificación del tratamiento médico asociando soporte inotrópico, el paciente perpetuó su cuadro franco de bajo gasto con deterioro de la función renal y hepática, por lo que, tras evaluación en sesión multidisciplinar, se consideró al paciente candidato con carácter urgente al implante de una asistencia ventricular izquierda junto a la valvulación del tracto de salida ventricular derecha (TSVD) mediante una bioprótesis valvular en posición pulmonar.
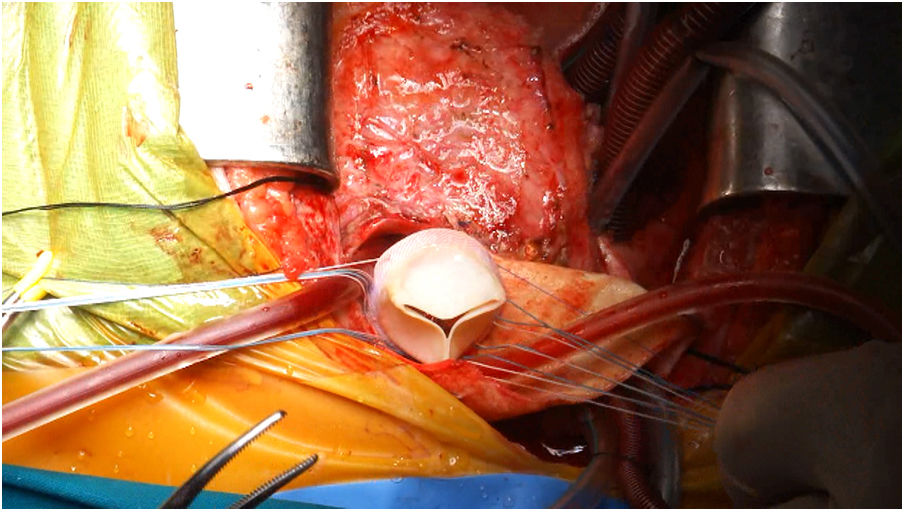
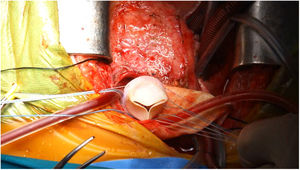
El paciente fue intervenido a través de re-esternotomía media y tras liberar las adherencias derivadas de las cirugías previas, se procedió a seleccionar con ayuda de ETE el punto del ápex VI donde se implantaría la cánula apical, y una vez confeccionados los túneles subcutáneos para la exteriorización de las cánulas del dispositivo de asistencia ventricular, se heparinizó al paciente estableciéndose la CEC con hipotermia ligera, procediendo (sin isquemia) primero al implante de una prótesis biológica valvular del número 25 en posición pulmonar ampliando la parte más anterior del TSVD con un parche obtenido de conducto de vena yugular bovina (fig. 4) y posteriormente se implantaron la cánula apical sobre el VI y la aórtica en este orden. Se usaron cánulas de EXCOR® (Berlin Heart AG, Berlín, Alemania) (la aórtica se manufacturó en banco suturando en su extremo aórtico un conducto de Dacron® de 12mm que se anastomosó término-lateral a la aorta nativa del paciente) y como sistema de asistencia se empleó el dispositivo Levitronix®. Bajo control con ETE se procedió con éxito a la desconexión de CEC sin incidencias, observando una buena estabilidad hemodinámica con bioprótesis pulmonar normofuncionante y función ventricular derecha aceptable con adecuada precarga del VI.
El paciente evolucionó favorablemente en la UCIP, manteniéndose hemodinámicamente estable, lo que permitió su extubación en las primeras 24h del postoperatorio, con normalización de los parámetros renales y hepáticos deteriorados previamente al implante de la asistencia ventricular; ello permitió listar al paciente en urgencia cero para trasplante cardiaco. Durante la fase pre-trasplante la asistencia ventricular izquierda implantada funcionó adecuadamente y las ecocardiografías mostraron una aceptable función ventricular derecha. Al cabo de una semana de asistencia sin incidencias, al surgir donante compatible, se realizó el trasplante cardiaco según técnica bicava sin problemas intraoperatorios con buena evolución posterior, estando actualmente el paciente asintomático en clase funcional I.
DiscusiónSi bien, la membrana extracorpórea de oxigenación (ECMO) ha representado un sistema de asistencia circulatoria muy extendido y experimentado en la población pediátrica, debido a sus frecuentes complicaciones como infección, sangrado, ACV,… la ECMO solo puede ser considerado como un sistema de asistencia a muy corto plazo1,2. La larga demora existente en las listas de trasplante cardiaco pediátrico, unidos a la dificultad en lograr la extubación y la deambulación del paciente pediátrico en ECMO, hacen que este sistema de asistencia sea inviable aplicarlo como puente al trasplante cardiaco en la población pediátrica. No en vano, la mortalidad infantil del ECMO como puente al trasplante cardiaco es superior al 50%2,3. Ello ha llevado a implementar sistemas de asistencia ventricular de larga duración, a pesar de su mayor complejidad técnica y demanda en el paciente pediátrico con cardiopatía congénita donde los escenarios que podemos encontrar son muy variables y desafiantes a la hora de diseñar la estrategia de asistencia ventricular.
En nuestro caso clínico, nunca nos planteamos asistir al paciente con una ECMO, ya que sus antecedentes (diagnosticado y seguido desde hacía 2 años de miocardiopatía idiopática con disfunción ventricular izquierda grave) hacían presagiar que el actual episodio de descompensación de su insuficiencia cardiaca raramente se pudiera resolver en el corto espacio de tiempo que brinda una ECMO. Más bien, pensábamos que era el estadio final de su miocardiopatía, y que el objeto de la asistencia ventricular debía ser recuperar la disfunción multiorgánica que había iniciado el paciente con objeto de listarlo lo antes posible como urgencia cero para trasplante cardiaco. Por ello, se apostó por una asistencia de mayor duración que una ECMO.
En nuestro caso particular, se apostó por canular usando las cánulas de EXCOR® y utilizar como sistema de bomba centrífuga un dispositivo Levitronix®, estrategia por otro lado ya descrita en la literatura4. Las razones para esta decisión hay que buscarlas, por un lado en la experiencia de nuestro centro con el uso de Levitronix®, que nos permitía la disponibilidad inmediata de dicho sistema (nuestro paciente tenía un peso de 27kg). Por otro lado, se optó por usar las cánulas de EXCOR® por una doble razón, en primer lugar su uso nos permitía una relativa fácil transición desde el sistema Levitronix® al EXCOR® en caso de necesitar prolongar ampliamente la asistencia en el tiempo por la no aparición de donante compatible; y en segundo lugar la fácil y rápida disponibilidad de las cánulas apropiadas de EXCOR® (se dispuso de las mismas al día siguiente de solicitarlas). Esto nos permitía, al día siguiente de sentar la indicación clínica, asistir a nuestro paciente con un dispositivo de asistencia de duración media-larga (Levitronix®) y con facilidad de transicionar a un dispositivo de larga duración si era preciso (EXCOR®) sin necesidad de pasar por el puente intermedio de una ECMO con sus conocidos inconvenientes y aumento de morbimortalidad.
El dilema más complejo en la toma de decisiones fue si inclinarnos por una asistencia ventricular izquierda exclusivamente, o una biventricular valvulando el TSVD (habida cuenta que el VD tenía una FE del 34% con una insuficiencia valvular pulmonar muy severa) o apostar por una decisión intermedia de implantar una bioprótesis valvular pulmonar asociando una asistencia ventricular izquierda solo. A la toma de decisiones no nos ayudó la literatura publicada. Por un lado, como ya hemos apuntado anteriormente, la variabilidad de las cardiopatías congénitas provocan escenarios muy variables e infrecuentes que se traducen en la dificultad de encontrar series o casos clínicos similares publicados sometidos a asistencia ventricular. Así, solo pudimos localizar en la literatura un caso similar al nuestro que correspondía a un paciente adulto con disfunción ventricular e insuficiencia valvular pulmonar moderada donde habían decidido una asistencia biventricular con implante de bioprótesis pulmonar5. Por otro lado, cuando consultamos las guías de recomendaciones para la asistencia ventricular mecánica publicadas en 2013, no mencionaban ninguna recomendación para el caso de coexistir valvulopatía pulmonar6.
Las citadas guías recomendaban tratar la insuficiencia valvular aórtica si esta era de grado superior a ligero cuando se implantaba una asistencia ventricular izquierda6. A pesar de que en el único caso similar al nuestro encontrado en la literatura5, habían apostado por una asistencia biventricular con implante de bioprótesis pulmonar simultáneo, los peores resultados asociados a las asistencias biventriculares y nuestra experiencia limitada en casos de asistencia biventricular, nos hicieron inclinarnos hacia una asistencia ventricular izquierda. Desde un punto de vista fisiopatológico, pensamos que era necesario implantar una bioprótesis en posición pulmonar con objeto de evitar la insuficiencia valvular pulmonar severa que presentaba el paciente; con ello, eliminaríamos el importante volumen de regurgitación hacia el VD y mejoraríamos por un lado la eficiencia funcional del VD y, por otro lado, mejoraríamos el gasto cardiaco derecho lo suficiente como para precargar adecuadamente al VI asistido, sin necesidad de implantar una asistencia ventricular derecha.
Con este razonamiento se llevó a cabo el implante de una bioprótesis en posición pulmonar asociado a una asistencia ventricular izquierda exclusiva, con buen resultado hemodinámico (fig. 5) que permitió precargar adecuadamente el VI asistido a pesar de disfunción del VD (FE del 34% en cardio-RMN de 2 años antes) sin necesidad de implantar una asistencia derecha, lo que se tradujo en una franca mejoría del gasto cardiaco y la rápida normalización de la función renal y hepática que permitió listar precozmente como urgencia cero para trasplante cardiaco a nuestro paciente.
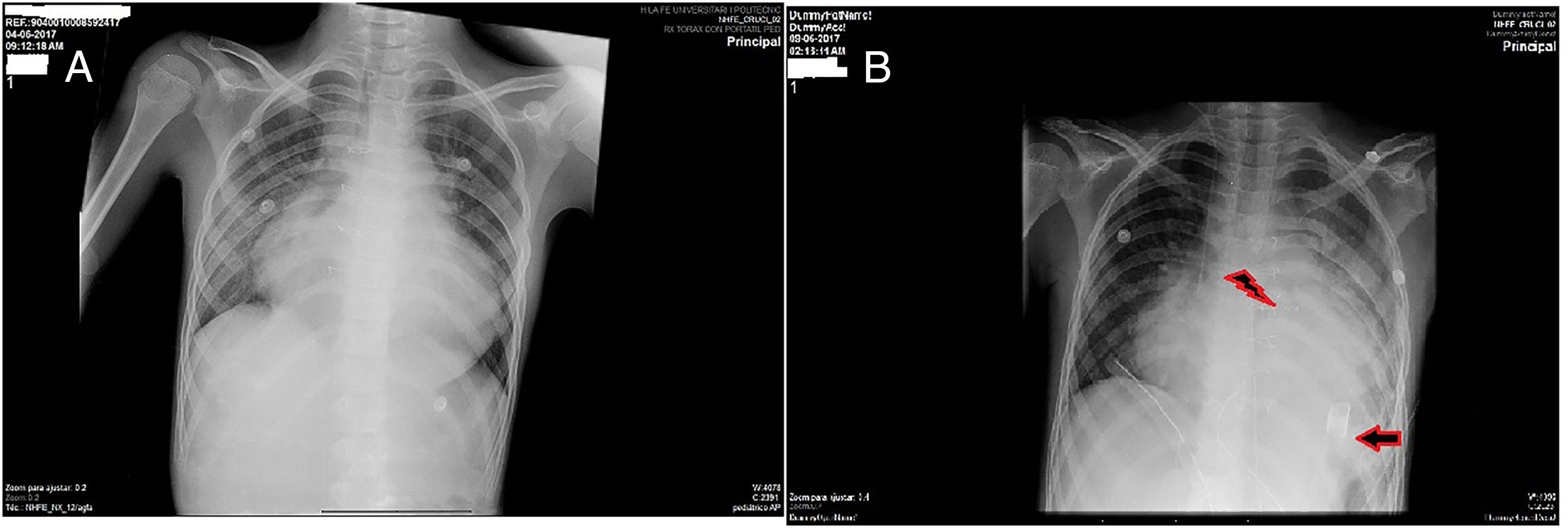
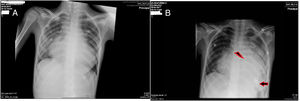
A) Se muestra la Rx de tórax previa al implante de la asistencia ventricular donde se aprecia una importante congestión venocapilar pulmonar secundaria a la grave disfunción del VI. B) Rx de tórax del 3.° día postimplante de la asistencia ventricular donde ha disminuido el componente de congestión venocapilar pulmonar. La flecha señala la posición de la cánula apical implantada en el VI. El símbolo del rayo marca la bioprótesis pulmonar que se identifica por los 3 puntos radioopacos de la misma.
El implante cardiaco pudo realizarse según técnica bicava sin problemas técnicos a pesar de la bioprótesis pulmonar implantada. Quizá el único inconveniente pueda ser la necesidad de disponer de longitud suficiente de tronco pulmonar en el corazón donado para poder realizar la anastomosis término-terminal del tronco pulmonar más allá del parche de ampliación del TSVD necesario para acomodar la bioprótesis pulmonar en el momento del implante cardiaco, inconveniente que tampoco se puede soslayar completamente en el caso de implantar una asistencia derecha.
ConclusiónCon las lógicas reservas impuestas por la infrecuencia de esta asociación de lesiones, la duración limitada de la asistencia (el paciente se trasplantó a la semana de iniciar la asistencia en nuestro caso) y la escasa y no concluyente bibliografía al respecto, podemos concluir que la valvulación del TSVD en casos de insuficiencia valvular pulmonar severa con disfunción del VD puede mejorar la eficiencia funcional del VD y el gasto cardiaco derecho lo suficiente para precargar adecuadamente al VI asistido y así evitar una asistencia biventricular con sus conocidos inconvenientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.