Los defectos del desarrollo del septo cono-truncal representan el 10-12% de las cardiopatías congénitas (CC). Entre las anomalías producto de este inadecuado desarrollo se encuentran: la tetralogía de Fallot, el ventrículo derecho de doble salida, la transposición de grandes arterias y el truncus arteriosus communis (TA).
El TA es una cardiopatía cianógena rara. Su incidencia fluctúa entre 6-10 casos por cada 100.000 nacimientos y representa el 0,7% de las CC. La combinación de TA e interrupción del arco aórtico (IAA) es un hallazgo aún más infrecuente, representa el 15% de los TA.
El TA se caracteriza por la emergencia de una única gran arteria truncal (AT) que cabalga el septo interventricular de donde nace el tronco arterial pulmonar común o las 2 arterias pulmonares. Las arterias coronarias emergen de una única raíz arterial truncal con una única válvula semilunar.
El primer caso documentado de TA se publicó en 1798, el tratamiento quirúrgico se limitaba al banding bilateral de las arterias pulmonares. La primera corrección exitosa se realizó en 1962 en Michigan. El primer registro de una corrección quirúrgica exitosa en un TA en combinación con IAA se realizó en 1971 por Gomes y McGoon.
Con intención de ilustrar lo que consideramos los puntos más importantes en el manejo preoperatorio, quirúrgico y postoperatorio de esta patología, compartimos el caso de un neonato con diagnóstico prenatal de TA tipo I en combinación con IAA tipo B.
Cono-truncal (CT) heart defects represents 10-12% of congenital heart diseases (CHD).
This group of anomalies include tetralogy of Fallot, double outlet right ventricle, transposition of great arteries and Truncus arteriosus (TA).
TA is a rare cyanotic CHD. Its incidence ranges from 6-10 cases per 100,000 births and represents 0.7% of all CHDs. The combination of TA and interrupted aortic arch (IAA) is much less common, 15% approximately of the patients with TA.
TA is characterized by a single large vessel (common arterial trunk) arising from the ventricles. The common trunk typically straddles a ventricular septal defect in the outlet portion of the interventricular septum.
Persistent TA was first documented in 1798. Early surgical treatment strategies were aimed at palliation using bilateral pulmonary artery banding techniques. The first successful correction was performed in 1962 in Michigan. The first report of TA with IAA surgical repair was published by Gomes and McGoon in 1971.
We report a case of a type I TA in combination with type B IAA and the critical points of care in preoperative, perioperative and postoperative management.
Siguiendo el protocolo habitual de screening de cardiopatías congénitas (CC) de nuestro centro, se realizó el control ecocardiográfico fetal en una gestante de 24 semanas. En este estudio se evidenciaron 4 cámaras cardiacas aparentemente normales y la existencia de un único gran vaso cabalgando un defecto septal ventricular. El doppler pulsado y color confirmó un flujo y onda única a través de este gran vaso. Bajo la sospecha de TA se realizó el estudio de cariotipo molecular prenatal (Array CGH) en una muestra de líquido amniótico en el que se descartó la deleción del cromosoma 22q11.2 (síndrome de DiGeorge). Durante el seguimiento prenatal se confirmaron los hallazgos descritos.
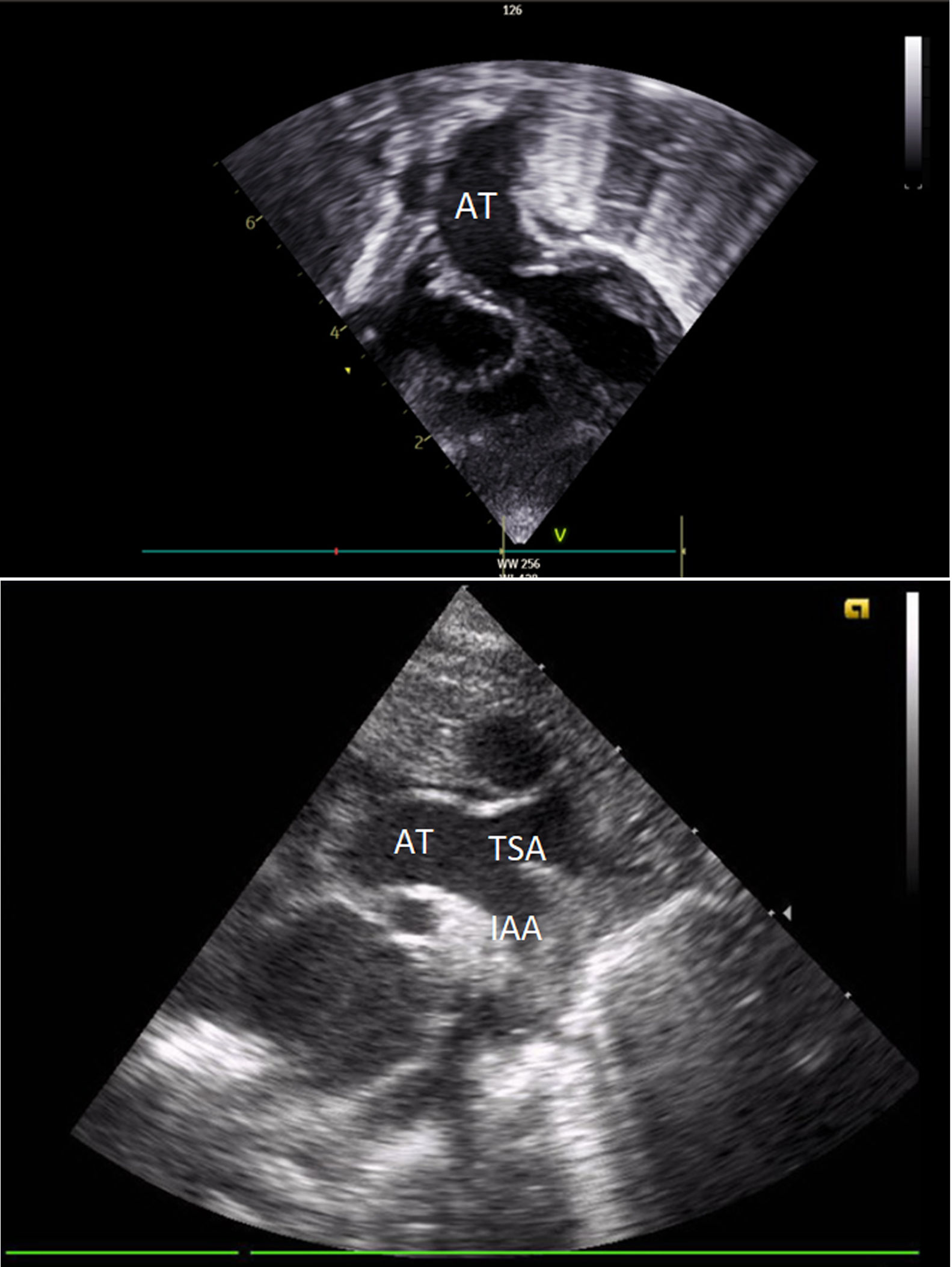
El primer estudio ecocardiográfico neonatal confirmó el diagnóstico. Se observaban 4 cámaras cardiacas con adecuadas características y adecuada contractilidad bi-ventricular. De estas cámaras emergía una única AT con una válvula competente de 3 velos. Al examinar el arco aórtico, el doppler color reveló una interrupción completa en el flujo entre la carótida común izquierda y la arteria subclavia izquierda. La comunicación interventricular (CIV) de 9mm se encontraba cabalgando en 50% la AT. El ductus arterioso (DA) de 7mm se mantenía permeable (figs. 1A y B).
Ecografía transtorácica: A) Eje subcostal, proyección de 4 cámaras en el que se visualiza una única AT emergiendo de la base del corazón. B) Eje supraesternal, corte longitudinal en el que se observa la AT y la IAA luego de la urgencia de la arteria carótida común izquierda.
AT: arteria truncal. IAA: interrupción del arco aórtico.
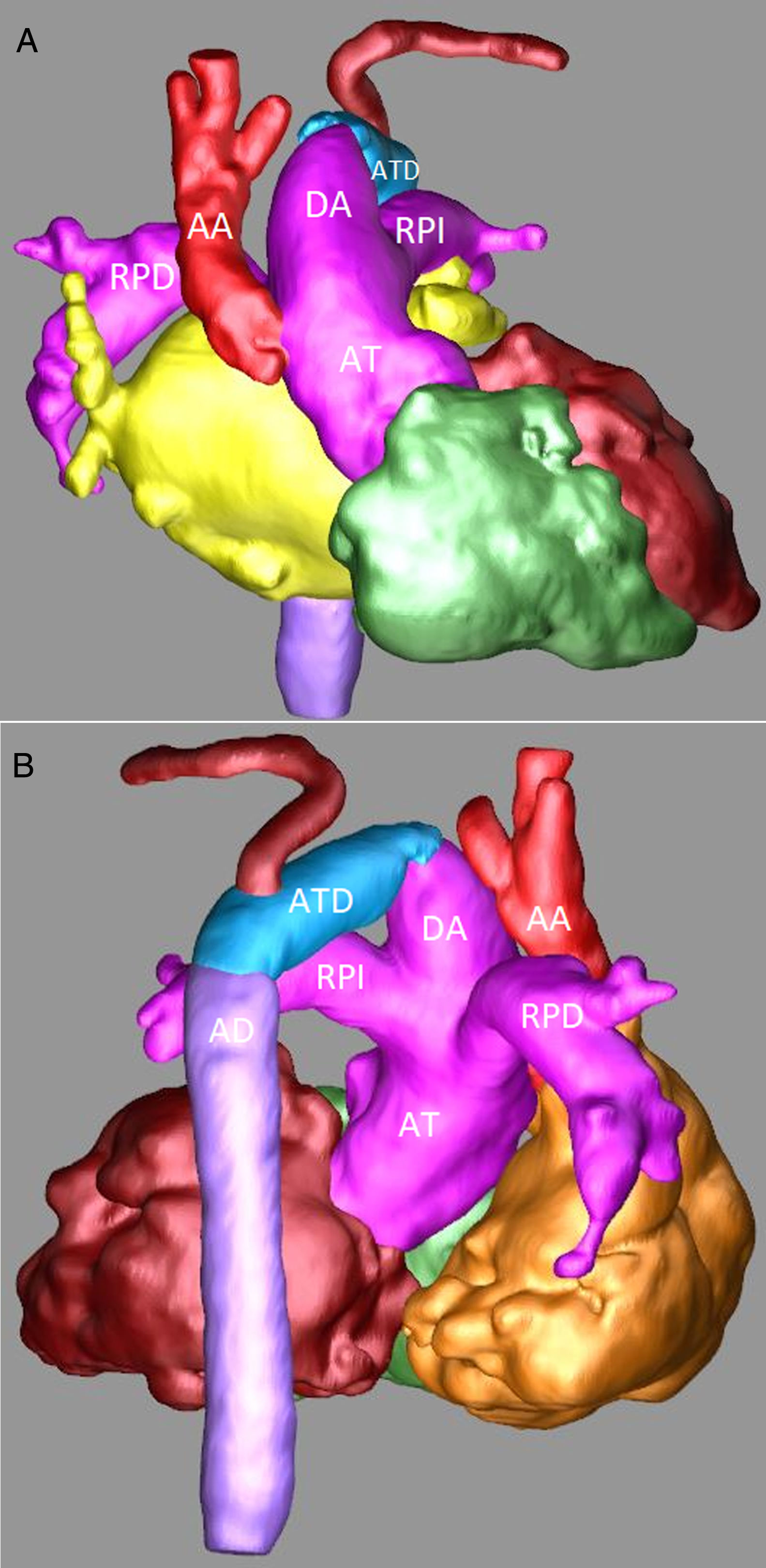
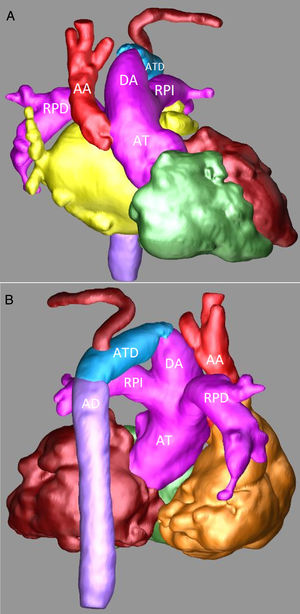
Sospechando de una IAA se realizó una angiotomografía en la que se confirmó el diagnóstico. Se observaba una AT de 12mm de donde nacía un gran tronco arterial pulmonar común (11mm) y una aorta ascendente de 7mm. Las ramas pulmonares bilaterales tenían un adecuado tamaño (5-6mm). El arco aórtico se encontraba interrumpido entre la carótida común izquierda y la arteria subclavia izquierda (figs. 2A y B).
Angiotomografía: A) Reconstrucción tridimensional, proyección anterior en la que se observa de forma detalla la AT, el gran DA, una pequeña AA y la IAA. B) Reconstrucción tridimensional, proyección posterior en la que se observan la continuidad del DA con el ATD y la AD.
AA: aorta ascendente. AD: aorta descendente. AT: arteria truncal. ATD: arco transverso distal. DA: ductus arterioso. RPD: rama pulmonar derecha. RPI: rama pulmonar izquierda.
Dado que el flujo de la aorta torácica descendente dependía de la permeabilidad del ductus arterioso se inició y mantuvo una perfusión de prostaglandinas hasta la corrección quirúrgica, realizada a los 7 días de vida.
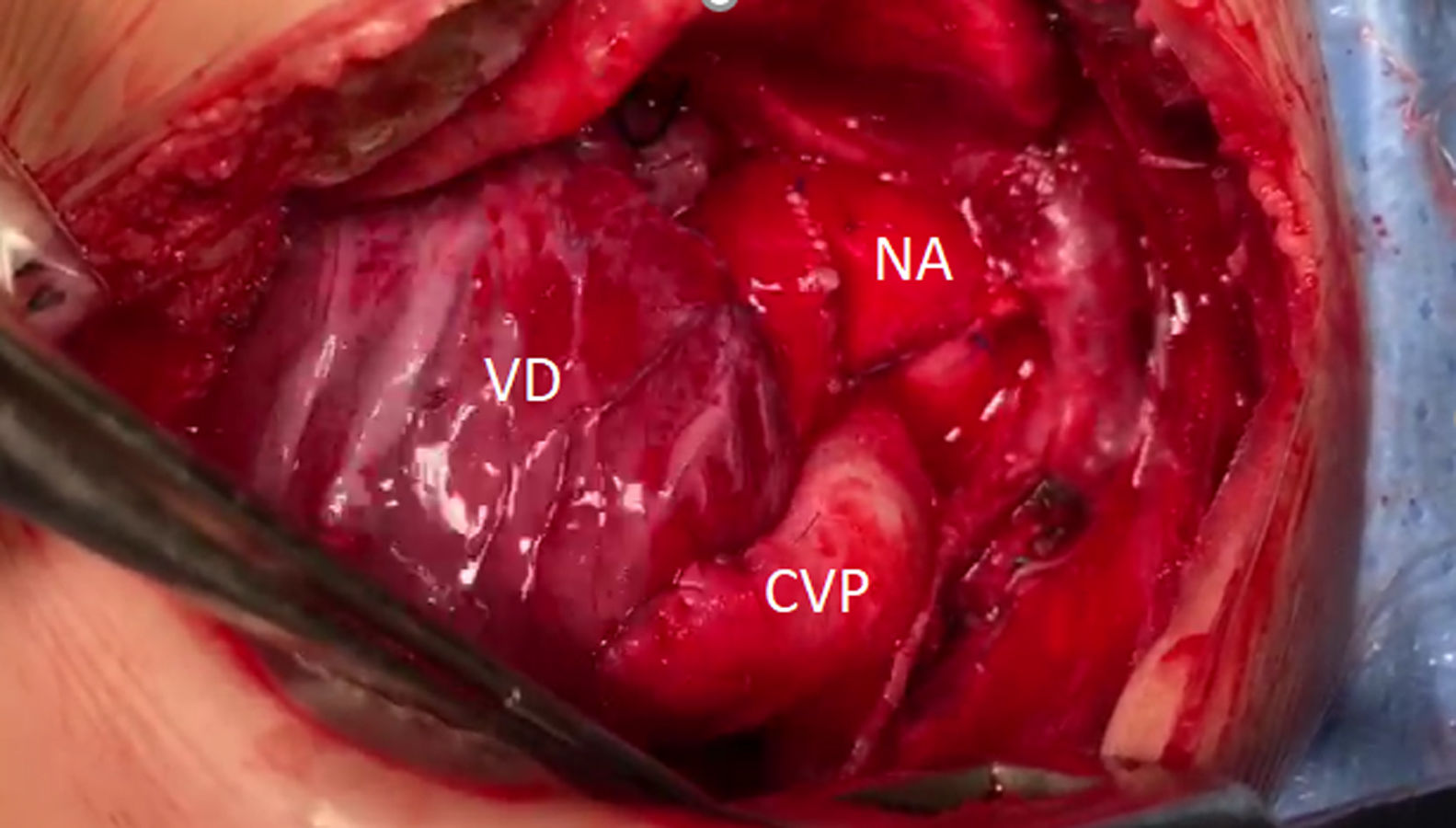
Técnica quirúrgicaLa reparación quirúrgica se realizó mediante esternotomía media, con circulación extracorpórea (CEC), hipotermia profunda y parada circulatoria. Una vez expuesta la cavidad pericárdica se movilizó ampliamente la arteria truncal (AT), aorta ascendente, arco aórtico, aorta torácica descendente proximal, ductus arterioso, tronco y arterias pulmonares hasta sus respectivos hilios. Los troncos supraaórticos fueron movilizados y controlados mediante torniquetes. La canulación arterial se realizó en la AT a nivel de las comisuras. El drenaje venoso se realizó mediante 2 cánulas. Se ocluyeron las arterias pulmonares bilaterales y se inició la CEC manteniendo flujo al hemicuerpo inferior a través del ductus arterioso. Una vez en hipotermia profunda se administró cardioplejía anterógrada hemática intermitente (cada 20min) y se ligó el ductus arterioso. Luego de movilizar proximalmente el istmo aórtico y aorta torácica descendente se ocluyó la misma con un clamp vascular curvo. Se resecó todo el tejido ductal del arco transverso distal. Los troncos supraaórticos se ocluyeron y se suspendió la asistencia circulatoria. Se realizó una incisión en la cara posterolateral izquierda de la aorta ascendente adecuando la arteriotomía al tamaño del arco transverso distal. Mediante una anastomosis término-lateral se reconstruyó el arco aórtico. Se identificó la distribución epicárdica de las arterias coronarias en la superficie del ventrículo derecho. A través del muñón del tronco pulmonar en la AT y a través de la válvula truncal utilizando un disector de ángulo recto se eligió y marcó el sitio para la ventriculotomía derecha, recordando que esta se encontrará a la derecha de la arteria descendente anterior y evitando las arterias conales mayores. Mediante una sutura continua en 2 planos se cerró el muñón del tronco pulmonar en la AT poniendo especial atención en no distorsionar la válvula truncal. Se reinició la asistencia circulatoria. Se finalizó la ventriculotomía derecha resecando el exceso de miocardio y asegurando una vía de flujo libre. Posteriormente se realizó el cierre de la CIV a través de la ventriculotomía derecha utilizando un parche elíptico de pericardio heterólogo. La sutura correspondiente al borde inferior y posterior del defecto septal se mantuvo a la derecha del septo muscular para evitar lesiones sobre el sistema de conducción. La sutura correspondiente al borde superior y anterior se apoyó sobre todo el espesor de la cara anterior del ventrículo derecho y epicardio. Finalmente se creó la continuidad ventrículo-pulmonar utilizando un xenoinjerto valvulado yugular bovino (Contegra®) de 12mm. Para evitar una obstrucción en la anastomosis proximal se realizó la misma a 5mm aproximadamente de la válvula del conducto. Finalmente, mediante una anastomosis del conducto valvulado a la bifurcación de las ramas pulmonares evitando el exceso de longitud del conducto y así el riesgo de acodamiento se finalizó la continuidad ventrículo-pulmonar.
Una vez recuperada la temperatura la salida de CEC se produjo sin eventualidades y en ritmo sinusal. La cirugía se realizó con un tiempo de isquemia de 85min, parada circulatoria de 21min y CEC de 133min (fig. 3).
Al terminar la intervención quirúrgica el paciente fue trasladado a la unidad de cuidados intensivos neonatales. Cuarenta y ocho horas después de la intervención quirúrgica se extubó el paciente sin incidencias y al 3er día del postoperatorio se suspendieron inotrópicos y vasopresores. Al 7mo día del postoperatorio se trasladó a la sala de hospitalización neonatal general donde fue dado de alta al mes de vida.
ConclusionesDesde aquella primera corrección quirúrgica realizada en 1962, la supervivencia de los pacientes con TA ha mejorado considerablemente. En 1997 el Departamento de Cirugía Cardíaca Pediátrica de la Universidad de San Francisco reportaba una supervivencia del 90% a 5 años, del 85% a 10 años y del 83% a 15 años1. Posteriormente otros reportes han publicado supervivencias del 74% a 30 años4.
En contraposición, la escasa evidencia publicada respecto a la evolución postoperatoria de pacientes con TA en combinación con IAA revela peores resultados de supervivencia a corto, mediano y largo plazo respecto a los casos con TA aislado. Konstantinov et al. publicaron una mortalidad del 44, 39 y 31% a 6 meses, un año y 10 años, respectivamente en un estudio retrospectivo multicéntrico en el que se incluyeron 50 neonatos desde el año 1987 hasta el año 1997. En el análisis multivariable identificaron la prematuridad, el bajo peso al nacer, el género femenino, la IAA tipo B o C, TA tipo III y la insuficiencia de la válvula truncal como factores independientes de riesgo de mortalidad en su cohorte6.
Sabemos que el TA en combinación con IAA es una cardiopatía de elevado riesgo y complejidad, sin embargo, consideramos que 3 aspectos fundamentales van a permitir mejorar la supervivencia en estos pacientes: la precisión del diagnóstico prenatal, el perfeccionamiento de la técnica quirúrgica y un manejo preoperatorio y postoperatorio adecuado.
El diagnóstico prenatal es un verdadero reto. La existencia de 4 cámaras cardiacas normales se presta a que pase desapercibido, disminuyendo la probabilidad de que la gestante y el neonato reciban asistencia sanitaria especializada3.
La precisión diagnóstica mediante ecocardiografía fetal reportada para los defectos cono-truncales varía entre el 75-90%. Estas mismas series reportan una tasa de aborto del 40%2.
Un diagnóstico prenatal preciso permitirá al equipo médico diseñar una estrategia terapéutica a medida para cada paciente. Como es lógico es también de trascendental importancia para el consejo prenatal.
El manejo posnatal-prequirúrgico tendrá como objetivo estabilizar y mantener la circulación sistémica y pulmonar, es decir, la estabilidad clínica dependerá de un delicado equilibrio entre el flujo a través del DA y las resistencias vasculares pulmonares (RVP).
La circulación sistémica luego del punto de interrupción del arco aórtico (IAA) dependerá de la permeabilidad del DA, mientras que el flujo pulmonar dependerá de las RVP. Las elevadas RVP al nacimiento favorecerán el flujo a través del DA y limitarán las posibilidades de congestión pulmonar por hiperaflujo.
Luego del nacimiento de forma paulatina, las RVP descenderán y el ductus arterioso podría disminuir su calibre. El deterioro clínico se producirá por hiperaflujo pulmonar y disminución del flujo sistémico al hemicuerpo inferior. Por ende, en este punto la situación clínica dependerá de las maniobras terapéuticas implementadas para mantener un ductus permeable y un flujo pulmonar controlado.
Conocer los detalles anatómicos permitirá prever el comportamiento hemodinámico con cierta exactitud y planear la estrategia quirúrgica. Por esta razón es de vital importancia descartar malformaciones añadidas. Con este fin, la tomografía computarizada, gracias a su elevada reconstrucción espacial y de contraste, permite valorar en conjunto todas las estructuras cardiacas y vasculares a través de reconstrucciones multiplanares y tridimensionales.
La afección del arco aórtico frecuentemente acompaña al TA, entre el 21-36% de los casos presentan arco aórtico derecho, entre el 11-19% interrupción de arco o coartación aórtica y el 3% hipoplasia del arco aórtico5.
En nuestro centro en caso de coartación aórtica añadida, preferimos resolver la misma antes de la corrección completa en un primer tiempo quirúrgico y a través de toracotomía izquierda. Esto permite disminuir los tiempos de isquemia, CEC y elimina la necesidad de parada circulatoria. En caso de requerir parada circulatoria el uso de perfusión cerebral anterógrada dependerá de la complejidad de la reparación del arco aórtico y la preferencia del cirujano. En caso de que se decida su uso, nuestra estrategia consiste en la anastomosis de una prótesis de politetrafluoroetileno (PTFE) habitualmente sobre el tronco braquicefálico. La perfusión arterial sistémica y cerebral anterógrada selectiva se realizará a través de este conducto.
Las malformaciones en la circulación coronaria son frecuentes. Conocer la existencia de estas permite reducir el riesgo de lesiones durante la cirugía, planear la mejor estrategia de protección miocárdica y abordarlas quirúrgicamente en caso de ser necesario.
Conocer la competencia de la válvula truncal es de gran importancia. La insuficiencia de la misma puede precipitar el fallo cardiaco por isquemia miocárdica. La isquemia se produce en este caso por disminución marcada de la presión diastólica en la raíz de la AT. Esta isquemia puede generar especial daño a un ventrículo con grandes necesidades metabólicos por la precarga incrementada característica de esta afección.
Las características y detalles que consideramos más relevantes de la técnica quirúrgica se encuentran descritos en el apartado correspondiente en este reporte.
Durante el seguimiento posquirúrgico, se deberá hacer especial hincapié en el estudio detallado de la continuidad ventrículo-pulmonar, el tamaño y desarrollo de las arterias pulmonares, el comportamiento de la válvula truncal, la motilidad bi-ventricular y el desarrollo del arco aórtico. Las causas más frecuentes de necesidad de reintervención quirúrgica son la obstrucción en el injerto usado para reconstruir la continuidad ventrículo-pulmonar, la insuficiencia valvular truncal y la re-estenosis del arco aórtico.
Como toda afección quirúrgica en las CC, solo el perfeccionamiento de cada una de las etapas descritas conducirá al éxito terapéutico.