El trasplante cardiaco es una terapia bien establecida para el tratamiento de la insuficiencia cardiaca terminal en pacientes pediátricos. Sin embargo, los niños pequeños presentan un mayor riesgo de muerte en lista de espera. Tradicionalmente, la extracorpórea con membrana de oxigenación (ECMO) ha sido la estrategia predominante de soporte en niños como puente a trasplante, pero su uso presenta limitaciones debido al elevado riesgo de complicaciones y mortalidad. Los dispositivos de asistencia ventricular han demostrado ser un puente efectivo a trasplante, con mejores resultados comparados con la ECMO. Los pacientes más pequeños (<10kg y, especialmente, los < 5kg) tienen el mayor riesgo de complicaciones severas y mortalidad durante la asistencia ventricular. Actualmente el único sistema de asistencia ventricular disponible para neonatos es el Berlin Heart EXCOR. Presentamos nuestra experiencia en 2 neonatos con miocardiopatía dilatada y afectación biventricular. Solo el paciente con asistencia aislada de ventrículo izquierdo presentó evolución favorable. En conclusión, el Berlin Heart EXCOR ofrece la posibilidad de asistencia ventricular como puente a trasplante en el periodo neonatal. En nuestra experiencia, el soporte aislado del ventrículo izquierdo, presentó menor dificultad técnica y menos morbi-mortalidad.
Cardiac transplantation is a well-established therapy for the treatment of end-stage heart failure in pediatric patients. However, young children have an increased risk of death on the waiting list. Traditionally, extracorporeal membrane oxygenation (ECMO) has been the predominant support strategy in children as a bridge to transplant, but its use has limitations due to the high risk of complications and mortality. Ventricular assist devices have proven to be an effective bridge to transplantation, with better results compared to ECMO. Smaller patients (<10kg and, especially, <5kg) have the highest risk of severe complications and mortality during ventricular assist. Currently, the only ventricular assist system available for newborns is the Berlin Heart EXCOR. We report our experience in 2 neonates with dilated cardiomyopathy and biventricular involvement. Only the patient with isolated left ventricle assistance had favorable outcome. In conclusion, the Berlin Heart EXCOR offers the possibility of ventricular assistance as a bridge to transplant in the neonatal period. In our experience, the isolated left ventricle support presented less technical difficulty and less morbi-mortality.
El trasplante cardiaco es el único tratamiento viable, a largo plazo, para los pacientes pediátricos en situación de fallo cardiaco terminal. Sin embargo, la escasez de donantes condiciona una elevada mortalidad durante el tiempo en lista de espera1. La ECMO ha demostrado ser un tratamiento efectivo como soporte circulatorio a corto plazo. No obstante, varios estudios han demostrado una mayor mortalidad, tanto pre como post-trasplante, de los pacientes asistidos con ECMO, comparada con los pacientes sin asistencia o asistidos con dispositivos de asistencia ventricular (VADs)2,3. El primer dispositivo de asistencia ventricular aprobado en pacientes pediátricos, y el más frecuentemente empleado, es el Berlin Heart EXCOR (BH). En la actualidad es el único dispositivo disponible para neonatos y lactantes pequeños. Existen pocas publicaciones respecto a los resultados de los sistemas de soporte ventricular en pacientes pediátricos y la información disponible es muy escasa en el grupo de neonatos.
Presentamos nuestra experiencia en asistencia ventricular neonatal con el sistema Berlin Heart EXCOR, como puente a trasplante cardiaco, en 2 pacientes con miocardiopatía dilatada y disfunción biventricular.
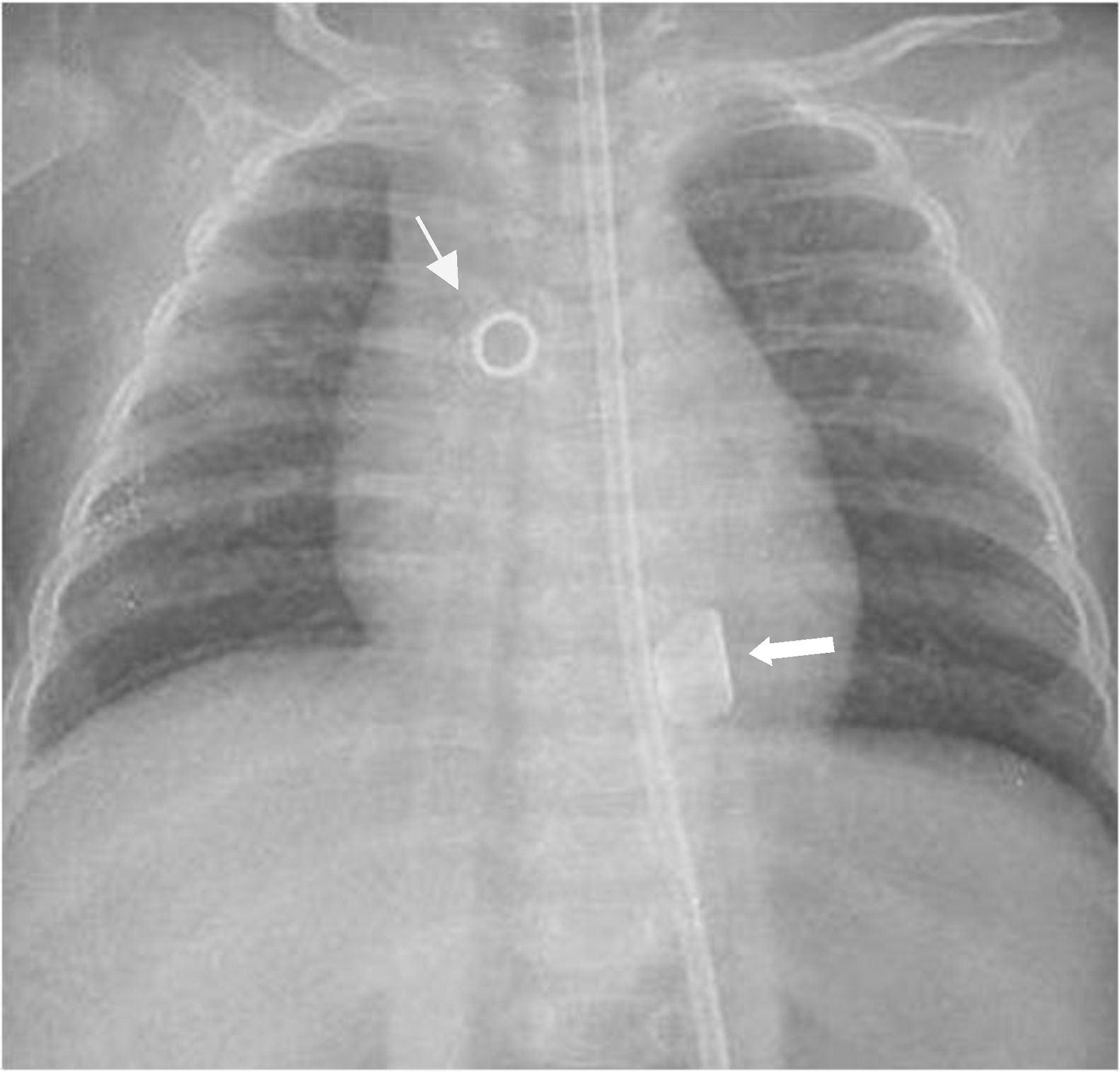
Caso 1Paciente de 7 días de vida (3 Kg de peso) que ingresa en neonatología por shock cardiogénico, precisando ventilación mecánica y drogas vasoactivas. Ecocardiograma: cavidades dilatadas con disfunción biventricular severa (FEVI de 30%, TAPSE de 5mm). Por ausencia de mejoría, con imposibilidad de retirar soporte inotrópico ni respiratorio, se decide implante de asistencia tipo Berlin Heart EXCOR como puente a recuperación/trasplante cardiaco. Tras el implante del dispositivo ventricular izquierdo (10ml) se valora, intraoperatoriamente, mediante parámetros ecográficos y hemodinámicos, la adecuada función del ventrículo derecho con soporte inotrópico. Procedimiento quirúrgico sin complicaciones técnicas, con canulación de ápex y aorta ascendente. La cánula aórtica se modificó, mediante la extensión de la misma con una prótesis de poliéster, para facilitar su sutura a la aorta. La figura 1 muestra la imagen radiológica post-operatoria, donde se aprecia la colocación de la cánula apical y aórtica. Tendencia a hipertensión en postoperatorio inmediato que se controla con vasodilatadores y ajustando los parámetros del dispositivo para un llenado incompleto. Disfunción moderada de ventrículo derecho que mejora progresivamente con empleo de óxido nítrico + diuréticos + milrinona. Retirada de ventilación mecánica en el 7° día post-implante. Mejoría progresiva de la función de ventrículo derecho. Anticoagulación con heparina de bajo peso molecular + doble antiagregación (dipiridamol/clopidogrel + AAS). Episodio transitorio de monoparesia de miembro superior derecho con sospecha de origen embólico (no se realiza TAC craneal). Trasplante cardiaco sin incidencias tras 140 días de asistencia ventricular.
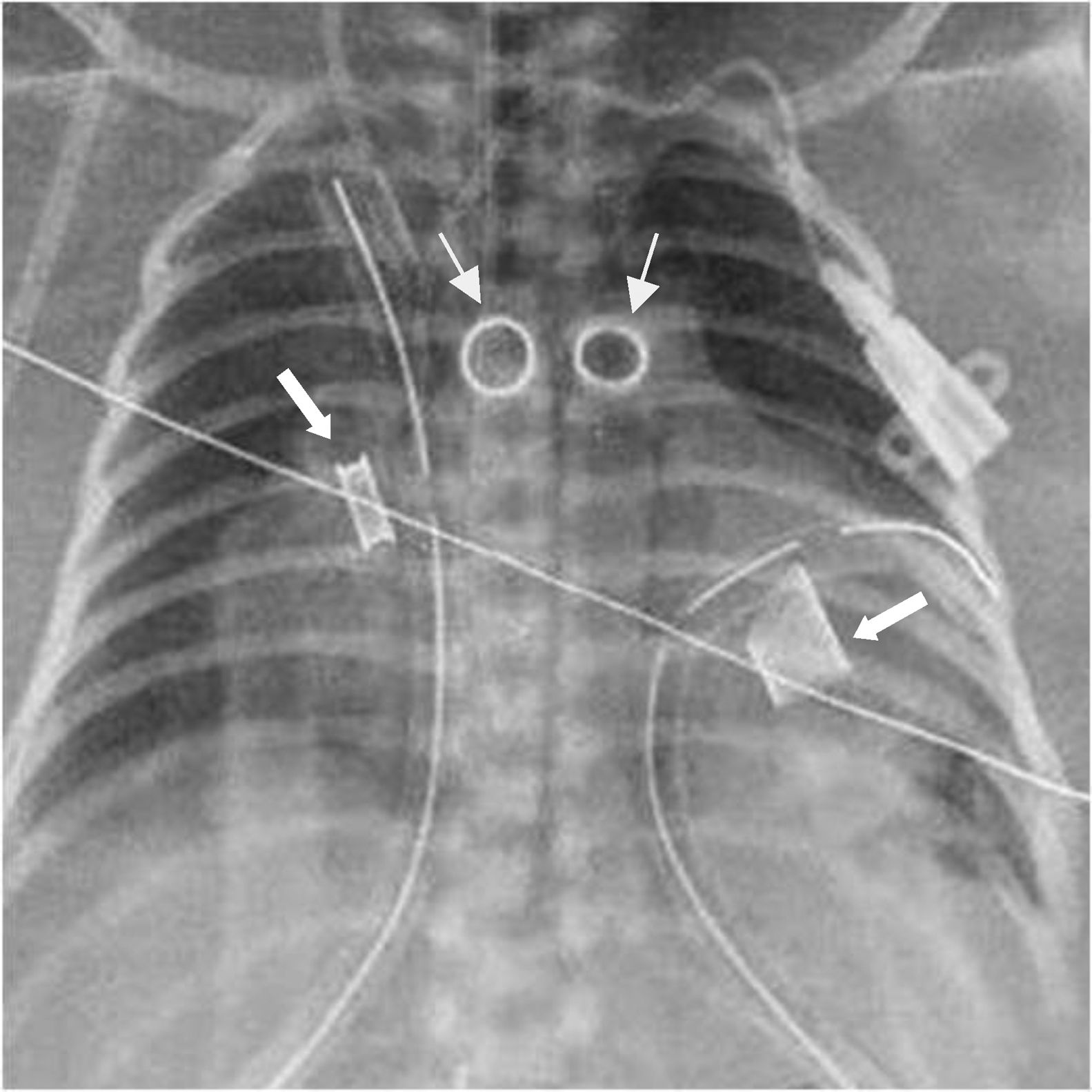
Caso 2Recién nacido (3’5 Kg de peso) con diagnóstico fetal de miocardiopatía dilatada congénita familiar (3 abortos previos por hidrops fetal). Disfunción biventricular severa en ecocardiograma. Intubación desde el nacimiento con necesidad de soporte inotrópico progresivo (levosimendan + dopamina + noradrenalina). Empeoramiento de la insuficiencia cardiaca con oliguria, sin respuesta a diuréticos, y edemas. Se realiza implante de Berrlin Heart EXCOR biventricular (10ml/10ml), a los 14 días de vida, como puente a trasplante. La decisión de asistencia biventricular se tomó preoperatoriamente. Dificultad técnica para el implante de las cánulas, especialmente las arteriales “modificadas”, por problema de espacio; precisando CEC prolongada con coagulopatía severa y sangrado postoperatorio importante. La figura 2 muestra la disposición de las 4 cánulas. Mala situación hemodinámica con llenado inadecuado del dispositivo izquierdo. Precisó reintervención por taponamiento y hemotorax. Evolución a fracaso multiorgánico, con evidencia de daño neurológico severo isquémico, por lo que se decide interrumpir la asistencia al 4° día post-implante. En el estudio genético realizado aparece mutación pHis 103Tyr del gen ACTC1.
DiscusiónLa asistencia circulatoria en neonatos y lactantes pequeños continúa siendo un gran reto. A los problemas técnicos que supone la miniaturización de los dispositivos, se añade el reducido número de casos, lo que hace que sea poco atractivo para la industria. Actualmente, aparte de la ECMO, solo el Berlin Heart EXCOR cuenta con aprobación de la FDA para este grupo de pacientes. Para promover el desarrollo de nuevos dispositivos surgió el programa “PumpKIN”. De los diversos dispositivos ensayados, el sistema Jarvik ha sido el que más ha avanzado. El primer modelo (pediatric Jarvik 2000 infant size) presentaba excesivos problemas de hemólisis. El posterior Jarvik 2015ha solucionado esta complicación, pero solo está aceptado (IDE) para niños de más de 8 Kg de peso, aunque algunos estudios in vitro sugieren su posible utilización en niños más pequeños4. Esto supone que, actualmente, el BH EXCOR es la mejor alternativa de asistencia circulatoria como puente a trasplante en neonatos, con menor morbi-mortalidad que la ECMO2,3.
Los pacientes más pequeños (< 10kg) tienen mayor riesgo de complicaciones severas y mortalidad durante la asistencia con BH5,6. En el estudio multicéntrico de Conway et al se demuestra una menor supervivencia de los pacientes < 10kg, respecto al resto del grupo pediátrico. Como factores de riesgo independientes de mortalidad aparecen la existencia de cardiopatía congénita y los niveles elevados de bilirrubina preimplante. Los resultados son aún peores en < 5kg (supervivencia hasta trasplante 27%), siendo el riesgo mayor en casos con ECMO previa o cardiopatía congénita. De hecho, ningún paciente < 5kg con ECMO previa y cardiopatía congénita sobrevive durante la asistencia con BH (0/11)7
En los últimos años, los resultados de pacientes < 10kg, con asistencia tipo BH, han mejorado8,9. No obstante, los pacientes < 5kg, continúan presentando un mayor riesgo9. La menor utilización de ECMO pre implante, y la asistencia aislada de ventrículo izquierdo (LVAD), se asocian con una mayor supervivencia8. Esto coincide con nuestra experiencia, donde solo evolucionó favorablemente el caso con implante univentricular. El grupo de Di Molfetta recomienda limitar la asistencia biventricular (Bi-VAD), en menores de 10kg, a los casos de miocardiopatía restrictiva8. Actualmente, nuestra estrategia es realizar primero el implante del LVAD y, en función de la valoración intraoperatoria, proceder al implante Bi-VAD en caso necesario.
Técnicamente, el implante de un BH en neonatos continua siendo un reto, especialmente en implantes biventriculares, donde el espacio disponible en el pericardio plantea problemas para ubicar las 4 cánulas de la asistencia10. En nuestra experiencia, el caso con asistencia biventricular presentó una dificultad técnica importante, especialmente en el implante de las dos cánulas arteriales, pese a emplear la modificación técnica de extensión de la punta con prótesis de Dacron para suturar en aorta y pulmonar. En este paciente se decidió preoperatoriamente la implantación de una asistencia biventricular, por disfunción muy severa del ventrículo derecho. Al modificar la estrategia, desconocemos si hubiese tolerado el implante de una asistencia aislada de ventrículo izquierdo, como en el primer caso.
Al igual que en otros grupos de edad, la principal complicación, y causa más frecuente de muerte, está relacionada con problemas trombo-embólicos del VAD. Este riesgo parece ser mayor en los pacientes < 10kg, presentando más complicaciones neurológicas y necesidad de recambios del dispositivo8. Nuestro segundo caso presentó daño cerebral isquémico severo, en el contexto de un cuadro de bajo gasto e hipoperfusión cerebral, no atribuible a fenómenos embólicos. En el primer paciente si se produjo un episodio transitorio de monoparesia de miembro superior derecho, con sospecha de causa embólica, aunque no llegó a confirmarse con TAC, ni presentó evidencias de trombos en el dispositivo durante el tiempo de asistencia.
Hemos implantado asistencias tipo Berlin Heart en 13 pacientes pediátricos (11 mayores de 1 año y 2 neonatos), de las cuales 8 fueron biventriculares y 5 ventriculares izquierdas. De estos, 2 pacientes fallecieron durante la asistencia (15%), ambos en el grupo de soporte biventricular; el resto (85%) sobrevivieron hasta ser trasplantados con éxito. En nuestra serie no aparecen diferencias estadísticas, respecto a mortalidad ni complicaciones, entre los 2 neonatos y el resto de pacientes de la serie. Sin embargo, al comparar tan poco número de casos, no se pueden extraer conclusiones.
ConclusionesEn nuestra experiencia, el sistema BH EXCOR ofrece unos resultados aceptables en neonatos que precisan asistencia circulatoria como puente a trasplante, especialmente en casos de asistencia aislada de ventrículo izquierdo. Aunque la modificación del implante de las cánulas arteriales, con extensión mediante una prótesis vascular de poliester, facilita el procedimiento, el tamaño de las cánulas supone una dificultad importante en casos de soporte biventricular. La decisión de implantar una asistencia biventricular debe ser cuidadosamente valorada en este grupo de pacientes.