La realización exitosa de una cirugía combinada de reparación de una cardiopatía congénita y trasplante pulmonar ha sido descrita raramente. Presentamos el caso de un paciente pediátrico con hipertensión pulmonar grave y cardiopatía congénita al que se le realizó un trasplante pulmonar bilateral combinado con corrección de su cardiopatía. Un año tras la cirugía el paciente se encuentra asintomático y en excelente clase funcional. Específicamente nos centramos en describir el protocolo y la técnica quirúrgica empleados en el procedimiento. Hasta donde sabemos, este podría ser el primer caso de estas características realizado con éxito en nuestro medio.
Successful completion of the combined repair of congenital heart disease and lung transplant has been rarely reported. The case is presented of a paediatric patient with severe pulmonary hypertension and congenital heart disease, who had a bilateral lung transplant combined with repair of his congenital heart defect. One year after surgery, the patient is asymptomatic and in excellent functional class. Specifically, focus was made on the surgical protocol and technique used to undertake the procedure. As far as we know, this could be the first case of its kind successfully carried out in our country.
Entre las opciones quirúrgicas de los pacientes con hipertensión pulmonar (HTP) grave asociada con cardiopatía congénita se encuentran el trasplante cardiopulmonar y el trasplante pulmonar (TP) combinado con la corrección de la cardiopatía. El manejo inicial de este tipo de pacientes fue el trasplante cardiopulmonar. Posteriormente y, desde la primera descripción exitosa de corrección de una cardiopatía congénita con TP asociado en 1990 por Fremes et al. en un paciente con una comunicación interauricular (CIA)1, se han comunicado algunos casos en la literatura2-4. No conocemos el caso de ningún paciente de estas características publicado en nuestro país.
Caso clínicoDescribimos un paciente varón de 15 años de edad, con HTP grave y una cardiopatía congénita consistente en anomalías de los drenajes venosos pulmonar y sistémico, con una CIA grande. El paciente había desarrollado HTP e insuficiencia tricuspídea graves de manera rápidamente progresiva. Antes de la intervención, el enfermo estaba en clase funcional IV con dolor torácico en reposo a pesar de triple terapia con sildenafilo oral, bosentán oral y trepostrinil subcutáneo, por lo que se decidió tratamiento quirúrgico.
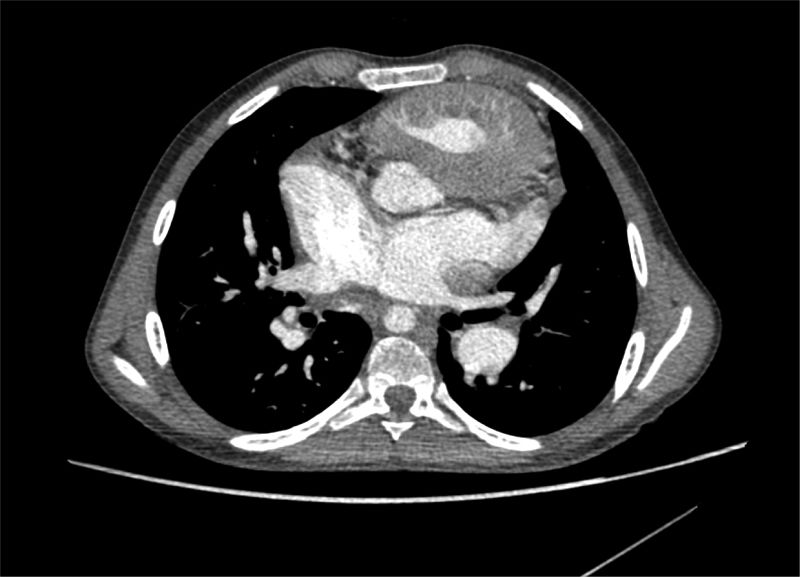
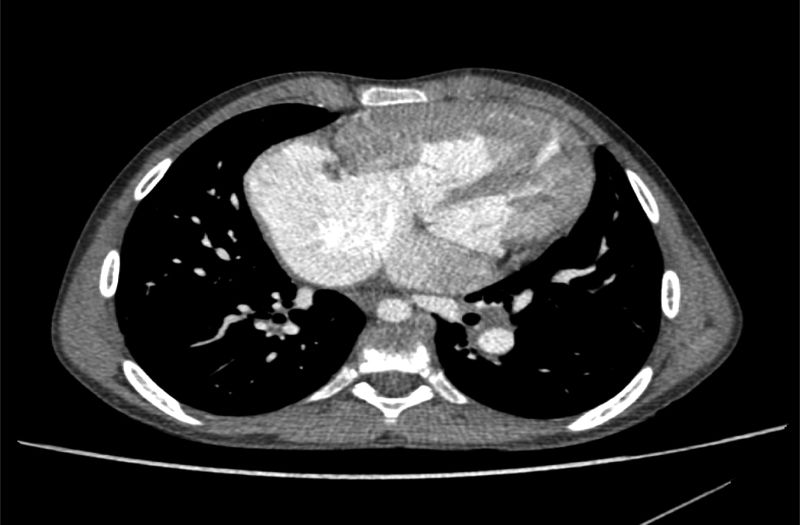
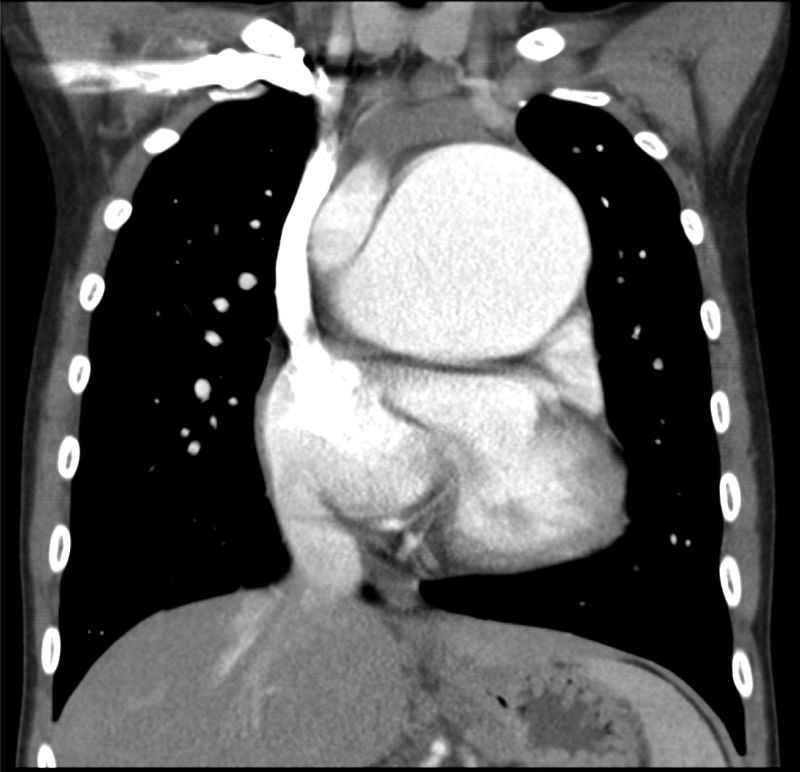
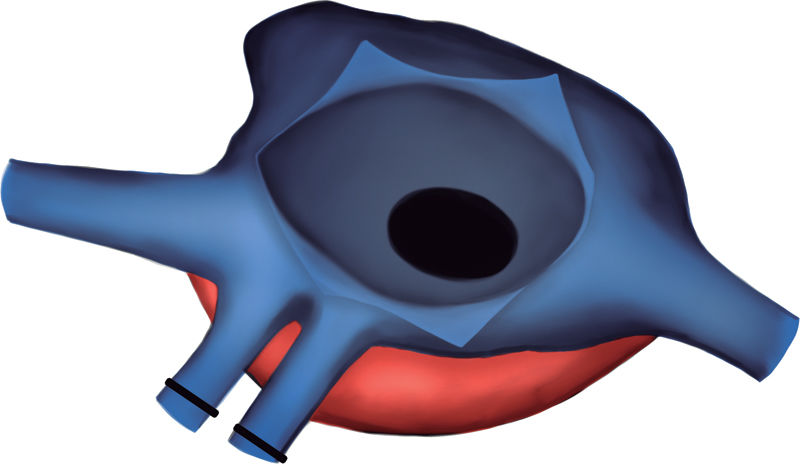
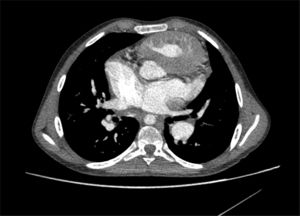
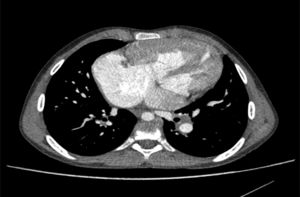
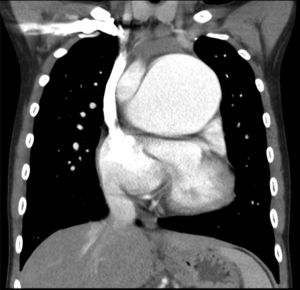
Con respecto a la cardiopatía, nuestro enfermo presentaba una interrupción de la vena cava inferior con continuación a través de la vena ácigos hasta una vena cava superior izquierda que drenaba al seno coronario. Había ausencia del tronco venoso innominado. El drenaje venoso pulmonar derecho completo llegaba a través de 2venas pulmonares a la aurícula derecha (fig. 1). La aurícula derecha estaba dilatada, mientras la aurícula izquierda tenía un tamaño reducido (fig. 2). También se visualizó un aneurisma gigante de más de 8cm de diámetro de la arteria pulmonar que desplazaba y comprimía estructuras vecinas (fig. 3). Finalmente, existía una CIA tipo ostium secundum grande con un cortocircuito derecha-izquierda continuo.
En el cateterismo preoperatorio se confirmaron los hallazgos previos con HTP grave suprasistémica (presión arterial pulmonar media > 90mmHg y resistencia vascular pulmonar de 32 unidades Wood). Además, se objetivó compresión del tronco coronario izquierdo por el aneurisma pulmonar.
Se desarrolló un protocolo quirúrgico específico para planear el procedimiento. El principal objetivo de este protocolo era el de coordinar a los diferentes profesionales sanitarios implicados en el procedimiento y, por tanto, reducir los tiempos de isquemia pulmonar, isquemia cardíaca y circulación extracorpórea (CEC).
Consideraciones quirúrgicasEl trasplante se planteó como un trasplante bipulmonar habitual con apoyo de CEC. Los pasos del procedimiento fueron los siguientes.
- •
Anestesia general con intubación orotraqueal y monitorización con catéter de arteria pulmonar. A pesar de la dificultad que puede entrañar la colocación del catéter de arteria pulmonar en pacientes con insuficiencia tricuspídea e hipertensión pulmonar graves, el procedimiento se realizó sin incidencias.
- •
Incisión «clam-shell».
- •
Canulación habitual de aorta y 3 venas sistémicas de manera independiente (vena cava superior derecha e izquierda y suprahepáticas).
- •
Heparinización sistémica y entrada en CEC.
- •
Disección del hilio pulmonar derecho y pneumonectomía derecha. Preoperatoriomente existía preocupación por la dificultad que podía suponer la existencia de un aneurisma de la arteria pulmonar de más de 8cm para la disección del hilio pulmonar. La entrada en CEC y la descompresión del aneurisma permitieron la movilización amplia del aneurisma y la disección de los hilios pulmonares de manera habitual.
- •
Anastomosis bronquial.
- •
Pinzamiento aórtico y parada cardíaca con cardioplejía anterógrada indirecta.
- •
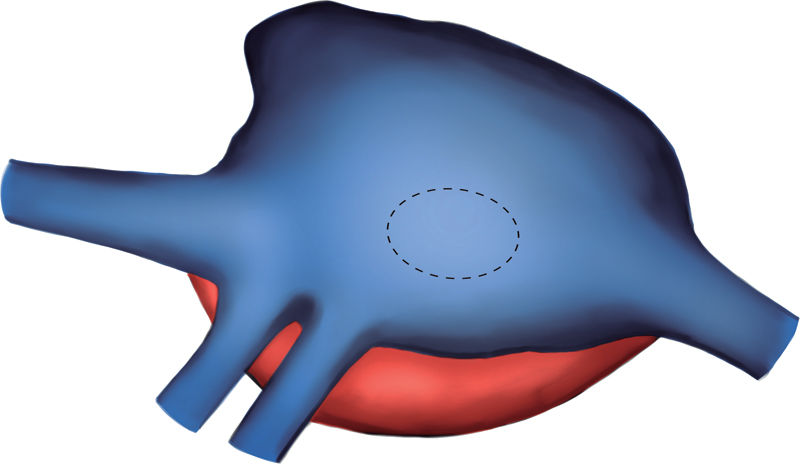
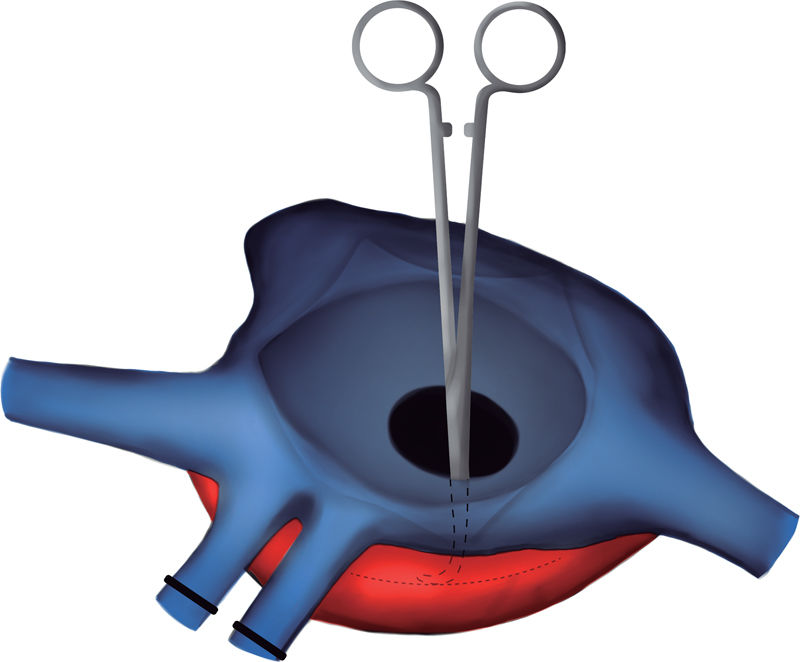
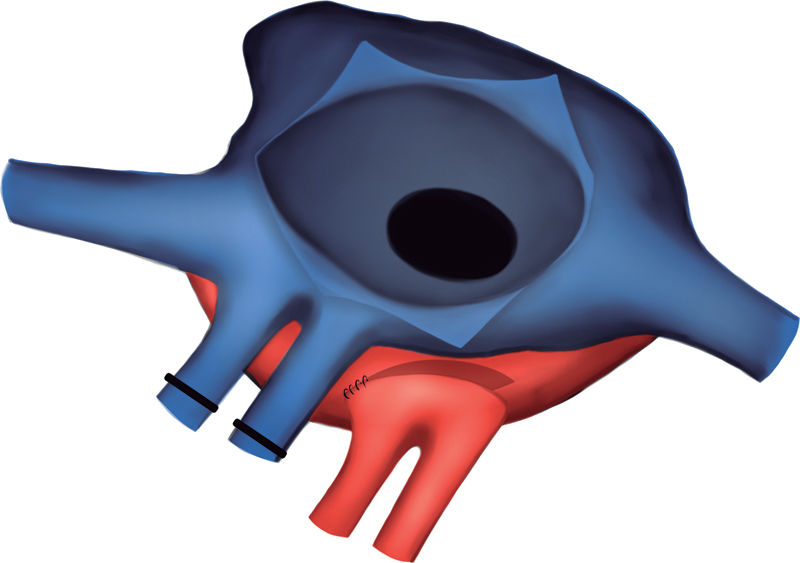
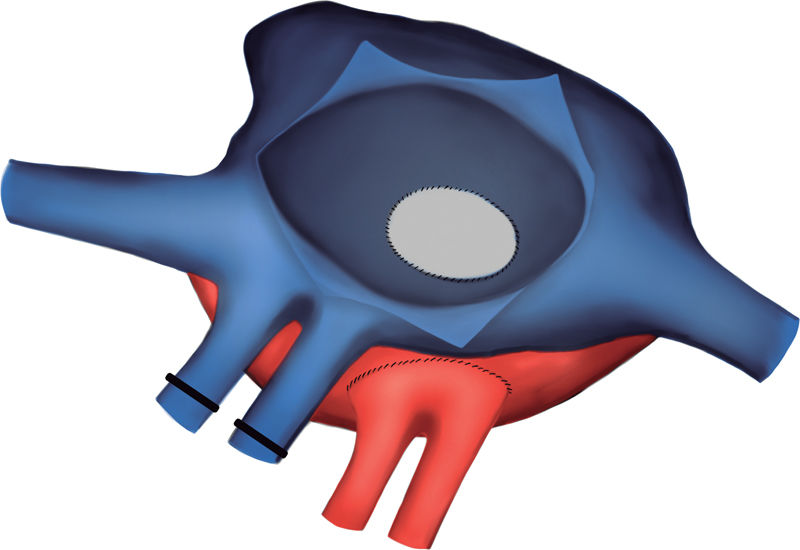
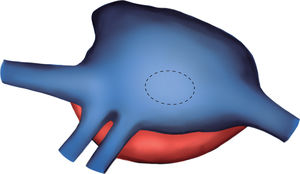
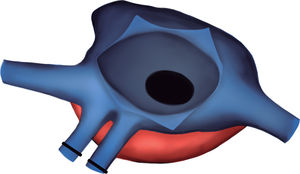
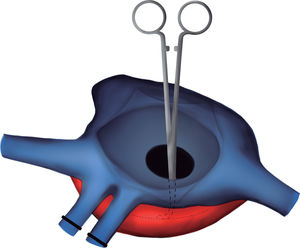
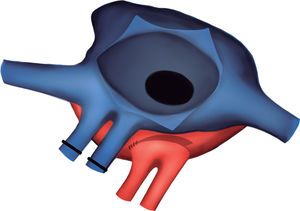
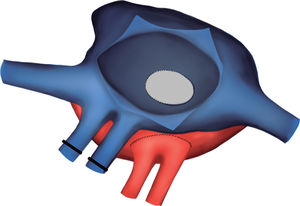
Exclusión de las cánulas venosas. Apertura de la aurícula derecha. A través de la CIA y con un ángulo recto, se localizó la pared lateral de la aurícula izquierda y se realizó una incisión longitudinal en la zona más relacionada con el casquete de las venas pulmonares derechas del donante. De este modo no se utilizaron, como habitualmente, las venas pulmonares derechas del receptor para la anastomosis. Anastomosis abierta entre la aurícula izquierda del receptor y del donante. Los esquemas de la técnica quirúrgica para la corrección de la cardiopatía congénita se pueden ver en las figuras 4-8.
Figura 6.Esquema para localizar la mejor zona de anastomosis del casquete de las venas pulmonares derechas del donante. Se pasa un ángulo recto a través de la comunicación interauricular y se localiza la zona de la aurícula izquierda que se relaciona mejor con las venas del donante (línea punteada).
(0.04MB). - •
Anastomosis entre la rama derecha de la arteria pulmonar del receptor y del donante.
- •
Cierre de CIA y de atriotomía derecha.
- •
Extracción del aire en cavidades cardíacas y despinzamiento de la aorta.
- •
El implante del pulmón izquierdo se hizo como habitualmente, con apoyo de CEC.
- •
No se realizó reducción del aneurisma de la arteria pulmonar.
- •
Salida de CEC y administración de protamina. Hemostasia y cierre.
Se seleccionó a un donante de un centro próximo, con edad y dimensiones similares para optimizar los tiempos de isquemia pulmonar. El procedimiento se realizó según el protocolo descrito. Los tiempos de isquemia pulmonar de los órganos derecho e izquierdo, de isquemia miocárdica y de CEC fueron 275, 365, 45 y 185min, respectivamente. A la salida de CEC se monitorizaron presiones pulmonares con catéter de arteria pulmonar y se decidió iniciar óxido nítrico como único vasodilatador pulmonar. También se hizo un ecocardiograma transesofágico para valorar las anastomosis entre los casquetes de venas pulmonares del donante y la aurícula izquierda del receptor. En las primeras horas hubo compromiso en la oxigenación con saturaciones de O2 bajas (PaFi<100) en las gasometrías arteriales, por lo que se realizaron broncoscopias de limpieza que evacuaron restos hemáticos posquirúrgicos y secreciones retenidas, sin que fuera necesario instaurar soporte respiratorio con ECMO. El postoperatorio inmediato se vio complicado por hemorragia significativa, que requirió de transfusión de hemoderivados para su control. Posteriormente requirió de intubación prolongada por delirio postoperatorio y crisis comiciales, con pruebas de imagen cerebral normales, relacionadas con niveles de tacrolimus supraterapéuticos. Finalmente se realizó traqueotomía en el día postoperatorio 12. La evolución posterior transcurrió sin incidencias; se pudo retirar 5 días después el soporte ventilatorio mecánico y después la cánula de traqueotomía; fue dado de alta a su domicilio 30 días tras la cirugía.
Tras un año de seguimiento, el paciente se encuentra asintomático, en clase de la NYHA I y con saturaciones de 96-97%. En la ecocardiografía se observan HTP e insuficiencia tricuspídea leves con buena función biventricular y sin defectos residuales significativos. En la espirometría presenta una capacidad vital forzada de 3,73 (71%), un volumen espiratorio forzado de 1,96 (62%) y un índice de 71.
DiscusiónLos artículos en la literatura sobre cirugía combinada de TP y corrección de la cardiopatía congénita son excepcionales y se reducen a pequeñas series o casos clínicos. La serie más larga descrita hasta la fecha es la del grupo de Saint Louis en Estados Unidos5. En una revisión de 2005 sobre una experiencia acumulada de 13 años, los autores describen 35 pacientes pediátricos que recibieron esta cirugía, aunque, a diferencia de nuestro paciente, en 13 de ellos la cardiopatía congénita fue reparada antes del TP. Las cardiopatías congénitas más frecuentes fueron comunicación interventricular, obstrucción de venas pulmonares y atresia o estenosis pulmonar. De manera interesante, la edad media en esta serie era de 1,7 años y la presión arterial media y la resistencia vascular pulmonar en su cohorte era de 66 y 21mmHg, respectivamente. Las cifras de HTP de nuestro paciente eran muy superiores, así como la edad, lo que podría indicar que en nuestro medio estos pacientes se mantienen con tratamiento médico, sin remitirlos a un programa de TP con experiencia en cardiopatías congénitas o de trasplante cardiopulmonar. En esta misma serie, 5 pacientes (14,3%) requirieron ECMO postoperatorio, 16 (45,7%) se reexploraron por sangrado, 6 (17,1%) tuvieron complicaciones de la vía aérea y 4 (11,4%) presentaron una parada cardiaca. Finalmente, 9 enfermos (25.7%) fallecieron en el hospital: 5 por fallo del injerto, 2 por hemorragia y 2 por infección; y 10 durante el seguimiento, debido a infección en 5 casos, bronquiolitis obliterante en 3 y malignidad en 2.
La presencia de un retorno pulmonar venoso anómalo complica el TP. En 2013, Belli et al. publicaron el caso de un paciente de 70 años con esta anomalía que recibió un TP izquierdo6. En este enfermo la anomalía se restringía a la vena pulmonar superior izquierda, que drenaba a la vena braquiocefálica. Con una ingeniosa modificación técnica que utilizaba la orejuela izquierda, se consiguió anastomosar el casquete de las venas pulmonares del donante con la aurícula izquierda del receptor, evitando el uso de la CEC. En el caso que presentamos, se decidió no hacer una reparación estándar del drenaje anómalo mediante tunelización con parche de las venas pulmonares anómalas a la aurícula izquierda a través de la CIA por 2 motivos: 1) reducir el tiempo de isquemia miocárdica y pulmonar y de CEC, lo cual era especialmente relevante en un paciente con cambios degenerativos crónicos en ambos ventrículos y para minimizar el riesgo de sangrado postoperatorio y, 2) se evitaba el riesgo de obstrucción del túnel intracardiaco en el contexto de las 3anastomosis que se realizan en el hilio pulmonar y el posicionamiento del nuevo órgano. Con esta técnica la reparación intracardiaca quedó reducida a un cierre de CIA. Las venas anómalas se dejaron grapadas y no participaron en la reparación, de manera similar a como se realiza el TP en pacientes afectos de estenosis congénita de las venas pulmonares. Esta modificación técnica permitió corregir la cardiopatía en nuestro paciente en un tiempo de isquemia miocárdica de 45 min.
En conclusión, el TP combinado con corrección de cardiopatía congénita representa una opción en nuestro medio para pacientes con dichas cardiopatías e HTP refractaria a tratamiento médico. En cualquier caso, es fundamental la selección del donante y la coordinación de los diferentes profesionales sanitarios implicados en la intervención para minimizar los tiempos quirúrgicos, ya que la mortalidad y la morbilidad grave asociadas a este procedimiento siguen siendo elevadas.
Conflicto de interesesNo.
Agradecemos a Dña. Ana L. Teruel Martínez (anateruel.louise@gmail.com) por el trabajo artístico contenido en este artículo.