La cirugía del arco aórtico continúa siendo una de las más desafiantes dentro de la cirugía cardiovascular, debido tanto a su complejidad técnica y táctica como a sus potenciales complicaciones. Al afrontar esta cirugía sin paro circulatorio global, se debe planificar meticulosamente cada uno de los pasos, sobre todo los cambios de las pinzas vasculares.
Se presenta el caso de un hombre de 62 años derivado por shock séptico de origen biliar. En una tomografía computarizada se diagnosticó un aneurisma disecante crónico de aorta ascendente y arco. Un ecocardiograma transesofágico confirmó la disección y objetivó insuficiencia aórtica moderada y disfunción ventricular izquierda severa. Una coronariografía evidenció estenosis significativa de arteria coronaria derecha. Superado su cuadro se planteó la cirugía del arco durante la misma internación.
Plan quirúrgico: reemplazo del arco y aorta ascendente con técnica de «branch-first», de válvula aórtica por prótesis biológica, y bypass venoso a arteria coronaria derecha. El paciente fue dado de alta a los 16 días del postoperatorio.
The surgical approach of the aortic arch, due to its technical and tactical complexity and possible complications, is still one of the most challenging interventions of cardiac surgery. Before facing an aortic arch operation, planning of the movement of clamps is of utmost importance to achieve this surgery with almost no circulatory arrest.
We herein report a 62-year-old man in septic shock with a biliary etiology. A computed tomography diagnosed a chronic aneurysm with dissection of the ascending aorta and the aortic arch. A transesophageal echocardiogram confirmed the dissection and revealed a moderate aortic regurgitation, and a severe left ventricular dysfunction. A coronary angiography showed a significant right coronary artery stenosis. Once the biliary disease was solved, it was planned the surgery for the aorta.
Operative plan: Aortic arch replacement with the branch-first technique, ascending aorta and aortic valve replacement, and a venous bypass to the right coronary artery. The patient was discharged after 16 days.
A pesar de las mejores tasas de sobrevida durante los últimos años, la cirugía del arco aórtico continúa teniendo mayor incidencia de daño neurológico o de otros órganos en comparación con cirugías de aorta ascendente proximal o de raíz aortica (6,7-8,6% vs. <2%)1,2. Sin perfusión cerebral el daño aumenta con relación al tiempo de hipotermia profunda, lo que puede llevar a una reconstrucción técnica insuficiente o a resultados neurológicos subóptimos3. El agregado de perfusión cerebral anterógrada permite un aumento en el tiempo de isquemia segura, con una disminución de la mortalidad operatoria, sin embargo, las lesiones neurológicas temporarias o permanentes no han disminuido. Los resultados postoperatorios reportados demuestran una tasa de disfunción neurológica de entre el 11-28% (accidente cerebrovascular permanente, entre el 8-22%)4. Esto podría estar relacionado con la manipulación de los vasos supraaórticos y con la introducción de cánulas de perfusión, posibilitando embolias de aire o de placas de ateroma5.
En nuestro caso se realizó un reemplazo de arco aórtico según la técnica de «branch-first»3,4.
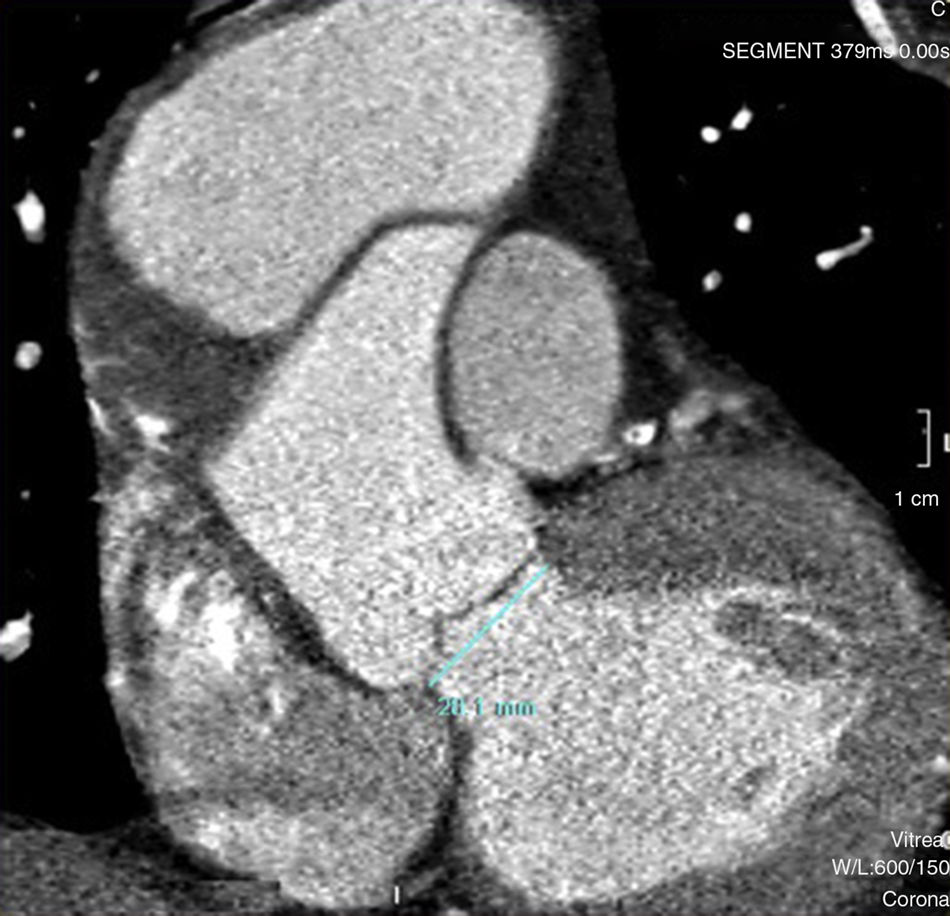
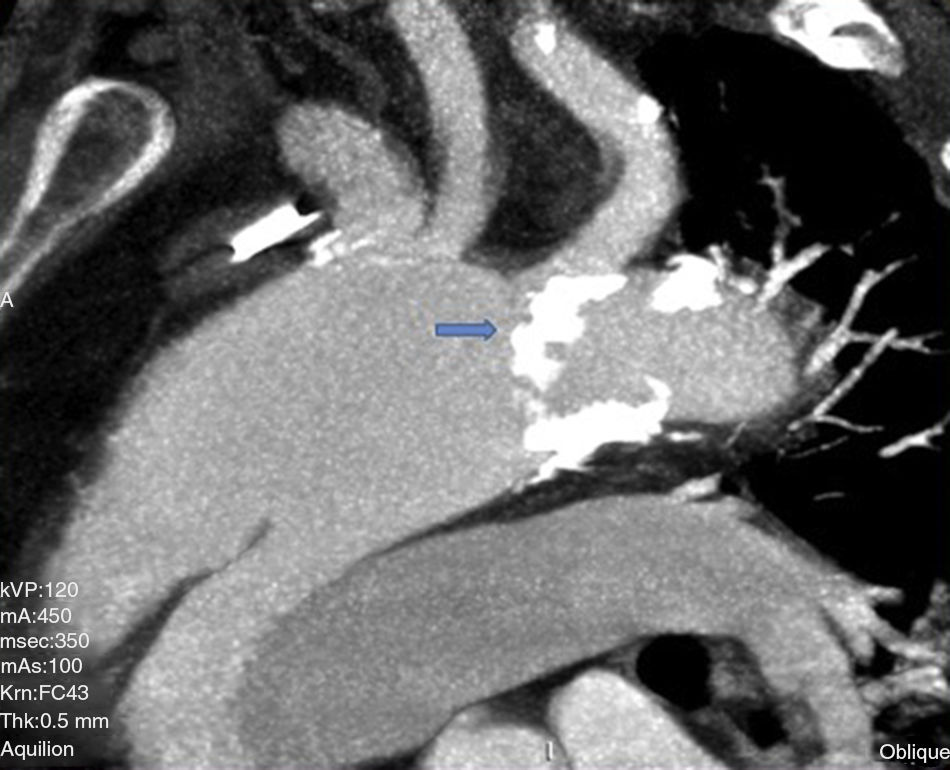
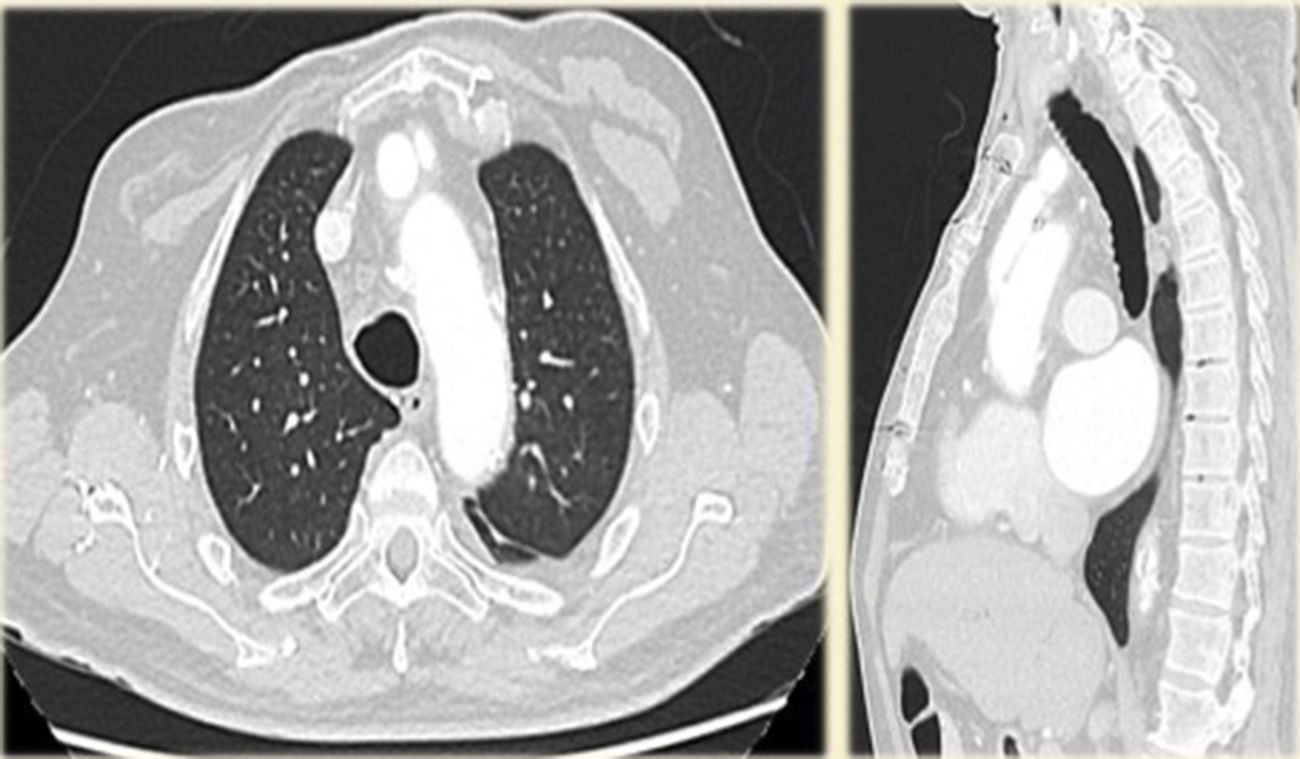
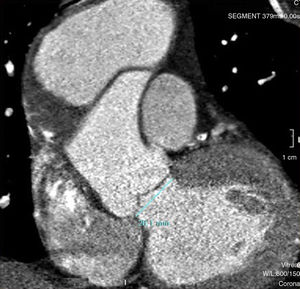
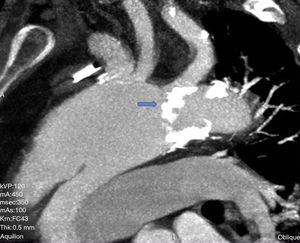
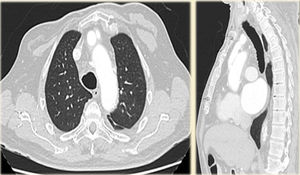
Caso clínicoHombre de 62 años, con antecedentes de hipertensión arterial, fibrilación auricular en tratamiento con anticoagulación oral, y miocardiopatía dilatada de etiología no aclarada, derivado el 31/1/2011. Veinte días previos a su ingreso, estuvo internado en otro hospital por síncope y descenso de hematocrito, descartándose sangrado digestivo. Ingresó a nuestro hospital en asistencia respiratoria mecánica con diagnóstico de colecistitis aguda e insuficiencia cardiaca descompensada. Fue tratado de urgencia mediante drenaje biliar percutáneo. Un ecocardiograma transesofágico (ETE) mostró insuficiencia aórtica moderada y prolapso de valva no coronariana, con disfunción ventricular severa. Una tomografía computarizada (TC) evidenció una disección aórtica crónica tipo A con aneurisma de 6,5cm de diámetro, comenzando a nivel de aorta ascendente y terminando a nivel de una gran placa de calcio próxima al nacimiento de la subclavia izquierda (figs. 1 y 2). Una coronariografía evidenció estenosis significativa de arteria coronaria derecha y estenosis del 50% de una arteria intermedia. Luego de compensar su cuadro biliar se programó la cirugía aórtica (24/2/2011).
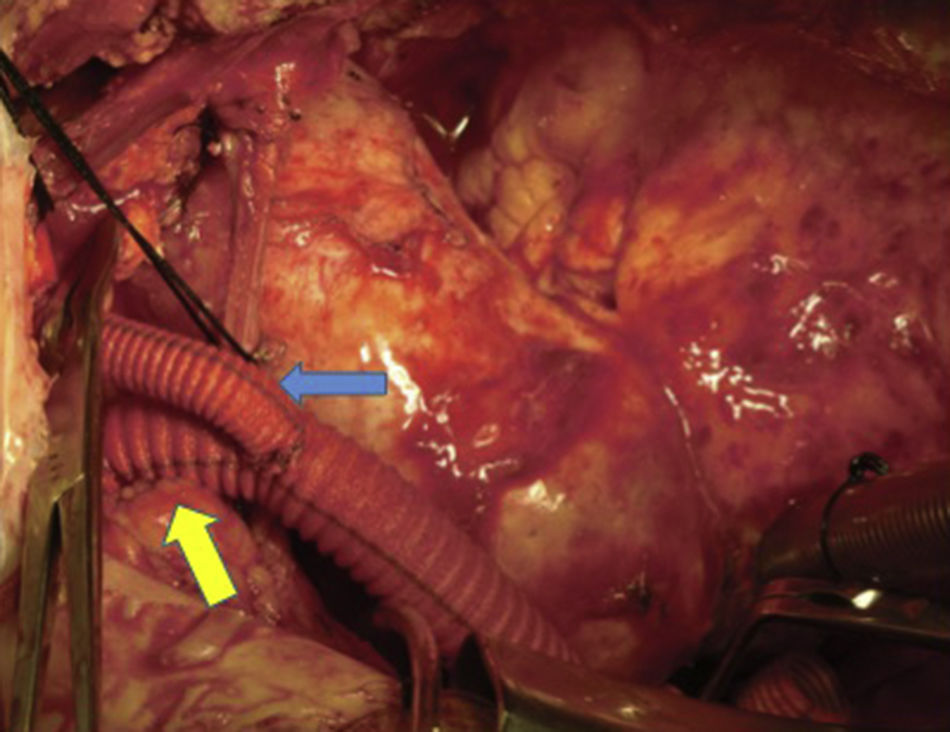
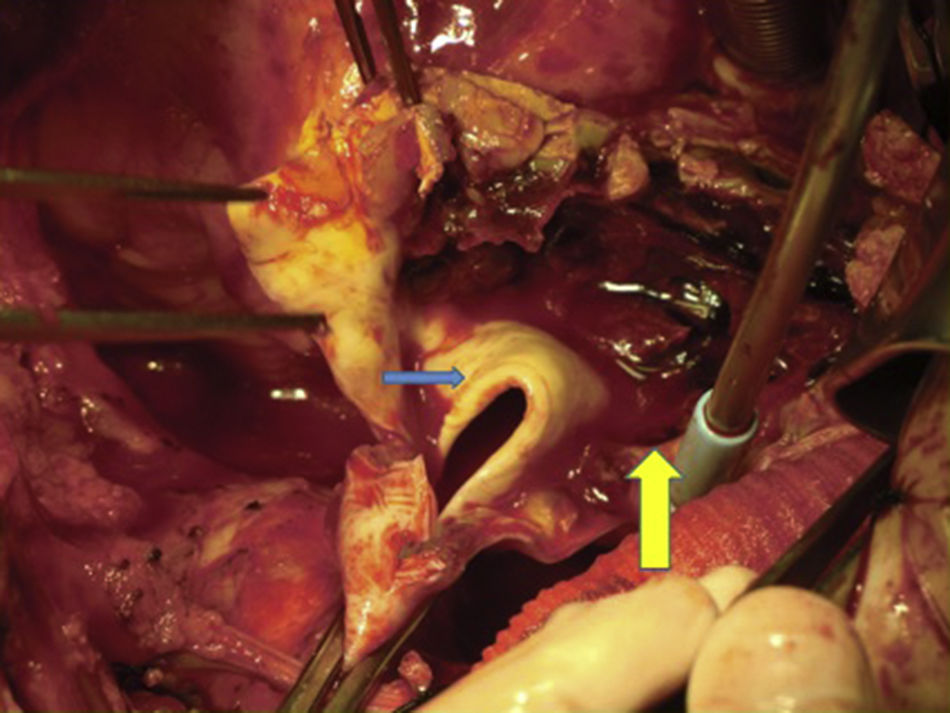
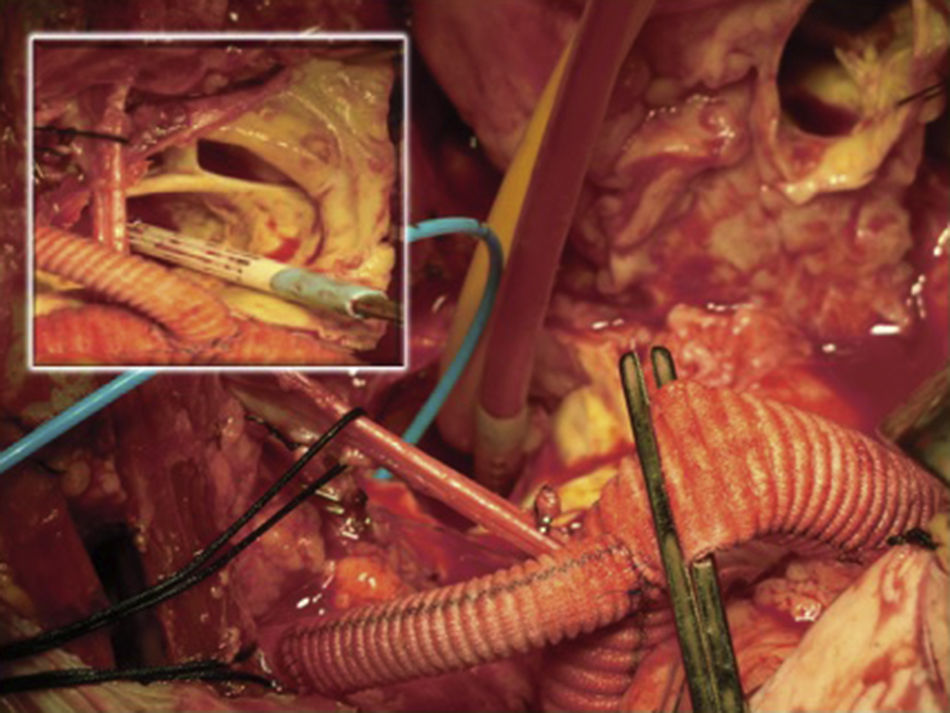
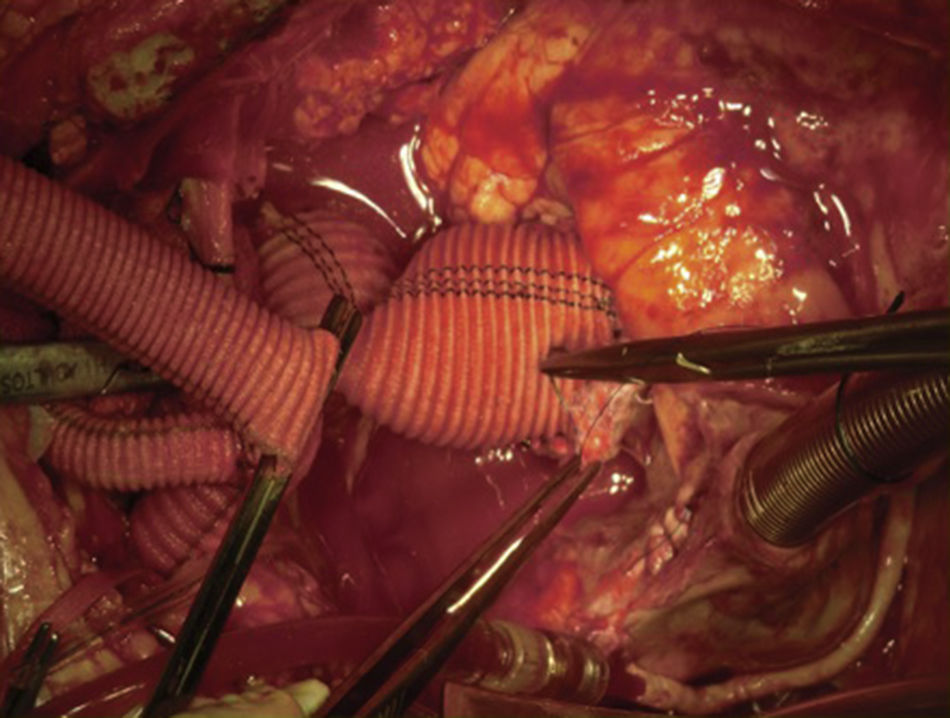
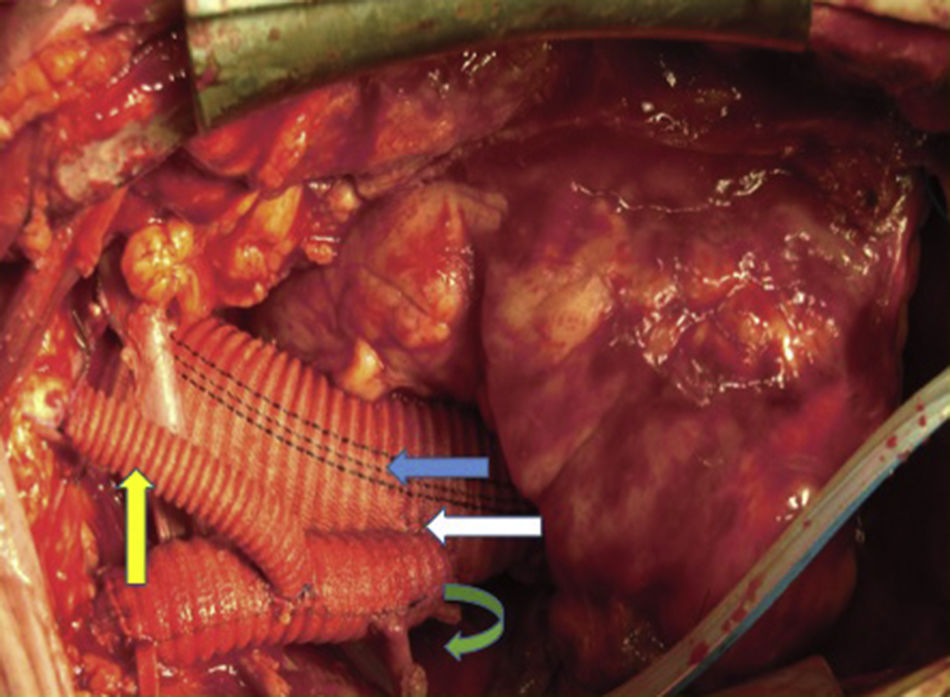
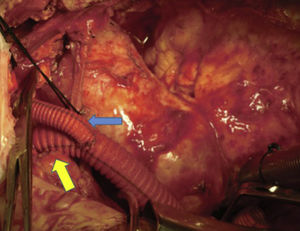
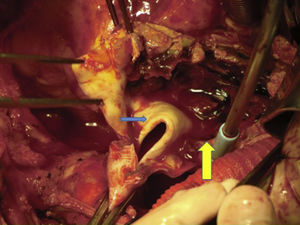
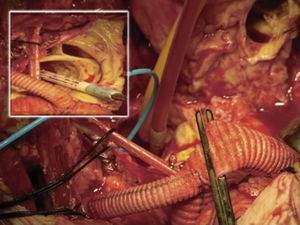
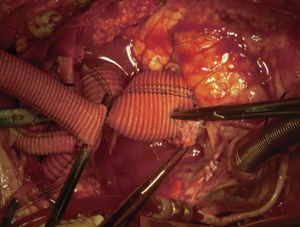
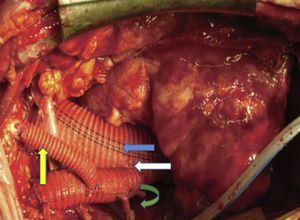
Canulación de arterias femoral común y subclavia derechas, simultáneamente por dos equipos. Esternotomía extendida 5cm al cuello sobre el lado izquierdo. Disección de tronco braquiocefálico (TBC) y de arteria carótida izquierda. No se disecó arteria subclavia izquierda. Canulación venosa en aurícula derecha (cánula única). Confección de prótesis bifurcada en «Y» entre una prótesis de dacrón de 14mm y otra de 8mm, para implantar en la prótesis que reemplazará al arco. Comienzo de circulación extracorpórea a 32°C (funcionamiento a rodillos, flujo esperado: 5.600ml/min [70ml/min/kg]). Pinzado del TBC y sección del mismo. Confección de anastomosis término-terminal de su cabo distal con la prótesis de 14mm y cerrando cabo proximal. Se traslada la pinza vascular del TBC a la prótesis de 14mm, continuando su perfusión por arteria subclavia derecha. Pinzado de arteria carótida izquierda, sección de la misma y anastomosis término-terminal de su cabo distal con la prótesis de 8mm (6min de oclusión carotidea a 32°C, con perfusión de TBC y subclavia izquierda). Cierre del cabo proximal (fig. 3). Se traslada la pinza vascular al inicio de la prótesis de 14mm. Ahora hay perfusión cerebral total. Se desciende la temperatura corporal lentamente hasta llegar a 20°C (hasta este momento el corazón estaba latiendo). Pinzado de aorta ascendente, apertura de la misma e inyección ostial de cardioplejía cristaloidea Bretschneider 2.000ml. Se sigue con resección del aneurisma de aorta ascendente (fig. 4). Se observan 2 valvas aórticas retraídas, no reparables. Se reseca la válvula. Cese de perfusión femoral durante 10min a 20°C. Despinzado de aorta ascendente; apertura y resección del arco aórtico. Con el objeto de perfundir los órganos distales, se coloca balón oclusor n.o 28 en aorta descendente, reiniciando así por vía femoral la perfusión de los mismos (fig. 5). Durante esta etapa el flujo aproximado por la cánula en arteria subclavia fue de 15ml/kg/min y por la cánula femoral fue de 35ml/kg/min. Al no perfundirse la subclavia izquierda, la hipotermia a 20°C permite proteger al paciente contra el riesgo de paraplejía. Luego de endarterectomía por placa de ateroma (fig. 2), anastomosis distal del arco, rasante a arteria subclavia izquierda con prótesis dacrón de 30mm interponiendo banda de teflón. La subclavia queda del lado de la aorta descendente. Se retira el balón oclusor y se pinza la prótesis. Ya hay perfusión total. Recalentamiento lento hasta alcanzar los 32°C. Implante de válvula aortica biológica n.o 25 (Hancock, Medtronic). Anastomosis de prótesis de dacrón 30mm con aorta ascendente supracoronariana (fig. 6). Se implanta la prótesis de 14mm en la de 30mm bajo perfusión de TBC y de carótida derecha por subclavia, y distal por femoral.
Finalmente, anastomosis proximal del bypass venoso a arteria coronaria derecha, sobre la prótesis de 14mm, que luego se despinza (fig. 7). Recalentamiento final durante 45min hasta alcanzar una temperatura esofágica de 37°C. Salida de circulación extracorpórea.
Tiempos:
Oclusión carotidea izquierda a 32°C: 6min.
Isquemia medular y visceral a 20°C: 10min.
Pinzado aórtico: 166min.
Circulación extracorpórea: 280min.
Control de deaireamiento y función cardiaca con ETE.
Buena evolución inicial postoperatoria. A las 24h de la cirugía se extuba, sin requerimiento de fármacos inotrópicos, con un débito por los drenajes de 700ml serohemático; creatininemia de 2,0mg/dl, que desciende a 1,2mg/dl (N: 0,6-1,3mg/dl) a las 72h del postoperatorio; GOT 63mg/ dl (N: 10-42mg/dl), GPT 54mg/dl (N: 10-40mg/dl), examen neurológico normal. Presenta fiebre postoperatoria, se punza colección retroesternal guiada por TC, cuyo cultivo muestra Klebsiella sp. Se da de alta a los 16 días del postoperatorio, con tratamiento antibiótico. Se realiza seguimiento durante 5 años con controles tomográficos. La última TC de control es de diciembre 2015 (fig. 8).
DiscusiónLas complicaciones posteriores a la cirugía del arco aórtico con hipotermia profunda (coagulopatía, elevada respuesta inflamatoria, disfunción de órganos) han despertado preocupación. Con la implementación de la parada circulatoria con hipotermia moderada (20-28°C) asociada a perfusión cerebral selectiva anterógrada se ha logrado disminuir dichas complicaciones manteniendo la neuroprotección6. Esta última técnica demuestra beneficios en los casos que requieren períodos más prolongados de parada circulatoria para llevar a cabo reparaciones más complejas7.
Desde el 2000, el grupo de Griepp ha comenzado a utilizar la técnica de «branch-first» con resultados alentadores. Ellos han reportado una disminución postoperatoria significativa de las tasas de fallas respiratoria y cardiaca, traqueostomía e infección, comparado con dos subgrupos de pacientes (uno con hipotermia profunda aislada y otro con hipotermia profunda más perfusión cerebral selectiva anterógrada). Con respecto a puntos finales duros como disfunción neurológica permanente o muerte, estos fueron del 16% en los dos primeros subgrupos y del 8% en el subgrupo «branch-first»4. Matalanis et al. reportan una tasa de disfunción neurológica permanente menor del 2% y un 3,1% de mortalidad perioperatoria3.
La técnica aquí descripta es relativamente nueva y podemos considerarla como una posibilidad de tratamiento más para el cirujano, al momento de tratar esta patología.
Los beneficios son:
- 1.
Ausencia de paro circulatorio global.
- 2.
Interrupción momentánea de solo uno de los 3 vasos del arco (a diferencia de la perfusión cerebral anterógrada unilateral, que interrumpe 2 vasos simultáneamente).
- 3.
La perfusión cardiaca y de órganos viscerales es mantenida durante la fase de reconstrucción del arco aórtico, disminuyendo el tiempo de parada cardiaca y el riesgo de disfunción miocárdica y de órganos distales, acortando el tiempo de recuperación postoperatoria. Existe un riesgo de paraplejía cercano al 2% en pacientes con parada circulatoria, que asciende al 18% si esta es mayor de 60min con hipotermia a 25°C4. En nuestro caso ese tiempo fue de solo 10min, ya que se mantuvo la perfusión visceral y medular luego de colocar el balón oclusor en aorta descendente, siendo esta una maniobra sencilla cuando se aborda la aorta descendente desde esternotomía8.
- 4.
Otra ventaja de esta técnica es que el nacimiento de los vasos supraaórticos es trasladado a una porción proximal de la aorta, permitiendo una amplia zona de apoyo en el caso de ser necesario un tratamiento intravascular de la aorta distal en un segundo tiempo9.
Se han considerado algunas críticas a esta técnica. La dependencia de la permeabilidad del polígono de Willis, que presenta variabilidad anatómica o ausencia en el 15% de la población. Sin embargo, además de dicho polígono, existen canales vasculares adicionales: carótida interna-carótida externa, carótida derecha-carótida izquierda, arterias subclavias-carótidas3. Asimismo, en nuestro caso siempre hubo perfusión de al menos 3 vasos del cuello.
Consideramos que esta cirugía es reproducible si se respeta cuidadosamente la secuencia de colocación de pinzas vasculares y el correcto deaireamiento cardiaco, y que nos acerca a resultados postoperatorios similares a los que podemos encontrar en operaciones de la raíz aórtica o de la aorta ascendente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.