La incidencia y el riesgo global de las infecciones de dispositivos de electroestimulación cardiaca (DEC) ha aumentado de manera exponencial en los últimos años con el incremento de implantes sobre una población más envejecida, que presenta más comorbilidades. La identificación de estas infecciones continúa siendo un reto por su amplia variabilidad de presentación clínica y complejidad del proceso diagnóstico. Hasta ahora, el uso de la ecocardiografía transesofágica (ETE) ha sido la técnica diagnóstica de elección. Sin embargo, la reciente incorporación de la tomografía por emisión de positrones/tomografía computarizada con 18F-Fluorodesoxiglucosa ([18F]FDG-PET/TC) ha supuesto un notable avance en este campo. La combinación de ambas técnicas permite incrementar considerablemente el diagnóstico de la afectación endovascular e intracardiaca y optimizar, por tanto, el posterior manejo terapéutico de estas infecciones. En esta revisión, presentamos un enfoque basado en las últimas evidencias publicadas en la literatura para el diagnóstico de la infección de DEC.
The incidence of cardiac implantable electronic device (CIED) infections has increased remarkably in recent years, with the higher implantation rate in an older population with more comorbidities. Diagnosing CIED infection is challenging due to the wide variability of clinical presentation and the complexity of the diagnostic process. To date, transesophageal echocardiography (TEE) has been the key in the diagnostic algorithm process. However, the recent introduction of 18F-Fluorodeoxyglucose positron emission tomography/computed tomography ([18F] FDG-PET/CT) has brought notable progress in this field, especially in local CIED infections. Nevertheless, combining both techniques increase the diagnosis yield on endovascular and intracardiac-lead systemic infections. In this review, we present an approach based on the latest evidence published in the literature to diagnose CIED infection.
En las últimas décadas se han producido notables avances en los dispositivos de electroestimulación cardiaca (DEC) con un incremento casi exponencial en el número de implantes, y dispositivos cada vez más sofisticados sobre una población diana con más esperanza de vida, más envejecida y frágil1,6. Este aumento en el número de implantes de DEC sobre una población con más comorbilidades ha tenido un indudable impacto sobre la tasa de infección, que ha ido aumentando más allá de lo esperado por el simple incremento de los implantes, elevando también las cifras de morbimortalidad, tal y como se refleja en publicaciones recientes6–8.
El diagnóstico de estas infecciones, cada vez más complicadas, sobre una población frágil y comórbida, se realiza en base a la presentación clínica, pruebas microbiológicas y la ecocardiografía transesofágica (ETE), como prueba de imagen.
Desde el punto de vista del diagnóstico microbiológico, el rendimiento para las infecciones de los DEC (especialmente las locales) del cultivo convencional es bajo (50-60%), aunque la sonicación ha mejorado los resultados del cultivo, sobre todo en los cables10. La biología molecular también ha demostrado ser muy útil para el diagnóstico etiológico11, aunque es difícil distinguir a veces, en presencia de bajos inóculos, entre infección y simple contaminación de una muestra local en dispositivos con rotura de la piel. Por otra parte, es necesario el cultivo para disponer de la susceptibilidad antibiótica completa de los microorganismos aislados y realizar un tratamiento antibiótico dirigido10,11.
Los hemocultivos seriados y la ETE han sido las piezas clave para el diagnóstico en las infecciones sobre el cable, aunque no son raros los casos en que ambos pueden ser negativos.
En los últimos años la incorporación de la tomografía por emisión de positrones/tomografía computarizada con 18F-Fluorodesoxiglucosa ([18F]FDG-PET/TC) ha supuesto un considerable avance en el diagnóstico de la endocarditis protésica por su elevada sensibilidad y especificidad, hasta el punto de ser propuesta como un criterio diagnóstico mayor1,4. Sin embargo, esta técnica ha sido mucho menos estudiada y presenta resultados variables en las infecciones por DEC, si bien es cierto que su uso sistemático puede y debe mejorar el rendimiento diagnóstico y, por lo tanto, el manejo terapéutico de estas infecciones.
Hasta ahora todas las evidencias publicadas en la literatura demuestran que la retirada del DEC en el manejo de estas infecciones tiene impacto en el pronóstico, especialmente en las infecciones sistémicas1–5; por lo que resulta mandatorio localizar anatómicamente la infección del dispositivo para valorar su retirada. Hay que tener en cuenta que, en presencia de una población envejecida y pluripatológica, el riesgo quirúrgico de retirada del dispositivo puede ser difícil de asumir5,8, y en una infección local podría optarse por un manejo conservador9. Por tanto, en el algoritmo diagnóstico conocer si la infección está limitada al generador o afecta, en cambio, a las porciones endovasculares y/o intracardiacas del cable, será determinante para el manejo quirúrgico en ciertos casos6,7.
En la presente revisión se describen los tipos de infecciones de los DEC, el rendimiento diagnóstico de las pruebas de imagen y se propone un algoritmo diagnóstico y terapéutico.
Definiciones y presentación clínica de las infecciones de dispositivos de electroestimulación cardiacaLas infecciones de DEC tienen una amplia variabilidad en sus manifestaciones clínicas. Las guías de práctica clínica americanas, europeas y británicas realizan una aproximación diagnóstica basándose en la definición previa de los tipos de infección y su correlación con la parte del DEC que está afectada1–4. Principalmente hay que discriminar si es una infección localizada o sistémica (tabla 1).
Criterios diagnósticos de infección de DEC según guías de práctica clínica
| Infección localizada de DEC | Decúbito/erosión del generador |
| Extrusión del generador ± signos infección localizada | |
| Signos locales infección bolsillo | |
| Infección sistémica de DEC(± infección localizada) | Infección cable endovascular o/y cable intracardiaco |
| Endocarditis valvular nativa o protésica asociada a infección sistémica de DEC |
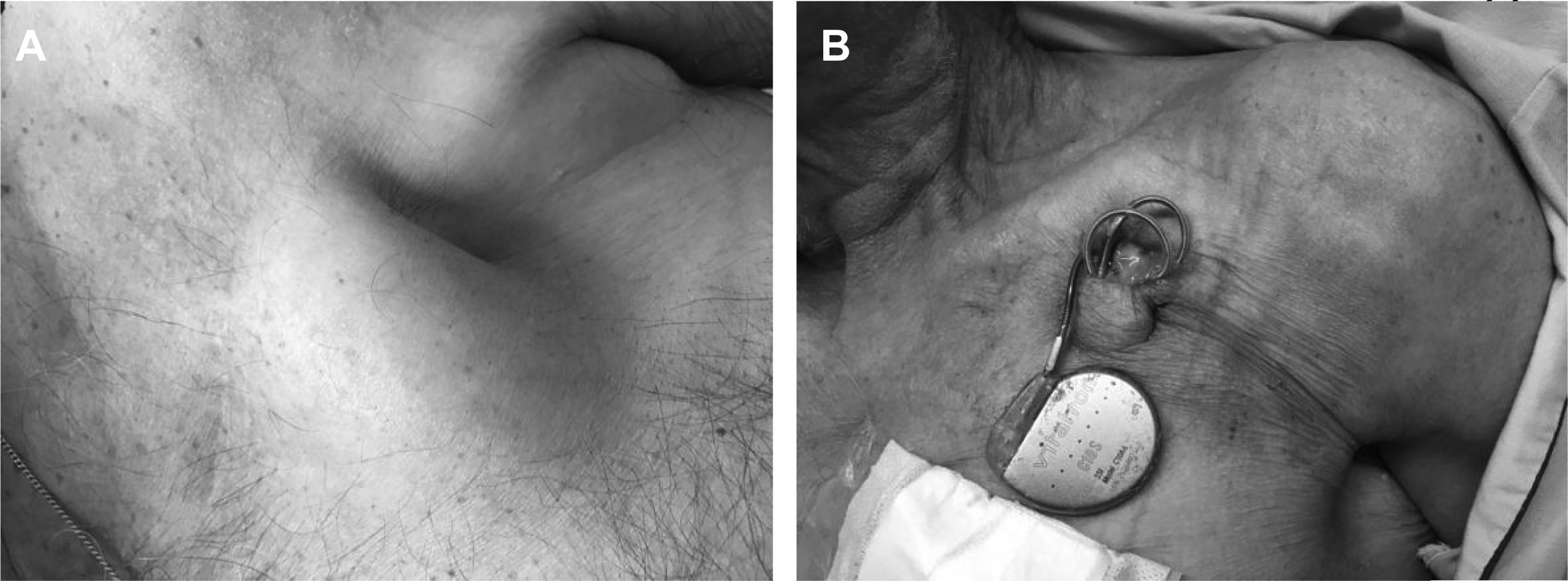
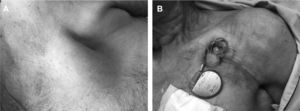
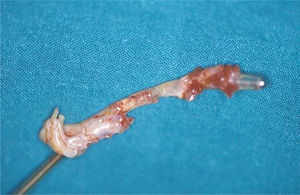
Es la forma más frecuente, presente en más de 60% de las infecciones de DEC4,7. Se caracterizan por signos locales de inflamación en el generador del dispositivo: eritema, dolor, edema, exudación purulenta y dehiscencia de la piel que recubre el bolsillo, o aparición de un trayecto fistuloso con exudación periódica por el orifico de salida (figs. 1A y B). Puede estar asociado a cultivos de aspirado con aguja del bolsillo o frotis del exudado positivos, y/o secuenciación del gen 16S rRNA positivo (16S-RNA-PCR)1–4.
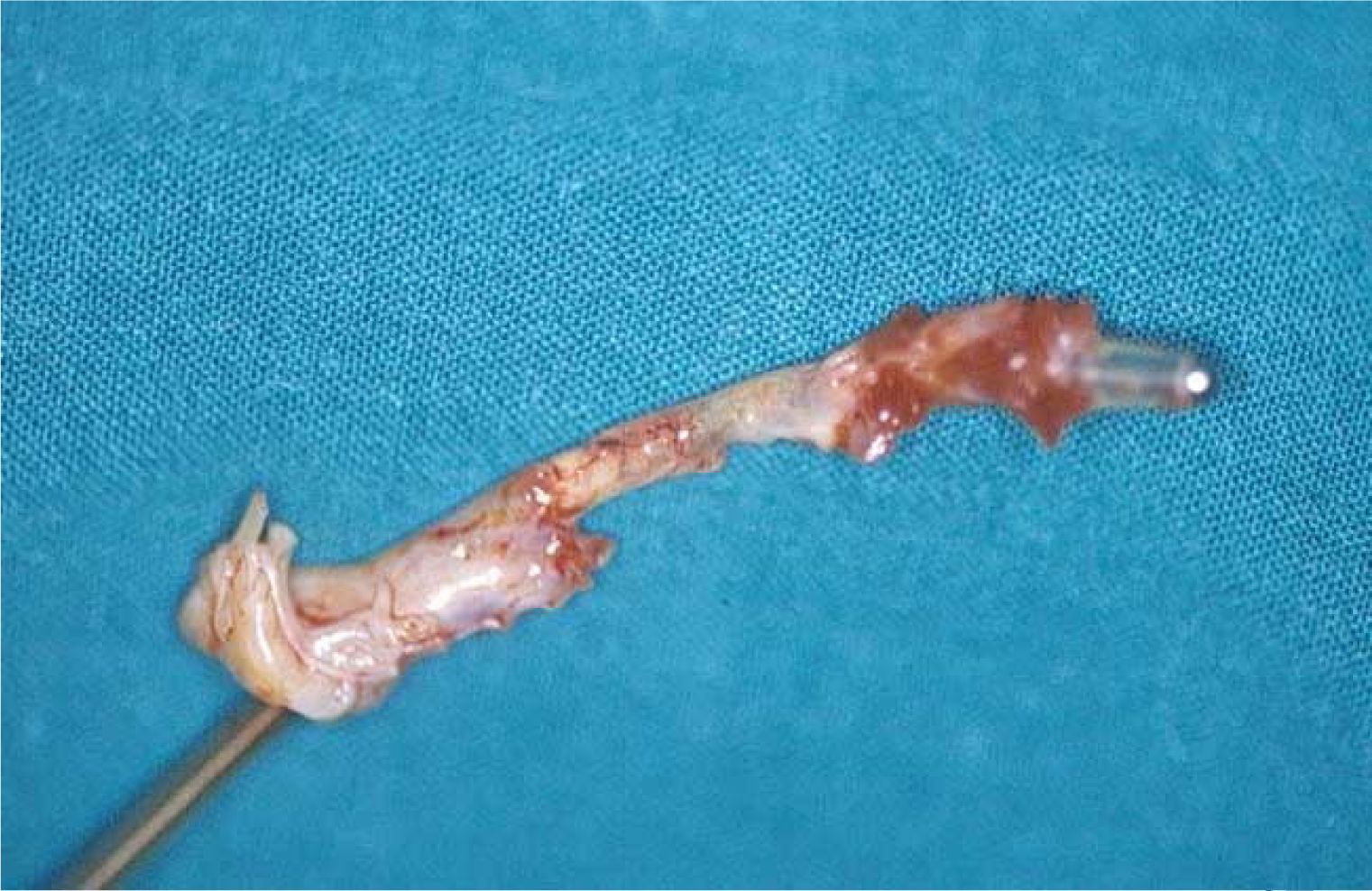
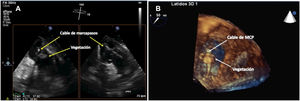
Infección sistémicaSe asocia a semiología clínica de infección como fiebre, escalofríos, malestar general o incluso signos de sepsis (taquicardia, hipotensión, shock...) y/o hemocultivos repetidamente positivos. En el 70-80% de los casos los pacientes tienen concomitantemente signos de infección localizada. Dentro de las infecciones sistémicas cabe destacar si afectan al cable en su porción endovascular y/o intracardiaca (fig. 2), o incluso a las válvulas cardíacas, lo que ocurre aproximadamente en un 10-25% de los casos.
Los pacientes con endocarditis asociada a DEC se diagnostican mediante la aplicación de los criterios de Duke modificados1–4. La presencia de vegetaciones en los cables o en las válvulas evidenciables en el estudio ecocardiográfico es más frecuente en la válvula tricúspide, reportándose hasta en un 10-25% del total de las endocarditis sobre DEC.
En contraste con los pacientes con endocarditis nativa o protésica, rara vez en la endocarditis sobre DEC se objetivan signos de esplenomegalia, fenómenos vasculares o la presencia de soplos de nueva aparición. Principalmente afecta a las válvulas cardiacas derechas, que ocasionan esencialmente embolismos pulmonares, derrame pleural y abscesos6,7. La implicación izquierda del corazón (endocarditis mitral y/o aórtica) y las metástasis sépticas extrapulmonares (p. ej., espondilitis) son posibles, pero infrecuentes y generalmente asociadas a microorganismos virulentos (p. ej., S. aureus).
Mecanismos de infección localizada y sistémica de dispositivos de electroestimulación cardiacaEn la infección localizada normalmente existe una lesión con puerta de entrada a nivel del generador por contaminación del lecho quirúrgico en el momento de implante, recambio o manipulación del dispositivo (normalmente comienzan en un periodo de tiempo inferior a un año); o en ocasiones (infecciones tardías), por la llegada del microorganismo desde la piel o un foco distante. Esta infección local puede extenderse por vía descendente al resto del DEC, alcanzando los segmentos distales del cable e incluso afectando a las válvulas cardiacas5 y en este caso, se definiría como una infección local que se ha complicado y se ha transformado en sistémica.
Por otro lado, puede existir una infección sistémica, de los cables del DEC, sin signos locales de infección del bolsillo del generador, por vía hematógena desde un foco distante, pero es menos frecuente y presentan más dificultad diagnóstica.
Todas estas situaciones clínicas, que generalmente son producidas microorganismos poco agresivos (ECN) pueden ser pauci-sintomáticas, con una fiebre de baja entidad y a menudo recurrente durante un tiempo de evolución muy prolongado (meses e incluso años), lo que va a dificultar en gran medida el diagnóstico6. Además, al afectar en muchas ocasiones en una población anciana se orienta hacia otros procesos más crónicos como por ejemplo un proceso neoplásico.
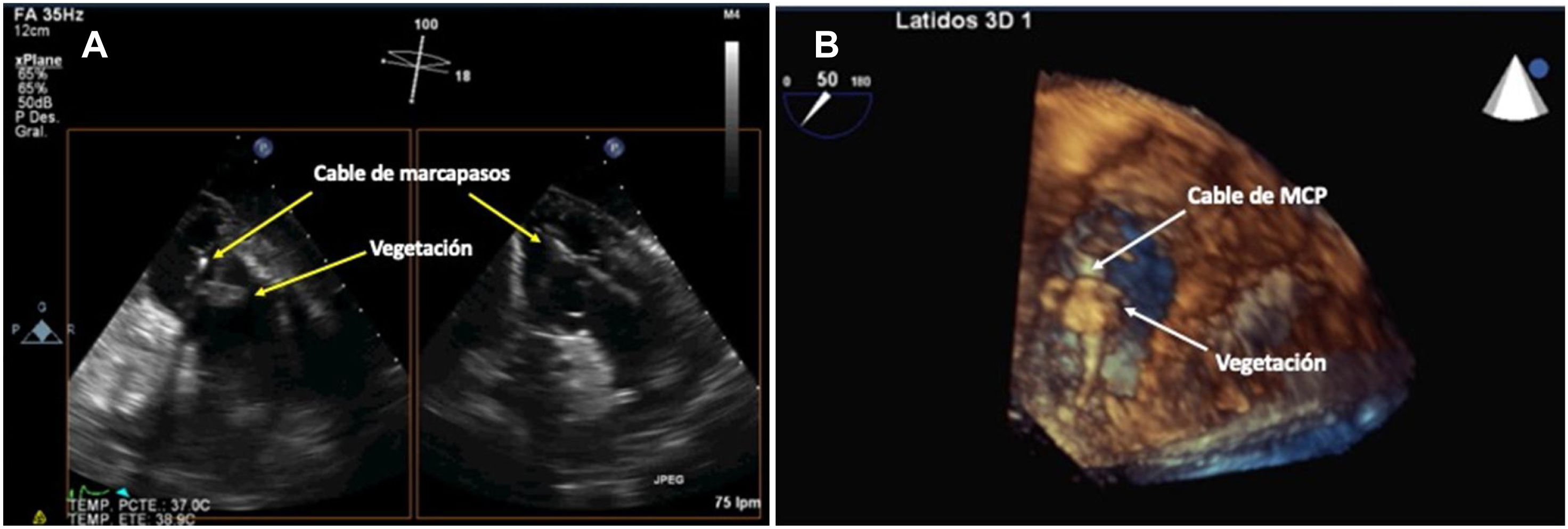
Ecocardiografía transtorácica y ecocardiografía transesofágicaLa ecocardiografía es la piedra angular del proceso diagnóstico de la afectación intracardiaca de DEC al poner en evidencia las vegetaciones en los electrodos (fig. 3) o en las válvulas cardiacas1–4. La ecografía transtorácica (ETT) puede identificar bien las vegetaciones sobre la válvula tricuspídea por la accesibilidad de las estructuras de corazón derecho y proporciona información útil sobre la existencia de derrame pericárdico, la disfunción ventricular y las valoraciones de la presión vascular pulmonar12,14. Sin embargo, su sensibilidad para detectar vegetaciones sobre los cables no va más allá de un 20-30%, por lo que el diagnóstico de las vegetaciones en los cables de los DEC debe realizarse mediante un ecocardiograma transesofágico (ETE) que tiene una sensibilidad del 60-90%, siendo por tanto una prueba obligada para discernir entre una infección puramente local y una complicada o sistémica1,5. La realización del ETE permite además la cuantificación del defecto valvular, si está presente, medir el tamaño de las vegetaciones y el seguimiento tras la extracción del electrodo14–15. De todas formas, la sensibilidad nunca es del 100% y, en ocasiones, bien por el estado clínico del paciente, las limitaciones anatómicas o la patología asociada (varices en el paciente cirrótico, estenosis esofágica, enfermedad del cavum...) no va a ser posible realizarla, por lo que en algunas circunstancias solo dispondremos de un ETT, y son precisas otras técnicas diagnósticas asociadas para establecer el diagnóstico definitivo. Por otro lado, en determinadas circunstancias resulta imposible diferenciar entre un trombo, una masa de fibrina o una vegetación séptica sin el contexto clínico adecuado, con una cifra no desdeñable de falsos positivos, en torno al 10-15%7,13–17.
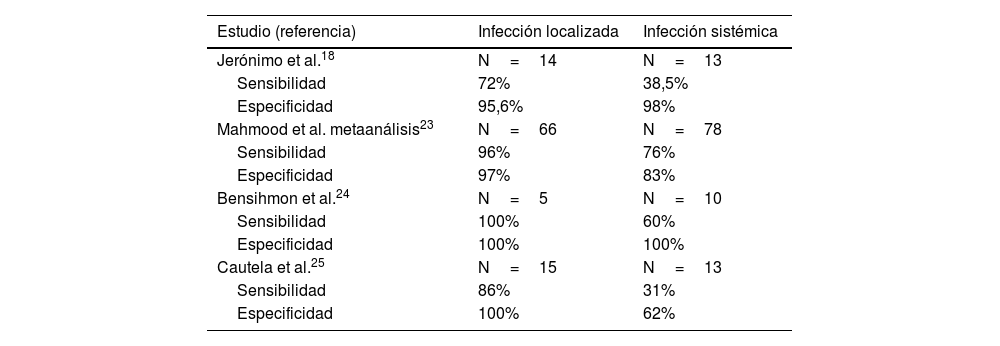
Tomografía por emisión de positrones/tomografía computarizada con 18F-FluorodesoxiglucosaEl uso del [18F]FDG-PET/TC que fue incorporado como criterio mayor de endocarditis infecciosa protésica en las últimas guías de práctica clínica2, también ha demostrado su capacidad para detectar émbolos sépticos a distancia 21. Se postula que puede ayudar a la localización anatómica de la infección de DEC. Recientes revisiones publicadas en la literatura contemplan el uso del [18F]FDG-PET/TC en el algoritmo diagnóstico por su alta sensibilidad y especificidad, para las infecciones localizadas del bolsillo del generador (fig. 4)12. Sin embargo, para los segmentos endovasculares e intracardiacos el rendimiento diagnóstico de esta técnica es menor (tabla 2).
Comparación del rendimiento diagnóstico del PET/CT-FDG para las infecciones localizadas vs. infecciones sistémicas de DEC, según los principales estudios publicados en la literatura
| Estudio (referencia) | Infección localizada | Infección sistémica |
|---|---|---|
| Jerónimo et al.18 | N=14 | N=13 |
| Sensibilidad | 72% | 38,5% |
| Especificidad | 95,6% | 98% |
| Mahmood et al. metaanálisis23 | N=66 | N=78 |
| Sensibilidad | 96% | 76% |
| Especificidad | 97% | 83% |
| Bensihmon et al.24 | N=5 | N=10 |
| Sensibilidad | 100% | 60% |
| Especificidad | 100% | 100% |
| Cautela et al.25 | N=15 | N=13 |
| Sensibilidad | 86% | 31% |
| Especificidad | 100% | 62% |
DEC: dispositivos de electroestimulación cardiaca.
En un metaanálisis recientemente publicado, Mahmood et al. reportan cifras de sensibilidad para las infecciones localizadas en torno al 96%, y hasta un 76% para las infecciones sistémicas22,23. Estas son las cifras más elevadas publicadas en la literatura. Sin embargo, Jerónimo et al., reportan para las infecciones sistémicas una sensibilidad y especificidad del 38,5 y 98%, respectivamente, mientras que para las localizadas dan cifras del 72 y 95,6%18. De todas formas, aunque aún existe poca evidencia publicada, la combinación de la ETE y el [18F]FDG-PET/TC puede aumentar el rendimiento diagnóstico en las infecciones sistémicas de DEC, de un 30 a un 60% en los pacientes con bacteriemia y ello se debería a la capacidad de la [18F]FDG-PET/TC para evaluar el segmento endovascular del cable próximo a la conexión con el generador dónde el ETE no tiene acceso26.
Es importante resaltar que varios estudios han sugerido que la terapia antibiótica previa durante más de 7 días previos a la realización de [18F]FDG-PET/TC puede reducir su rendimiento diagnóstico y aumentar los falsos negativos18,20. Otro aspecto para tener en cuenta es el tiempo transcurrido entre el implante del dispositivo y la realización del [18F]FDG-PET/TC ya que muchos trabajos publicados indican que la actividad inflamatoria postoperatoria es una causa de falsos positivos19,20.
Otros métodos diagnósticos de la afectación endovascular e intracardiacaExisten publicaciones que reportan una mayor sensibilidad de la ecocardiografía intracardiaca en pacientes con dispositivos cardiacos, sin embargo, su uso es eventual, ya que es una técnica invasiva y costosa, poco aplicable en la práctica clínica diaria27. Asimismo, la gammagrafía de leucocitos marcados también tiene capacidad diagnóstica por su alta especificidad, pero actualmente se considera como una herramienta complementaria para el diagnóstico de infecciones de DEC por poseer una metodología más compleja y una sensibilidad menor con respecto a la [18F]FDG-PET/TC28.
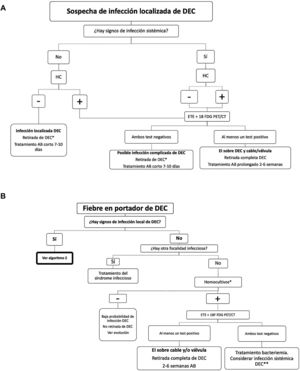
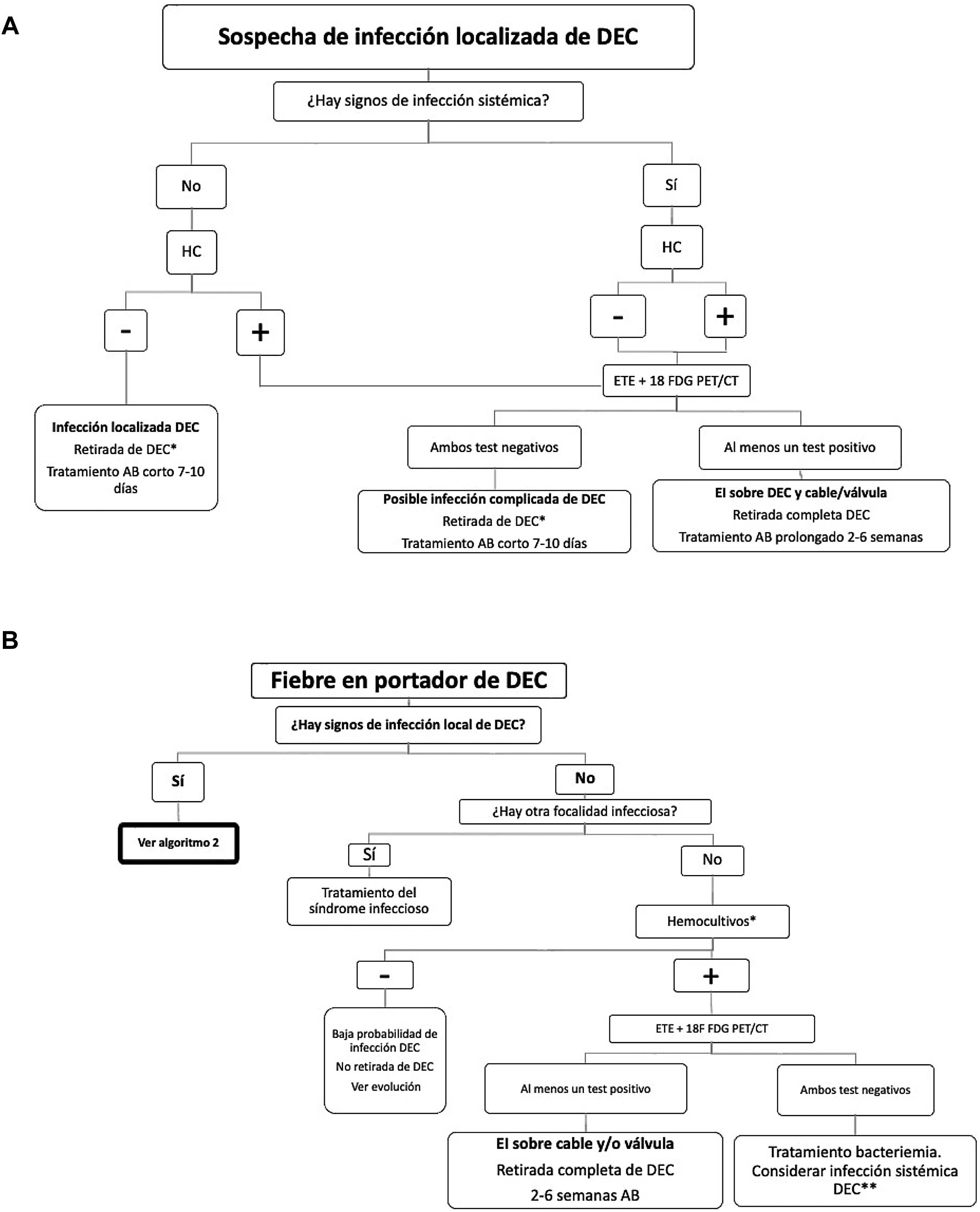
Algoritmo diagnóstico y terapéutico de las infecciones del dispositivo de electroestimulación cardiacaEn la figura 5 se muestra el algoritmo de manejo clínico y diagnóstico por imagen de las infecciones de DEC partiendo de 2 escenarios clínicos frecuentes.
Algoritmos diagnósticos clínico y por imagen y manejo terapéutico de las infecciones de los dispositivos de estimulación cardiaca (DEC). A) Sospecha de infección localizada de DEC. B) Fiebre en portador de DEC.
*Se podría contemplar la retirada solo del generador en pacientes de edad avanzada con extrema fragilidad y comorbilidades y/o gran dificultad para la extracción completa del sistema y elevado riesgo quirúrgico.
** En los casos con bacteriemia continua por microorganismos típicos de infección del DEC y en ausencia de otro foco alternativo, considerar infección sistémica de DEC a pesar de ETE y 18F FDG PET/CT negativos. En estos casos sería recomendable la retirada completa del sistema.
El primer escenario clínico se basa en que exista una sospecha de infección localizada del DEC (fig. 5A). En estos casos deben realizarse hemocultivos y evaluar si existen signos de infección sistémica o no. Si los hemocultivos son negativos y no hay signos de infección sistémica, debe considerarse que el paciente tiene una infección localizada de DEC y se debería retirar de forma completa el sistema. No obstante, se podría plantear solo la retirada del generador en pacientes de edad avanzada, extrema fragilidad, comorbilidades y con elevado riesgo quirúrgico en el procedimiento de extracción. Por otro lado, si los hemocultivos son positivos y/o hay signos de infección sistémica, recomendamos realizar un ETE y el [18F]FDG-PET/TC cardíaco. Si ambos son negativos, es menos probable que el paciente tenga una infección sistémica del DEC, aunque si el microorganismo aislado en los hemocultivos es típico de infección del DEC (Staphylococcus aureus, S. epidermidis, otros estafilococos coagulasa negativos y en menor medida otros cocos grampositivos y Pseudomonas aeruginosa)29 recomendamos la retirada completa del mismo y un tratamiento antibiótico corto. Por el contrario, si una de las 2 pruebas o ambas son positivas, el paciente tiene una endocarditis sobre el DEC (cable o válvula), debe retirarse todo el sistema y dar un tratamiento antibiótico prolongado (2-6 semanas).
En el segundo escenario clínico se describe el manejo de los casos con fiebre en pacientes portadores de DEC, sin signos de infección localizada (fig. 5B). En estos casos hay que buscar un foco infeccioso. Si existe un foco (p. ej., infección urinaria) debe tratarse y en general es improbable que el paciente tenga una infección del DEC. Si no existe foco infeccioso, deben esperarse al resultado de los hemocultivos. Si son negativos es improbable que exista una infección del DEC. Si son positivos y existe bacteriemia por microorganismos típicos de infección del DEC y, en ausencia de otro foco evidente, debe efectuarse un ETE y [18F]FDG-PET/TC cardíaco. Si una de los 2 o ambas pruebas son positivas, el paciente tiene una endocarditis sobre el DEC (cable o válvula), debe retirarse todo el sistema y dar un tratamiento antibiótico prolongado (2-6 semanas). Si ambas son negativas y no existe un foco evidente, también deberá plantearse la retirada completa del sistema.
Una causa frecuente de hemocultivos negativos es la antibioticoterapia previa, que con frecuencia se administra ambulatoriamente a estos pacientes, lo que puede dificultar el diagnóstico de las infecciones de los DEC. Finalmente, si en cualquiera de los 2 escenarios no es posible la retirada completa del DEC, tras una fase intensiva IV, debería administrarse tratamiento antibiótico supresivo crónico.
FinanciaciónLos autores confirman no haber recibido financiación para la realización de esta revisión.
Conflicto de interesesJMM recibió una beca de investigación personal 80:20 del Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Barcelona, España, durante los años 2017-2023. También ha recibido honorarios por consultoría y/o becas de investigación de AbbVie, Angelini, Contrafect, Cubist, Genentech, Gilead Sciences, Jansen, Medtronic, MSD, Novartis, Pfizer y ViiV Healthcare, aunque no relacionados con este estudio. El resto de autores confirman la ausencia de conflictos de interés y no ha habido financiación para este trabajo.
Enfermedades Infecciosas: José M. Miró, Guillermo Cuervo, Marta Hernández-Meneses, Asunción Moreno. Laboratorio de Endocarditis experimental: Cristina García de la María, Javier García-González, María-Alejandra Cañas-Pacheco. Microbiología: Francesc Marco, Jordi Vila. Cirugía cardiaca: Eduard Quintana, Elena Sandoval. Cardiología: Carlos Falces, Bàrbara Vidal, José M. Tolosana. Unidad de cuidados intensivos: Pedro Castro, Adrián Téllez. Medicina Nuclear: Andrés Perissinotti, David Fuster. Anatomía Patológica: José Ramírez. Toxicología: Mercè Brunet. Farmacia: Dolors Soy. Departamento de genética, microbiología y estadística, Universidad de Barcelona: Jaume Llopis.





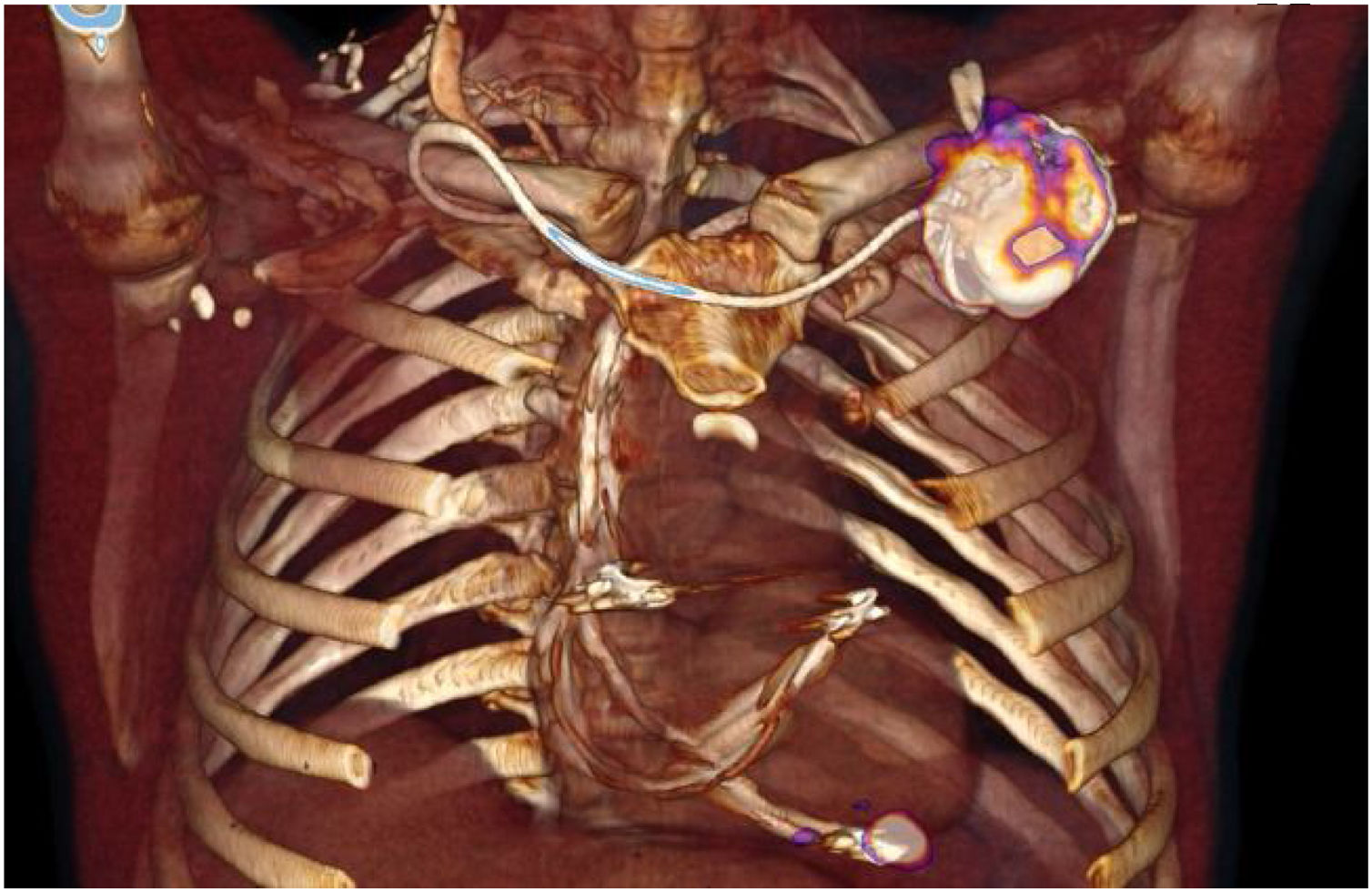

![Reconstrucción en 3D de la [18F]FDG-PET/TC que muestra captación patológica del radio trazador en el bolsillo del DEC y en el extremo distal del trayecto intracardiaco del cable. Reconstrucción en 3D de la [18F]FDG-PET/TC que muestra captación patológica del radio trazador en el bolsillo del DEC y en el extremo distal del trayecto intracardiaco del cable.](https://static.elsevier.es/multimedia/11340096/0000003000000004/v2_202309200559/S1134009622002959/v2_202309200559/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)