La terapia antibiótica en las infecciones de dispositivos implantables de electroestimulación cardiaca (DEC) debe ser siempre considerada como adyuvante a una extracción completa del dispositivo, única opción segura de lograr una curación completa. Sin embargo, en algunas infecciones locales puede ser exitosa de manera aislada y debe ser supervisada por un experto. En las infecciones sistémicas, el tratamiento antimicrobiano apropiado es imprescindible para evitar una sepsis grave y hacer posible la negativización pronta de los hemocultivos, lo que va a tener su importancia de cara al momento del recambio del sistema, una vez realizada la extracción completa del DEC. Finalmente, en los casos en los que no se puede retirar el dispositivo de forma completa, es preciso considerar el tratamiento oral supresivo.
Antibiotic therapy in Cardiac Implantable Electrostimulation Devices (CIED) infections should always be considered as an adjunct to complete removal of the device, the only safe option to achieve the complete cure. However, in some local infections, it may be successful and should be supervised by an expert. In systemic infections, appropriate antimicrobial treatment is essential to avoid severe sepsis and to enable prompt negative blood cultures, which will be important at the time of system replacement, after the complete removal of the CIED. Finally, in cases where the device cannot be completely removed, chronic suppressive oral therapy should be considered.
Curar una infección de largo tiempo de evolución en un dispositivo de estimulación cardiaca (DEC), sin realizar una extracción del mismo, es una tarea casi imposible. Sin embargo, en las infecciones locales es preciso realizar en ocasiones un tratamiento antimicrobiano que reduzca el inóculo y minimice los efectos inflamatorios antes de la extracción, y en las infecciones sistémicas en las que los microorganismos han accedido al torrente sanguíneo, afectando a veces a estructuras cardiacas (válvulas) e incluso se han diseminado a otros órganos (pulmón, hueso…), el tratamiento es fundamental para la supervivencia (evitación de la sepsis) y la erradicación completa de la enfermedad. Por tanto, las infecciones de DEC van a precisar a menudo un tratamiento médico que acompañe a la siempre recomendable extracción del sistema. En algunas infecciones locales, un tratamiento antibiótico puede evitar incluso una extracción dificultosa, y en algunas infecciones sistémicas en las que no se ha podido extraer el sistema va a ser necesario un tratamiento supresor crónico. En este capítulo revisaremos los conceptos fundamentales del tratamiento antimicrobiano analizando las variables fundamentales (tipo, momento de inicio y duración de la terapia) y las estrategias básicas quirúrgicas para intentar conseguir el mejor resultado dentro de lo posible.
Principios fundamentales del tratamiento antimicrobianoEl principal predictor de la eficacia de un tratamiento antimicrobiano es cuando se consigue alcanzar en el medio donde está radicada la bacteria una concentración por encima de la concentración mínima inhibitoria (CMI) de esta1. Teniendo en cuenta este principio, intentamos dar el antimicrobiano en las dosis necesarias para, atendiendo a sus características farmacocinéticas (biodisponibilidad, semivida plasmática, unión a proteínas, penetración en tejidos y vías de eliminación), alcanzar siempre niveles por encima (al menos durante un intervalo de tiempo) de esa concentración. La CMI de un determinado antimicrobiano para un microorganismo es la dosis necesaria para evitar el crecimiento de 90% de las colonias en un medio de cultivo ideal, que puede ser líquido (por ejemplo, Mueller-Hinton) o semisólido (una placa de agar) y con un inóculo estándar (habitualmente 5 x 105 UFC). Sin embargo, en el medio real que queremos tratar, la concentración bacteriana puede ser mucho más elevada que el inóculo utilizado en las pruebas in vitro, y además no siempre se consigue en él la misma concentración que conocemos bien en plasma (donde sí es fácil de medir). Por ello, intentamos dar una dosis que alcance varias veces en plasma esa concentración «mínima», para que luego, en el tejido problema donde presumimos que la penetración no va a ser completa, alcance niveles al menos por encima de la CMI. En algunos tejidos esto va a ser muy sencillo, como en riñón, ya que al ser un órgano de eliminación del fármaco, este va a alcanzar concentraciones muy por encima de lo necesario, y en pulmón o válvulas cardiacas, en los que el antimicrobiano alcanza niveles de 80-90% de los medidos en plasma. En cambio, en otros tejidos (por ejemplo, hueso) ya no va a ser tan sencillo, y por último en algunos tejidos como el cerebro (aislado por la barrera hematoencefálica) va a ser francamente complicado, pero posible utilizando dosis muy altas. Las infecciones en dispositivos biológicos son aún más complicadas de tratar, ya que en una vez que las bacterias se adhieren a los biomateriales, se agrupan en biocapas de estructura más o menos desarrollada dependiendo de la especie, el tipo de biomaterial, las condiciones del medio y el tiempo de evolución. En estas biocapas compuestass por colonias bacterianas inmersas en una compleja matriz extracelular, la penetración de los antimicrobianos está francamente disminuida e incluso son degradados por enzimas liberadas a la matriz. Por último, las bacterias adoptan una forma de crecimiento diferente a la planctónica (que es la que utilizamos in vitro para la medición de la CMI), mucho más lenta en su desarrollo y que, por tanto, no va a ser tan afectada por los antimicrobianos dirigidos contra la pared (fundamentalmente betalactámicos), que son más eficaces cuando las bacterias están en fase de rápido crecimiento. El resultado de todo ello es que se necesitan niveles plasmáticos hasta 1.000 veces por encima de la CMI para conseguir la inhibición total del crecimiento bacteriano en estas biocapas2.
Es evidente que por razones de simple toxicidad, difícilmente vamos a alcanzar en el ser humano estas concentraciones, por lo que debemos asumir que una infección ya estructurada en biocapas sobre un biomaterial es literalmente imposible de erradicar, si no eliminamos el biomaterial. Por tanto, aunque en este capítulo hablemos del tratamiento antimicrobiano como herramienta terapéutica no debemos olvidar que nuestra máxima posibilidad de éxito depende de la extracción completa del dispositivo, a ser posible mediante tracción percutánea endovascular (TPE) y nunca hay que perder de vista ese objetivo.
¿Qué antimicrobiano debemos utilizar?El mejor antimicrobiano es por tanto aquel que puede conseguir una concentración varias veces por encima de la CMI en el medio problema (donde se halla asentado el microorganismo y por ende la infección). Añadido a esto podemos exigir además que sea poco tóxico (poco efectos secundarios e indeseables), que alcance buenas concentraciones en el medio problema (cosa casi imposible cuando se habla de infecciones en biomateriales) y luego podemos incluso pedir que tenga buena biodisponibilidad para poder darlo por vía oral, lo que va a facilitar las cosas.
La mayoría de las infecciones sobre DEC van a estar producidas por cocos grampositivos (Staphylococcus aureus, estafilococos coagulasa negativos, estreptococos…) y en un porcentaje alrededor de 10% por bacilos gramnegativos e incluso anaerobios (Cutibacterium acnes)3,4. Los betalactámicos son siempre, por su amplio margen terapéutico (diferencia entre concentración eficaz y concentración tóxica) y en general pocos efectos secundarios, los antimicrobianos habitualmente preferidos. Sin embargo, un porcentaje considerable (60-80%) de los estafilococos coagulasa negativos son resistentes a la mayoría de betalactámicos, por lo que frecuentemente deberemos usar otros antimicrobianos (glicopéptidos, quinolonas, clindamicina, cotrimoxazol, linezolid…) con mayor toxicidad y dificultad de manejo, por lo que es fundamental que el tratamiento esté basado siempre en el antibiograma y a ser posible dirigido por un infectólogo con experiencia en el tema. Debe huirse, por tanto, del tratamiento empírico y tomar los cultivos con la técnica y el medio de cultivo adecuados, cuantas veces sea necesario al menos en infecciones locales, en las que no hay auténtica urgencia para tratar. Es preferible tomar siempre un alto inóculo (cuanta más muestra, mejor), lo que se logra en general aspirando líquido de la bolsa con una jeringa, en vez de mojando una torunda en un exudado y sembrando luego para aerobios y también para anaerobios (C. acnes), que requieren además un tiempo de incubación en ocasiones prolongado (7-10 días). En caso de cultivos repetidamente negativos pueden intentarse técnicas moleculares de detección genómica, que al menos determinarán el microorganismo responsable, y que incluso pueden informar sobre la resistencia a beta-lactámicos en cocos gram-positivos5. En caso de que los cultivos del exudado sean negativos, deben realizarse cultivos tisulares de la zona de la bolsa (durante la extracción) y de los cables extraídos, que van a aumentar mucho la rentabilidad6.
En las infecciones con síntomas sistémicos (fiebre, embolismos, diseminación de la infección a otros territorios…), es imprescindible tomar hemocultivos seriados por su alta rentabilidad (mayor de 90%) antes de empezar un tratamiento empírico. Hay que tener en cuenta que un tratamiento empírico inapropiado puede no ser eficaz, pero suficiente para inhibir un crecimiento en sangre de los microorganismos implicados (hemocultivos negativos por toma previa de antibióticos), privándonos así de un pilar básico para el diagnóstico. En efecto, sabemos que un microorganismo que es capaz de alcanzar la sangre no resiste más de 20-30 min la acción de los diversos mecanismos que componen la inmunidad innata (polimorfonucleares, macrófagos, células NK, sistema del complemento, cininas, etc.) y que hacen del torrente sanguíneo un medio muy hostil para cualquier bacteria. Por tanto, varias tomas separadas por intervalos de tiempo de por ejemplo, 30 min (lo que denominamos «tanda» de hemocultivos), que muestren una constante positividad (bacteriemia «continua») en pacientes con una inmunidad no alterada, solo es posible en infecciones con muy alto inóculo en el foco problema o aquellas en contacto permanente con la sangre (válvulas cardiacas, catéteres, cables…). De ahí la importancia de la toma de hemocultivos seriados (basal, 30 min, 60 min), ya que su constante positividad nos confirma un diagnóstico que en ocasiones no puede ser refrendado por otra técnica, por ejemplo la ecografía transesofágica (ETE), que no siempre es capaz de visualizar vegetaciones.
En la tabla 1 se muestran las pautas que recomendamos para la mayoría de las infecciones en DEC, basadas en la mayoría de los aislamientos obtenidos en la mayoría de las series.
Pautas de tratamiento utilizadas en las principales infecciones
| Etiología | Infecciones sistémicas | Infecciones locales o sistémicas tras extracción del dispositivo |
|---|---|---|
| ECN y S. aureus MS | Cloxacilina 2 g i.v./4-6 hCefazolina 2 g/8 h i.v.Vancomicina, teicoplanina o daptomicina si alergia a beta-lactámicos | Cefadroxilo 1 g/12 h oralCiprofloxacino 500 mg/12 h oLevofloxacino 500 mg/24 h oral |
| ECN y S. aureus MR* | Vancomicina 15-20 mg/kg/12 h i.v.Teicoplanina 10 mg/kg/24 h i.v.Daptomicina 10 mg/kg/24 h | Clindamicina 300 mg/8 h oralCotrimoxazol 160/800/12 h oralLinezolid 600 mg/12 h oral |
| Streptococcus spp. | Ceftriaxona 2 g/24 h i.v. | Amoxicilina 1 g/6 h oral |
| Enterocococcus spp. | Ampicilina 2 g/4 h i.v. + ceftriaxona 2 g i.v./4 hVancomicina, teicoplanina o daptomicina si alergia a betalactámicos o R a ampicilina | Amoxicilina 1 g/6 h oralLinezolid 600 mg/12 h oral si alergia a betalactámicos o R a ampicilina |
| Bacilos gramnegativos | Ceftriaxona 2 g/24 i.v.Ceftazidina 2 g/8 h i.v.Meropenem 1 g/8 h i.v. | Ciprofloxacino 500 mg/12 h oLevofloxacino 500 mg/24 h oral |
| Anaerobios | Ampicilina 2 g/6 h i.v.Clindamicina 600 mg/h i.v. si alergia a betalactámicos | Amoxicilina 1 g/6 h oralClindamicina 300 mg/8 h oral si alergia a betalactámicos |
ECN: estafilococos coagulasa-negativos; MR: meticilín-resistentes.
En las infecciones locales es importante determinar el tiempo de evolución (aparición de síntomas desde la implantación o la última manipulación), la forma de presentación (inflamación sin supuración, inflamación con supuración y fístula crónica con o sin extrusión del dispositivo), así como el microorganismo productor.
Como norma general, es preciso aclarar que en las formas de inflamación con supuración (comprobada mediante dehiscencia de la herida o aspiración con aguja), el tratamiento es siempre la extracción completa del sistema, ya que el alto inóculo existente o la agresividad del microorganismo (generalmente S. aureus o gramnegativos, esencialmente si ha habido hematoma previo) va a hacer casi imposible la curación con un tratamiento médico exclusivo. Una vez obtenido el cultivo y con la guía del antibiograma, puede iniciarse el tratamiento antimicrobiano mientras se programa la extracción. Esto va a reducir los síntomas del paciente y también evitar en gran manera la transformación en una infección sistémica por la progresión de la infección desde la bolsa hasta el torrente vascular, siguiendo el camino señalado por los cables del dispositivo, lo que es muy frecuente en determinados microorganismos con alto potencial destructivo (S. aureus). El tratamiento puede realizarse por vía oral y prolongarse entre una y dos semanas tras la extracción de todo el material, aunque no disponemos de evidencias científicas para esta recomendación3,4. A falta de estudios randomizados, los infectólogos tienden a prolongar el tratamiento a dos semanas en aquellas infecciones producidas por S. aureus7, pero en nuestra experiencia, si se ha hecho una resección adecuada de la bolsa, no hemos visto diferencias entre una y dos semanas y si se dispone de agentes con buena actividad frente al microorganismo y adecuada biodisponibilidad, el tratamiento puede realizarse por vía oral, lo que obvia la necesidad de una hospitalización prolongada.
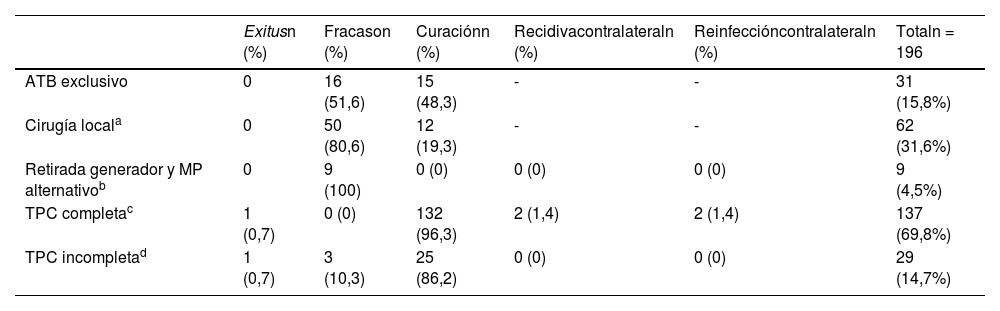
En caso de que el paciente presente una fístula crónica con exudación recurrente (que puede ser mínima) es también recomendable la extracción, pues el prolongado tiempo de evolución ya nos indica la formación de una biopelícula que solo puede ser erradicada mediante la extracción completa. Estos casos suelen debutar muchos meses después del procedimiento y están generalmente causados por estafilococos coagulasa-negativos o por C. acnes, que son microorganismos de lento desarrollo. Por tanto, no debe haber prisa alguna por iniciar el tratamiento antimicrobiano y en el caso en que los cultivos sean negativos, puede incluso demorarse hasta el día de la extracción procesando microbiológicamente los tejidos de la bolsa extraída6 y realizando también cultivo de los cables con sonicación previa, lo que va a aumentar la rentabilidad de los mismos8,9. De igual modo, es conveniente guardar una muestra para realizar técnicas genómicas, si hubiera disponibilidad10. El tratamiento puede emplearse por vía oral y no es preciso prolongarlo más allá de una semana tras la extracción. La misma recomendación es extensible para los casos en que no existe un claro exudado, los cultivos son negativos, pero hay una rotura de la piel, con extrusión parcial o incluso completa del dispositivo, lo que a menudo hace catalogarlos como «decúbito estéril». Sin embargo, aún asumiendo una posible etología «mecánica» de la extrusión en pacientes con implantación muy superficial del dispositivo, cuando se rompe la piel todo el dispositivo va a estar colonizado en muy breve tiempo por la flora cutánea de proximidad, incluyendo la parte proximal de los cables que está conectada al generador, por lo que las cirugías de limpieza (con o sin recambio del generador) que dejan los cables in situ van a cosechar repetidos fracasos en la mayoría de los casos. En la tabla 2 se exponen los diversos abordajes y su resultado obtenidos en nuestro centro, en la que puede observarse cómo el abordaje meramente «local» no llega ni a 20% de curaciones y habitualmente es responsable de varias cirugías sucesivas («reprofundizaciones») que no hacen más que entorpecer la solución final. En los casos en que la extracción de todo el sistema se presuponga muy dificultosa, puede intentarse el tratamiento antimicrobiano curativo, pero en nuestra experiencia hay que señalar que solo es efectivo en los casos con un tiempo de evolución entre el implante y/o la manipulación sea inferior a un mes. Cincuenta por ciento de curaciones que reflejamos en nuestra serie se lograron mayoritariamente en los casos de corto tiempo de evolución, escasa supuración en la bolsa y producidos por microorganismos poco agresivos. En la tabla 3 exponemos las diferencias observadas cuando se utilizó el tratamiento médico exclusivo. Estos cuadros son catalogados en ocasiones como «fenómenos inflamatorios» o «celulitis superficial», en teoría producidos por la propia implantación del DEC, e incluso se ha recomendado no tratar, porque en ocasiones se resuelven espontáneamente. Nuestra opinión es de que se trata de auténticas infecciones, ya que si tomamos cultivos adecuados mediante punción de la bolsa, o una vez extraídos los cables, suelen ser positivos. Sin embargo, es un hecho observado que algunas pueden resolverse espontáneamente o incluso con un corto tiempo de tratamiento antimicrobiano, pero posiblemente esto se deba a que se establece un equilibrio entre hospedador y huésped. Este equilibrio aparente puede en ocasiones romperse meses más adelante al realizarse en la zona una nueva manipulación o sufrir un traumatismo, que parece actuar como un predisponente para el reinicio de los síntomas inflamatorios11. Por ello, al menos en los casos en que el cultivo de la bolsa sea positivo, nuestra recomendación es tratar durante cuatro a seis semanas basándonos en que un tratamiento precoz cuando la estructura del biofilm aún no se ha establecido del todo, quizás pudiera erradicar la infección. No obstante, nunca se insistirá demasiado en que la mejor estrategia es la extracción completa por manos experimentadas.
Infecciones locales y resultados según el abordaje terapéutico (datos del HU Virgen del Rocío)
| Exitusn (%) | Fracason (%) | Curaciónn (%) | Recidivacontralateraln (%) | Reinfeccióncontralateraln (%) | Totaln = 196 | |
|---|---|---|---|---|---|---|
| ATB exclusivo | 0 | 16 (51,6) | 15 (48,3) | - | - | 31 (15,8%) |
| Cirugía locala | 0 | 50 (80,6) | 12 (19,3) | - | - | 62 (31,6%) |
| Retirada generador y MP alternativob | 0 | 9 (100) | 0 (0) | 0 (0) | 0 (0) | 9 (4,5%) |
| TPC completac | 1 (0,7) | 0 (0) | 132 (96,3) | 2 (1,4) | 2 (1,4) | 137 (69,8%) |
| TPC incompletad | 1 (0,7) | 3 (10,3) | 25 (86,2) | 0 (0) | 0 (0) | 29 (14,7%) |
ATB: tratamiento antibiótico; MP: marcapaso; TPC: tracción percutánea.
Características de las infecciones tratadas exclusivamente con tratamiento antimicrobiano (n = 31) como abordaje inicial (Hospital Universitario Virgen del Rocío)
| Curación (n = 15) | Fracaso (n = 16) | |
|---|---|---|
| Etiología | ||
| ECN | 8 | 9 |
| S. aureus | 0 | 2 |
| Gramnegativos | 1 | 0 |
| P. acnes | 3 | 2 |
| Polimicrobiana | 0 | 2 |
| Sin aislamiento | 3 | 1 |
| Mediana (días) Tiempo de evolución (p25, p75) | 10 (3, 15) | 37,5 (19, 187) |
| Rotura de piel | 4 (28,6%) | 11 (64,7%) |
| Mediana (días) Tiempo de tratamiento (p25, p75) | 60 (40, 90) | 80 (60, 120) |
ECN: Estafilococos coagulasa-negativos.
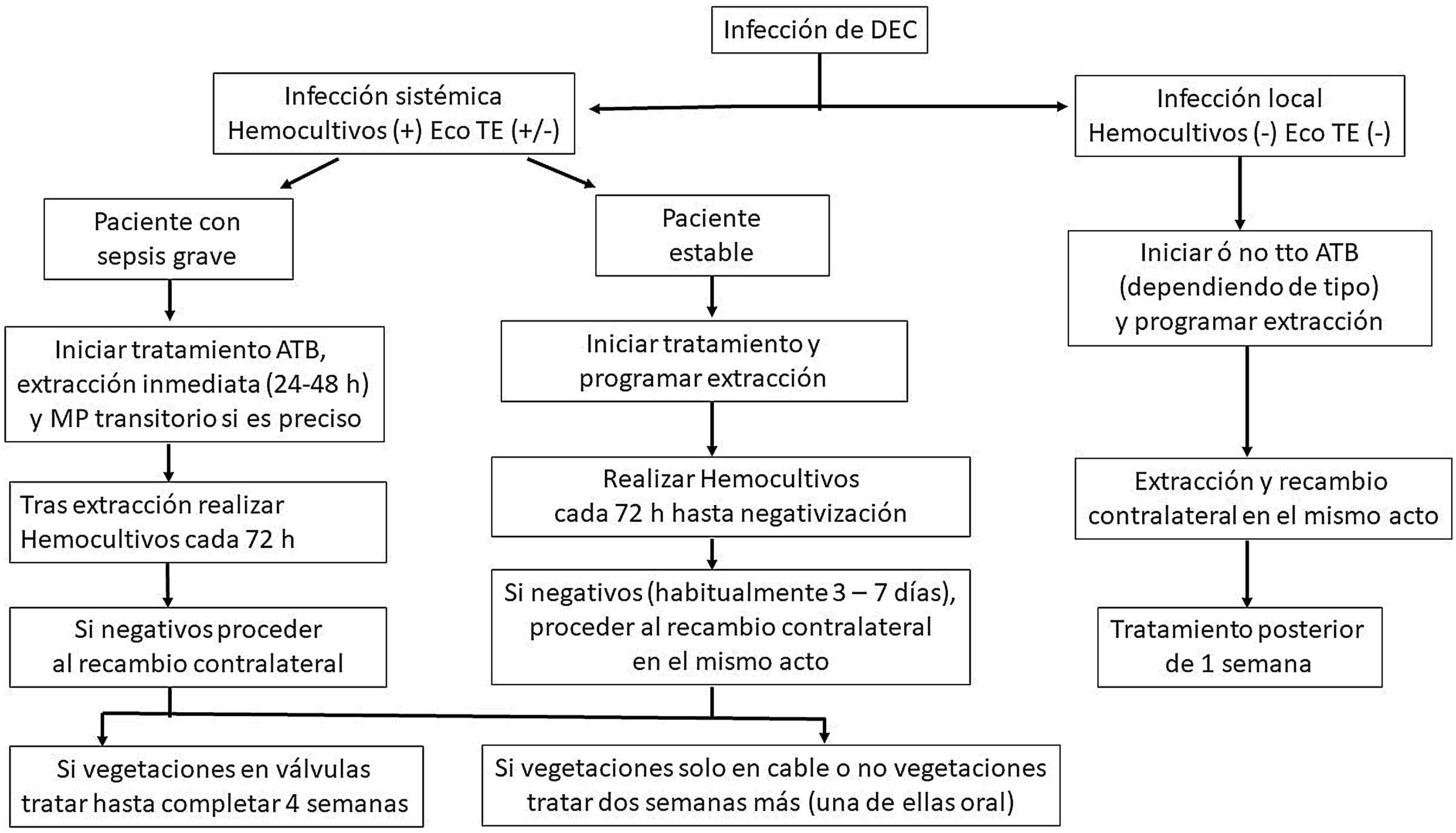
En la infección sistémica, el paciente debe ser tratado precozmente. En presencia de signos de sepsis grave, a la par que se toman los hemocultivos (y los cultivos de la bolsa si hay también signos locales), debe iniciarse el tratamiento empírico contra grampositivos y gramnegativos hasta que el antibiograma nos permita definir mejor la pauta apropiada. En caso de que el paciente esté estable y lleve con fiebre mucho tiempo, no hay tanta prisa porque la infección suele estar producida por estafilococos coagulasa-negativos, que tienen escasa agresividad (si lleva con fiebre varios meses, no va a pasar nada porque espere 24-48 h al resultado de los hemocultivos). En muchas ocasiones, los pacientes han iniciado ya tratamiento empírico prescrito en urgencias o por sus médicos de atención primaria, dificultando así un diagnóstico microbiológico adecuado. En estos casos puede incluso suspenderse el antimicrobiano dejando hasta cinco a siete días de «lavado» antibiótico para volver a tomar cultivos.
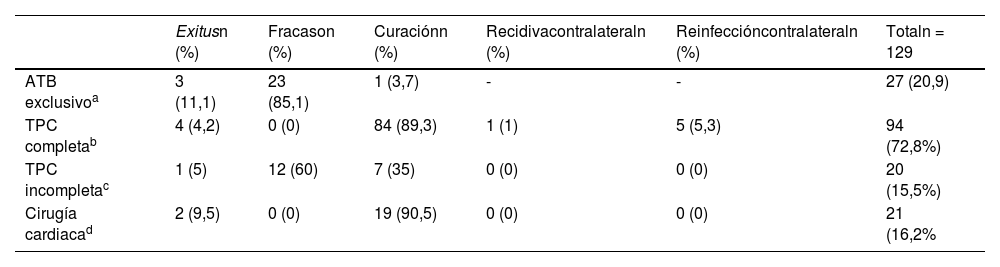
De todas formas, una infección sistémica hace necesaria la extracción completa del dispositivo, bien mediante tracción percutánea endovascular en centros especializados, o bien mediante cirugía cardíaca si lo anterior no fuera posible. Aunque hay descripciones de curaciones en casos aislados con tratamiento antimicrobiano exclusivamente12, solo hay un trabajo en la literatura13 que apoya el tratamiento antimicrobiano de manera pautada en pacientes sin signos de inflamación en la bolsa ni vegetaciones en los cables observadas mediante ecocardiografía transesofágica, lo que supondría una infección en teoría «exclusiva» de los cables y con bajo inóculo (al no observarse vegetaciones). Los autores reportan una tasa de éxito de 100% en todos ellos (19 pacientes), pero nuestra experiencia ha sido muy diferente, como puede observarse en la tabla 4. No recomendamos por tanto esta actuación y creemos que debe procederse a la extracción completa por vía percutánea lo más rápido posible, lo que en manos experimentadas arroja unos resultados excelentes y con relativamente bajo índice de mortalidad y complicaciones (1-2%). En pacientes muy frágiles, añosos y de muy difícil extracción fundamentalmente por el número de años del implante, se han realizado intentos de manejo conservador tal como detallaremos más adelante, pero generalmente con consecuencias ominosas14.
Infecciones sistémicas y resultado según el abordaje empleado (Hospital Universitario Virgen del Rocío)
| Exitusn (%) | Fracason (%) | Curaciónn (%) | Recidivacontralateraln (%) | Reinfeccióncontralateraln (%) | Totaln = 129 | |
|---|---|---|---|---|---|---|
| ATB exclusivoa | 3 (11,1) | 23 (85,1) | 1 (3,7) | - | - | 27 (20,9) |
| TPC completab | 4 (4,2) | 0 (0) | 84 (89,3) | 1 (1) | 5 (5,3) | 94 (72,8%) |
| TPC incompletac | 1 (5) | 12 (60) | 7 (35) | 0 (0) | 0 (0) | 20 (15,5%) |
| Cirugía cardiacad | 2 (9,5) | 0 (0) | 19 (90,5) | 0 (0) | 0 (0) | 21 (16,2% |
ATB: tratamiento antibiótico; TPC: tracción percutánea.
Quince pacientes no tenían síntomas locales y la ecografía realizada en 14 de ellos mostró vegetaciones en 10. Otros 12 pacientes tenían síntomas locales y la ecografía realizada en 10 mostró vegetaciones en siete de ellos.
En el caso (por fortuna la mayoría de las veces) en que logremos la extracción completa del sistema, la duración del tratamiento recomendada en las guías es de dos a cuatro semanas postextracción3,4. Nosotros tratamos dos semanas en todos los pacientes, salvo en aquellos con afectación de la válvula tricúspide en cuyo caso lo prolongamos hasta cuatro semanas postextracción. Inicialmente son recomendables las dosis máximas de antimicrobianos por vía endovenosa (tabla 1), aunque tras la extracción completa nosotros hemos realizado casi siempre el paso a vía oral tras una semana, sin observar complicaciones. En caso de que la extracción percutánea no haya sido completa (por rotura de cables, por ejemplo) debe procederse a la extracción mediante cirugía cardiaca abierta, si bien en estos pacientes es esperable una mayor mortalidad15.
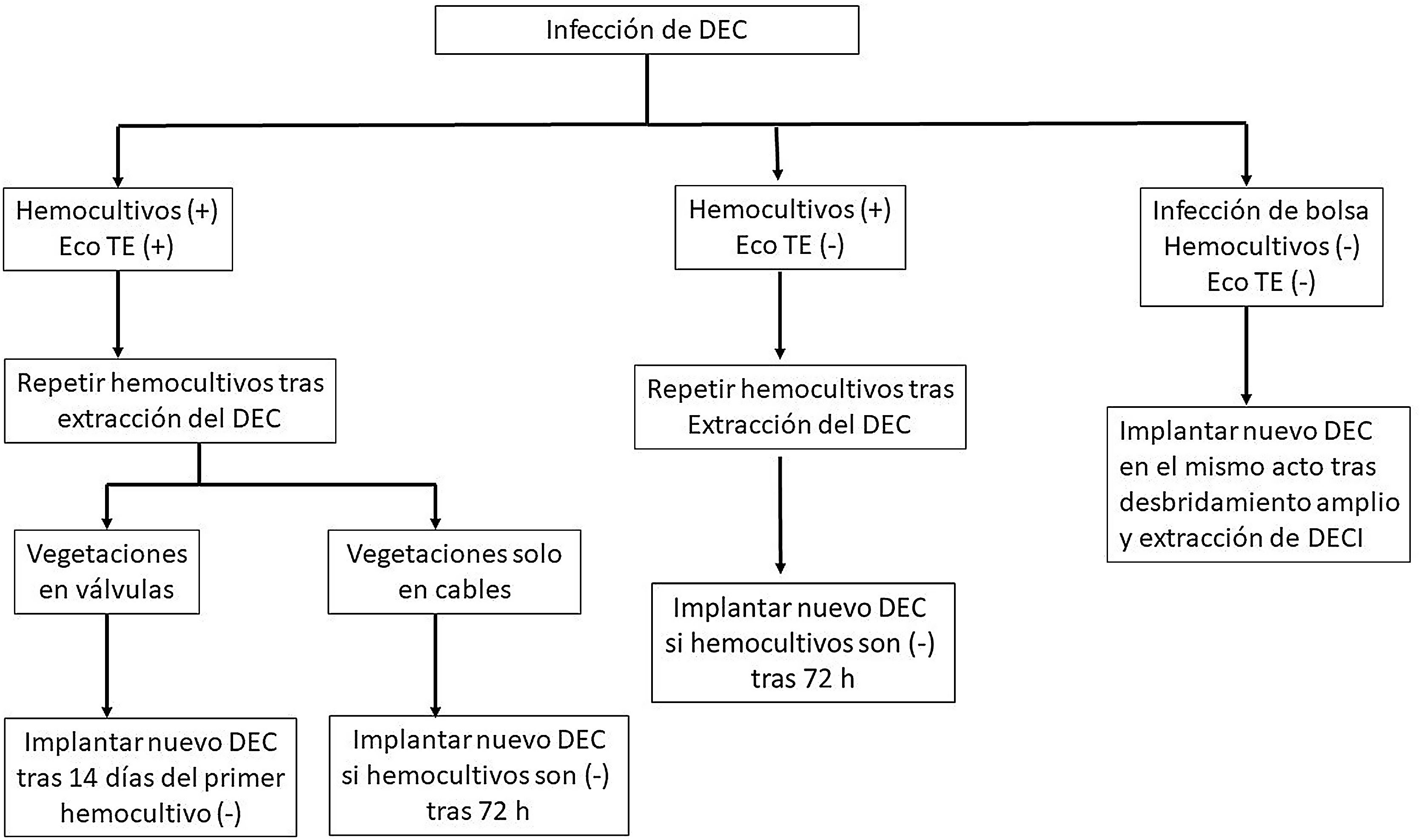
Reimplante del nuevo dispositivoEl momento de reimplantación de un dispositivo es un tema controvertido. Una vez bien establecida la necesidad del reimplante, suele hacerse en el lado contralateral al de la infección para evitar así la contaminación del nuevo sistema. Sin embargo, el miedo a una contaminación del nuevo implante ha llevado a proponer, sin ningún tipo de evidencia, la reimplantación diferida, con un intervalo «puente» de entre 72 h y cuatro semanas dependiendo del tipo de infección (local o sistémica), la existencia o no de vegetaciones en los cables, la afectación de la válvula tricúspide y el microorganismo identificado3,4. En una encuesta realizada en 164 centros de 30 países europeos16 el intervalo «puente» osciló entre 48 h y una semana en caso de infecciones locales y tres a 14 días en infecciones sistémicas si el paciente era marcapasos-dependiente. En caso contrario, los tiempos fueron de una a cuatro semanas para las infecciones locales y dos a cuatro para las infecciones sistémicas. Parece deducirse pues, que en pacientes estrictamente dependientes, la necesidad de mantener un sistema transitorio «puente» antes del reimplante definitivo (marcapasos transvenoso transitorio por vía yugular o femoral o incluso marcapaso epicárdico) con las molestias que conlleva (desinserciones, necesidad de encamamiento, tiempo de hospitalización, empeoramiento de la función hemodinámica por estimulación monocameral17, etc.) «aceleraba» la reimplantación. Algunas series americanas de hecho acortaban el periodo exigido18,19 y las últimas guías4 proponen la realización de hemocultivos tras el explante y si son negativos a las 72 h recomiendan realizar el reimplante en ese tiempo, salvo que existiesen vegetaciones en tricúspide, en cuyo caso aconsejan 14 días de intervalo (fig. 1). Sin embargo, las razones para este esquema no están basadas en evidencia alguna y de hecho existen trabajos que demuestran una mayor tasa de infección de un nuevo implante en pacientes que han tenido colocado un dispositivo transitorio20, por lo que parece contradictorio aconsejar, para evitar una nueva infección, un procedimiento que en sí mismo aumenta el riesgo de la misma. Por otra parte, se han comunicado trabajos con reimplantes en el mismo acto en infecciones locales, sin que ello supusiera un mayor número de recidivas contralaterales19,21. Inclusive existe un trabajo publicado en el que se mezclaban infecciones locales (n = 51) e infecciones sistémicas (n = 17) con reimplante en el mismo acto e igual ausencia de recidivas22. Esto tampoco debería extrañarnos si tenemos en cuenta los datos experimentales de que disponemos. En efecto, se ha demostrado que concentraciones de antimicrobianos por debajo de la CMI inhiben fuertemente la adherencia de los microorganismos a biosuperficies23,24. Si a esto añadimos la desaparición de formas infectantes en el torrente sanguíneo (negativización de hemocultivos bajo tratamiento antibiótico) parece muy improbable la contaminación de un nuevo sistema, aunque se haga en el mismo momento del explante del dispositivo infectado, como también se ha demostrado con otros biomateriales25.
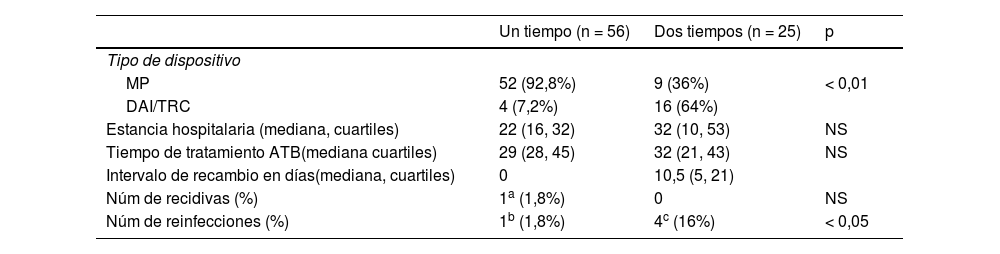
Nuestra experiencia en este sentido es muy similar, habiendo realizado reimplantes en uno o dos tiempos que por razones técnicas han agrupado a la mayoría de los reimplantes de marcapasos en un tiempo, ya que son extraídos por los cirujanos cardiacos que también los implantan en el mismo acto quirúrgico y realizan el seguimiento posterior. En cambio, los pacientes con indicación (primaria o secundaria) de un desfibrilador automático implantable o susceptibles de terapia de resincronización, son controlados por los cardiólogos que realizan estos implantes, por lo que los dispositivos infectados eran explantados en el quirófano de cirugía cardiaca un día y normalmente a las 48 h se realizaba el reimplante en la sala de electrofisiología por los cardiólogos. No obstante estas peculiaridades, puede apreciarse que no hubo diferencias en el número de recidivas (infección por el mismo microorganismo) contralaterales y sí en cambio un mayor número de nuevas infecciones en los dispositivos implantados en dos tiempos (tablas 5 y 6). Esto podría explicarse por las mayores dificultades que implican estos implantes (generadores más voluminosos, necesidad de canalización de seno coronario con más tiempo de procedimiento, pacientes más frágiles con insuficiencia cardiaca, y a menudo anticoagulados) comparados con los marcapasos y que favorecen más infecciones en este tipo de dispositivos20. Sin embargo, llama la atención que estas nuevas infecciones contralaterales eran producidas por microorganismos resistentes a los antibióticos utilizados para tratar la infección inicial (habitualmente grampositivos), lo que hace pensar en una colonización por flora no habitual (gramnegativos) tras la reducción de la flora cutánea residente debido a un tratamiento antimicrobiano prolongado, fenómeno conocido como «selección de flora»26.
Características de los pacientes con infecciones locales sometidas a TPC y reimplante en uno o dos tiempos
| Un tiempo (n = 96) | Dos tiempos (n = 32) | p | |
|---|---|---|---|
| Tipo de dispositivo | |||
| MP | 82 (85,5%) | 7 (21,8%) | < 0,01 |
| DAI/TRC | 14 (14,5%) | 25 (78,2%) | |
| Estancia hospitalaria(mediana, cuartiles) | 8 (6, 17) | 8 (5, 23) | NS |
| Tiempo de tratamiento ATB(mediana quartiles) | 21 (17, 28) | 21 (21, 28) | NS |
| Intervalo de recambio en días(mediana, cuartiles) | 0 | 6 (4, 9) | |
| Núm de recidivas (%) | 1a (1%) | 1b (3%) | NS |
| Núm de reinfecciones (%) | 2c (2%) | 0 | NS |
MP: marcapasos; DAI: desfibrilador automático implantable; TRC: terapia de resincronización cardiaca; ATB: tratamiento antibiótico.
Características de los pacientes con infecciones sistémicas sometidas a TPC y reimplante en uno o dos tiempos
| Un tiempo (n = 56) | Dos tiempos (n = 25) | p | |
|---|---|---|---|
| Tipo de dispositivo | |||
| MP | 52 (92,8%) | 9 (36%) | < 0,01 |
| DAI/TRC | 4 (7,2%) | 16 (64%) | |
| Estancia hospitalaria (mediana, cuartiles) | 22 (16, 32) | 32 (10, 53) | NS |
| Tiempo de tratamiento ATB(mediana cuartiles) | 29 (28, 45) | 32 (21, 43) | NS |
| Intervalo de recambio en días(mediana, cuartiles) | 0 | 10,5 (5, 21) | |
| Núm de recidivas (%) | 1a (1,8%) | 0 | NS |
| Núm de reinfecciones (%) | 1b (1,8%) | 4c (16%) | < 0,05 |
MP: marcapaso; DAI: desfibrilador automático implantable; TRC: terapia de resincronización cardiaca; ATB: tratamiento antibiótico.
Por tanto, aunque los grupos no son exactamente comparables, creemos que no hay razones para sostener un abordaje sistemático en dos tiempos, que muchas veces lo que único que produce es un mayor tiempo de hospitalización, mayor posibilidad de complicaciones en pacientes frágiles e incluso favorece la infección por microorganismos diferentes a los tratados (y a menudo más resistentes). La única condición para hacer esto en infecciones sistémicas es que los hemocultivos de control bajo tratamiento antimicrobiano deben ser negativos, lo que habitualmente se consigue a la semana de iniciar el tratamiento (fig. 2). En caso de no conseguir la negatividad o precisar el paciente una extracción pronta (por ejemplo, si hay datos de sepsis grave) preferimos realizar la extracción y reimplante en dos tiempos (con sistema transitorio de estimulación en pacientes estrictamente dependientes de marcapaso) y siguiendo las indicaciones de las guías, reimplantar lo antes posible cuando se hayan negativizado los cultivos.
Tratamiento antimicrobiano supresor crónicoEn las infecciones locales en las que no puede retirarse el dispositivo completo y han fracasado los abordajes locales, el tratamiento antimicrobiano prolongado puede atenuar los síntomas de infección, si bien en casos de escasa exudación y ya una vez producida la extrusión parcial o total del dispositivo, va a ser de muy poca utilidad, por lo que no lo recomendamos rutinariamente, salvo sospecha de infección local complicada.
Otras veces, la extracción mediante TPE no es completa por rotura de los cables durante el procedimiento. En casos de que se trate de una infección local, la extracción del generador y parte de los cables en ocasiones es suficiente para curar el proceso (tabla 2), aunque como hemos dicho antes, pueden producirse recidivas tardías en forma de infecciones sistémicas, debido a la infección persistente en los fragmentos intravasculares retenidos. Esto es así porque en ocasiones la diferencia entre una infección local y una sistémica se basa únicamente en la expresión clínica, pero no es raro cuando realizamos extracciones de sistemas con infección local de largo tiempo de evolución, encontrar pus en el interior de los cables, preludio de una futura expresión sistémica que aún no se ha manifestado cono tal11. Estas recidivas por material retenido en forma de infección sistémica, así como las que ya lo eran desde un inicio, obligan a recurrir a la cirugía cardiaca cuando todas las técnicas percutáneas alternativas (lazo/asa por vías femoral o yugular) han fracasado. Sin embargo, en algunos pacientes muy añosos y con graves comorbilidades este proceder puede juzgarse inaceptable. En estos casos, un tratamiento antimicrobiano muy prolongado (especialmente si la vía oral es posible) puede ser la única alternativa, aunque nadie ha determinado el tiempo necesario antes de la suspensión, ni tampoco los factores que harían predecir un éxito con esta actuación27–29. De todas formas, la estrategia de salvamento de los dispositivos con tratamiento antimicrobiano creemos que solo puede ser válida para microorganismos poco agresivos (ECN, por ejemplo) y susceptibles de ser tratados con un fármaco con buena biodisponibilidad y buena tolerancia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.