«La anuloplastia De Vega es una ingeniosa y exitosa técnica. Solo puede fallar cuando se utiliza indiscriminadamente ante una inadecuada enfermedad tricúspide».
INTRODUCCIÓN
Después de la primera descripción en autopsia de la endocarditis infecciosa realizada por Lazaire Riviere en 1723, Osler presentó la endocarditis en 1885 en sus conferencias en el Real Colegio de Médicos como una enfermedad maligna considerada en todas sus formas como un proceso micótico1. La enfermedad tenía un alto riesgo de morbilidad y mortalidad, pero afortunadamente se pudo empezar a tratar cuando Alexander Fleming descubrió la penicilina en septiembre de 1928. Posteriormente, Lerner y Weinstein presentaron en 1966 una serie de publicaciones en el New England Journal of Medicine sobre la «endocarditis infecciosa en la era de los antibióticos», mostrando mejor supervivencia en el curso de la enfermedad con la terapia antimicrobiana2-5.
Aunque la introducción de la terapia antimicrobiana ha cambiado significativamente el curso de la endocarditis aguda, la resección quirúrgica o la desinfección local de la válvula infectada y su reparación siguió siendo necesaria para aquellos pacientes que desarrollaban resistencia a los antibióticos. Posteriormente, y en base a los trabajos pioneros de Wallace en 1963 y Robiscek en 1967 con el reemplazamiento de válvulas aórtica y mitral infectadas, respectivamente, otros cirujanos siguieron su ejemplo reemplazando válvulas cardíacas infectadas resistentes al tratamiento con antibióticos6,7.
En 1978, Chandraratna, et al. describen en los casos de endocarditis de la válvula tricúspide con afectación localizada, la escisión de los puntos infectados y la reconstrucción de la válvula como una opción posible de tratamiento8; y los principios técnicos para esta reparación fueron expuestos posteriormente por Yee y Khonsari14. La endocarditis infecciosa del lado derecho representa el 5-10% de todas las endocarditis infecciosas según nos muestran diversas series15 (Tabla I).
ENDOCARDITIS TRICÚSPIDE
Criterios diagnósticos de duke para la endocarditis infecciosa
Los criterios para el diagnóstico de endocarditis infecciosa fueron desarrollados por Durack, et al. y se basan en las características clínicas, microbiológicas, anatomopatológicas y ecocardiográficas de cada paciente16.
Factores predisponentes
Los usuarios de drogas endovenosas (adictos a drogas), catéteres y dispositivos endovenosos (marcapasos, catéteres centrales venosos) en el lado derecho del corazón; sepsis, alcoholismo, enfermedades congénitas del corazón17.
Manifestación clínica
Fiebre persistente, bacteriemia, neumonía (70-100% de los pacientes), embolia pulmonar séptica múltiple (70-100% de los pacientes), dolor de pecho, disnea, tos, hemoptisis, síntomas neurológicos por embolia paradójica ante la presencia de foramen oval permeable17.
Indicaciones quirúrgicas y el momento para la cirugía
Fiebre persistente durante más de tres semanas de tratamiento antibiótico adecuado, la insuficiencia cardíaca derecha intratable a pesar de una apropiada terapia médica, sepsis no controlada a pesar del tratamiento antibiótico adecuado, absceso paravalvular, endocarditis fúngica, endocarditis concomitante del lado izquierdo, vegetación de gran tamaño (diámetro > 10 mm) e historia de la embolia séptica pulmonar recurrente17,18.
Enfermedad de la válvula
Vegetaciones grandes, formación de absceso perianular, perforación de velo, destrucción total o parcial de los velos, rotura de cuerdas tendinosas, válvula tricúspide frágil con moderada o grave regurgitación19-25.
Estructuras importantes alrededor de la válvula tricúspide
Triángulo de Koch
Es un área más o menos triangular en la pared septal de la aurícula derecha, limitada por la base de la valva septal de la válvula tricúspide, el margen anteromedial del orificio del seno coronario (o la válvula Tebesio), y el tendón de Todaro (extensión anterior de la válvula de Eustaquio). El tendón de Todaro marca el sitio del nodo auriculoventricular y el haz de His.
Tendón de Todaro
Un palpable haz subendocárdico de colágeno en la pared de la aurícula derecha, que se extiende desde el cuerpo fibroso central a través de la aorticus torus hacia el extremo medial de la válvula de la vena cava inferior.
Principios del manejo quirúrgico
Resumido en la tabla II.
- Esternotomía media o toracotomía anterolateral derecha (o minitoracotomía lateral derecha).
- La valvulectomía sin reemplazo ha sido el método escogido para los pacientes drogadictos persistentes o en los que no se puede excluir el uso recurrente de drogas.
- La extirpación completa y la sustitución por una válvula bioprotésica o mecánica.
- Resección en bloque de las cuerdas y los músculos papilares.
- Homoinjerto compuesto para el reemplazo de la válvula tricúspide.
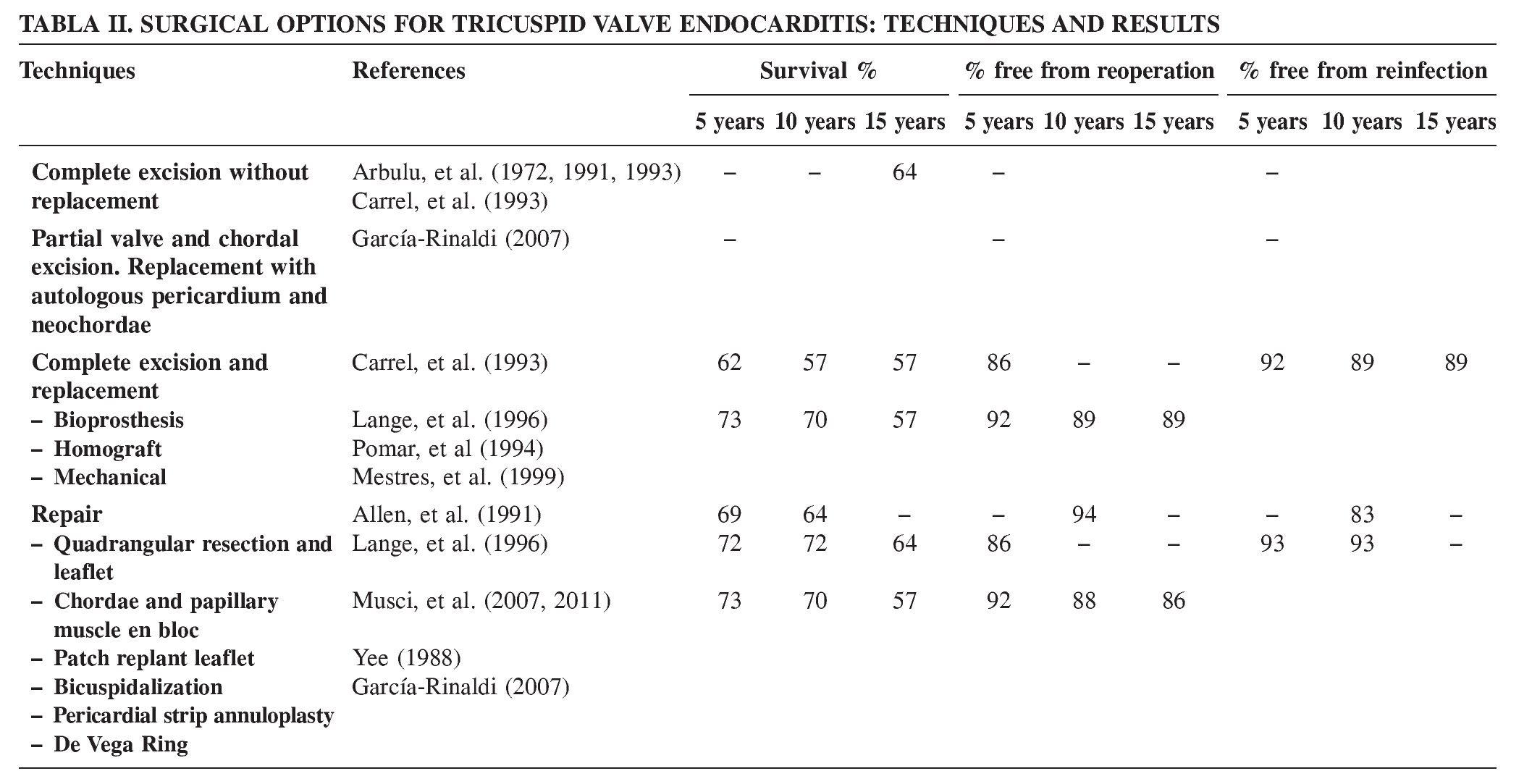
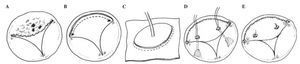
- Resección parcial del velo anterior y las cuerdas tendinosas, y reemplazo con un pericardio autólogo y cuerdas artificiales (Goretex), respectivamente (Figs. 1 A-E).
Figura 1. A: dibujo de una válvula tricúspide con endocarditis aguda predominantemente de la valva anterior. B: escisión del velo anterior infectado y las cuerdas correspondientes. C: técnica para la sustitución del velo anterior tricuspídeo con pericardio autólogo descrito por García-Rinaldi24: con ayuda de un medidor, se diseca y corta un fragmento apropiado de pericardio autólogo; la base del segmento que corresponderá con el velo anterior resecado es referenciado con suturas de sujeción. D: el parche de pericárdico se cose sobre el anillo anterior de la válvula tricúspide con sutura continua. Después de la implantación del velo, la longitud de las neocuerdas se mide y se inserta para garantizar la adecuada neocoaptación de los velos. E: completada la sustitución de la valva anterior de la válvula tricúspide. En presencia de dilatación anular sin hipertensión pulmonar, se considera necesaria la anuloplastia de De Vega con una tira pericárdica. Esta técnica implica un mínimo de material extraño, asegura un área de orificio efectivo no regurgitante y un buen funcionamiento de la válvula tricúspide, lo que permite una recuperación rápida de la función ventricular derecha y una baja tasa en recurrencia de endocarditis.
- Resección cuadrangular y reparación del velo.
- Bicuspidización y anillo de anuloplastia (anillo protésico en la endocarditis curada; preferiblemente anuloplastia con pericárdico para las endocarditis activas) en presencia de dilatación del anillo para restablecer un área normal de orificio efectivo.
- Reconstrucción pericárdica en las perforaciones de velo19-25.
Resultados
En las grandes series con reparación de la endocarditis de la válvula tricúspide la supervivencia (curvas de Kaplan-Meier) a los 5, 10 y 20 años de seguimiento está en unos rangos del 69,4 ± 8,8 al 73,5%, del 64,5 ± 9,5 al 70,4%, y del 57%, respectivamente26. En esta serie libre de reoperación a los 5 y 10 años fue del 92,2 ± 3,4 y 88,6 ± 4,8%, mientras que la tasa de reinfección fue significativamente mayor en los consumidores de drogas por vía parenteral (p < 0,0001)26.
En los estudios clínicos que comparan el reemplazo versus la reparación se muestra una supervivencia a los 10 años de 68,1 y 57,6%, y a los 20 años de 20,0 y 20,0% (p = 0,43); libres de reoperación en el mismo periodo fue del 88,6%26,27.
DISCUSIÓN
La anuloplastia tricúspide de De Vega tiene su lugar en la reparación de la endocarditis curada de la válvula tricúspide con moderada regurgitación y dilatación moderada del anillo en presencia de presiones pulmonares normales. Desde su introducción en la cirugía cardíaca esta técnica ha salvado miles de vidas de pacientes. El procedimiento ha sentado los principios de la anuloplastia para la dilatación anular de la válvula auriculoventricular, y ha sido modificada por muchos cirujanos, quienes la han perfeccionado24-28. La comunidad quirúrgica mundial ha reconocido el trabajo ingenioso y pionero de González de Vega N y, por lo tanto, merece una felicitación por el 40 aniversario de este procedimiento.
El reemplazo de la válvula tricúspide con homoinjertos aún está en manos de unos pocos cirujanos expertos. La reparación de la válvula tricúspide se puede realizar bajo supervisión tutelada con buenos resultados en centros con moderado volumen de cirugías. La cirugía reconstructiva y la sustitución de la válvula con homoinjerto en pacientes con VIH y en los consumidores de drogas por vía endovenosa requiere de un control postoperatorio especial para minimizar la recurrencia en estos pacientes28-30,32,33. Los velos perforados son fisiológicamente reparados mediante un parche de pericardio autólogo, y los destruidos se sustituyen por pericardio autólogo utilizando la técnica de García-Rinaldi con sustitución neocordal, para restaurar la altura fisiológica de coaptación de las valvas y una rápida recuperación funcional de la hemodinámica del ventrículo derecho24 (Fig. 1). En presencia de endocarditis curadas con o sin válvula tricúspide frágil y dilatación anular, las técnicas de comisuroplastia y bicuspidización pueden proporcionar durabilidad a largo plazo25,31,33,34. La aplicación de un anillo de anuloplastia aseguraría la estabilidad del anillo valvular en presencia de hipertensión pulmonar crónica moderada. La terapia farmacológica antihipertensiva pulmonar se considera necesaria en estos pacientes. Desafortunadamente, no hay resultados específicos a largo plazo para las diferentes técnicas quirúrgicas descritas en la literatura debido al bajo número de pacientes.
En presencia de hipertensión pulmonar es preferible el reemplazo protésico de la válvula. La sustitución de la válvula por bioprótesis u homoinjerto puede ser considerada en los pacientes con alguna contraindicación para la anticoagulación a largo plazo o con una mala situación socioeconómica. La experiencia clínica en el adulto tras 20 años de seguimiento con sustitución valvular mecánica y bioprótesis en posición tricuspídea muestra que ambas tienen similares números de eventos relacionados con las prótesis. Las curvas actuariales de supervivencia a 20 años de seguimiento considerando en el análisis cualquier tipo de prótesis valvulares tricúspides (mecánicas y bioprótesis) fue del 65,1 ± 9,3%: 68,3 ± 10,6% para las mecánicas y 54,8 ± 12,1% para las prótesis biológicas; a los 20 años, en el grupo de válvula bioprotésica están libre de degeneración estructural el 90 ± 5,5%; y en el grupo de válvula mecánica, libres de deterioro, endocarditis y leak perivalvular el 97,8 ± 4,2%, y la ausencia de tromboembolismo el 92,6 ± 6,9%35. Estar libre de reoperación a los 5 y 10 años fue similar entre las mecánicas (86 y 76%) y las bioprótesis (97 y 83%) en otras series36.
CONCLUSIÓN
La cirugía de la endocarditis de la válvula tricúspide requiere de un manejo quirúrgico adecuado para comprender y dominar la compleja enfermedad de todo el aparato valvular tricuspídeo, y pueden ser necesarias técnicas reconstructivas extensas. La selección de una técnica quirúrgica adecuada restaurará la función del ventrículo derecho y la circulación venosa visceral. Una reconstrucción fisiológica de la válvula tricúspide asegura una durabilidad funcional a medio y largo plazo, con una baja tasa de infección recurrente. Un estricto control postoperatorio de los pacientes, especialmente consumidores de drogas por vía endovenosa, es una parte integral del tratamiento.
Tricuspid Valve Endocarditis: Evolution of Surgical Techniques and Options
"The De Vega annuloplasty is an ingenious and successful technique. It can only fail when you use it indiscriminately in an improper tricuspid pathology"
INTRODUCTION
Following the first description of infective endocarditis from autopsy findings by Lazaire Riviere in 1723,
Sir William Osler presented in 1885, in his Gulstonian lectures at the Royal college of Physicians, endocarditis as a malignant disease that is in all its forms a mycotic process1. The disease carried high risk of morbidity and mortality, but fortunately became treatable when penicillin was discovered by Sir Alexander Fleming in September 1928. Lemer and Weinstein presented in their series of publications on "Infective endocarditis in the antibiotic era", in 1966 in the New England Journal of Medicine, the impact of the live-saving antimicrobial therapy on the course of the disease2-5.
Although introduction of antimicrobial therapy has significantly changed the course of acute endocarditis, surgical resection or local disinfection of the infected valve and repair has been required, with success in patients in whom resistance to antibiotics developed. Based on the pioneering work by Wallace in 1963 and Robiscek in 1967 to replace infected aortic and mitral valves, respectively, other surgeons followed suit to replace infected cardiac valves which are resistant to antibiotic therapy6,7.
In 1978, Chandraratna, et al. described the excision of infected sites and valve reconstruction as a treatment option in cases of localized endocarditis involvement of the tricuspid valve8 and the technical principles were outlined by Yee and Khonsari14. Right-sided infective endocarditis accounts for 5-10% of all infective endocarditis according to population-based surveys15 (Table I).
DUKE DIAGNOSTIC CRITERIA FOR DIAGNOSING INFECTIVE ENDOCARDITIS
Criteria for diagnosing infective endocarditis were developed by Durack, et al. and they are based on the clinical, microbiological, pathological, and echocardiographic characteristics of the individual patient16.
Predisposing factors
Intravenous drug users, indwelling catheters and devices (pacemakers, central venous lines) to the right heart, sepsis, alcoholism, and congenital heart diseases17.
Clinical manifestation
Persistent fever, bacteremia, pneumonia (70-100% of patients), multiple septic pulmonary emboli (70-100% of patients), chest pains, dyspnea, cough, hemoptysis, neurological symptoms following paradoxical embolism in presence of foramen ovale17.
Indications and timing for surgery
Persisting fever for more than three weeks of adequate antibiotic therapy, intractable right heart failure despite appropriate anti-failure medical therapy, uncontrolled sepsis despite adequate antibiotic treatment, paravalvular abscess, fungal endocarditis, concomitant left-sided endocarditis, large vegetation size (diameter > 10-20 mm) and history of recurrent septic pulmonary embolism17,18.
Valve pathology
Large vegetations (< 10-22 mm), periannular abscess formation, leaflet perforation/s or complete or partial destruction, chordal rupture, frail tricuspid valve with moderate-to-severe regurgitation19-25.
Important structures around the tricuspid valve
Triangle of Koch
A roughly triangular area on the septal wall of the right atrium, bounded by the base of the septal leaflet of the tricuspid valve, the anteromedial margin of the orifice of the coronary sinus (or the Thebesian valve), and the Eustachian valve along with its anterior extension, the tendon of Todaro; it marks the site of the atrioventricular node and bundle of His.
Tendon of Todaro
A palpable subendocardial collagen bundle in the wall of the right atrium, extending from the central fibrous body across the torus aorticus toward the medial extremity of the valve of the inferior vena cava.
Surgical approach and principles
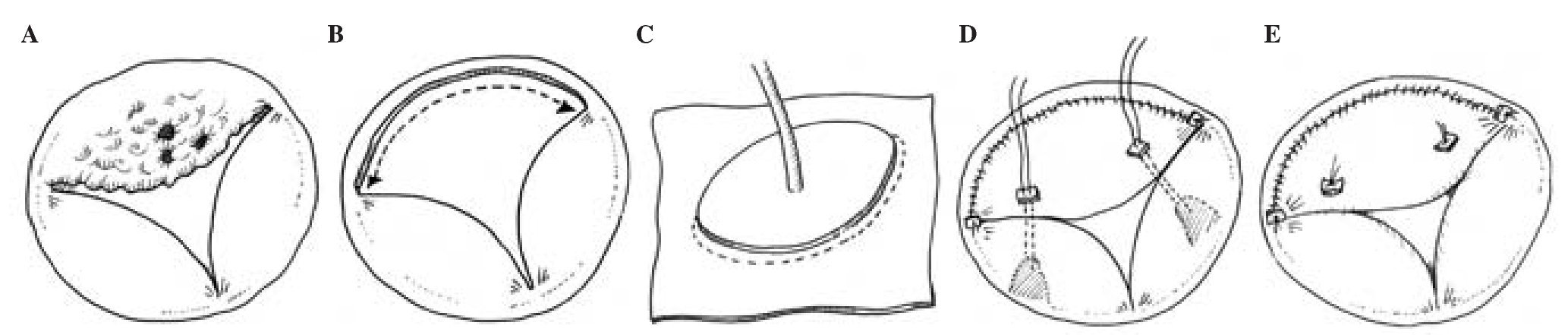
Median sternotomy or right anterolateral thoracotomy (or right lateral mini-thoracotomy). Valvulectomy without replacement was the chosen method for those where persistent or recurrent drug abuse could not be excluded. Complete excision and replacement with a bioprosthetic or mechanical valve. En bloc resection of the chordate and the papillary muscles. Composite homograft tricuspid valve replacement. Partial excision of anterior leaflet and chordae and replacement with an autologous pericardium and artificial chordae (Goretex), respectively (Figs. 1 A-E). Quadrangular resection and leaflet repair. Bicuspidalization and ring annuloplasty (synthetic for a healed endocarditis, preferably pericardial for active infective endocarditis) in presence of annulus dilatation to achieve a normal effective orifice area, pericardial reconstruction of a perforated leaflet19-25 (Table II).
Results
The Kaplan-Meir estimates of survival at five, 10, and 20 years ranges from 69.4 ± 8.8 to 73.5%, and 64.5 ± 9.5% to 70.4%, and 57% in tricuspid valve repair in large series (Musci, et al.). Freedom from reoperation at five and 10 years was 86.0 ± 6.6 and 86.0 ± 6.6%, respectively, for tricuspid valve repair in similar series, while reinfection rate was significantly higher in intravenous drug abusers (p < 0.0001).
In comparative clinical studies, repair versus replacement at 10 and 20 years revealed a survival of 68.1 and 57.6% vs. 20.0 and 20.0%, respectively (p = 0.43). Freedom from reoperation in the same periods was 88.6%26,27.
DISCUSSION
The de Vega tricuspid annuloplasty has its place in the repair of healed tricuspid valve endocarditis, with a moderate annulus dilatation and regurgitation in the presence of normal pulmonary pressures. The technique has saved the lives of thousands of patients since its introduction into cardiac surgery. The procedure has posed the principles of annuloplasty for a-v valve annular dilatation and has been modified by many surgeons for its perfection24-28. The global surgical community has recognized the ingenious and pioneering work of Dr. Norberto de Vega and therefore deserves congratulations on the 50th anniversary of this procedure.
Homograft tricuspid valve replacement still remains in the hands of a few skilled surgeons. Tricuspid valve repair under tutorial guidance can be mastered in moderate-volume centers with good results. Following reconstructive surgery and homograft valve replacement in patients with HIV and in intravenous drug abusers, special postoperative counseling would be required to minimize recurrence in these patients28-30,32,33. Perforated leaflets are physiologically repaired by autologous pericardial patch closure and destroyed leaflets are replaced by autologous pericardium using the technique of Garcia-Rinaldi and neo-chordal replacement to restore physiological leaflet coaptation heights and the right ventricular hemodynamics for a rapid functional recovery24 (Fig. 1). In the presence of healed endocarditis with or without failed tricuspid valve and annular dilatation, commissuroplasty and bicuspidization techniques can provide long-term durability25,31,33,34. Application of a ring annuloplasty would secure annulus stability in presence of chronic moderate pulmonary hypertension. Postoperative anti-pulmonary hypertensive therapy is deemed necessary in these patients. Unfortunately, there are no exclusive long-term results for the different surgical techniques described in the literature because of the low number of patients.
Figure 1. A: artist drawings of a tricuspid valve with an acute endocarditis, predominantly the anterior tricuspid valve leaflet. B: excision of the infected anterior leaflet of the tricuspid valve and the corresponding chordate. C: technique for replacing the anterior tricuspid valve leaflet with an autologous pericardium as described by Garcia-Rinaldi24. The base of the excised infected anterior tricuspid valve leaflet is marked with stay sutures and the leaflet size is determined by using the obturator. An appropriate size of autologous pericardium is dissected. An appropriate autologous pericardial leaflet replacement is cut out from the pericardial sheet using the obturator. D: the pericardial sheet is sewn onto the anterior annulus of the tricuspid valve in a running suture technique. After the implantation, the length of the neo-chordae is measured and inserted to ensure proper neo-leaflet coaptation. E: completed replacement of the anterior leaflet of the tricuspid valve. In the presence of annular dilatation without pulmonary hypertension, De Vega annuloplasty with a pericardial strip is deemed necessary. This technique entails minimal foreign material, ensures sustained effective orifice area and good functioning tricuspid valve for a rapid right ventricular recovery and low rate of recurrent endocarditis.
In presence of pulmonary hypertension, prosthetic valve replacement is preferred. Bioprosthetic or homo-graft valve replacement can be considered in patients in whom contraindication for a long-term anticoagulation is present or with a poor socioeconomic background. In the adult experience, both mechanical and bioprosthetic valves in tricuspid position have similar 20-year valve-related events. Actuarial estimates of survival in 20 years of follow-up for all tricuspid prosthetic valves, mechanical valves, and bioprosthetic valves were 65.1 ± 9.3%, 68.3 ± 10.6%, and 54.8 ± 12.1%, respectively. For the bioprosthetic valve group, freedom from structural valve degeneration was 90 ± 5.5%; for the mechanical valve group, freedom from deterioration, endocarditis, and leakage was 97.8 ± 4.2%, and freedom from thromboembolism was 92.6 ± 6.9%35. Freedom from reoperation at five and 10 years was similar between mechanical (86 and 76%) and bioprostheses (97 and 83%) in other series36.
CONCLUSION
Surgery of tricuspid valve endocarditis requires proper surgical skills to understand and to master the complex pathology of the entire tricuspid valve apparatus. Extended reconstructive techniques might be required. Selection of an appropriate surgical technique will restore the right ventricular function and the visceral organs venous circulation. A physiologic reconstruction of the tricuspid valve will ensure mid- and long-term functional durability with a low rate of recurrent infection. Intensive postoperative counseling of the patients, especially intravenous drug abusers, is an integral part of the treatment.
Correspondencia:
Charles Yankah
German Heart Institute Berlin
Charite Medical University Berlín 13353
Alemania
E-mail: cyankah@web.de
Recibido: 9 de octubre de 2012
Aceptado: 14 de octubre de 2012