La disección aórtica aguda tipo i, que afecta a la aorta torácica y abdominal, continúa presentando en nuestro medio una alta morbimortalidad, a pesar de los avances que en el manejo quirúrgico y perioperatorio han tenido lugar en los últimos años. En este sentido, la técnica de frozen elephant trunk es probablemente la última técnica disponible para el cirujano cardiaco que tiene que enfrentarse a la patología compleja y extensa de la aorta torácica.
En el siguiente artículo, revisamos las ventajas y desventajas de esta técnica para el tratamiento de la disección aórtica aguda tipo i, desde un punto de vista clínico y práctico.
Acute aortic dissection type i, involving the ascending aorta and aortic arch and extending downstream into the descending thoracic or thoracoabdominal aorta, is still associated with a significant operative and medium-term mortality, as well as a high incidence of complications, despite the development in surgical techniques and perioperative management. In this scenario, the frozen elephant trunk technique is probably the latest to be introduced into the armamentarium of the cardiac surgeon to treat extensive lesions of the thoracic aorta.
In the following review article, an analysis is presented on the advantages and drawbacks of this technique in the treatment of acute aortic dissection type i, from clinical and practical perspectives.
La disección aórtica aguda (DAA) tipo i de deBakey1 continúa siendo, a día de hoy, un gran desafío para el cirujano cardiaco que se tiene que enfrentar a ella. A pesar de los avances que en los últimos años se han producido en las técnicas quirúrgicas, sobre todo con el empleo masivo de la perfusión cerebral anterógrada, así como en el manejo perioperatorio de estos pacientes, la mortalidad quirúrgica no es despreciable hoy día. Así, el registro alemán GERAADA ha comunicado una mortalidad del 20,2%2 y el estudio IRAD una reducción de la mortalidad del 25 al 18% de forma significativa en los últimos 17 años3. Nuestro país permanece con una mortalidad estabilizada alrededor del 27% según el Registro Nacional de la SECTCV4-6, similar a la referida en el estudio multicéntrico italiano, del 25,7%7.
En España, según el registro de la SECTCV, se operan anualmente alrededor de 300 casos de DAA tipo A de Stanford, lo que equivaldría a una incidencia de 7 casos/millón de habitantes8, que probablemente esté infraestimada y que no tiene en cuenta a los pacientes que fallecen antes de llegar a quirófano9, ya que estudios de población europeos han estimado una incidencia de 17,4 casos/millón de habitantes10.
El objetivo primordial del cirujano que se enfrenta a esta patología ha sido y continúa siendo salvar la vida del paciente, en una situación de urgencia quirúrgica. Las técnicas quirúrgicas actuales han sido revisadas recientemente en esta publicación11. Por este motivo, hay numerosos grupos que abogan todavía por una actuación conservadora, dirigida a sustituir el segmento donde con más frecuencia se encuentra la rotura intimal, la aorta ascendente supracoronaria12, a fin de restablecer el flujo en la luz verdadera distal, con o sin actuación sobre la raíz de aorta dependiendo de que exista patología a este nivel.
Sin embargo, se ha demostrado que en hasta el 80% de los pacientes sometidos a una cirugía convencional queda una disección residual ya que la falsa luz permanece permeable, lo cual empeora el pronóstico del paciente, al aumentar el riesgo de muerte tardía, reintervención ulterior o dilatación aneurismática de la falsa luz. La región de mayor riesgo para desarrollar un aneurisma es el arco aórtico distal y la aorta descendente proximal. En este punto, la sustitución completa del arco aórtico junto al implante anterógrado de una endoprótesis en la aorta torácica descendente en el mismo acto quirúrgico, técnica llamada frozen elephant trunk (FET), ha supuesto una interesante y novedosa técnica quirúrgica para estos pacientes, siendo probablemente el mayor avance de los últimos años en el tratamiento de la patología compleja de la aorta torácica.
Frozen elephant trunkEste abordaje híbrido en un único tiempo propuesto para el abordaje de la aorta torácica está basado en la técnica originaria en 2 tiempos de elephant trunk (ET) descrita por Borst en 198313, y se desarrolló en Japón en la década de los 9014, siendo inicialmente empleado para el tratamiento de aneurismas crónicos de aorta torácica15 y posteriormente extendido al tratamiento de la DAA16. Inicialmente, su utilización se hizo con la idea del efecto beneficioso que esta técnica tendría en el remodelado aórtico al promover la trombosis precoz de la falsa luz en pacientes tratados de DAA, tanto a nivel de la endoprótesis como a nivel distal a la misma. Se ha visto que estos cambios comienzan inmediatamente tras la cirugía y se mantienen en el tiempo17.
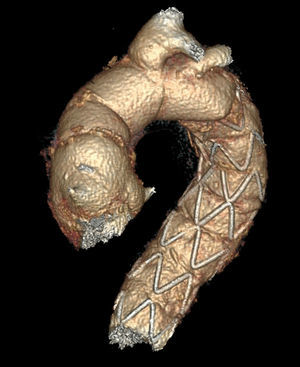
Así, la técnica de FET permite en un único procedimiento quirúrgico combinar los conceptos de la técnica clásica de ET y el tratamiento endovascular de la aorta torácica descendente. La porción proximal está formada por un injerto de dacrón que permite realizar una cirugía convencional en la aorta ascendente y el arco, combinado con una endoprótesis distal.
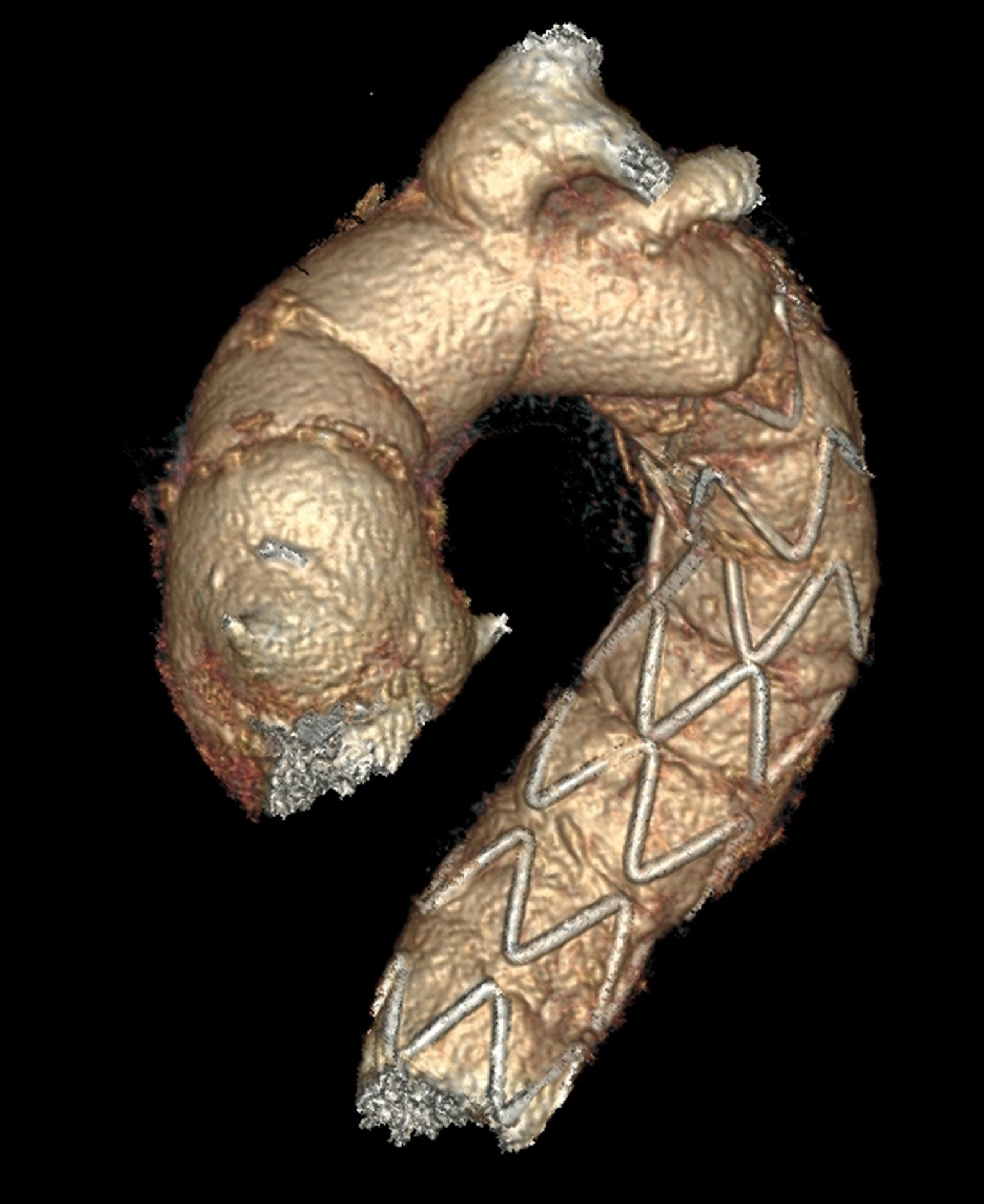
Comercialmente, en Europa están disponibles los siguientes dispositivos: E-vita Open Plus™ (Jotec, Hechingen, Alemania) y Thoraflex Hybrid™ (Vascutek Terumo, Renfrewshire, Scotland, Reino Unido). Disponibles en varios tamaños de diámetro y longitud, ambos tienen un collar de dacrón para facilitar la anastomosis distal. La principal diferencia entre ambos dispositivos reside en que el dispositivo Thoraflex incorpora un injerto de dacrón con 4 ramas en su porción proximal, lo cual facilita el reimplante individual de los troncos supraaórticos y la reperfusión más rápida utilizando la rama adicional de la porción del cuerpo que está sufriendo isquemia visceral, mientras que el dispositivo E-vita incorpora el dacrón tubular, para reimplante en bloque de los troncos supraaórticos (fig. 1). De forma añadida, el dispositivo Thoraflex presenta una sobredimensión del 15-25% del tamaño de la endoprótesis, con respecto al tamaño de la prótesis de dacrón.
Técnica quirúrgicaLa técnica quirúrgica ha sido ya ampliamente publicada18-20. Brevemente, con el paciente bajo circulación extracorpórea, hipotermia moderada (25°C) y perfusión cerebral anterógrada, los pasos a seguir serían:
- 1.
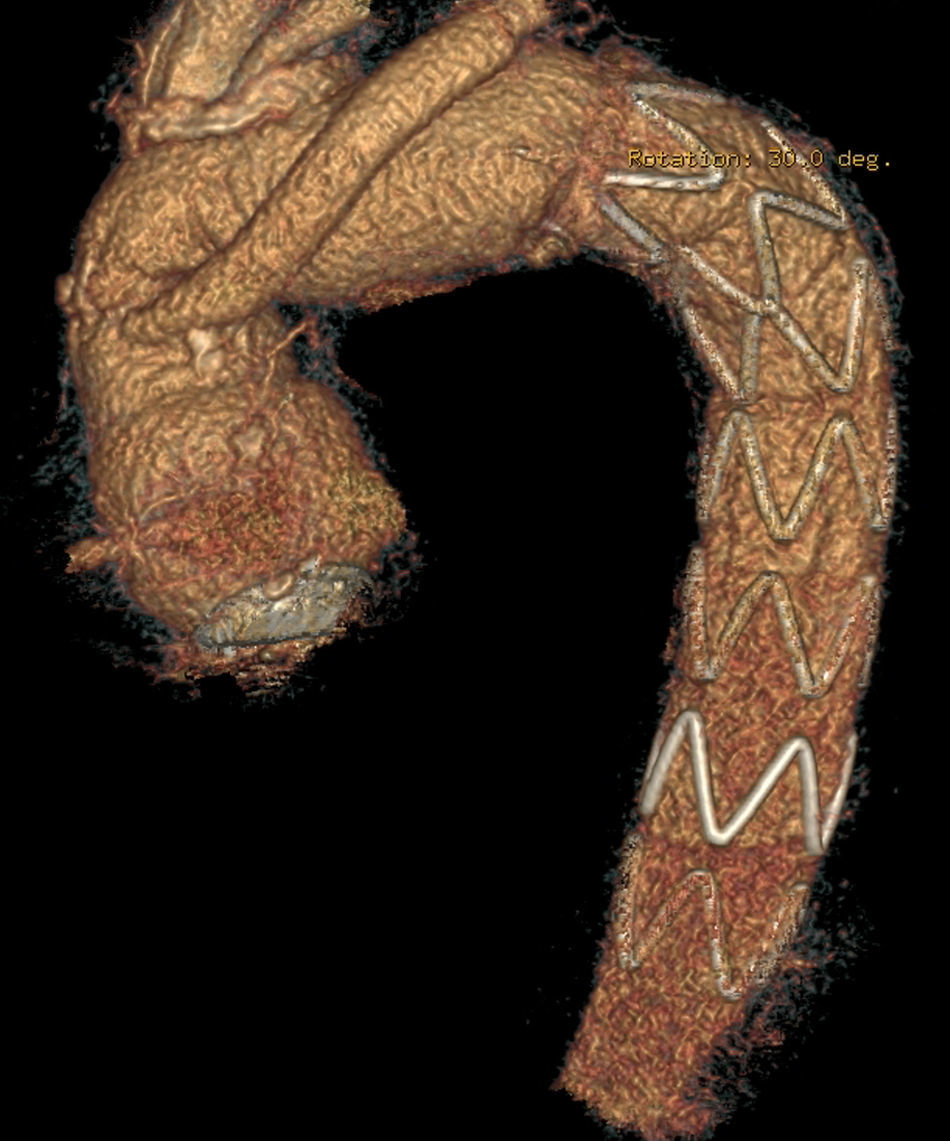
Preparación de la aorta distal, donde se va a implantar el dispositivo, habitualmente en zona 2 de Criado21, entre la arteria carótida izquierda y la arteria subclavia izquierda, que se suele ligar proximalmente en aorta y reimplantar de manera aislada. Esto facilita mucho la realización de la anastomosis, que no está tan profunda para el cirujano, además de disminuir el nivel torácico que alcanza la endoprótesis, con una menor tasa de paraplejia22. En el caso de la disección aórtica, se intenta obliterar la falsa luz, mediante el empleo de 4 puntos cardinales de polipropileno 3/0 apoyados en teflón, anudados a otra banda de teflón por fuera de la aorta, para dar soporte a la sutura del dispositivo.
- 2.
Avance de la endoprótesis en la aorta torácica descendente, habitualmente utilizando una guía previamente implantada en la luz verdadera desde la arteria femoral.
- 3.
Liberación de la endoprótesis en la aorta torácica descendente.
- 4.
Sutura del collar de la prótesis a la aorta distal, mediante sutura continua, utilizando para ello los puntos previamente implantados.
- 5.
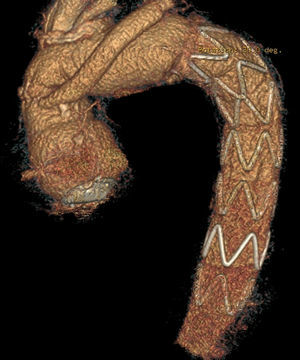
Reimplante aislado de la arteria subclavia izquierda en el caso de la E-vita, con un injerto de dacrón separado de 8-10 mm23.
- 6.
Reimplante de la pastilla formada por el tronco braquiocefálico-arteria carótida izquierda, en el caso de la prótesis E-vita, o reimplante aislado de los troncos supraaórticos en el caso de la prótesis Thoraflex.
- 7.
Anastomosis proximal del dacrón del dispositivo en aorta supracoronaria.
- 8.
Anastomosis en aorta del injerto de arteria subclavia izquierda en el caso de reimplante aislado con el dispositivo E-vita (fig. 2).
- 1.
Se recomienda el empleo de una guía en la luz verdadera para el implante de la prótesis.
- 2.
Comprobar mediante ecocardiograma transesofágico intraoperatorio que la guía esté bien posicionada en luz verdadera.
- 3.
Implantar la prótesis en zona 2 de Criado siempre que sea posible.
- 4.
Intentar reducir el tiempo de isquemia visceral, reperfundiendo por la rama adicional al finalizar la anastomosis distal en el dispositivo Thoraflex o mediante una sonda vesical de Foley 24 F20 colocada en el interior de la endoprótesis E-vita.
- 5.
Evitar sobredimensionar la prótesis en el caso de la disección aguda, para evitar la formación de nuevas roturas intimales relacionadas con la endoprótesis. Habitualmente, en la DAA se emplean prótesis menores de 30mm de diámetro, basándonos en el diámetro estimado de la luz verdadera en la tomografía computarizada o en la medida intraoperatoria.
- 6.
Evitar endoprótesis de longitud 150mm para reducir el riesgo de paraplejia. Con 100mm (Thoraflex) o 130mm (E-vita) es suficiente.
- 7.
Mantener siempre que sea posible una presión arterial media de perfusión mayor de 80mmHg en el postoperatorio, igualmente para disminuir el riesgo de isquemia medular.
El registro E-vita24,25ha referido una mortalidad de la técnica FET en la DAA del 17,1%, con una incidencia de ictus del 11,2%, que se reduce al 7,2% cuando no hay malperfusión cerebral preoperatoria, y una incidencia de paraplejia permanente del 2,9%. Más de la mitad de los casos incluidos presentaban malperfusión visceral. La trombosis completa de la falsa luz a nivel de la endoprótesis se alcanzó en el 86% de los pacientes de modo inmediato y aumentó al 92% durante el seguimiento. A los 5 años, el 90% de los pacientes están libres de reoperación en la aorta toracoabdominal distal.
Un reciente metaanálisis reduce la mortalidad al 8,6%, con una incidencia de ictus-paraplejia del 3,7 y el 1,9%, respectivamente26.
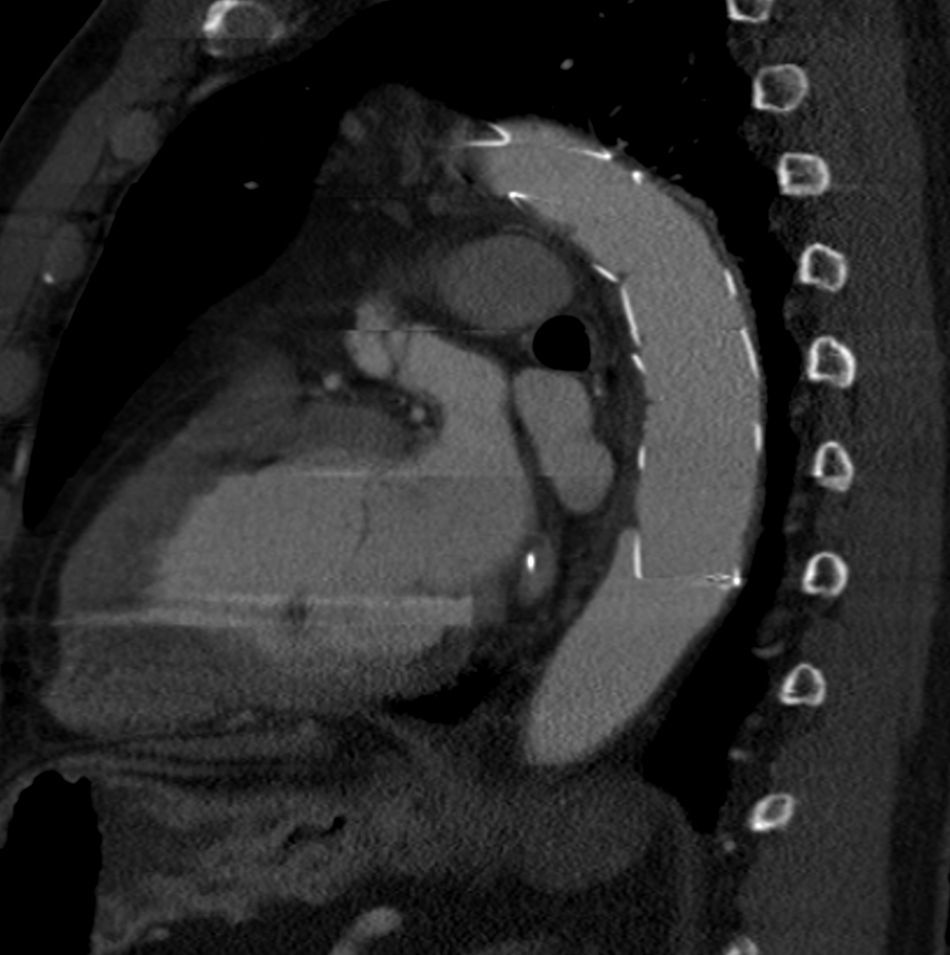
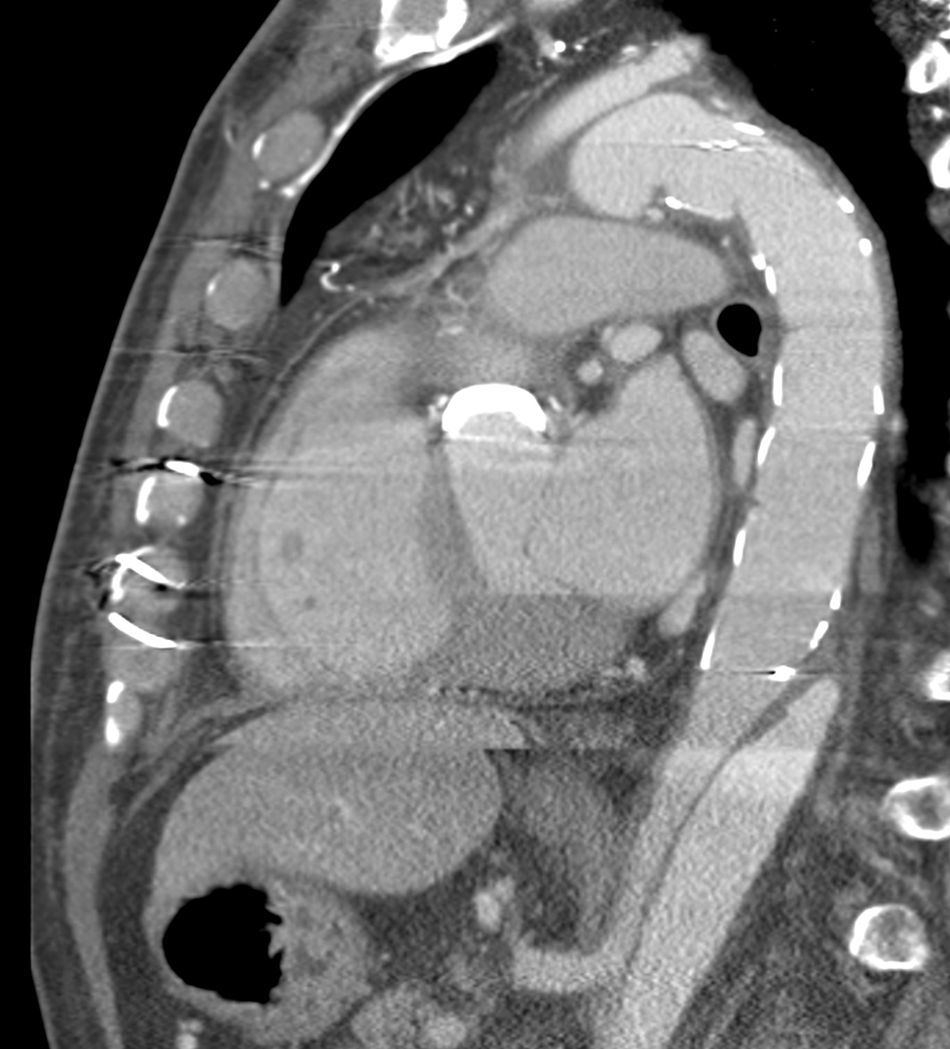
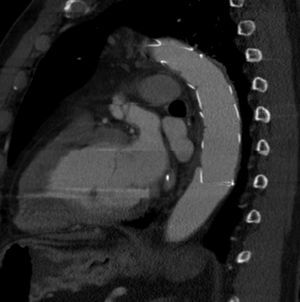
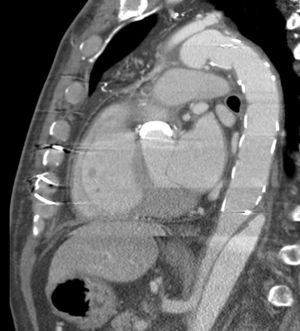
A nivel individual, la mayor experiencia con la prótesis E-vita corresponde al grupo de Essen, que recientemente ha publicado en un total de 96 casos de DAA solamente un 10% de mortalidad27. Aunque la supervivencia a 7 años baja al 55%, este dato es muy dependiente de la presencia de malperfusión en el momento de la cirugía, variando dicha supervivencia entre el 27-85%, dependiendo de si esta existe o no. A los 7 años están libres de muerte por causa aórtica el 91% de los pacientes. De forma interesante, el 92% de los pacientes presentan trombosis de la falsa luz a nivel de la endoprótesis (fig. 3), descendiendo al 73% a nivel distal (fig. 4). La tasa de paraplejia permanente fue del 2%.
Con respecto a la prótesis Thoraflex, desarrollada por el grupo de Hannover, en 70 casos comunican una mortalidad en DAA del 9%, estando el 89% de los pacientes libres de un segundo procedimiento en aorta distal, siendo la mayoría de estos a nivel infrarrenal, y nunca a nivel torácico28. La trombosis de la falsa luz a nivel de la endoprótesis se alcanzó en el 95% de los pacientes, descendiendo al 40% a nivel distal29. La tasa de paraplejia fue del 5%.
Argumentos en contra del frozen elephant trunk en la disección aórtica agudaAlgunos autores se muestran todavía escépticos con el empleo del FET en la DAA, no tanto por el recambio completo del arco aórtico, cuanto por el empleo de una endoprótesis en aorta torácica30. Recientemente, se ha comunicado una incidencia de reoperación distal tras aorta supracoronaria/hemiarco del 15,7%, mientras que con recambio completo del arco completo se reduce al 4,3%, todo ello con una mortalidad aceptable31,32, por lo que defienden que no sería necesario añadir una endoprótesis al procedimiento. En cualquier caso, la realización de la anastomosis distal en el FET parece más segura y hemostática que en el ET, sobre todo cuando se realiza en centros con poca experiencia. En el FET, aunque a nivel de la endoprótesis la trombosis de la falsa luz es prácticamente completa (86-94%), distal a la endoprótesis, y sobre todo a nivel abdominal, la falsa luz permanece permeable hasta en el 50%, si bien a día de hoy no está definido el comportamiento que este hecho vaya a tener a largo plazo. En términos de supervivencia en el seguimiento no hay diferencia entre la realización de ET clásico y FET33,34.
Sí merece especial análisis la isquemia medular, que produce una de las complicaciones más devastadoras en esta cirugía, la paraplejia. Desde el inicio, se ha visto que la tasa de paraplejia tras la FET es más alta que tras el ET clásico25, al menos del 9% en aneurismas crónicos como ha puesto de manifiesto el registro E-vita35, y que en algunos centros llega hasta el 21,7%33, si bien es cierto que en la DAA la incidencia parece ser menor (3-4%)25,36, habiendo mostrado un reciente metaanálisis un 1,9%26. Aunque la causa parece ser multifactorial, la longitud de la endoprótesis, con una zona de anclaje por debajo de T735 o T1025 parece influir tanto en la perfusión segmentaria de la médula espinal, como en la Colateral Network37, cuyo flujo depende de la arteria vertebral. Hay que tener presente que el flujo arterial medular depende de arterias segmentarias, las arterias subclavias y las arterias ilíacas. Mientras que las primeras se verían afectadas por la endoprótesis, las segundas se verían afectadas por el periodo de isquemia visceral, ya que la isquemia medular no se asocia a pacientes en los que se ha sacrificado la arteria subclavia izquierda por no poder reimplantarse25. De esta forma, la temperatura corporal mayor de 28°C durante un periodo de parada circulatoria mayor de 40 min se ha visto como factor predictivo independiente38, hecho que ha sido ya profundamente investigado39-41, pero que no ha sido corroborado por otros grupos25. En resumen, esta complicación parece tener una causa multifactorial: una combinación de periodos de isquemia, hipotermia sistémica y situación hemodinámica postoperatoria.
Indicaciones quirúrgicasCon estas premisas, la Sociedad Europea de Cirugía Cardio-Torácica (EACTS) ha establecido unas recomendaciones42 para el empleo de esta técnica en patología compleja de aorta (tabla 1). El FET sería la técnica ideal en la DAA para tratar complicaciones secundarias a malperfusión visceral, ya que ayudaría a expandir la luz verdadera en la aorta torácica descendente proximal, así como a promover el cierre de las reentradas que pudiera haber a este nivel. La malperfusión visceral y renal están asociadas frecuentemente con roturas intimales en el arco aórtico y en la aorta descendente proximal, por lo que la realización de la anastomosis distal clásica a nivel de aorta ascendente distal o hemiarco podría no reestablecer adecuadamente el flujo anterógrado a través de la luz verdadera y no resolver adecuadamente un síndrome de malperfusión por compresión de la luz verdadera. Además, podría ayudar a prevenir complicaciones futuras (principalmente la formación de aneurismas en la disección crónica residual), por lo que prevenir la formación de un aneurisma en la evolución posterior sería otro punto a tener en cuenta, dado que no siempre es posible una reparación endovascular pasado el tiempo. En este sentido, se recomienda expresamente hacer un balance entre el riesgo de una cirugía más exigente y el beneficio preventivo a medio-largo plazo, ya que en una situación de urgencia, lo importante es salvar la vida del paciente, ya que una cirugía posterior se puede realizar en un centro de referencia bajo condiciones óptimas.
Recomendaciones de empleo del FET en la DAA, según la EACTS
| Recomendación | Nivel de evidencia | |
|---|---|---|
| Rotura intimal en arco aórtico distal/aorta descendente proximal, para tratar o prevenir un síndrome de malperfusión | II-A | C |
| Prevención de la formación de aneurismas en la aorta distal residual | II-B | C |
| Disección tipo B complicada cuando el tratamiento endovascular no es posible o hay riesgo de disección retrógrada | II-A | C |
Como conclusión, se recomienda que el FET debería ser considerado en pacientes con DAA tipo A con rotura intimal en el arco aórtico distal o en la aorta torácica descendente proximal para tratar síndrome de malperfusión asociado o para prevenirlo de forma postoperatoria. Se trata de un nivel de recomendación clase iiA con nivel de evidencia C.
Igualmente, se recomienda que el FET podría ser considerado en pacientes con DAA tipo A para prevenir a medio plazo la formación de aneurismas en la aorta distal, en este caso con un nivel de recomendación clase iiB con nivel de evidencia C.
En la disección aguda tipo B complicada, cuando el abordaje endovascular no sea posible por no existir zona de anclaje de la endoprótesis, se asocie un aneurisma de aorta ascendente y arco o haya un riesgo alto de disección tipo A retrógrada, el FET tendría un nivel de recomendación clase iiA con nivel de evidencia C.
Recomendaciones prácticasSegún estas recomendaciones, estableceríamos las indicaciones de empleo de la técnica FET en la DAA tipo i en los casos siguientes43-45 (tabla 2):
La resección del segmento donde se encuentre la rotura intimal primaria es fundamental en el tratamiento de la DAA46. Habitualmente, esta rotura se encuentra en la aorta ascendente (60%), pero en el 20-30% de los casos vamos a encontrar reentradas en el arco aórtico47. En casos con roturas intimales en el arco aórtico distal-aorta descendente proximal es posible que la realización de un hemiarco no sea suficiente, además de la dificultad que puede suponer realizar la anastomosis distal en tejido disecado y con roturas intimales. Además, es bien conocido que la realización de una anastomosis distal abierta, aunque incluya la resección de la concavidad del cayado (hemiarco), no tiene efecto beneficioso en la permeabilidad de la falsa luz en la mayoría de los casos. El recambio completo del arco aórtico podría reducir la permeabilidad de la falsa luz, aunque a expensas de una mayor mortalidad operatoria, sobre todo en centros de bajo volumen quirúrgico. En este caso, la técnica FET, con implante de una endoprótesis en la aorta torácica asociada al recambio completo del arco aórtico facilita el realizar una anastomosis distal segura, es más fácil de realizar que un ET clásico, disminuyendo el riesgo de rotura o sangrado de una aorta disecada con pared extremadamente frágil. Además, se reduce al mínimo la permeabilidad de la falsa luz a nivel torácico y se reduce igualmente la permeabilidad de la falsa luz a nivel abdominal.
Síndrome de malperfusiónEl 25-40% de los pacientes con DAA tipo i presentan un síndrome de malperfusión48, lo cual es un factor que afecta a la supervivencia de forma significativa, sobre todo si es cerebral o abdominal. La presencia de malperfusión triplica la mortalidad operatoria49 y afecta igualmente de forma negativa a la supervivencia a largo plazo27. El mecanismo que lo produce suele ser una oclusión dinámica de la falsa luz, secundaria a una presión elevada de la misma, bien por una reentrada de gran tamaño o bien por rotura intimal de salida pequeña, que puede ir asociado a una oclusión estática posterior por mecanismo trombótico. La expansión de la luz verdadera, cerrando el mayor número de roturas intimales mediante el implante de una endoprótesis, conduciría a la resolución del cuadro, disminuyendo la probabilidad de presentar un síndrome de malperfusión en el postoperatorio.
Edad menor de 70 años sin comorbilidades asociadasEl tratamiento convencional de la DAA tipo i de deBakey habitualmente deja al paciente con falsa luz permeable distal a la reparación. Este hecho está asociado a riesgo aumentado de muerte, reoperación o crecimiento aneurismático de la falsa luz. En pacientes a los que se les realiza una resección limitada, la falsa luz permeable conduce a un remodelado aórtico patológico, con degeneración de la luz falsa, lo que conduce a la formación de aneurismas que tienen necesidad de reintervención. La zona de mayor riesgo para la formación de aneurismas es el arco aórtico distal y la aorta torácica descendente proximal50. Este crecimiento suele ser lento y lineal, de aproximadamente 1mm/año, aunque el seguimiento de estos enfermos suele ser incompleto en nuestro medio, por lo que es difícil conocer la incidencia real del problema. Dado que existe un riesgo de crecimiento aneurismático de la falsa luz con el tiempo, la edad del paciente sería un factor a tener en cuenta a la hora de plantear un tratamiento más agresivo.
La progresión de la enfermedad aórtica está relacionada con variables anatómicas ya presentes en la fase aguda de la enfermedad: diámetro inicial mayor de 35mm, falsa luz inicial mayor de 22mm o rotura intimal proximal de más de 10mm.
Un metaanálisis reciente51 que ha evaluado el comportamiento de la falsa luz residual en pacientes intervenidos de DAA ha concluido que la falsa luz permeable es un predictor independiente de mortalidad a largo plazo (HR 1,71) y de presentar complicaciones secundarias a su patología (HR 4,11). Todo ello siendo la extensión de la resección quirúrgica (hemiarco vs. arco completo) el único factor de riesgo independiente para tener permeabilidad o trombosis parcial de la falsa luz, en contraposición con la trombosis total52.
ComentarioA pesar de los avances en el tratamiento, la DAA aguda continúa siendo un reto para los cirujanos cardiacos, con mortalidades que oscilan entre el 17 y el 26%. Por esta razón, un abordaje conservador, limitado a realizar la técnica más sencilla y corta con menor impacto en el paciente, ha sido adoptado en general por la mayoría de los grupos.
Sin embargo, es bien conocido que en esos casos la disección residual distal permanece en la mayoría de los casos, con el consiguiente riesgo de dilatación, malperfusión o rotura. En este sentido, desde hace años se venía recomendando una estrategia más agresiva con recambio completo del arco para prevenir complicaciones futuras53, técnica no exenta de importante morbimortalidad, sobre todo en centros con baja experiencia.
En este escenario, el FET surge como una alternativa quirúrgica en el tratamiento de estos pacientes54,55. Su implante permite disminuir radicalmente la presión en la falsa luz a nivel torácico, induciendo la trombosis de la misma. Esta técnica es una herramienta útil en pacientes con malperfusión visceral, roturas de reentrada a nivel del arco aórtico o la aorta torácica descendente o arco aórtico severamente dañado. En el caso de pacientes con malperfusión, el FET facilita el flujo de sangre hacia la luz verdadera, cubriendo roturas intimales a nivel de aorta torácica descendente y disminuyendo la presión de perfusión de la falsa luz. Además de trombosar la falsa luz al nivel donde está reimplantada la endoprótesis, el FET disminuye el riesgo de dilatación de la falsa luz a nivel distal, favoreciendo el remodelado adecuado de la aorta y reduciendo la muerte tardía y la necesidad de cirugías posteriores a menos de un 20%. Sin embargo, estos hallazgos a nivel de estudios de imagen deben ser refutados con estudios clínicos a largo plazo que demuestren un claro beneficio en términos de supervivencia. El seguimiento de estos pacientes, con pruebas de imagen, se antoja imprescindible para conocer la evolución de la enfermedad.
Asumiendo la necesidad de un recambio completo del arco en este tipo de pacientes31,53, si queremos evitar complicaciones a largo plazo, el FET ofrece una evolución postoperatoria más favorable, si se compara con el ET clásico, y una menor necesidad de nuevos procedimientos ulteriores56.
Desde un punto de vista técnico, no cabe duda de que la técnica es todo un desafío para el cirujano, que además la tiene que realizar en condiciones no programadas de urgencia quirúrgica. Se ha sugerido que el cirujano debe haber realizado al menos 20 casos electivos45 antes de empezar a realizar la técnica en pacientes con disección aguda, lo cual en España se antoja difícil. En nuestro Departamento (Toledo), se viene realizando la técnica con el dispositivo E-vita Open Plus desde el año 2011, habiendo incluido un total de 12 pacientes (28% de los pacientes con DAA operados), con una mortalidad operatoria del 16,7%, ningún caso de paraplejia, un 100% de trombosis de la falsa luz a nivel torácico y un 40% de trombosis a nivel abdominal, cifras concordantes con el registro europeo E-vita en el que participamos. La realización de la anastomosis del dispositivo antes de la salida de la arteria subclavia izquierda simplifica mucho el procedimiento para el cirujano, que puede asegurar una correcta hemostasia de una forma más rápida y sencilla, ayudado por la trombosis de la falsa luz que empieza de forma inmediata.
El principal problema de la técnica es la tasa de paraplejia, mayor que la que se había evidenciado en la técnica clásica de ET, que llega hasta el 21,7% en la literatura, estando la media en centros de excelencia en el 6,5-8,5%. El que la endoprótesis alcance el nivel torácico T10 o inferior ha sido el único factor predictor independiente para que suceda esta complicación. Ni la temperatura corporal ni el tiempo de isquemia visceral influyen, dado que probablemente sea el hecho de cubrir arterias intercostales lo que desempeñe un papel primordial, además de posibles embolizaciones (dado que la tasa es sensiblemente mayor en patologías crónicas) o la presencia de hipotensión postoperatoria.
La mejora de la técnica quirúrgica, así como la mejora de los dispositivos, ha contribuido a disminuir las complicaciones. Probablemente, la incorporación de un injerto de 4 ramas que facilita el reimplante de los troncos supraaórticos y el reinicio rápido de la perfusión de la parte inferior del organismo pueda contribuir a que esta complicación disminuya.
ConclusionesEl FET es una técnica útil, cuyo empleo se debe valorar en un número no despreciable de pacientes que hoy día presentan una DAA, con roturas intimales en arco-aorta descendente, síndrome de malperfusión o edad menor de 70 años sin comorbilidades, todo ello con unas cifras aceptables de mortalidad y un resultado a largo plazo esperanzador. A pesar del reto que para el cirujano supone la técnica, la curva de aprendizaje no debe suponer un rechazo a la misma. La reducción de la incidencia de paraplejia debe seguir siendo un estímulo para el desarrollo de la técnica, así como el manejo perioperatorio de estos enfermos.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El autor (LFLA) agradece especialmente al Prof. Roberto Di Bartolomeo y a sus colaboradores (Dr. Davide Pacini y Dra. Sofía Martín Suárez) la inestimable ayuda y soporte que desde hace años vienen proporcionando para que la técnica se haya podido desarrollar con éxito en el Servicio de Cirugía Cardiaca del Complejo Hospitalario de Toledo.