Determinar la incidencia de deterioro valvular estructural (DVE) entre todos los modelos de bioprótesis aórtica Mitroflow (A12/LX/DL), así como definir los factores de riesgo implicados y el posible papel protector del tratamiento anticalcificación phospholipid reduction treatment (PRT) del modelo DL.
MétodosEstudio retrospectivo de 1.023 pacientes consecutivos operados de recambio valvular aórtico con bioprótesis Mitroflow entre 2001 y 2014.
ResultadosEl seguimiento medio fue de 5,4±3,1 años. La incidencia acumulada global de DVE fue 0,48% a un año, 2,1% a 5 años y 6,8% a 10 años. El grupo PRT mostró menor incidencia acumulada de DVE (0,2% vs. 1,2% a 4 años) (p=0,04).
El análisis de regresión de riesgos competitivos confirmó: edad < 70 años (HR=2,98 [1,5-5,89], p=0,002), tamaño valvular de 19mm (HR=4,7 [2,29-9,64], p<0,001) y gradiente pico transvalvular > 30mmHg en postoperatorio precoz (HR=10,3 [5,3-19,9], p<0,001) como factores predictores de DVE. La presencia de PRT demostró un efecto protector frente al DVE (HR=0,42 [0,096-0,892], p=0,04).
ConclusionesEl comportamiento hemodinámico postoperatorio precoz, el tamaño valvular de 19mm y una edad del paciente < 70 años son factores de riesgo para el DVE. El tratamiento anticalcificación del modelo DL reduce la incidencia de DVE y extiende la vida de la bioprótesis.
This study aims to determine the incidence of structural valve deterioration (SVD) among all models of the Mitroflow valve (12A/LX/DL), as well as to define the potential influence of PRT (Phospholipid Reduction Treatment) anti-calcification treatment in the DL model on SVD on the follow-up results.
MethodsA retrospective review was performed on a series of 1023 patients who underwent aortic valve replacement with a Mitroflow bioprosthesis between 2001 and 2014.
ResultsThe mean follow-up was 5.4±3.1 years. Overall cumulative incidence of SVD was 0.48% at 1 year, 2.1% at 5 years, and 6.8% at 10 years. PRT showed a significantly lower cumulative incidence of SVD (0.2% vs. 1.2% at 4 years) (P=.04).
Competing risks regression confirmed age <70 years (HR=2.98 [1.5-5.89], P=.002), 19mm bioprosthesis (HR=4.7 [2.29-9.64], P<.001), and an early postoperative peak aortic gradient >30mmHg (HR=10.3 [5.3-19.9], P<.001) as independent predictors of SVD, while the protective effect of PRT was associated with a lower rate of SVD (HR=0.42 [0.096-0.892], P=.04).
ConclusionsThe anti-calcification treatment reduces the incidence of SVD and extends the life of the bioprosthesis. Early postoperative haemodynamic behaviour of bioprosthesis, 19mm valve size, and patient age has also been shown to be strong risk factors for SVD.
En la última década se ha producido un cambio en la tendencia en el recambio valvular aórtico (RVA) hacia un uso más liberal de las bioprótesis, fundamentalmente debido a la no necesidad de anticoagulación oral y menores complicaciones asociadas en una población cada vez más envejecida. Las bioprótesis ofrecen además una hemodinámica más favorable, lo que se traduce en una mejoría en la recuperación y en la supervivencia. La bioprótesis Mitroflow (SORIN GROUP, Milán, Italia) fue diseñada para optimizar su perfil hemodinámico, siendo particularmente útil en pacientes con un anillo aórtico pequeño por su generosa área efectiva y su pequeño anillo de sutura. Estas características pueden ser de vital importancia en pacientes en riesgo de desarrollar mismatch paciente-prótesis1,2.
Recientemente, se han publicado varios estudios3-6 reportando un deterioro valvular estructural (DVE) precoz de las bioprótesis Mitroflow. Sin embargo, dichos estudios3-6 se han limitado a los modelos carentes de tratamiento anticalcificación (modelos 12A y LX). En diciembre del 2011, el modelo DL de Mitroflow incorporó por primera vez un tratamiento anticalcificación denominado phospholipid reduction treatment (PRT), que es un proceso químico que elimina los fosfolípidos de los materiales tisulares usando una solución acuosa con alcoholes de cadena larga como el octanediol y el etanol. Diferentes estudios en modelos animales7,8 demostraron la efectividad del tratamiento con octanediol en la prevención de la calcificación, mostrando diferencias estadísticamente significativas en términos de mineralización y reducción del contenido de fosfolípidos7,8. A su vez, estos cambios se han asociado a una reducción significativa del contenido fosfolipídico y calcificación del tejido pericárdico7,8. Sin embargo, no existe información en la literatura médica hasta la fecha sobre la eficacia de este tratamiento anticalcificación en la reducción de la incidencia de DVE en series clínicas y tampoco existen estudios publicados comparando los resultados de los 3 modelos de Mitroflow comercializados.
El objetivo de este estudio es determinar la incidencia de DVE precoz en todos los modelos de la bioprótesis Mitroflow (12A/LX/DL), así como definir la influencia potencial del tratamiento anticalcificación e identificar los potenciales factores de riesgo de DVE durante el seguimiento a largo plazo.
MétodosPoblación a estudioEntre enero del 2001 y junio del 2014 se operó a 2.162 pacientes consecutivos en nuestra institución de RVA con una bioprótesis, de los que 1.023 recibieron una válvula Mitroflow, 718 una válvula Carpentier-Edwards y 421 una miscelánea de otras bioprótesis.
Se analizaron los 3 modelos de bioprótesis Mitroflow disponibles en el mercado hasta la fecha (12A/LX/DL). El modelo 12A se implantó en 199 pacientes (19,5%), el modelo LX en 426 pacientes (41,6%) y el modelo DL en 398 pacientes (38,9%).
Con objeto del análisis, la población fue dividida en 2 grupos de acuerdo con la presencia o no del tratamiento anticalcificación en el modelo: grupo PRT (modelo DL 398 pacientes) y grupo no PRT (modelos 12A y LX, 625 pacientes). Ambos modelos —12A y LX— fueron clasificados como no PRT y se asumieron los mismos resultados a largo plazo. Para ratificar esa hipótesis se efectuó también una comparación entre ambos modelos (tabla A, material suplementario online).
El Comité de Ética de la Investigación de Galicia y Servicio Gallego de Salud (SERGAS) dio la autorización para este estudio con fecha 17 de diciembre del 2015, con código de registro del estudio 2015/646.
EcocardiografíaLos ecocardiogramas fueron realizados siguiendo los protocolos institucionales previamente reportados9,10 de acuerdo con las recomendaciones de la American Society of Echocardiography (ASE)11. Los gradientes pico a través de las bioprótesis aórticas fueron determinados mediante Doppler continuo (gradiente aórtico máximo [GAM]).
El área del orificio efectivo (AOE) se calculó usando la ecuación de continuidad11. El AOE esperado preoperatorio de cada tamaño protésico se obtuvo del fabricante y fue, además, confirmado en publicaciones de otros autores12. El AOE postoperatorio se determinó en cada ecocardiograma de control durante el seguimiento de acuerdo con las recomendaciones de la ASE11. Además, el AOE se indexó (AOE indexada [AOEi]) al área superficie corporal de cada paciente en todos los casos.
El umbral para el mismatch paciente-prótesis en posición aórtica se definió como un AOEi ≤ 0,85 cm2/m2, siendo moderado con valores entre 0,65-0,85cm2/m2 y severo con un valor < 0,65 cm2/m22.
El concepto de raíz aórtica pequeña fue definido como un diámetro indexado de raíz aórtica < 15mm/m213.
La masa del VI se determinó mediante ecocardiografía bidimensional y se calculó usando la fórmula de Devereux et al.14. La masa del VI se categorizó como una variable dependiente del sexo del paciente siguiendo las recomendaciones de la ASE13. La hipertrofia del VI se definió como una masa indexada del VI ≥ 88g/m2 en mujeres o ≥ 102g/m2 en hombres13. Una masa del VI por debajo de dichos valores se consideró normal. La hipertrofia severa del VI se definió como una masa indexada del VI ≥ 122g/m2 en mujeres o ≥ 149g/m2 en hombres, según los criterios actuales de la ASE13.
Técnica quirúrgicaLa medición del anillo aórtico se efectuó de forma estandarizada en todos los casos de acuerdo con el protocolo institucional y realizado con un medidor cilíndrico específico del set de medición valvular Mitroflow proporcionado por el grupo SORIN. Se seleccionó en todos los casos una bioprótesis de un número inmediatamente superior al del medidor que atravesaba el anillo aórtico de forma ajustada. Esta técnica de medición garantiza el implante de la bioprótesis Mitroflow en una posición verdaderamente supraanular, de forma que se aprovecha al máximo su AOE. Las prótesis se implantaron con puntos de Tycron 2-0 con teflón colocado hacia la cara ventricular del anillo aórtico.
SeguimientoEl seguimiento clínico y ecocardiográfico se completó en todos los pacientes vivos al alta hospitalaria. El período de seguimiento se extendió desde enero del 2001 hasta enero del 2016. Los datos recogidos durante el seguimiento incluyeron mortalidad intrahospitalaria, datos ecocardiográficos postoperatorios precoces y tardíos, mortalidad durante el seguimiento y causas, así como complicaciones valvulares.
Todos los eventos adversos valvulares han sido definidos de forma precisa siguiendo las recomendaciones de las guías de la EACTS/STS/AATS15 para el reporte de eventos valvulares adversos. En particular, hemos incluido el deterioro estructural protésico como el identificado por reoperación, autopsia o investigación clínica (p. ej., vigilancia ecocardiográfica periódica). El DVE se ha definido según las guías de la EACTS/STS/AATS15 como cambios intrínsecos en la prótesis tales como desgaste, fractura, calcificación, desgarro de velos, distorsión de la estructura o disrupción de la línea de sutura de los componentes de la válvula.
Análisis estadísticoLos datos fueron expresados como media y desviación típica, o mediana y rango según procediese. Para el análisis bivariable, las proporciones se compararon a través de tablas de contingencia usando la prueba de la chi al cuadrado. En la comparación de medias se emplearon el test de los rangos con signo de Wilcoxon o la prueba t de Student. Un valor de p<0,05 se consideró estadísticamente significativo.
La supervivencia actuarial se determinó mediante el método de Kaplan-Meier y las diferencias en la probabilidad de supervivencia entre ambos grupos se calcularon con el test de log rank (Mantel-Cox).
En el análisis de riesgos competitivos, se empleó la función de incidencia acumulada desarrollada por Kalbfleisch y Prentice16 para cuantificar la probabilidad acumulada de fallo causa-específico en presencia de eventos competitivos. Los eventos competitivos para el análisis del DVE fueron muerte o reoperación por causa no estructural primaria (p. ej., endocarditis protésica).
Las siguientes variables fueron analizadas como factores de riesgo potenciales para el DVE: edad, sexo, reoperación, otra cirugía concomitante, insuficiencia renal crónica, tamaño protésico, tratamiento anticalcificación (PRT), hipertrofia ventricular severa, fracción de eyección < 35% y GAM en ecocardiograma de control precoz. La edad y el GAM fueron analizados tanto como variables continuas como variables dicotómicas, con puntos de corte en 70 años y 30mmHg, respectivamente.
La incidencia acumulada para el DVE ajustada para eventos competitivos y ajustada para covariables se determinó mediante el modelo de regresión propuesto por Fine y Gray17.
El análisis estadístico de datos se realizó con la plataforma «R: A language and environment for statistical computing» (R Core Team, 2015. R Foundation for Statistical Computing, Vienna, Austria) y los paquetes estadísticos de R («Rcmdr», «splines», «survival» y «cmprsk»).
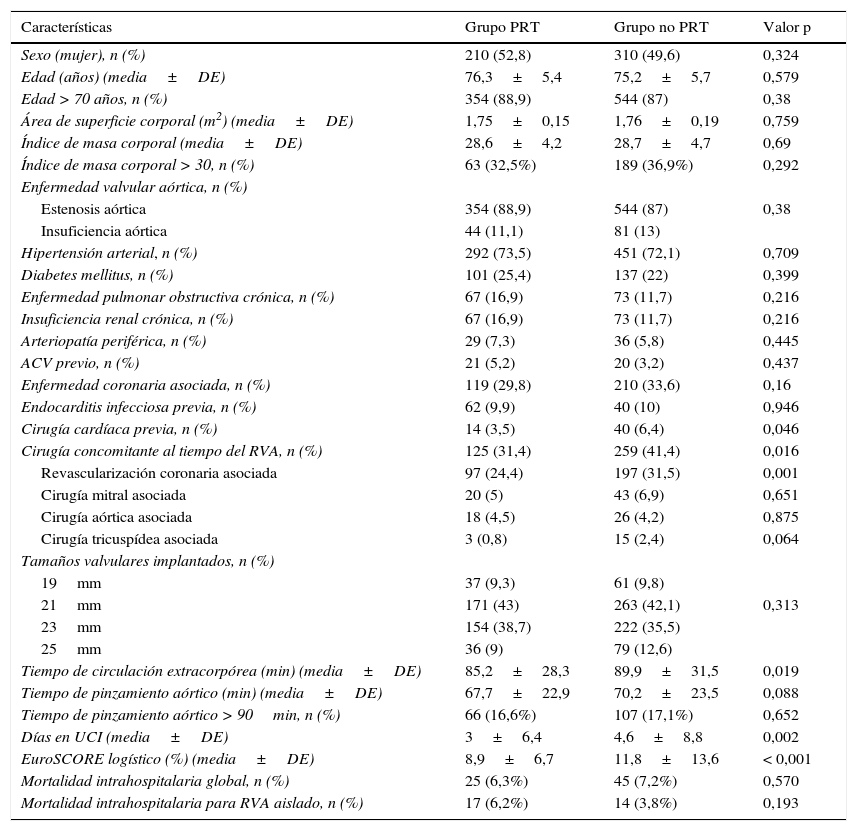
ResultadosResultados clínicosEn la tabla 1 se muestran las características clínicas y demográficas de ambos grupos. No se hallaron diferencias estadísticamente significativas en la mayoría de características basales de ambos grupos. La proporción de pacientes con cirugía cardíaca previa fue más alta en el grupo no PRT, así como la necesidad de un procedimiento asociado al RVA.
Demográficos y características clínicas y quirúrgicas de ambos grupos
| Características | Grupo PRT | Grupo no PRT | Valor p |
|---|---|---|---|
| Sexo (mujer), n (%) | 210 (52,8) | 310 (49,6) | 0,324 |
| Edad (años) (media±DE) | 76,3±5,4 | 75,2±5,7 | 0,579 |
| Edad > 70 años, n (%) | 354 (88,9) | 544 (87) | 0,38 |
| Área de superficie corporal (m2) (media±DE) | 1,75±0,15 | 1,76±0,19 | 0,759 |
| Índice de masa corporal (media±DE) | 28,6±4,2 | 28,7±4,7 | 0,69 |
| Índice de masa corporal > 30, n (%) | 63 (32,5%) | 189 (36,9%) | 0,292 |
| Enfermedad valvular aórtica, n (%) | |||
| Estenosis aórtica | 354 (88,9) | 544 (87) | 0,38 |
| Insuficiencia aórtica | 44 (11,1) | 81 (13) | |
| Hipertensión arterial, n (%) | 292 (73,5) | 451 (72,1) | 0,709 |
| Diabetes mellitus, n (%) | 101 (25,4) | 137 (22) | 0,399 |
| Enfermedad pulmonar obstructiva crónica, n (%) | 67 (16,9) | 73 (11,7) | 0,216 |
| Insuficiencia renal crónica, n (%) | 67 (16,9) | 73 (11,7) | 0,216 |
| Arteriopatía periférica, n (%) | 29 (7,3) | 36 (5,8) | 0,445 |
| ACV previo, n (%) | 21 (5,2) | 20 (3,2) | 0,437 |
| Enfermedad coronaria asociada, n (%) | 119 (29,8) | 210 (33,6) | 0,16 |
| Endocarditis infecciosa previa, n (%) | 62 (9,9) | 40 (10) | 0,946 |
| Cirugía cardíaca previa, n (%) | 14 (3,5) | 40 (6,4) | 0,046 |
| Cirugía concomitante al tiempo del RVA, n (%) | 125 (31,4) | 259 (41,4) | 0,016 |
| Revascularización coronaria asociada | 97 (24,4) | 197 (31,5) | 0,001 |
| Cirugía mitral asociada | 20 (5) | 43 (6,9) | 0,651 |
| Cirugía aórtica asociada | 18 (4,5) | 26 (4,2) | 0,875 |
| Cirugía tricuspídea asociada | 3 (0,8) | 15 (2,4) | 0,064 |
| Tamaños valvulares implantados, n (%) | |||
| 19mm | 37 (9,3) | 61 (9,8) | |
| 21mm | 171 (43) | 263 (42,1) | 0,313 |
| 23mm | 154 (38,7) | 222 (35,5) | |
| 25mm | 36 (9) | 79 (12,6) | |
| Tiempo de circulación extracorpórea (min) (media±DE) | 85,2±28,3 | 89,9±31,5 | 0,019 |
| Tiempo de pinzamiento aórtico (min) (media±DE) | 67,7±22,9 | 70,2±23,5 | 0,088 |
| Tiempo de pinzamiento aórtico > 90min, n (%) | 66 (16,6%) | 107 (17,1%) | 0,652 |
| Días en UCI (media±DE) | 3±6,4 | 4,6±8,8 | 0,002 |
| EuroSCORE logístico (%) (media±DE) | 8,9±6,7 | 11,8±13,6 | < 0,001 |
| Mortalidad intrahospitalaria global, n (%) | 25 (6,3%) | 45 (7,2%) | 0,570 |
| Mortalidad intrahospitalaria para RVA aislado, n (%) | 17 (6,2%) | 14 (3,8%) | 0,193 |
No hay valores perdidos en los datos demográficos ni clínicos.
AOEi: área del orificio efectivo indexada; RVA: recambio valvular aórtico.
Los datos quirúrgicos están recogidos en la tabla 1. No existieron diferencias estadísticamente significativas en los tamaños valvulares implantados en ambos grupos (p=0,337). La proporción de pacientes que recibieron una bioprótesis pequeña (19 y 21mm) también fue similar entre ambos grupos (52,3% vs. 51,5%, p=0,817).
La media del EuroSCORE I fue superior en el grupo no PRT (11,8%±13,6% vs. 8,9%±6,7%, p<0,001).
La mortalidad intrahospitalaria global fue del 6,8% (n=70/1.023), mientras que la mortalidad intrahospitalaria para el RVA aislado fue del 5% (n=32/639). No hubo diferencias entre grupos ni en la mortalidad intrahospitalaria global (6,3% vs. 7,2%, p=0,57) ni en la mortalidad intrahospitalaria para RVA aislado (3,8% vs. 6,2%, p=0,193).
Características hemodinámicasLos datos ecocardiográficos preoperatorios y postoperatorios precoces y tardíos se recogen en la tabla 2. Todos los pacientes del estudio tenían un ecocardiograma preoperatorio completo.
Características ecocardiográficas pre y postoperatorias de ambos grupos
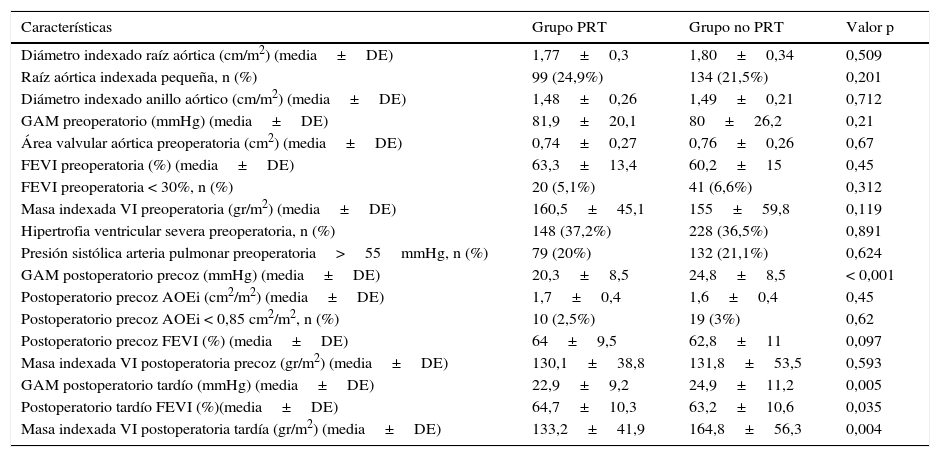
| Características | Grupo PRT | Grupo no PRT | Valor p |
|---|---|---|---|
| Diámetro indexado raíz aórtica (cm/m2) (media±DE) | 1,77±0,3 | 1,80±0,34 | 0,509 |
| Raíz aórtica indexada pequeña, n (%) | 99 (24,9%) | 134 (21,5%) | 0,201 |
| Diámetro indexado anillo aórtico (cm/m2) (media±DE) | 1,48±0,26 | 1,49±0,21 | 0,712 |
| GAM preoperatorio (mmHg) (media±DE) | 81,9±20,1 | 80±26,2 | 0,21 |
| Área valvular aórtica preoperatoria (cm2) (media±DE) | 0,74±0,27 | 0,76±0,26 | 0,67 |
| FEVI preoperatoria (%) (media±DE) | 63,3±13,4 | 60,2±15 | 0,45 |
| FEVI preoperatoria < 30%, n (%) | 20 (5,1%) | 41 (6,6%) | 0,312 |
| Masa indexada VI preoperatoria (gr/m2) (media±DE) | 160,5±45,1 | 155±59,8 | 0,119 |
| Hipertrofia ventricular severa preoperatoria, n (%) | 148 (37,2%) | 228 (36,5%) | 0,891 |
| Presión sistólica arteria pulmonar preoperatoria>55mmHg, n (%) | 79 (20%) | 132 (21,1%) | 0,624 |
| GAM postoperatorio precoz (mmHg) (media±DE) | 20,3±8,5 | 24,8±8,5 | < 0,001 |
| Postoperatorio precoz AOEi (cm2/m2) (media±DE) | 1,7±0,4 | 1,6±0,4 | 0,45 |
| Postoperatorio precoz AOEi < 0,85 cm2/m2, n (%) | 10 (2,5%) | 19 (3%) | 0,62 |
| Postoperatorio precoz FEVI (%) (media±DE) | 64±9,5 | 62,8±11 | 0,097 |
| Masa indexada VI postoperatoria precoz (gr/m2) (media±DE) | 130,1±38,8 | 131,8±53,5 | 0,593 |
| GAM postoperatorio tardío (mmHg) (media±DE) | 22,9±9,2 | 24,9±11,2 | 0,005 |
| Postoperatorio tardío FEVI (%)(media±DE) | 64,7±10,3 | 63,2±10,6 | 0,035 |
| Masa indexada VI postoperatoria tardía (gr/m2) (media±DE) | 133,2±41,9 | 164,8±56,3 | 0,004 |
No hubo valores perdidos en los datos ecocardiográficos preoperatorios. Todos los pacientes supervivientes al alta tuvieron un ecocardiograma de control postoperatorio precoz. Los valores ecocardiográficos perdidos en los controles de seguimiento tardío se deben a muertes durante el seguimiento antes de la realización de un ecocardiograma de control tardío y a aquellos pacientes con seguimiento insuficiente para alcanzar el ecocardiograma de control tardío al final de este estudio.
AOEi: área del orificio efectivo indexado; FEVI: fracción de eyección del ventrículo izquierdo; VI: ventrículo izquierdo.
No se identificaron diferencias estadísticamente significativas en los diámetros preoperatorios indexados medios de raíz ni anillo aórtico. Tampoco se encontraron diferencias significativas en la media de GAM y de masa indexada del VI entre ambos grupos (tabla 2). En el 36,7% de los pacientes (n=376) de la serie se halló hipertrofia ventricular izquierda severa, pero no se detectaron diferencias entre grupos (37,2% vs. 36,5%, p=0,891).
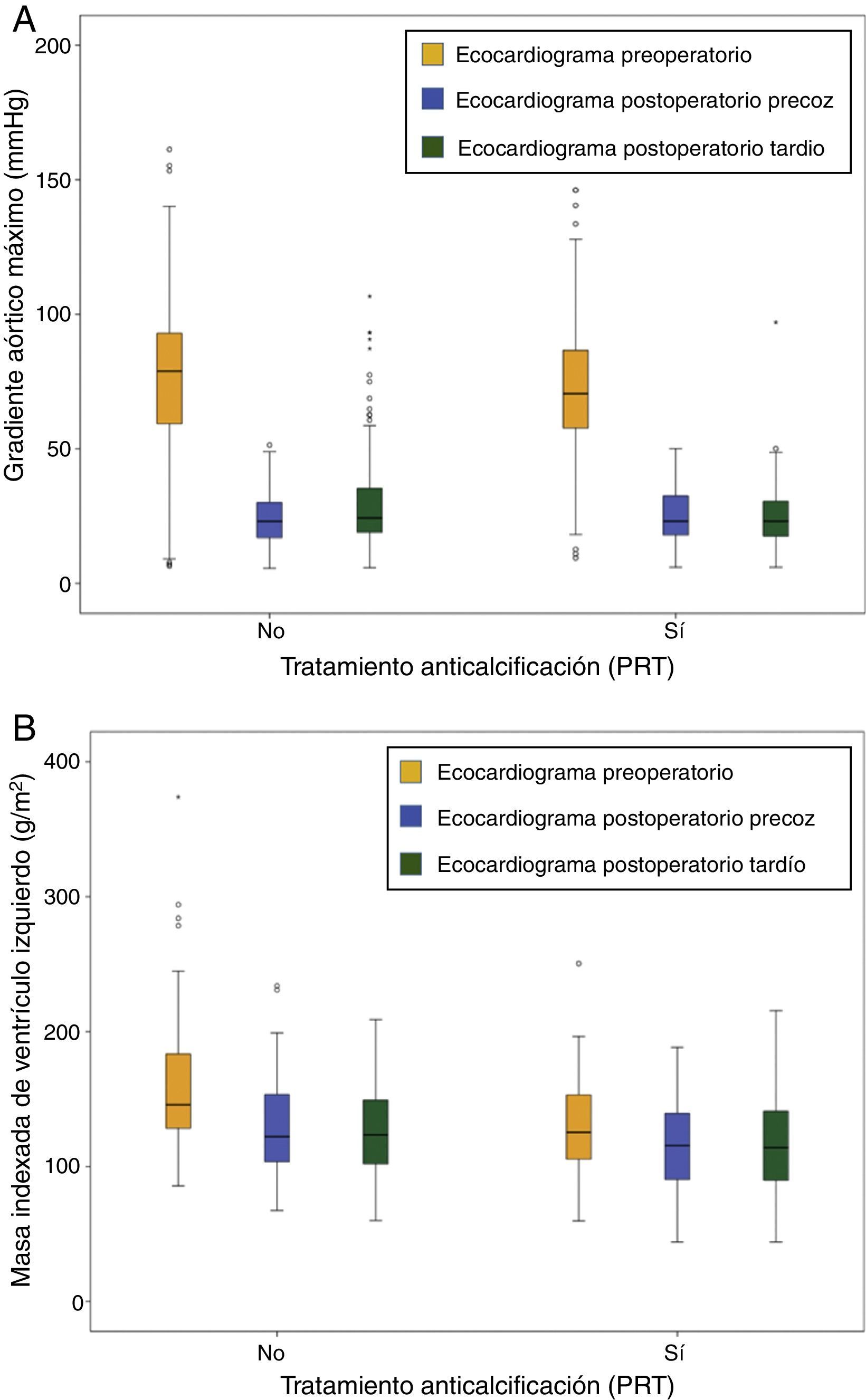
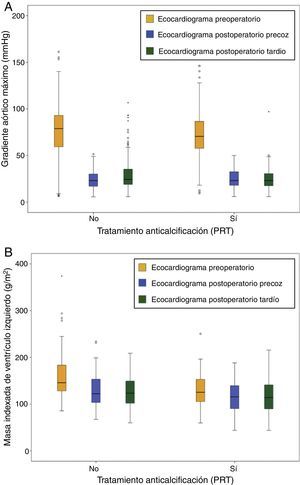
Durante el seguimiento, tanto el GAM postoperatorio precoz como tardío fue significativamente inferior en el grupo PRT (tabla 2). Cuando evaluamos la hipótesis nula de igual disminución del GAM entre los ecocardiogramas pre y postoperatorios entre ambos grupos, encontramos diferencias estadísticamente significativas entre los pacientes PRT (–62mmHg [–64,2- –59,7]) y los pacientes no PRT (–56,0mmHg [–58,1- –53,8]) (p=0,0003). La figura 1 muestra la evolución de los GAM (fig. 1A) y de la masa indexada del VI (fig. 1B) de ambos grupos.
El grupo PRT demostró mayor AOEi en los controles postoperatorios tardíos (1,4±0,2 cm2/m2 vs. 1±0,2 cm2/m2, p<0,001). Aunque no se encontraron diferencias en la masa indexada media del VI en los controles postoperatorios precoces, el grupo PRT mostró menor masa indexada del VI en los controles postoperatorios tardíos (133,2±41,9 gr/m2 vs. 164,8±56,3 gr/m2, p<0,001).
En toda la serie, 29 pacientes (2,8%) presentaron mismatch paciente-prótesis, pero no se evidenciaron diferencias entre ambos grupos (2,5% vs. 3%, p=0,62). Solo en 2 casos se produjo un mismatch paciente-prótesis severo. Ambos pacientes eran mujeres octogenarias que recibieron una bioprótesis Mitroflow 12A de 19mm. Una de las pacientes, que había sido sometida a cirugía combinada de RVA y revascularización coronaria, falleció 96 meses tras la cirugía debido a una neumonía extrahospitalaria. La otra paciente, quien había sido operada de cirugía combinada mitral y RVA, falleció 60 meses tras la intervención a causa de un infarto agudo de miocardio.
SeguimientoEl seguimiento medio fue de 5,4±3,1 años (rango 0-13 años) y acumulado de 4.936,3 pacientes-año.
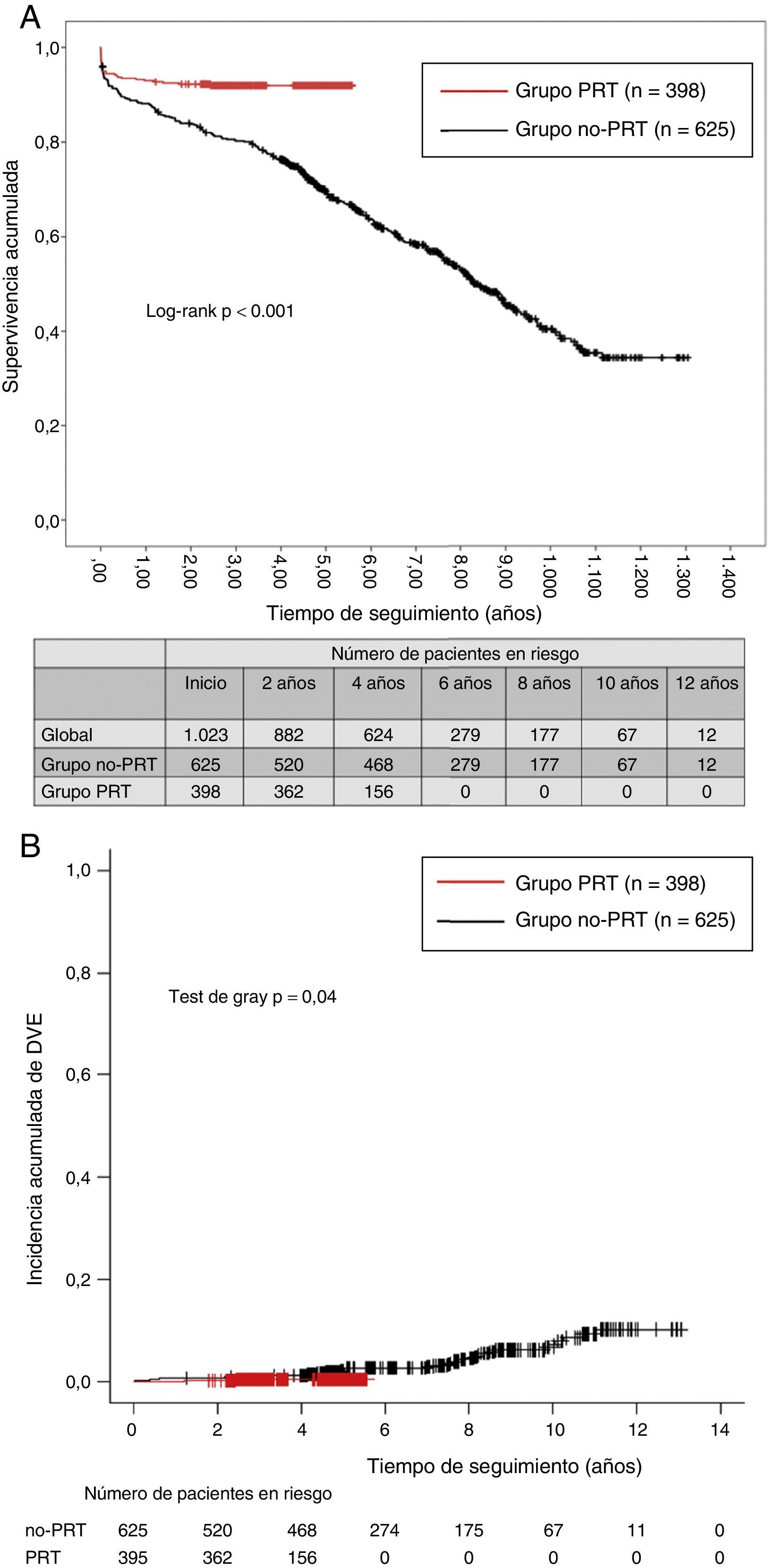
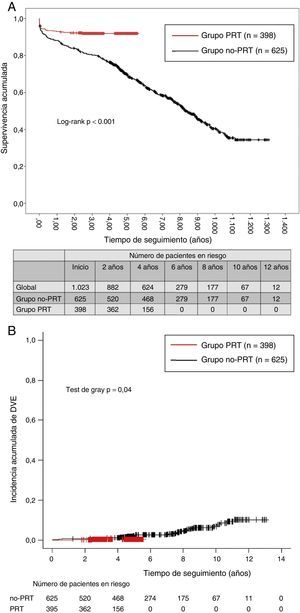
La supervivencia media en el grupo PRT fue del 93% a un año y del 91,9% a 3 y 5 años. En el grupo no PRT, la supervivencia acumulada fue del 88,1% a un año, el 80,2% a 3 años, el 69,6% a 5 años y el 40,5% a 10 años (fig. 2A). La supervivencia a largo plazo fue significativamente superior en el grupo PRT (log-rank p<0,001). En el análisis univariable, el tratamiento anticalcificación demostró ser un factor protector para la supervivencia a largo plazo (HR: 0,31 [0,21-0,45]) (p<0,001).
Las enfermedades respiratorias constituyeron la principal causa de muerte tras el alta hospitalaria (n=54, 16,8%), seguidas por las causas de muerte cardíaca no valvular aórtica (n=47, 14,6%) y las neoplasias (n=39, 12,1%). El estado de los 1.023 pacientes al final del estudio se muestra en la tabla 3.
Estado de los 1.023 pacientes al final del estudio, incluyendo las muertes perioperatorias
| Estado vital | Pacientes (n, %) |
|---|---|
| Vivos | 702 (68,6) |
| Fallecidos | 321 (31,4) |
| Causas mortalidad (n, % fallecimientos) 1. Muertes perioperatorias 2. Enfermedades respiratorias 3. Muerte cardíaca no valvular aórtica 4. Cáncer 5. Causa infecciosa (excluye infecciones respiratorias) 6. Accidente cerebrovascular 7. Otras 8. Desconocidas | 70 (21,9) 54 (16,8) 47 (14,6) 39 (12,1) 33 (10,3) 29 (9) 25 (7,8) 24 (7,5) |
Se detectó DVE en 35 pacientes (3,4%) de la población global durante el seguimiento. La tasa de incidencia fue de 35 casos de DVE por cada 4.936,3 pacientes-año, es decir, 7,1 casos por cada 1.000 pacientes-año, o tasa de incidencia linearizada del 0,7% pacientes-año. La incidencia acumulada global de DVE fue del 0,6% a 2 años, el 1% a 4 años y el 2,2% a 10 años. El seguimiento medio de los pacientes que presentaron DVE hasta su diagnóstico fue de 3,8±0,7 años.
Solo 2 pacientes en el grupo PRT (0,5%) y 33 pacientes en el no PRT (5,3%) presentaron DVE (p<0,001). En el grupo PRT, la incidencia acumulada de DVE fue del 0,2% a 2 años y el 0,5% a 4 años, mientras que en el grupo no PRT alcanzó el 0,8% a 2 años, el 1,3% a 4 años y el 6,7% a 10 años (p=0,04) (fig. 2B). El análisis de regresión de riesgos competitivos mostró que la presencia de PRT se asociaba de forma significativa a una menor tasa de DVE, actuando como factor protector con una HR=0,42 (0,096-0,892) (p=0,04).
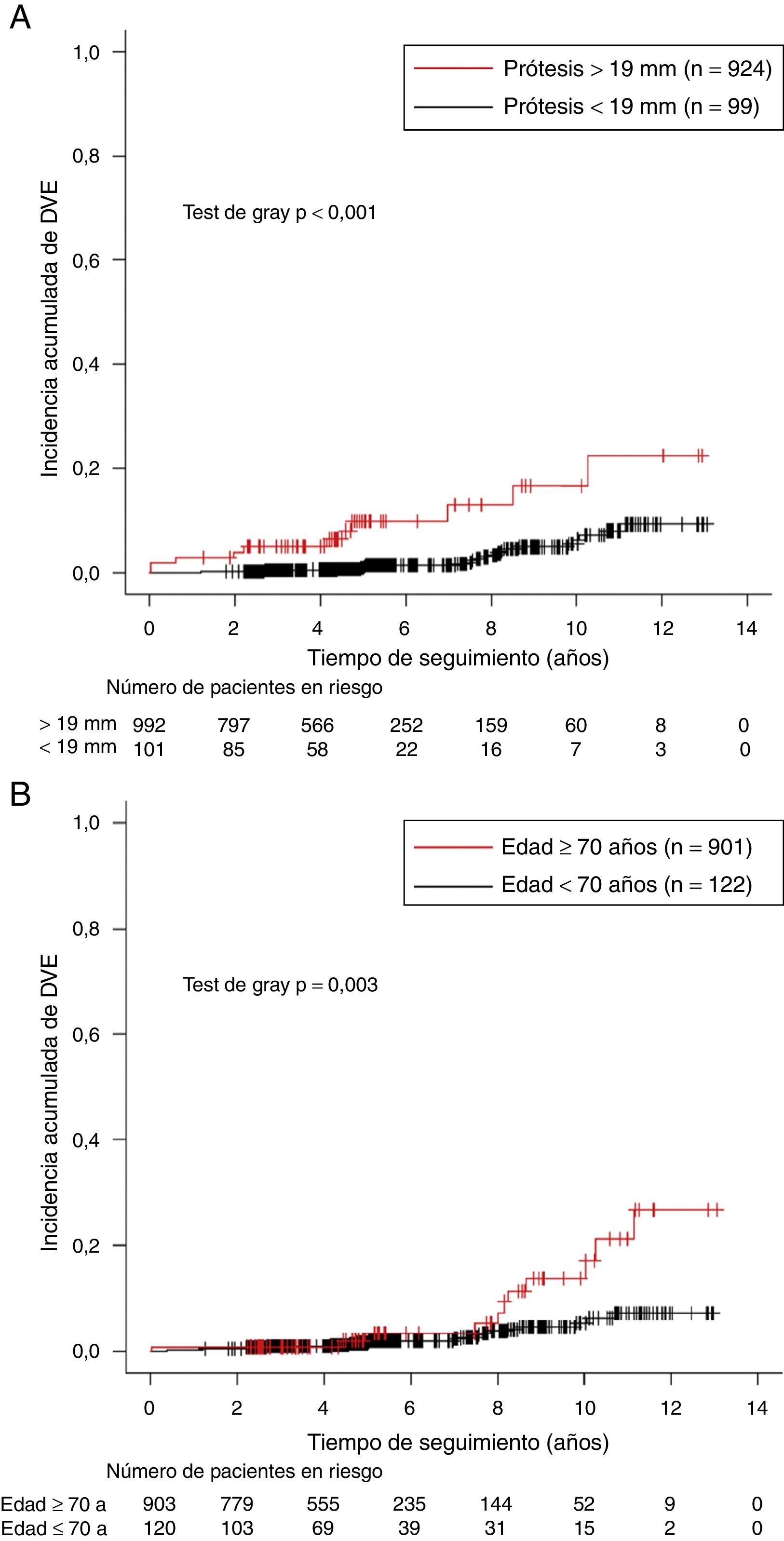
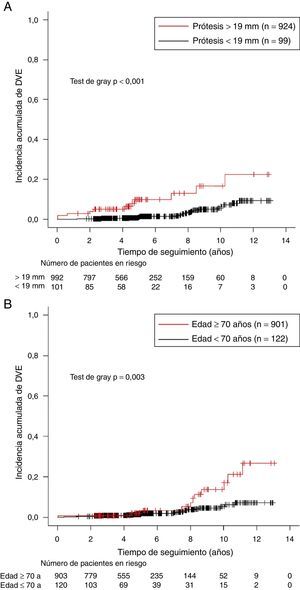
Por el contrario, un tamaño protésico de 19mm se identificó como factor de riesgo de DVE (HR=4,66 [2,27-9,56], p<0,001). La incidencia acumulada de DVE fue mayor en pacientes con una bioprótesis de 19mm (4% a 2 años, 5% a 4 años y 16,7% a 10 años) que en pacientes con una bioprótesis de mayor tamaño (0,2% a 2 años, 0,6% a 4 años y 5,6% a 10 años) (p<0,001) (fig. 3A).
La edad del paciente en el momento del implante se confirmó también como otro factor de riesgo de DVE. Cuando analizamos la edad como variable continua, la edad presentó un efecto protector con una HR de 0,93 (0,9-0,96) por cada año de incremento en la edad del paciente (p<0,001). Cuando consideramos un punto de corte en 70 años, los pacientes menores de 70 años asociaron un riesgo significativamente mayor de DVE con respecto a los de edad más avanzada (HR=2,98 [1,5-5,89], p=0,002). La incidencia acumulada de DVE fue mayor en pacientes < 70 años (0,8% a 2 y 4 años, y 13,7% a 10 años) que en pacientes > 70 años (0,5% a 2 años, 1% a 4 años y 5,4% a 10 años) (p=0,003) (fig. 3B).
Se estudió también la asociación entre la aparición de DVE y el resultado postoperatorio precoz del RVA determinado por el GAM en el ecocardiograma de control postoperatorio precoz. Cuando analizamos el GAM postoperatorio precoz como variable continua, este presentó una HR de 1,08 (1,05-1,12) por cada mmHg de incremento (p<0,001), o lo que es equivalente, un incremento del riesgo del 80% por cada 10mmHg de aumento en el GAM postoperatorio precoz.
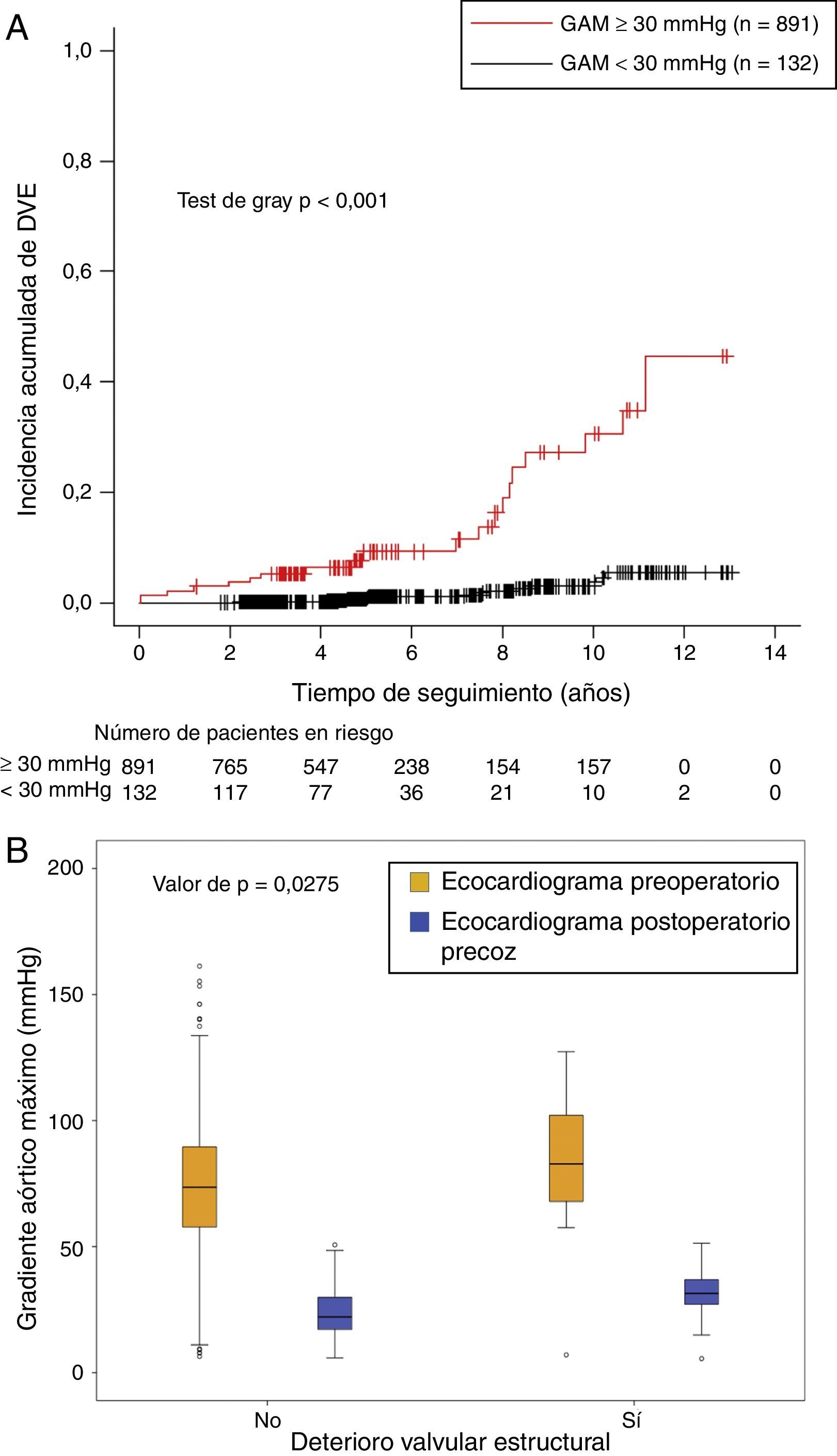
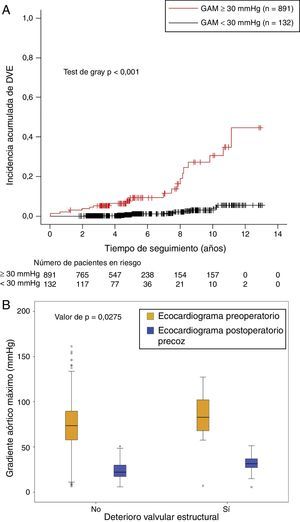
Con el fin de facilitar la interpretación de dicho análisis, los pacientes fueron agrupados en función de su GAM postoperatorio precoz empleando un punto de corte en 30mmHg. Aquellos pacientes con un GAM postoperatorio precoz > 30mmHg asociaron un riesgo significativamente mayor de DVE (HR=10,2 [5,2-19,7], p<0,0001). La incidencia acumulada de DVE fue del 0,1% a 2 años, el 0,2% a 4 años y el 3% a 10 años en pacientes con un GAM postoperatorio precoz < 30mmHg, mientras que alcanzó el 3,8% a 2 años, el 6,4% a 4 años y el 30,7% a 10 años en el grupo > 30mmHg (p<0,001) (fig. 4A).
Gráfica de incidencia acumulada de deterioro valvular estructural en función del gradiente aórtico máximo en el ecocardiograma de control postoperatorio precoz con umbral en 30mmHg (A). Diagrama de cajas que muestra la reducción del gradiente aórtico máximo entre el ecocardiograma de control preoperatorio y el postoperatorio precoz en función de si el paciente desarrolló o no deterioro valvular estructural (B).
No se identificaron diferencias significativas entre los pacientes que presentaron DVE y aquellos libres de ella en cuanto a los GAM preoperatorios (tabla 2). Sin embargo, cuando evaluamos la hipótesis nula de igual disminución de los GAM en el postoperatorio precoz entre los pacientes con y sin DVE, aquellos pacientes que desarrollaron DVE presentaron una menor reducción del gradiente tras el RVA (no DVE: –58,3mmHg [–59,9- –56,7]; DVE: –56mmHg [–58,1- –53,8]) (p=0,0275) (fig. 4B), así como mayores GAM postoperatorios tardíos (24,7±10,3mmHg vs. 58,6±19,4mmHg, p<0,001).
No se hallaron diferencias significativas entre los pacientes con y sin DVE en cuanto a la masa indexada del VI, tanto preoperatoria (156±55,1 g/m2 vs. 159,4±44,3 g/m2, p=0,8) como postoperatoria precoz (126,1±38,8 g/m2 vs. 137,5±32,2 g/m2, p=0,2). No obstante, la masa indexada del VI en los controles postoperatorios tardíos tendió a ser superior en el grupo de pacientes con DVE (124,6±40,8 g/m2 vs. 142,8±37,9 g/m2, p=0,05).
El estado de los pacientes que desarrollaron DVE se muestra en la tabla 4. Entre los 35 pacientes con DVE, 20 pacientes (57,2%) fallecieron y 15 pacientes (42,8%) están vivos, de los que 11 actualmente ya han sido reoperados, 3 pacientes todavía no han sido enviados a cirugía por sus clínicos por hallarse en clase funcional NYHA II y un paciente ha sido desestimado por enfermedad neoplásica avanzada.
Estado de los 31 pacientes que desarrollaron DVE
| Estado pacientes con DVE | Pacientes (n=35) |
|---|---|
| Vivos, n (%) Reoperados No candidatos a cirugía No remitidos a cirugía | 15 (42,8) 11 (8 abierta/3 TAVI) 1 (cáncer colon estadio IV) 3 |
| Fallecidos, n (%) Reoperados Muerte en lista de espera No candidatos a cirugía No remitidos a cirugía | 20 (57,2) 3 (cirugía abierta) 4 (3 abierta/1 TAVI) 4 (2 demencia/2 EPOC severa) 9 (5 ICC relacionada con prótesis; 4 no relacionada con prótesis: 2 AMI; 1 causa infecciosa;1 EPOC) |
DVE: deterioro valvular estructural; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; ICC: insuficiencia cardíaca congestiva.
Una de las principales razones para desarrollar este estudio ha sido que, a pesar del excelente comportamiento hemodinámico de las válvulas de pericardio bovino, especialmente en pacientes añosos, se ha publicado en los últimos años una serie de estudios3-6 que ponen en duda su durabilidad a largo plazo, e incluso su seguridad3.
Nuestro estudio contribuye a desvelar la verdadera incidencia de DVE y sus potenciales factores causales en todos los modelos de bioprótesis Mitroflow. Tras revisar la literatura científica hasta la fecha, este es el primer estudio reportando diferencias potenciales en los resultados de seguimiento entre los 3 modelos de Mitroflow (12A/LX/DL), así como la influencia sobre el DVE del tratamiento anticalcificación recientemente incorporado.
Nuestro estudio demuestra que el tratamiento PRT reduce la incidencia de DVE y extiende la vida de las bioprótesis Mitroflow. Asimismo, esta investigación contribuye a dibujar el perfil de paciente de alto riesgo de presentar DVE.
Algunos autores3-6,18 han reportado desgarros en los velos y DVE precoz debido a calcificación prematura, incluso en pacientes de edad avanzada, lo cual fue altamente infrecuente en nuestra serie con solo un 3,4% de los pacientes afectados al final del seguimiento. Esto se correspondió con una tasa de incidencia de 4.936,3 pacientes-año o, de forma más sencilla, 7,1 casos por cada 1.000 paciente-año. De hecho, nuestro estudio demostró una incidencia acumulada global de DVE del 1% a 4 años y el 6,7% a 10 años.
Hemos identificado diferencias hemodinámicas significativas en los controles ecocardiográficos postoperatorios precoces entre los pacientes libres de DVE y aquellos pacientes que finalmente presentaron DVE. Estos últimos presentaron una menor reducción media del GAM tras el RVA. Además, hemos observado que el GAM en los controles ecocardiográficos precoces es un excelente predictor del riesgo de DVE. De hecho, definimos un riesgo un 80% superior de DVE por cada 10mmHg de aumento en el GAM postoperatorio precoz (HR de 1,08 por mmHg de incremento). Con el fin de facilitar la comunicación de los datos, escogimos un punto de corte de 30mmHg en el GAM postoperatorio precoz. Aquellos pacientes con un gradiente igual o superior demostraron un riesgo de DVE casi 10 veces superior (HR=10,2) al de los pacientes con un gradiente inferior a 30mmHg. Más aun, la incidencia acumulada de DVE en los pacientes con un GAM superior a dicho umbral alcanzó el 30,7% a 10 años. Sobre la base de estos hallazgos, podemos recomendar un seguimiento clínico y ecocardiográfico más estrecho en aquellos pacientes que presenten un GAM igual o superior a 30mmHg en el control ecocardiográfico en el primer año postoperatorio. Estos hallazgos también justifican futuros estudios con un mayor seguimiento para intentar definir mejor qué valores de corte en los gradientes aórticos medio y máximo postoperatorios precoces pueden predecir el desarrollo de DVE.
Las bioprótesis Mitroflow se implantan normalmente en raíces aórticas pequeñas12, como ocurre en nuestra serie. Por otra parte, el implante de una prótesis pequeña asocia un mayor riesgo de mismatch paciente-prótesis y DVE1,2.
En 2014 Senage et al.3 reportaron un 6% de DVE con un tercio de degeneración precoz en una serie de 617 válvulas Mitroflow (modelos 12A y LX), entre las que había un 22% de bioprótesis de 19mm. Ese porcentaje de implantes de 19mm es extraordinariamente elevado. En nuestra serie, el implante total de bioprótesis Mitroflow de 19mm fue del 9,6%, lo que está en línea con lo publicado por otros autores19-21. Recientemente, Piccardo et al.22 han publicado un estudio de 728 pacientes con los modelos Mitroflow 12A y LX en el que el tamaño protésico de 19mm se asociaba con el desarrollo de DVE. En dicha serie se implantaron un 10% de bioprótesis de 19mm.
En nuestro estudio hemos demostrado que el riesgo de DVE es 4,6 veces mayor (HR=4,66) en los pacientes que reciben una prótesis de 19mm. Asimismo, los portadores de una bioprótesis de 19mm tuvieron una incidencia acumulada de DVE de 16,7% a 10 años.
Las nuevas prótesis sin sutura, que favorecen un abordaje mínimamente invasivo, pueden desempeñar un papel determinante en esta subpoblación de pacientes con anillo aórtico pequeño pues aportan una considerable ventaja hemodinámica, como ha sido recientemente indicado por algunos autores23.
Por tanto, en las series que reportan resultados desfavorables a medio y largo plazo3-6 y presentan un alto porcentaje de bioprótesis pequeñas, existe un sesgo de selección dado que estas bioprótesis están sometidas a condiciones hemodinámicas más hostiles. Además, podemos concluir que el tamaño protésico de 19mm debería evitarse, quedando reservado para casos de alto riesgo para ampliación de anillo aórtico y contraindicación anatómica para el implante de una prótesis sin sutura.
La edad del paciente en el momento del RVA es otro factor de riesgo de DVE24,25. Un estudio recientemente publicado por Anantha Narayanan et al.26 con 1.003 pacientes sometidos a RVA con el modelo 12A encontró que la edad era el único factor independiente de reintervención por DVE. En nuestro estudio, los pacientes menores de 70 años presentaron un riesgo de DVE casi 3 veces mayor (HR=2,98) que aquellos de edad mayor de 70 años.
Ninguno de los citados estudios que reportaron una incidencia anormal de DVE en las bioprótesis Mitroflow3-6,18 incluyó en sus series el modelo más reciente, el modelo DL. Dicho modelo ha sido el primero en incorporar un tratamiento anticalcificación del pericardio bovino (PRT), que puede influir positivamente en la supervivencia libre de DVE.
En nuestra serie, la incidencia acumulada de DVE fue significativamente inferior en el grupo con tratamiento anticalcificación en comparación con el grupo sin PRT. Asimismo, el análisis de regresión de riesgos competitivos confirmó el efecto protector de dicho tratamiento anticalcificación, de modo que los pacientes con una válvula con PRT presentaron un 58% menos de riesgo (HR=0,42). Este efecto protector del PRT también debe destacarse porque, además del modelo DL, la actual evolución de las bioprótesis Mitroflow, la bioprótesis CROWN PRT (SORIN GROUP, Milán, Italia), incorpora dicho tratamiento anticalcificación. Además, los pacientes con prótesis PRT presentaron unos mejores datos ecocardiográficos en los controles durante el seguimiento.
Por otra parte, el grupo PRT también demostró mayor supervivencia a largo plazo, al tiempo que el factor PRT se revelaba como un factor protector de mortalidad a largo plazo.
LimitacionesEste estudio presenta las limitaciones inherentes a cualquier estudio retrospectivo. Sin embargo, la principal limitación es el menor seguimiento del grupo PRT debido a que el modelo DL fue lanzado al mercado en 2011. Por tanto, este estudio puede carecer de suficiente poder estadístico para identificar otras variables clínicamente relevantes en los resultados a largo plazo. Es por ello necesario realizar estudios a más largo plazo.
La mortalidad global intrahospitalaria fue del 6,8% y del 5% para el RVA aislado. Otros estudios publicados con RVA combinado reportaron mortalidades perioperatorias < 5% pero en poblaciones más jóvenes26, lo que podría explicar esta diferencia.
Otra limitación es que los controles ecocardiográficos durante el seguimiento, aunque se realizaron de acuerdo con las recomendaciones actuales, no fueron efectuados exactamente al mismo tiempo en todos los pacientes. Además, el número de controles ecocardiográficos y su calendario variaron entre pacientes debido a presentar distintos médicos y hospitales de procedencia.
Finalmente, en los resultados de regresión de la masa ventricular izquierda pueden haber influido otros factores concomitantes, como por ejemplo el tipo de tratamiento antihipertensivo27. Desafortunadamente, no disponemos de un seguimiento clínico postoperatorio lo suficientemente estricto en todos los pacientes como para ajustar por dichos parámetros.
ConclusionesEl DVE es un fenómeno multifactorial en el que influyen parámetros relacionados con el paciente, la bioprótesis y su comportamiento hemodinámico postoperatorio. Una edad del paciente < 70 años, un tamaño valvular de 19mm y un gradiente postoperatorio precoz mayor o igual a 30mmHg son factores de riesgo para el DVE. Por otra parte, el tratamiento anticalcificación del modelo DL actúa como factor protector, reduce la incidencia de DVE y extiende la vida de la bioprótesis.
Responsabilidades éticasEste estudio fue aprobado por el Comité de Ética de la Investigación de Galicia y Servicio Gallego de Salud (SERGAS) en fecha 17 de diciembre del 2015 con código de registro del estudio 2015/646.
Conflicto de interesesLos autores tampoco reportan ningún conflicto de interés con este trabajo.