Numerosos estudios han demostrado los beneficios del levosimendán en pacientes con insuficiencia cardiaca crónica y aguda; sin embargo, los resultados son contradictorios cuando se analiza el uso de levosimendán previo a cirugía de revascularización miocárdica y disfunción ventricular severa. El objetivo de este estudio es valorar el rendimiento del precondicionamiento con levosimendán en cirugía de revascularización coronaria en pacientes con disfunción ventricular severa.
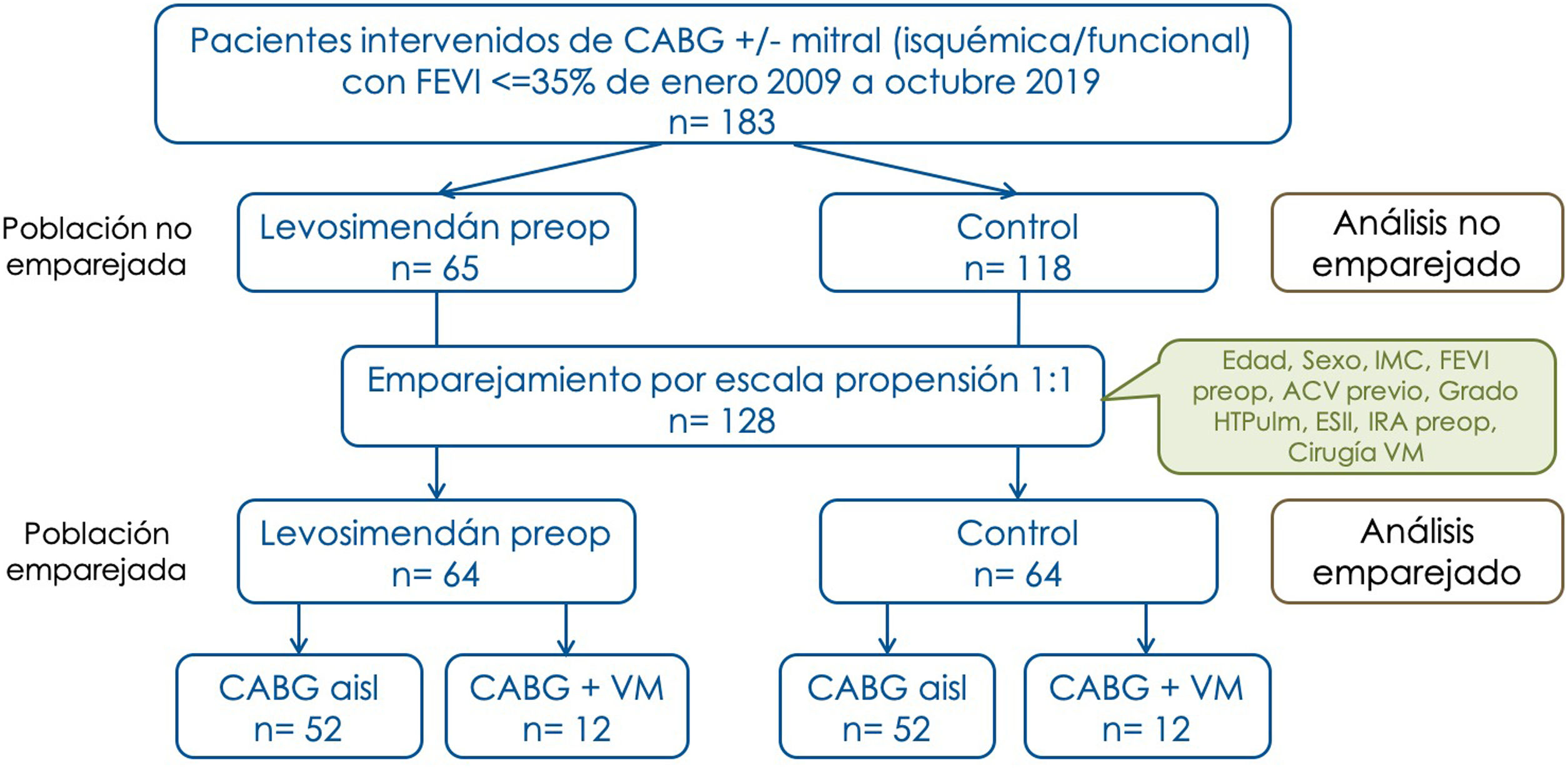
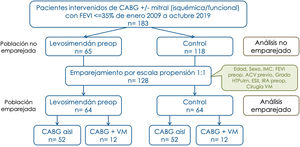
MétodosSe realizó un estudio de cohortes retrospectivo emparejado por escala de propensión. Participantes: pacientes intervenidos desde enero de 2009 a octubre de 2019 de cirugía de revascularización coronaria, asociada o no a cirugía mitral de etiología isquémica/funcional con FEVI ≤ a 35%. Se dividieron en dos cohortes, según si recibieron levosimendán (Levo) o no (NoLevo) previamente a la intervención, quedando tras el emparejamiento 64 pacientes por cohorte. Variables analizadas: morbimortalidad postoperatoria, reingreso y mortalidad en el seguimiento. Análisis estadístico: los datos categóricos se compararon mediante χ2 o test de Fisher, y los cuantitativos mediante t de Student o W de Wilcoxon. Se estimó el RR/HR para valorar la asociación entre el uso de levosimendán preoperatorio y las variables resultado.
ResultadosEl uso de levosimendán preoperatorio no disminuyó la mortalidad (RR = 0,86, p = 0,770), ni la estancia hospitalaria, ni tampoco las complicaciones postoperatorias. La supervivencia libre de reingreso cardiológico, mortalidad en seguimiento por cualquier causa y de causa cardiaca fue similar entre cohortes.
ConclusionesLos resultados obtenidos no apoyan el uso extendido de levosimendán previo a la cirugía de revascularización miocárdica en pacientes con disfunción ventricular severa.
Numerous studies have demonstrated the benefit of levosimendan in patients with chronic and acute heart failure. However, when it comes to its preoperatory use in coronary by-pass surgery in patients with severe ventricular dysfunction, there are some contradictory results. The objective of this study is assessing preconditioning efficiency with levosimendan in surgical myocardial revascularization in patients with severe ventricular dysfunction.
MethodsWe design a propensity score-matched cohort study. The study included patients with a LVEF less or equal to 35% who underwent isolated coronary artery by-pass grafting or associated to ischemic/functional mitral surgery from January 2009 to October 2019. They were split into two cohorts whether they received levosimendan preoperatively (Levo) or not (NoLevo); after matching there were 64 patients per cohort. Outcome variables were postoperative morbi-mortality, readmission and follow-up mortality. Statistical analysis: categorical data were compared with a Chi-square or Fisher exact test, and quantitative data with a t-Student or W-Wilcoxon tests. RR/HR were estimated for assessing the association between preoperative use of levosimendan and outcomes.
ResultsPreoperative levosimendan use did not decreased in-hospital mortality (RR = 0,86, p = 0.770), and neither do hospital stay, nor postoperative complications. Event-free survival was similar between cohorts in terms of cardiological readmissions, all-cause and cardiological follow-up mortality.
ConclusionsOur results do not support the widespread use of levosimendan previously to myocardial revascularization surgery in patients with severe ventricular dysfunction.
El levosimendán forma parte de los estimulantes cardiacos, aunque también tiene otros efectos. Este fármaco y su metabolito activo actúan aumentando la sensibilidad al calcio de diferentes proteínas: troponina C –de lo que deriva su inotropismo sin alterar la relajación– y canales de potasio sensibles a ATP tanto de la musculatura lisa –lo que conduce a la vasodilatación, sobre todo a nivel de la circulación pulmonar y coronaria–, como de la membrana mitocondrial –lo que le proporciona un efecto cardioprotector–1. In vitro se conoce un efecto inhibidor de la fosfodiesterasa III, pero no está clara su importancia in vivo a concentraciones terapéuticas2.
Su concentración plasmática máxima se alcanza a los dos días, y la semivida de los metabolitos activos es de 75-80 horas2. Esta farmacocinética suscitó a empezar a utilizarlo en pacientes con insuficiencia cardiaca aguda o crónica descompensada, y los resultados iniciales fueron prometedores. En los ensayos clínicos LIDO3 y SURVIVE4, el levosimendán producía mayor aumento de gasto cardiaco, y mayor disminución de la PCP, mejoraba la disnea y presentaba menor mortalidad temprana que la dobutamina. En los estudios REVIVE I y II5, el levosimendán produjo mayor mejoría clínica, mayor disminución del ntBNP, y mortalidad ligeramente mayor, aunque no significativa, que el placebo en pacientes con insuficiencia cardiaca aguda.
La incidencia de síndrome de bajo gasto cardiaco poscardiotomía varía del 3 al 14% en pacientes operados de revascularización miocárdica, y este riesgo se duplica si la fracción de eyección es menor del 40%6. Por todo esto, diversos grupos comenzaron a usarlo previamente a la cirugía cardiaca con circulación extracorpórea (CEC), en pacientes con disfunción ventricular, pero los resultados fueron contradictorios. Los primeros estudios observaron menor mortalidad y necesidad de vasoactivos, con una mayor probabilidad de éxito en el primer intento de desconexión de CEC7,8. En cambio, otros grupos no encontraron diferencias, en comparación con el placebo respecto a mortalidad, necesidad de catecolaminas, o infarto perioperatorio9–12. Además, se ha observado mayor riesgo de fibrilación auricular (FA) postoperatoria13.
El objetivo de este estudio es valorar el rendimiento del uso preoperatorio de levosimendán en pacientes revascularizados quirúrgicamente con disfunción ventricular severa.
MétodosSe diseñó un estudio de cohortes retrospectivo con emparejamiento 1:1 por escala de propensión.
ParticipantesSe recogieron los datos de los pacientes intervenidos en nuestro hospital de revascularización miocárdica, asociada o no a cirugía sobre la válvula mitral de origen isquémico o funcional, y con FEVI ≤ a 35%, desde enero de 2009 a octubre de 2019, con un seguimiento hasta diciembre de 2019. Se dividieron en dos cohortes, según habían recibido levosimendán preoperatoriamente (Levo) o no (NoLevo-control).
Incorporación de levosimendán preoperatorio en cirugía cardiaca y criterios de administraciónA raíz de los resultados de levosimendán en insuficiencia cardiaca y de los primeros estudios que observaban un beneficio del uso de levosimendán en cirugía cardiaca, en 2014 llegamos al consenso en nuestro centro de usar levosimendán preoperatoriamente en pacientes tributarios a revascularización miocárdica ± cirugía mitral de origen isquémico o funcional con disfunción ventricular severa.
Inicialmente, los pacientes ingresaban 24-48 h antes en la UCI. Conforme adquirimos experiencia con el manejo clínico de estos pacientes, el ingreso preoperatorio pasó a tener lugar en la sala de hospitalización, con control por telemetría. Sin embargo, la estrategia no fue uniforme, y no todos los pacientes candidatos a priori a levosimendán pudieron realmente recibirlo, a veces por motivos logísticos (falta de cama en UCI o en sala con telemetría), y otras por mala tolerancia hemodinámica por hipotensión; esta última situación fue más frecuente en pacientes que ingresados en la Unidad Coronaria. De esta manera, el tamaño de las cohortes no emparejadas fue de 65 pacientes en grupo Levo y 118 en NoLevo (grupo control), y tras el emparejamiento, de 64 en ambas cohortes (fig. 1).
Consideraciones éticasEste estudio respeta los principios establecidos en la Declaración de Helsinki (2000), en el Convenio del Consejo de Europa relativo a los derechos humanos y la biomedicina (BOE, 20 de octubre de 1999). Así mismo, se ajusta a los requisitos establecidos en la legislación española en el ámbito de la investigación médica (Ley 14/2007 de 3 de julio, BOE 4 de julio) y la protección de datos de carácter personal (Ley Orgánica 3/2018, BOE de 5 de diciembre). Este estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital de la Santa Creu i Sant Pau de Barcelona.
Variables resultadoLa variable principal es la mortalidad operatoria, definida como aquella que ocurre durante el ingreso hospitalario, o durante los primeros 30 días tras la cirugía, aunque el paciente haya sido dado de alta.
Las variables secundarias son: complicaciones perioperatorias, estancia en UCI y postoperatoria total, y en el seguimiento: reingresos por causa cardiaca (que incluye insuficiencia cardiaca, angina, arritmias, necesidad de implantación de marcapasos, taponamiento cardiaco diferido, etc.) y mortalidad por todas las causas y de origen cardiológico.
La insuficiencia renal aguda postoperatoria se definió según los criterios AKIN14.
Algunas definicionesDentro de las variables procedimentales, no disponemos del tiempo real de desconexión de CEC. De esta manera, se calculó como la diferencia entre el tiempo de CEC y de isquemia, y se le restó el tiempo en CEC prepinzamiento aórtico utilizado para marcar las coronarias y purgado de cardioplejía (estimado en siete minutos). En el caso de uso de vena safena y de realización de la anastomosis proximal en aorta después del despinzamiento aórtico, también se descontó el tiempo de realización de la anastomosis, estimado en nueve minutos.
Análisis estadísticoLos datos se analizaron con el paquete estadístico de datos Stata (Stata/IC 13.1 para Mac de StataCorp). Las variables continuas se presentan como mediana y rango intercuartílico (IQR); las variables categóricas se muestran en forma de porcentaje.
Para evitar el sesgo de confusión, se emparejaron las cohortes por medio de una escala de propensión, que fue determinada por las siguientes covariables: edad, sexo, IMC, FA permanente preoperatoria, accidente cerebrovascular (ACV) previo, FEVI preoperatoria, grado de hipertensión pulmonar (categorizada en no, ligera, moderada y severa), EuroSCORE II, enfermedad renal crónica (filtrado glomerular menor a 60 mL/min y/o necesidad de diálisis), diálisis preoperatoria y tipo de intervención (CABG aislada vs. CABG + mitral). Posteriormente, se realizó el emparejamiento con el comando psmatch2 por el vecino más cercano con una ratio 1:1. Se estableció el calibre máximo en 0,2.
Para evaluar la comparabilidad entre cohortes de las variables preoperatorias y procedimentales, se utilizó el comando pstest, que estima la diferencia estandarizada absoluta de las medias de los valores de la escala de propensión entre cohortes (valor B de Rubin), y la ratio entre varianzas de los valores de la escala de propensión de las cohortes (valor R de Rubin). Un valor B mayor a 25, o un valor R fuera del rango (0,5-2), determina que las cohortes no están adecuadamente balanceadas15.
Para comparar las diferencias entre las variables intra (tiempos de CEC, isquemia y desconexión de CEC y eventos hemodinámicos) y postoperatorias, se usó la prueba W de Wilcoxon para las continuas, y la prueba de χ2, o prueba exacta de Fisher en el caso de las categóricas. Para valorar la asociación entre el uso de levosimendán preoperatorio y las variables postoperatorias se estimó el RR. Para las variables de seguimiento, se estimó la HR –siendo la cohorte NoLevo el grupo control–, se calcularon las curvas de supervivencia acumulada libre del evento, y dichas curvas se compararon con la prueba de Mantel-Cox (log rank test). El análisis se realizó tanto en toda la población no emparejada como en la muestra emparejada.
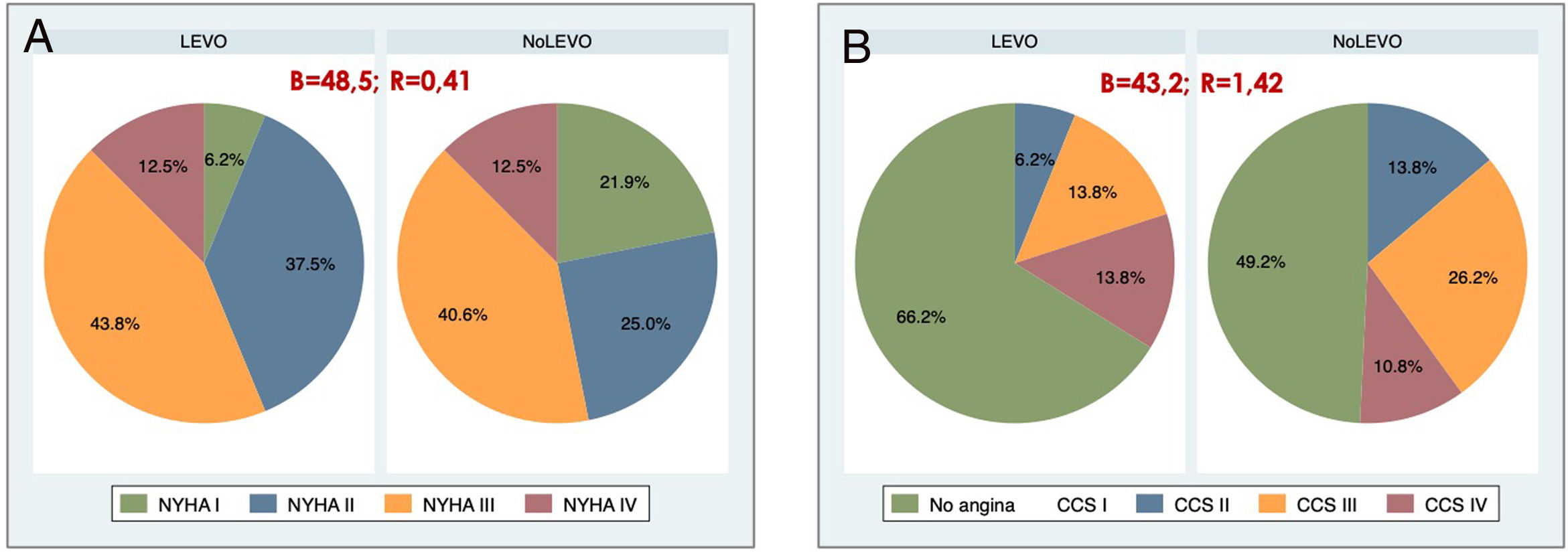
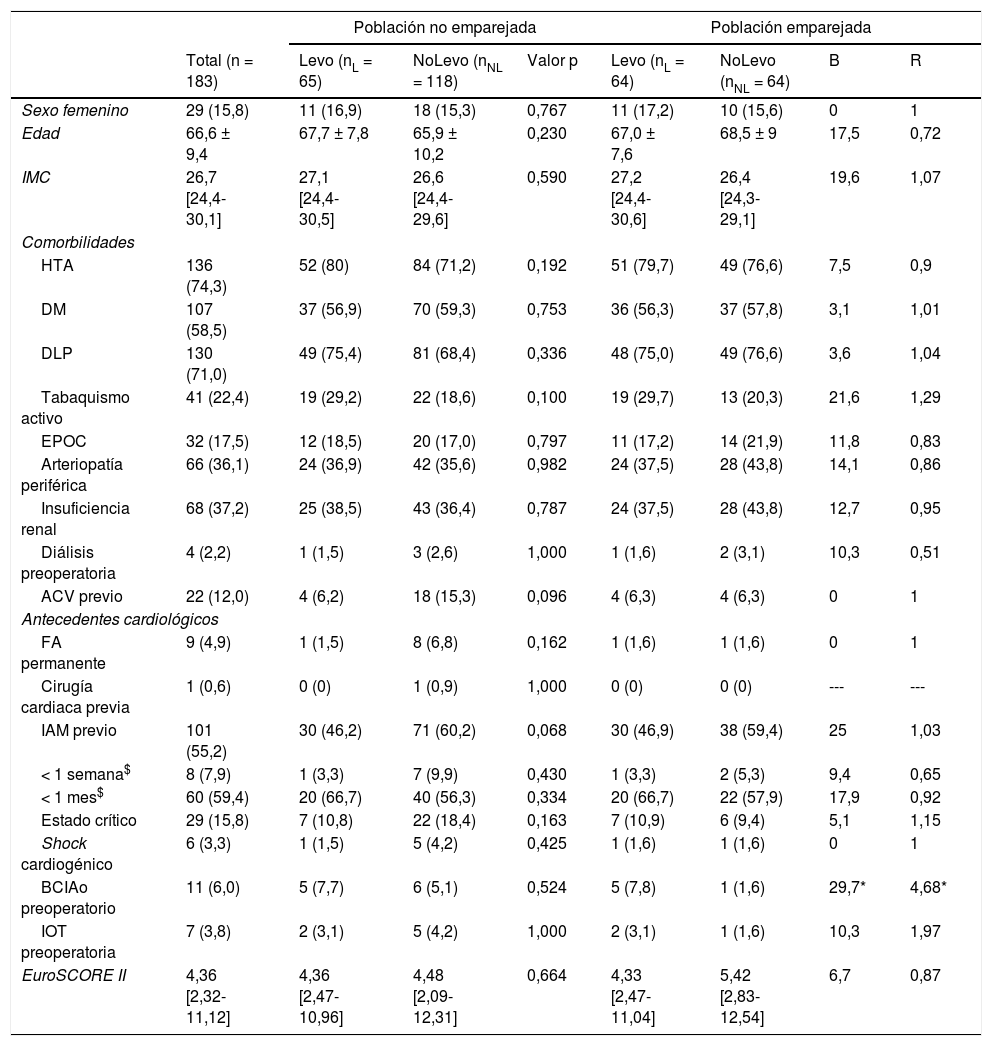
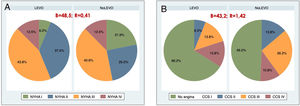
ResultadosCaracterísticas preoperatoriasLas tablas 1 y 2 muestran las características preoperatorias y procedimentales de los pacientes. La distribución de las comorbilidades fue similar en ambas cohortes. Respecto al estado cardiológico, en el análisis emparejado la cohorte NoLevo presentó una tendencia a mayor prevalencia de IAM previo que no alcanzó la significación (B = 25; R = 1,03). La frecuencia de pacientes con balón de contrapulsación intraaórtico (BCIAo) preoperatorio fue significativamente mayor en los pacientes que recibieron levosimendán (B = 29,7; R = 4,68). La cohorte Levo presentó una mayor proporción de pacientes en clase funcional II-III de la New York Heart Association (NYHA) (B = 48,5; R = 0,41) (fig. 2A); la distribución de la clase funcional de angina CCS también fue diferente (B = 38,4; R = 1,41), destacando que en la cohorte Levo había un mayor porcentaje de pacientes sin angina, en los cuales la clínica predominante fue de fallo cardiaco (fig. 2B).
Características preoperatorias de los pacientes
| Población no emparejada | Población emparejada | |||||||
|---|---|---|---|---|---|---|---|---|
| Total (n = 183) | Levo (nL = 65) | NoLevo (nNL = 118) | Valor p | Levo (nL = 64) | NoLevo (nNL = 64) | B | R | |
| Sexo femenino | 29 (15,8) | 11 (16,9) | 18 (15,3) | 0,767 | 11 (17,2) | 10 (15,6) | 0 | 1 |
| Edad | 66,6 ± 9,4 | 67,7 ± 7,8 | 65,9 ± 10,2 | 0,230 | 67,0 ± 7,6 | 68,5 ± 9 | 17,5 | 0,72 |
| IMC | 26,7 [24,4-30,1] | 27,1 [24,4-30,5] | 26,6 [24,4-29,6] | 0,590 | 27,2 [24,4-30,6] | 26,4 [24,3-29,1] | 19,6 | 1,07 |
| Comorbilidades | ||||||||
| HTA | 136 (74,3) | 52 (80) | 84 (71,2) | 0,192 | 51 (79,7) | 49 (76,6) | 7,5 | 0,9 |
| DM | 107 (58,5) | 37 (56,9) | 70 (59,3) | 0,753 | 36 (56,3) | 37 (57,8) | 3,1 | 1,01 |
| DLP | 130 (71,0) | 49 (75,4) | 81 (68,4) | 0,336 | 48 (75,0) | 49 (76,6) | 3,6 | 1,04 |
| Tabaquismo activo | 41 (22,4) | 19 (29,2) | 22 (18,6) | 0,100 | 19 (29,7) | 13 (20,3) | 21,6 | 1,29 |
| EPOC | 32 (17,5) | 12 (18,5) | 20 (17,0) | 0,797 | 11 (17,2) | 14 (21,9) | 11,8 | 0,83 |
| Arteriopatía periférica | 66 (36,1) | 24 (36,9) | 42 (35,6) | 0,982 | 24 (37,5) | 28 (43,8) | 14,1 | 0,86 |
| Insuficiencia renal | 68 (37,2) | 25 (38,5) | 43 (36,4) | 0,787 | 24 (37,5) | 28 (43,8) | 12,7 | 0,95 |
| Diálisis preoperatoria | 4 (2,2) | 1 (1,5) | 3 (2,6) | 1,000 | 1 (1,6) | 2 (3,1) | 10,3 | 0,51 |
| ACV previo | 22 (12,0) | 4 (6,2) | 18 (15,3) | 0,096 | 4 (6,3) | 4 (6,3) | 0 | 1 |
| Antecedentes cardiológicos | ||||||||
| FA permanente | 9 (4,9) | 1 (1,5) | 8 (6,8) | 0,162 | 1 (1,6) | 1 (1,6) | 0 | 1 |
| Cirugía cardiaca previa | 1 (0,6) | 0 (0) | 1 (0,9) | 1,000 | 0 (0) | 0 (0) | --- | --- |
| IAM previo | 101 (55,2) | 30 (46,2) | 71 (60,2) | 0,068 | 30 (46,9) | 38 (59,4) | 25 | 1,03 |
| < 1 semana$ | 8 (7,9) | 1 (3,3) | 7 (9,9) | 0,430 | 1 (3,3) | 2 (5,3) | 9,4 | 0,65 |
| < 1 mes$ | 60 (59,4) | 20 (66,7) | 40 (56,3) | 0,334 | 20 (66,7) | 22 (57,9) | 17,9 | 0,92 |
| Estado crítico | 29 (15,8) | 7 (10,8) | 22 (18,4) | 0,163 | 7 (10,9) | 6 (9,4) | 5,1 | 1,15 |
| Shock cardiogénico | 6 (3,3) | 1 (1,5) | 5 (4,2) | 0,425 | 1 (1,6) | 1 (1,6) | 0 | 1 |
| BCIAo preoperatorio | 11 (6,0) | 5 (7,7) | 6 (5,1) | 0,524 | 5 (7,8) | 1 (1,6) | 29,7* | 4,68* |
| IOT preoperatoria | 7 (3,8) | 2 (3,1) | 5 (4,2) | 1,000 | 2 (3,1) | 1 (1,6) | 10,3 | 1,97 |
| EuroSCORE II | 4,36 [2,32-11,12] | 4,36 [2,47-10,96] | 4,48 [2,09-12,31] | 0,664 | 4,33 [2,47-11,04] | 5,42 [2,83-12,54] | 6,7 | 0,87 |
B: valor B de Rubin; R: ratio R de Rubin. Cohortes balanceadas si B < 25 y R en rango (0,5-2).
Valores B o R que indican cohortes no balanceadas.
ACV: accidente cerebrovascular; BCIAo: balón de contrapulsación intraaórtico; DLP: dislipemia; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IOT: intubación orotraqueal. $ Porcentajes calculados sobre los pacientes que presentaron IAM previo.
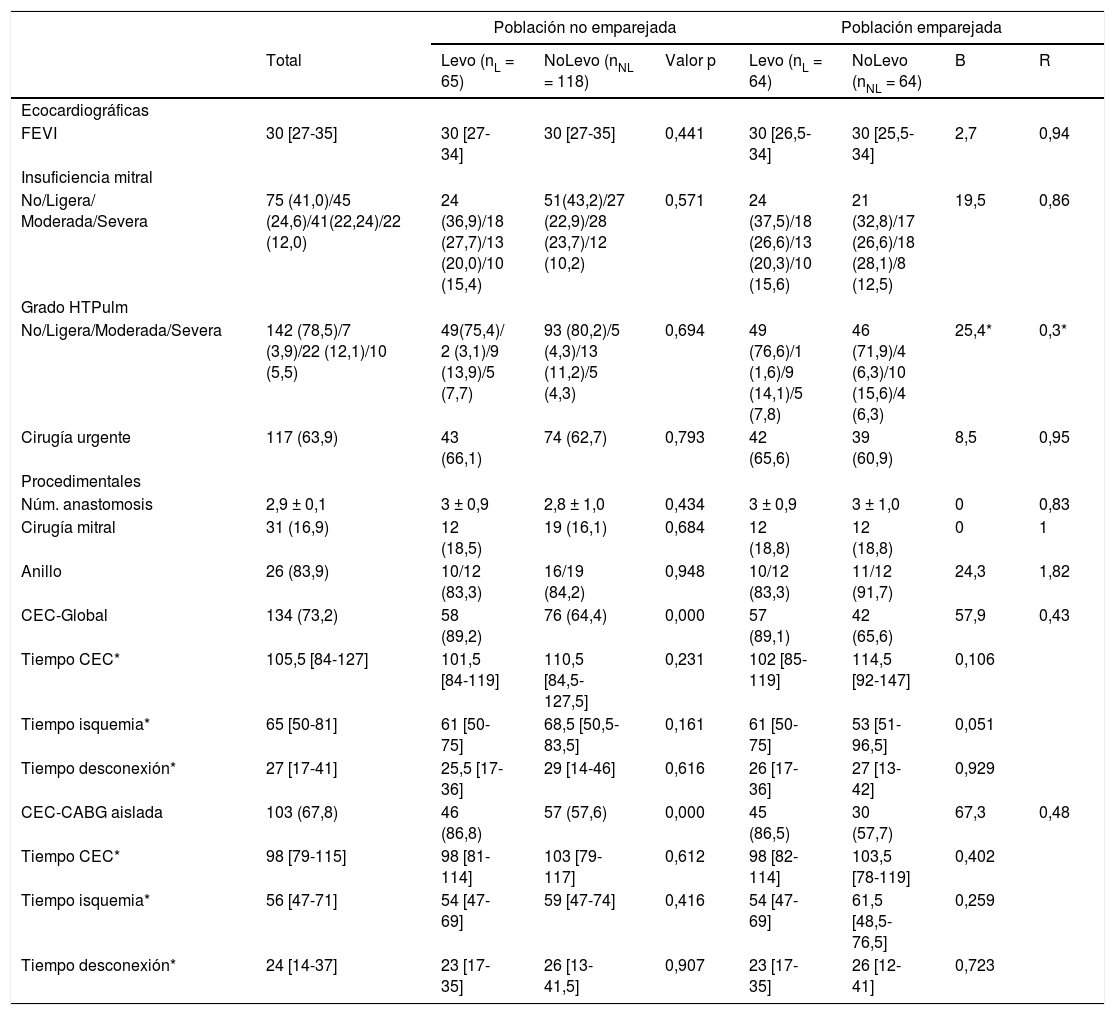
Características cardiológicas y procedimentales de los pacientes
| Población no emparejada | Población emparejada | |||||||
|---|---|---|---|---|---|---|---|---|
| Total | Levo (nL = 65) | NoLevo (nNL = 118) | Valor p | Levo (nL = 64) | NoLevo (nNL = 64) | B | R | |
| Ecocardiográficas | ||||||||
| FEVI | 30 [27-35] | 30 [27-34] | 30 [27-35] | 0,441 | 30 [26,5-34] | 30 [25,5-34] | 2,7 | 0,94 |
| Insuficiencia mitral | ||||||||
| No/Ligera/ Moderada/Severa | 75 (41,0)/45 (24,6)/41(22,24)/22 (12,0) | 24 (36,9)/18 (27,7)/13 (20,0)/10 (15,4) | 51(43,2)/27 (22,9)/28 (23,7)/12 (10,2) | 0,571 | 24 (37,5)/18 (26,6)/13 (20,3)/10 (15,6) | 21 (32,8)/17 (26,6)/18 (28,1)/8 (12,5) | 19,5 | 0,86 |
| Grado HTPulm | ||||||||
| No/Ligera/Moderada/Severa | 142 (78,5)/7 (3,9)/22 (12,1)/10 (5,5) | 49(75,4)/ 2 (3,1)/9 (13,9)/5 (7,7) | 93 (80,2)/5 (4,3)/13 (11,2)/5 (4,3) | 0,694 | 49 (76,6)/1 (1,6)/9 (14,1)/5 (7,8) | 46 (71,9)/4 (6,3)/10 (15,6)/4 (6,3) | 25,4* | 0,3* |
| Cirugía urgente | 117 (63,9) | 43 (66,1) | 74 (62,7) | 0,793 | 42 (65,6) | 39 (60,9) | 8,5 | 0,95 |
| Procedimentales | ||||||||
| Núm. anastomosis | 2,9 ± 0,1 | 3 ± 0,9 | 2,8 ± 1,0 | 0,434 | 3 ± 0,9 | 3 ± 1,0 | 0 | 0,83 |
| Cirugía mitral | 31 (16,9) | 12 (18,5) | 19 (16,1) | 0,684 | 12 (18,8) | 12 (18,8) | 0 | 1 |
| Anillo | 26 (83,9) | 10/12 (83,3) | 16/19 (84,2) | 0,948 | 10/12 (83,3) | 11/12 (91,7) | 24,3 | 1,82 |
| CEC-Global | 134 (73,2) | 58 (89,2) | 76 (64,4) | 0,000 | 57 (89,1) | 42 (65,6) | 57,9 | 0,43 |
| Tiempo CEC* | 105,5 [84-127] | 101,5 [84-119] | 110,5 [84,5-127,5] | 0,231 | 102 [85-119] | 114,5 [92-147] | 0,106 | |
| Tiempo isquemia* | 65 [50-81] | 61 [50-75] | 68,5 [50,5-83,5] | 0,161 | 61 [50-75] | 53 [51-96,5] | 0,051 | |
| Tiempo desconexión* | 27 [17-41] | 25,5 [17-36] | 29 [14-46] | 0,616 | 26 [17-36] | 27 [13-42] | 0,929 | |
| CEC-CABG aislada | 103 (67,8) | 46 (86,8) | 57 (57,6) | 0,000 | 45 (86,5) | 30 (57,7) | 67,3 | 0,48 |
| Tiempo CEC* | 98 [79-115] | 98 [81-114] | 103 [79-117] | 0,612 | 98 [82-114] | 103,5 [78-119] | 0,402 | |
| Tiempo isquemia* | 56 [47-71] | 54 [47-69] | 59 [47-74] | 0,416 | 54 [47-69] | 61,5 [48,5-76,5] | 0,259 | |
| Tiempo desconexión* | 24 [14-37] | 23 [17-35] | 26 [13-41,5] | 0,907 | 23 [17-35] | 26 [12-41] | 0,723 | |
CABG: coronary artery bypass grafting; CEC: circulación extracorpórea; HTPulm: hipertensión pulmonar.
Desde el punto de vista quirúrgico, la cohorte Levo presentó mayor prevalencia de uso de CEC (global: B = 57,9; R = 0,43; y CABG aislada: B = 67,3; R = 0,48). El número medio de anastomosis distales fue similar en ambas cohortes (3 ± 0,9 vs. 3 ± 1,0, B = 0; R = 0,83). Ambos grupos presentaron frecuencias similares de intervención sobre la válvula mitral. No hubo diferencias en los tiempos de CEC, de isquemia, ni de desconexión de CEC.
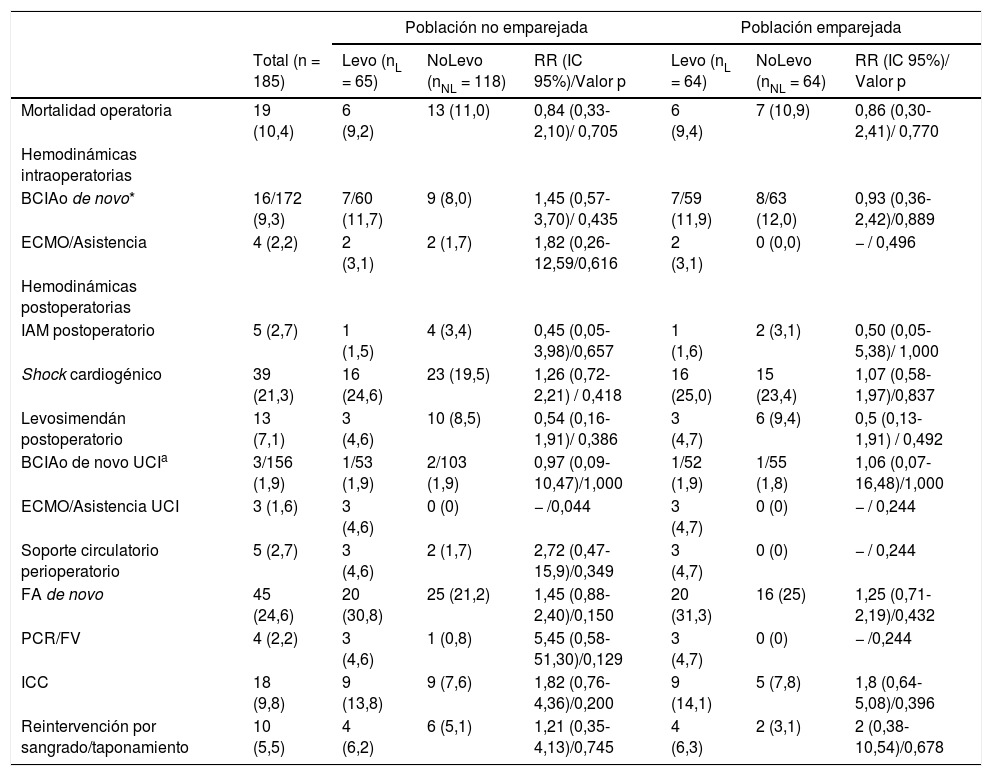
Morbimortalidad postoperatoriaLa tabla 3 muestra las complicaciones postoperatorias. No hubo diferencias significativas en la mortalidad operatoria (9,4 vs. 10,9%, RR = 0,86, IC 95% 0,30-2,41; p = 0,770). En cuanto a las variables resultado secundarias, la cohorte Levo presentó mayor riesgo de insuficiencia renal aguda (IRA) postoperatoria en el análisis no emparejado (RR = 1,75, IC 95% 1,10-2,76, p = 0,012), sin ser significativo en el análisis emparejado (RR = 1,47, IC 95% 0,88-2,45, p = 0,132); la necesidad de terapia de reemplazo renal postoperatorio fue similar (RR = 1,45, IC 95% 0,73-2,86, p = 0,279). No hubo diferencias en la necesidad de soporte circulatorio perioperatorio (RR no estimable, p = 0,244).
Complicaciones perioperatorias de los pacientes
| Población no emparejada | Población emparejada | ||||||
|---|---|---|---|---|---|---|---|
| Total (n = 185) | Levo (nL = 65) | NoLevo (nNL = 118) | RR (IC 95%)/Valor p | Levo (nL = 64) | NoLevo (nNL = 64) | RR (IC 95%)/ Valor p | |
| Mortalidad operatoria | 19 (10,4) | 6 (9,2) | 13 (11,0) | 0,84 (0,33-2,10)/ 0,705 | 6 (9,4) | 7 (10,9) | 0,86 (0,30-2,41)/ 0,770 |
| Hemodinámicas intraoperatorias | |||||||
| BCIAo de novo* | 16/172 (9,3) | 7/60 (11,7) | 9 (8,0) | 1,45 (0,57-3,70)/ 0,435 | 7/59 (11,9) | 8/63 (12,0) | 0,93 (0,36-2,42)/0,889 |
| ECMO/Asistencia | 4 (2,2) | 2 (3,1) | 2 (1,7) | 1,82 (0,26-12,59/0,616 | 2 (3,1) | 0 (0,0) | − / 0,496 |
| Hemodinámicas postoperatorias | |||||||
| IAM postoperatorio | 5 (2,7) | 1 (1,5) | 4 (3,4) | 0,45 (0,05-3,98)/0,657 | 1 (1,6) | 2 (3,1) | 0,50 (0,05-5,38)/ 1,000 |
| Shock cardiogénico | 39 (21,3) | 16 (24,6) | 23 (19,5) | 1,26 (0,72-2,21) / 0,418 | 16 (25,0) | 15 (23,4) | 1,07 (0,58-1,97)/0,837 |
| Levosimendán postoperatorio | 13 (7,1) | 3 (4,6) | 10 (8,5) | 0,54 (0,16-1,91)/ 0,386 | 3 (4,7) | 6 (9,4) | 0,5 (0,13-1,91) / 0,492 |
| BCIAo de novo UCIa | 3/156 (1,9) | 1/53 (1,9) | 2/103 (1,9) | 0,97 (0,09-10,47)/1,000 | 1/52 (1,9) | 1/55 (1,8) | 1,06 (0,07-16,48)/1,000 |
| ECMO/Asistencia UCI | 3 (1,6) | 3 (4,6) | 0 (0) | − /0,044 | 3 (4,7) | 0 (0) | − / 0,244 |
| Soporte circulatorio perioperatorio | 5 (2,7) | 3 (4,6) | 2 (1,7) | 2,72 (0,47-15,9)/0,349 | 3 (4,7) | 0 (0) | − / 0,244 |
| FA de novo | 45 (24,6) | 20 (30,8) | 25 (21,2) | 1,45 (0,88-2,40)/0,150 | 20 (31,3) | 16 (25) | 1,25 (0,71-2,19)/0,432 |
| PCR/FV | 4 (2,2) | 3 (4,6) | 1 (0,8) | 5,45 (0,58-51,30)/0,129 | 3 (4,7) | 0 (0) | − /0,244 |
| ICC | 18 (9,8) | 9 (13,8) | 9 (7,6) | 1,82 (0,76-4,36)/0,200 | 9 (14,1) | 5 (7,8) | 1,8 (0,64-5,08)/0,396 |
| Reintervención por sangrado/taponamiento | 10 (5,5) | 4 (6,2) | 6 (5,1) | 1,21 (0,35-4,13)/0,745 | 4 (6,3) | 2 (3,1) | 2 (0,38-10,54)/0,678 |
| Población no emparejada | Población emparejada | ||||||
|---|---|---|---|---|---|---|---|
| Total (n = 185) | Levo (nL = 65) | NoLevo (nNL = 118) | RR (IC 95%) / Valor p | Levo (nL = 64) | NoLevo (nNL = 64) | RR (IC 95%)/Valor p | |
| Renales | |||||||
| IRA | 51 (27,9) | 25 (38,5) | 26 (22,0) | 1,75 (1,10-2,76)/0,012 | 25 (39,1) | 17 (26,6) | 1,47 (0,88-2,45)/0,132 |
| AKIN I | 5/51 (9,8) | 3/25 (12,0) | 2/26 (7,7) | 0,655 | 3/25 (12,0) | 1/17 (5,9) | 0,758 |
| AKIN II | 6/51 (11,8) | 2/25 (8,0) | 4/26 (15,4) | 2/25 (8,0) | 2/17 (11,8) | ||
| AKIN III | 40/51 (78,4) | 20/25 (80,0) | 20/26 (76,9) | 20/25 (80,0) | 14/17 (82,4) | ||
| HDFVVC/HD conv | 33 (18,0) | 16 (24,6) | 17 (14,4) | 1,71 (0,93-3,15)/ 0,086 | 16 (25,0) | 11 (17,2) | 1,45 (0,73-2,86)/ 0,279 |
| Neurológicas | |||||||
| AIT | 1 (1,1) | 0 (0) | 2 (1,7) | − /0,539 | 0 (0) | 1 (1,6) | − /1,000 |
| ACV | 3 (1,6) | 1 (1,5) | 2 (1,7) | 0,91 (0,08-9,82)/1,000 | 1 (1,6) | 0 (0) | − /1,000 |
| Respiratorias | |||||||
| Ventilación prolongada | 13 (17,8) | 7/40 (17,5) | 6/33 (18,2) | 0,96 (0,36-2,59) / 1,000 | 7/39 (17,9) | 3/17 (17,6) | 1,02 (0,30-3,47)/1,000 |
| Neumonía | 12 (6,6) | 6 (9,2) | 6 (5,1) | 1,82 (0,61-5,40) / 0,352 | 6 (9,4) | 3 (4,7) | 2 (0,52-7,65)/0,492 |
| Estancia hospitalaria | |||||||
| UCI | 5 [3-7] | 5 [4-8] | 5 [3-7] | 0,307 | 5 [3,5-8,5] | 5 [3-7] | 0,473 |
| Postoperatorio total | 9 [6-14] | 10 [8-15] | 8 [6-14] | 0,104 | 10 [8-15] | 9 [6-13] | 0,072 |
ACV: accidente cerebrovascular; AKIN: Acute Kidney Injury Network scale; AIT: accidente isquémico transitorio; BCIAo: balón de contrapulsación intraaórtico; ECMO: extracorporeal membrane oxygenation; FA: fibrilación auricular; FV: fibrilación ventricular; HDFVVC: hemodiafiltración vena-vena continua; HD conv: hemodiálisis convencional; ICC: insuficiencia cardiaca congestiva; IRA: insuficiencia renal aguda; PCR: parada cardiorrespiratoria; UCI: unidad de cuidados intensivos.
La estancia en UCI fue similar en ambas cohortes (5 d [IQR 3,5-8,5] vs. 5 d [IQR 3-7], p = 0,473), mientras la estancia postoperatoria total tendió a ser mayor, aunque de forma no significativa, en la cohorte Levo (10 d [IQR 8-15] vs. 9 d [IQR 6-13], p = 0,072).
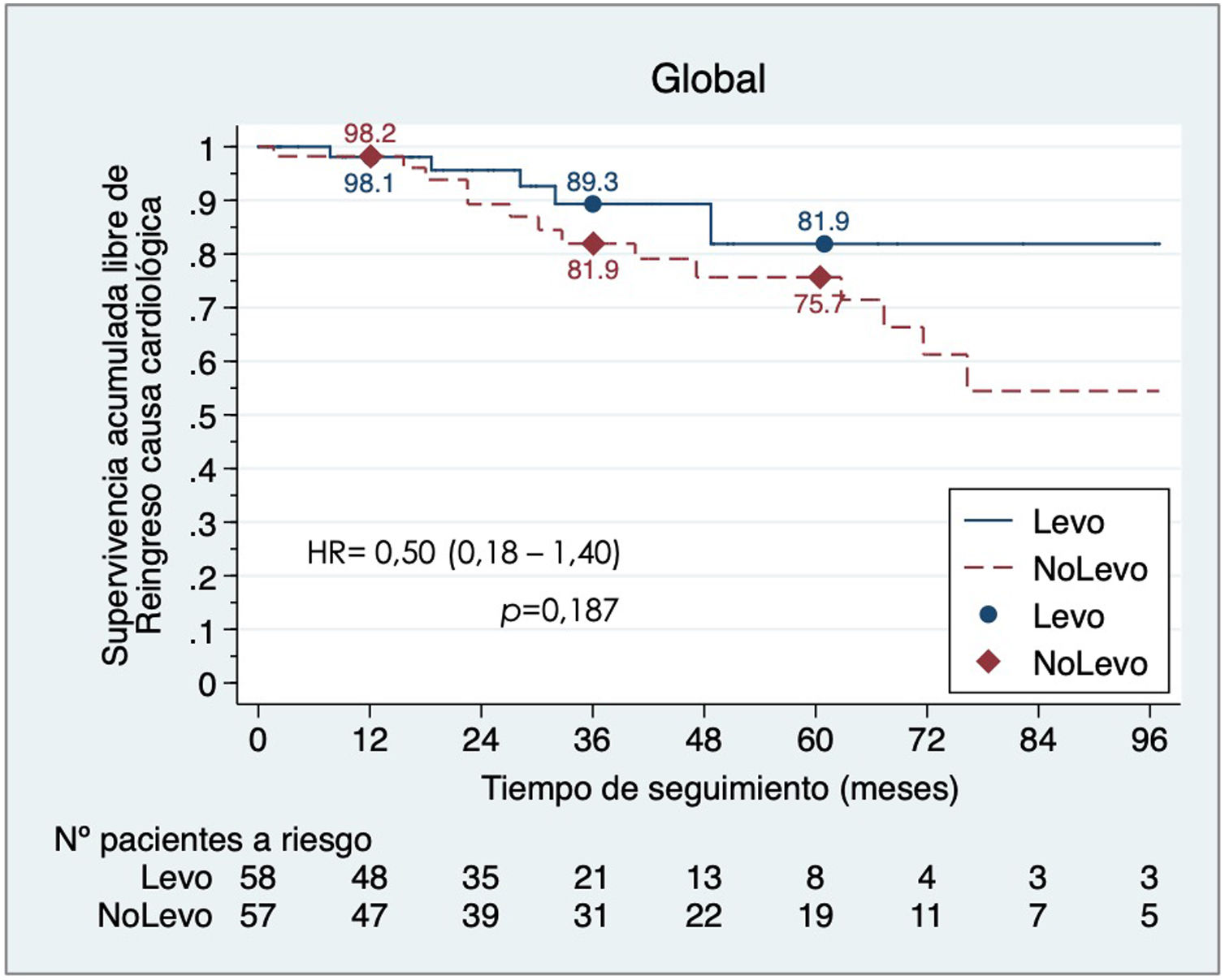
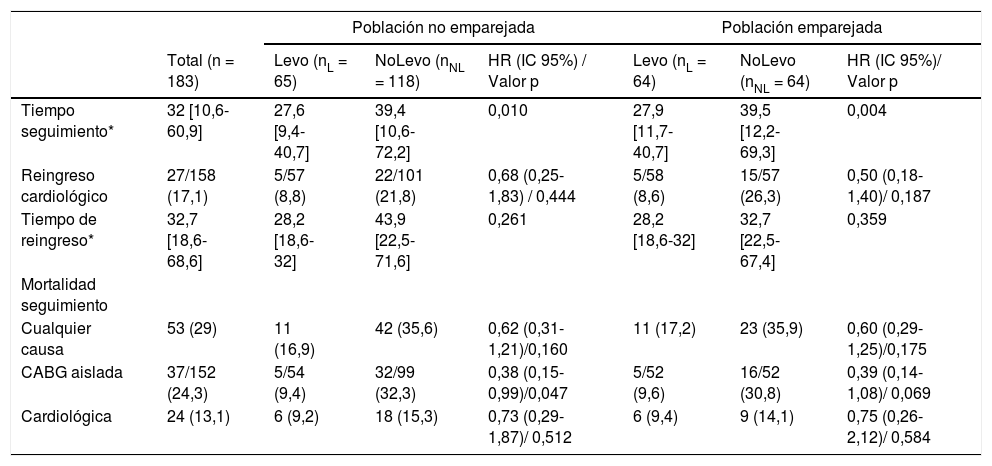
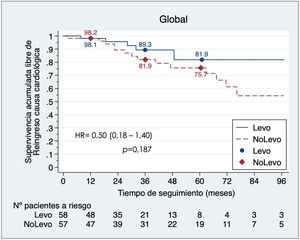
SeguimientoLa tabla 4 refleja los datos de seguimiento. La cohorte Levo presentó un tiempo de seguimiento menor (27,9 m [IQR 11,7-40,7] vs. 39,5 m [IQR 12,2-69,3], p = 0,004). La supervivencia libre de reingreso por causa cardiaca fue mayor en la cohorte Levo, aunque no significativa (HR = 0,50, IC 95% 0,18-1,40, p = 0,187) (fig. 3).
Seguimiento de supervivientes
| Población no emparejada | Población emparejada | ||||||
|---|---|---|---|---|---|---|---|
| Total (n = 183) | Levo (nL = 65) | NoLevo (nNL = 118) | HR (IC 95%) / Valor p | Levo (nL = 64) | NoLevo (nNL = 64) | HR (IC 95%)/ Valor p | |
| Tiempo seguimiento* | 32 [10,6-60,9] | 27,6 [9,4-40,7] | 39,4 [10,6-72,2] | 0,010 | 27,9 [11,7-40,7] | 39,5 [12,2-69,3] | 0,004 |
| Reingreso cardiológico | 27/158 (17,1) | 5/57 (8,8) | 22/101 (21,8) | 0,68 (0,25-1,83) / 0,444 | 5/58 (8,6) | 15/57 (26,3) | 0,50 (0,18-1,40)/ 0,187 |
| Tiempo de reingreso* | 32,7 [18,6-68,6] | 28,2 [18,6-32] | 43,9 [22,5-71,6] | 0,261 | 28,2 [18,6-32] | 32,7 [22,5-67,4] | 0,359 |
| Mortalidad seguimiento | |||||||
| Cualquier causa | 53 (29) | 11 (16,9) | 42 (35,6) | 0,62 (0,31-1,21)/0,160 | 11 (17,2) | 23 (35,9) | 0,60 (0,29-1,25)/0,175 |
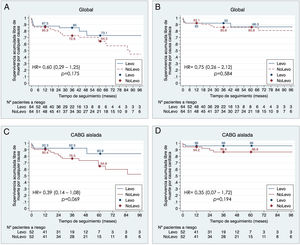
| CABG aislada | 37/152 (24,3) | 5/54 (9,4) | 32/99 (32,3) | 0,38 (0,15-0,99)/0,047 | 5/52 (9,6) | 16/52 (30,8) | 0,39 (0,14-1,08)/ 0,069 |
| Cardiológica | 24 (13,1) | 6 (9,2) | 18 (15,3) | 0,73 (0,29-1,87)/ 0,512 | 6 (9,4) | 9 (14,1) | 0,75 (0,26-2,12)/ 0,584 |
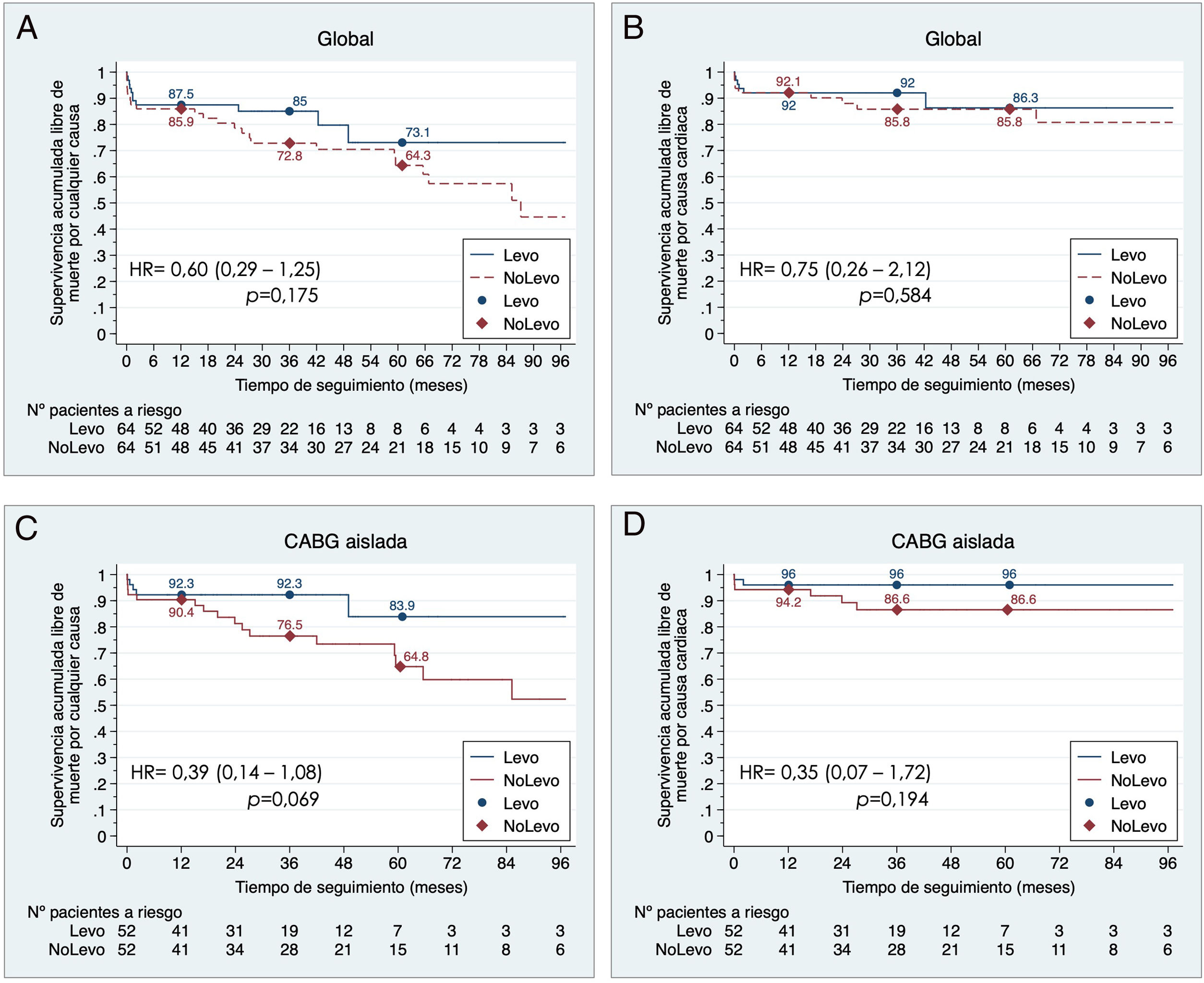
La supervivencia libre de muerte por cualquier causa y de origen cardiológico tendió a ser mayor en la cohorte Levo, pero no significativa (HR = 0,60, IC 95% 0,29-1,25, p = 0,175 y HR = 0,75, IC 95% 0,26-2,12, p = 0,584, respectivamente) (fig. 4 A y fig. 4 B). En el subgrupo de cirugía coronaria aislada la cohorte Levo presentó tendencia casi significativa a mejor supervivencia libre de muerte por cualquier causa (HR = 0,39, IC 95% 0,14-1,08, p = 0,069) (fig. 4 C).
DiscusiónEl uso de levosimendán está altamente estudiado y avalado en pacientes con insuficiencia cardiaca crónica descompensada3–5. Se ha visto que la administración periódica de levosimendán en algunos pacientes en lista de espera de trasplante cardiaco les permite soportar clínicamente mejor la espera16.
Sin embargo, la eficacia del precondicionamiento con levosimendán, previo a la cirugía cardiaca, no ha sido suficientemente demostrada. El Levosimendan in Patients with Left Ventricular Systolic Dysfunction Undergoing Cardiac Surgery Requiring Cardiopulmonary Bypass (LEVO-CTS) trial es el ensayo clínico aleatorizado con mayor número pacientes por rama (más de 800), que compara el uso de levosimendán vs. placebo en pacientes con disfunción ventricular severa (FEVI ≤ a 35%), candidatos a cirugía cardiaca con CEC11. En dicho estudio no se observaron diferencias en el efecto compuesto de mortalidad operatoria, necesidad de diálisis postoperatoria, incidencia de IAM perioperatorio o necesidad de soporte circulatorio11.
Nuestro trabajo se trata de un estudio retrospectivo de cohortes emparejado, con el objetivo de valorar el rendimiento del levosimendán preoperatorio en pacientes intervenidos de revascularización miocárdica, con o sin cirugía mitral isquémica o funcional, con FEVI ≤ a 35%. El emparejamiento disminuyó el tamaño muestral (64 por cohorte), y por tanto, la potencia estadística, pero aseguró que las características preoperatorias y procedimentales fueran similares en ambas cohortes, a excepción de mayor frecuencia de pacientes con BCIAo preoperatorio y mayor prevalencia de procedimientos con CEC en la cohorte Levo. La cohorte NoLevo presentó tendencia a mayor frecuencia de IAM previo, aunque no fue significativo en el análisis emparejado.
De acuerdo con los resultados de Cholley et al.9 y del LEVO-CTS11, no hallamos diferencias en la mortalidad operatoria, en la incidencia de IAM perioperatorio y shock cardiogénico, ni en la necesidad de soporte circulatorio. Al contrario que Mehta et al.11, en nuestro estudio se observó una tendencia a mayor incidencia de IRA y necesidad de diálisis postoperatoria, que fue significativa en el análisis no emparejado, pero no significativa tras el emparejamiento. Esto contrasta con otros estudios, que han demostrado un efecto nefroprotector del levosimendán preoperatorio, probablemente en relación con la mejoría del gasto cardiaco y vasodilatación de la arteria renal aferente13,17. El motivo por el que en nuestro estudio se observó esa tendencia de fallo renal en la cohorte Levo no está claro y requeriría un análisis más profundo: una hipótesis podría ser la hipoperfusión renal secundaria a una posible mayor vasoplejía asociada al uso de levosimendán.
Previamente al LEVO-CTS, De Hert et al.7 y Eriksson et al.8 publicaron los resultados de otros ensayos clínicos aleatorizados de levosimendán vs. placebo en cirugía cardiaca, aunque con menor número de pacientes por rama (15 y 30, respectivamente), en los que observaron mejoría de la supervivencia hospitalaria en favor del levosimendán.
En nuestro estudio no disponemos del número de intentos de desconexión de CEC; no obstante, no hubo diferencias en el tiempo estimado de desconexión de CEC, lo que parece indicar que el número de intentos de desconexión exitosa fue similar, en contraposición con lo reportado por Eriksson et al.8.
Tampoco observamos menor incidencia de síndrome de bajo gasto cardiaco, al contrario que en un estudio reciente de cohortes publicado por Jiménez-Rivera et al.18, con cohorte histórica como control (levosimendán n = 13 vs. control n = 41), en que los pacientes que recibieron levosimendán presentaron menor incidencia significativa de bajo gasto cardiaco postoperatorio. En el subanálisis del grupo de cirugía coronaria aislada del ensayo clínico LEVO-CTS, publicado por Van Diepen et al.12 (283 levosimendán vs. 280 placebo), también se observó una disminución del síndrome de bajo gasto cardiaco.
En nuestro estudio, el uso de levosimendán preoperatorio no disminuyó la estancia en UCI. De hecho, Grieshaber et al. observaron mayor estancia en UCI en el grupo con levosimendán preoperatorio13. La estancia postoperatoria total tendió a ser discretamente más larga en el grupo Levo, probablemente por mayor incidencia de IRA postoperatoria y necesidad de diálisis, pero la diferencia no alcanzó la significación, probablemente por la baja potencia estadística.
En cuanto a la incidencia de arritmias auriculares, algunos estudios han reportado mayor incidencia de fibrilación auricular con el uso de levosimendán4,13, hecho que no se observó en nuestro estudio.
El tiempo de seguimiento a medio-largo plazo fue significativamente mayor en la cohorte NoLevo, lo que concuerda con el hecho de que el uso de levosimendán preoperatorio se extendió en nuestro hospital a partir de 2014.
Diversos estudios han analizado la mortalidad a largo plazo en pacientes que recibieron levosimendán profiláctico, previo a cirugía cardiaca, pero hasta el momento no existen publicaciones respecto a la necesidad de reingreso de causa cardiológica. En nuestro estudio no hubo diferencias en la supervivencia libre de reingresos de causa cardiológica. La supervivencia libre de muerte en el seguimiento, tanto por causa cardiológica como por todas las causas, fue similar en ambas cohortes. En el subanálisis por procedimientos, la cohorte Levo presentó una tendencia no significativa a mejor supervivencia libre de muerte, por cualquier causa, en cirugía coronaria aislada, contrariamente a lo observado por Grieshaber et al.13, pero consistente con los hallazgos observados por Van Diepen et al. en el subanálisis del LEVO-CTS12; este último grupo demostró menor mortalidad a 90 días en cirugía coronaria aislada con disfunción ventricular severa en la rama que recibió levosimendán.
LimitacionesAl tratarse de un estudio retrospectivo, la comparabilidad de las cohortes se ve dificultada. Por ello se utilizó emparejamiento por escala de propensión, pero este método redujo la muestra a analizar y, en consecuencia, disminuyó la potencia estadística.
No se recogió la necesidad de vasoactivos en el postoperatorio, ni sus dosis (aparte de levosimendán). Tampoco se dispone de datos de resistencias sistémicas o pulmonares, ni el índice cardiaco, por lo que no se puede analizar el efecto de levosimendán sobre la vasoplejía ni sobre la hemodinámica cardiaca.
Por último, el seguimiento de pacientes procedentes de otros hospitales es inconstante y podrían existir otros factores que influyan en la supervivencia, y que no podemos controlar, por lo que los resultados de seguimiento podrían estar sesgados. Además, en la causa de la muerte no está consignada en un número significativo de pacientes.
ConclusionesLos resultados obtenidos en este estudio no apoyan el uso extendido de levosimendán, previo a la cirugía de revascularización miocárdica, en pacientes con disfunción ventricular severa. No se encontraron diferencias en la mortalidad postoperatoria ni en ninguna de las complicaciones estudiadas.
FinanciaciónEste estudio no precisó financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.