Recientemente, se ha publicado en la Revista Española de Cardiología un Documento de Consenso sobre el manejo del tratamiento antitrombótico en el paciente quirúrgico, fruto de la colaboración de varias de las sociedades de especialidades implicadas en el manejo de este tipo de pacientes, entre ellas la SECTCV. En esta revisión, se intenta tanto comentar este documento como ampliarlo con puntualizaciones, centrándolo en nuestra especialidad.
Para ello, además de seguir las recomendaciones aportadas en la citada publicación, se añaden las presentes en las guías clínicas de medicación perioperatoria elaboradas por la European Association for Cardio-Thoracic Surgery en 2017.
El paciente con tratamiento antitrombótico (tanto anticoagulante como antiagregante) es una entidad común en el contexto de la cirugía cardíaca, por lo que estas pautas son de aplicación frecuente en la práctica diaria. No obstante, cada caso debe someterse a una evaluación individualizada, teniendo en cuenta tanto el riesgo hemorrágico como trombótico, según las características del paciente o de la intervención a realizar, a la hora de tomar las decisiones.
A Consensus Document has recently been published in the Spanish Journal of Cardiology (Revista Española de Cardiología) on the management of antithrombotic treatment in the surgical patient. This has been prepared with the collaboration of several societies of the specialties involved in the management of this type of patient, among them the Spanish Society of Thoracic-Cardiovascular Surgery (SECTCV). In this review, it is intended to comment on this Document, as well as to amplify it with some points, focusing them on our speciality.
For this, besides following the recommendations provided in the aforementioned publication, the present ones are added in the clinical guides for peri-operative medication prepared by the European Association for Cardio-Thoracic Surgery in 2017.
The patient on antithrombotic treatment (both anticoagulant as well as anti-platelet) is a common entity in the cardiac surgery context, so these recommendations are frequently applied in daily practice. However, each case must be subjected to an individualised assessment, taking into account the haemorrhagic, as well as the thrombotic risk, depending on the patient characteristics or the intervention to be performed, when making decisions.
Recientemente, ha sido publicado en la Revista Española de Cardiología el documento de consenso elaborado por el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología1. En la elaboración de este documento han participado especialistas relacionados de forma directa o indirecta con el manejo de este tipo de pacientes, como cirujanos, cardiólogos, médicos de familia o anestesiólogos, y representantes de, entre otras sociedades científicas, la Sociedad Española de Cirugía Torácica y Cardiovascular.
Este documento trata de unificar las pautas para el manejo de la medicación tanto anticoagulante como antiagregante en el contexto de cualquier intervención quirúrgica o procedimiento invasivo. Pese a la gran heterogeneidad de los pacientes con tratamiento antitrombótico y la necesidad de individualizar cada caso teniendo en cuenta tanto el riesgo trombótico como el riesgo de sangrado, se han propuesto unas recomendaciones prácticas para poder aplicarlas de forma general a este tipo de pacientes en el día a día.
El paciente con tratamiento anticoagulante o antiagregante es una entidad frecuente en el contexto de la cirugía cardiovascular. Los pacientes intervenidos son, en su mayoría y por definición, cardiópatas; por lo tanto, es frecuente la prevalencia de patologías que requieren anticoagulación o antiagregación, como son la fibrilación auricular, la cardiopatía isquémica o los portadores de prótesis valvulares.
Es por ello que este documento recientemente publicado tiene una especial relevancia en nuestra práctica clínica diaria.
En el presente trabajo, vamos a analizar la implicación de estas recomendaciones en el manejo perioperatorio del paciente con tratamiento antitrombótico intervenido de algún procedimiento en el ámbito de la cirugía cardiovascular. Para ello, tendremos en cuenta también las últimas recomendaciones reflejadas en las guías europeas de manejo de la medicación perioperatoria publicadas por la European Association for Cardio-Thoracic Surgery (EACTS) y la European Society of Cardiology (ESC) en 20172.
Riesgo de sangrado en el paciente de cirugía cardíacaExcepto algunos procedimientos menores, como la ventana pericárdica por acceso subxifoideo o el implante de marcapasos intravenoso, el resto de las intervenciones del ámbito de la especialidad conllevan un riesgo de sangrado intermedio-alto (tabla 1).
Estratificación del riesgo hemorrágico según el tipo de cirugía/procedimiento
| Riesgo hemorrágico | ||
|---|---|---|
| Bajo | Moderado | Alto |
| Ventana pericárdica subxifoidea Implante subcutáneo transvenoso de MCP, DAI, CRT Recambio de generador de marcapasos, desfibrilador o resincronizador | Cirugía de revascularización coronaria no urgente (con o sin CEC) Cirugía valvular mitral/aórtica Cirugía de aorta ascendente Implantación de marcapasos diafragmático | Cirugía de revascularización coronaria urgente (con o sin CEC) Disección de aorta ascendente/arco Cirugía complicaciones mecánicas IAM Cirugía valvular urgente/endocarditis Cirugía urgente tras iatrogenia postintervencionismo Reintervención coronaria y/o valvular Pericardiectomía (tras o en pericarditis constrictiva) |
CEC: circulación extracorpórea; DAI: desfibrilador automático implantable; IAM: infarto agudo de miocardio; MCP: marcapasos; TRC: terapia de resincronización cardíaca.
Adaptado de Vivas et al.1.
Esto, claramente, depende también del tipo de cirugía. Las reintervenciones y la cirugía urgente de aorta, de la endocarditis o relacionada con la cardiopatía isquémica presentan un mayor riesgo de sangrado. Intraoperatoriamente, un mayor tiempo de circulación extracorpórea también puede favorecer esta complicación.
Otros factores relacionados con el incremento del riesgo de sangrado son3 la edad (mayor de 65 años), la presencia de insuficiencia renal o hepática, el tratamiento farmacológico antitrombótico concomitante, el antecedente de sangrado en los 3 meses previos, la trombocitopenia o trombopatía y la variabilidad en los niveles de INR como factores independientemente relacionados con un mayor sangrado perioperatorio.
Estos factores de riesgo para el sangrado son también aplicables a la cirugía cardíaca infantil, con la particularidad de que hay un mayor porcentaje de reintervenciones o de cirugías altamente complejas con un mayor riesgo hemorrágico postoperatorio. Se han descrito como factores de riesgo para un mayor sangrado en la cirugía pediátrica las cardiopatías cianóticas, el bajo peso o la presencia de shunts intracardíacos4.
Tratamiento anticoagulanteSegún los últimos datos, en España en mayores de 40 años la prevalencia de fibrilación auricular supera el 4%5. Este porcentaje es todavía mayor si nos ceñimos a los pacientes intervenidos de cirugía cardíaca: según datos de la Society of Thoracic Surgeons National Cardiac Database puede variar desde el 6% en pacientes coronarios hasta el 27% en aquellos con patología mitral6. La mayoría de estos pacientes se encuentran bajo tratamiento anticoagulante por vía oral, generalmente acenocumarol a dosis terapéuticas para mantener un INR entre 2 y 3. Aunque cada vez es mayor el número de pacientes anticoagulados con un fármaco anticoagulante oral de acción directa, como el dabigatrán, apixabán, rivaroxabán y edoxabán, cuya farmacocinética es más predecible y su manejo preoperatorio es más sencillo que los antagonistas de la vitamina K ya mencionados.
Pero no solo la fibrilación auricular constituye una indicación para la anticoagulación en el paciente cardiópata: la presencia de prótesis valvulares mecánicas, la estenosis mitral, un gran tamaño auricular y la mala función ventricular también pueden presentar indicación de anticoagulación oral a largo plazo7.
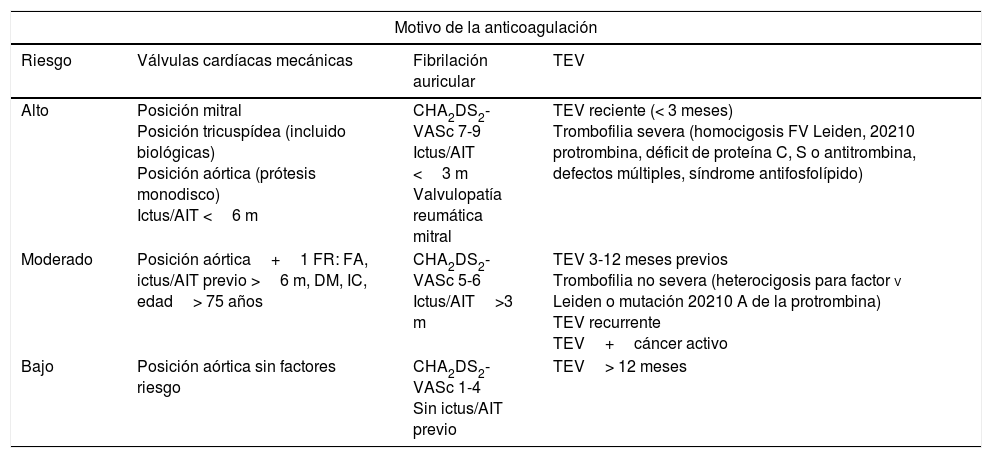
Por ello, es necesario establecer una pauta y saber cuándo y qué hay que suspender antes de un procedimiento de cirugía cardíaca, así como si hay necesidad de administrar terapia puente, atendiendo tanto al riesgo hemorrágico de la intervención como al riesgo tromboembólico por la suspensión de la anticoagulación (tabla 2).
Estratificación del riesgo tromboembólico del paciente con tratamiento anticoagulante
| Motivo de la anticoagulación | |||
|---|---|---|---|
| Riesgo | Válvulas cardíacas mecánicas | Fibrilación auricular | TEV |
| Alto | Posición mitral Posición tricuspídea (incluido biológicas) Posición aórtica (prótesis monodisco) Ictus/AIT <6 m | CHA2DS2-VASc 7-9 Ictus/AIT <3 m Valvulopatía reumática mitral | TEV reciente (< 3 meses) Trombofilia severa (homocigosis FV Leiden, 20210 protrombina, déficit de proteína C, S o antitrombina, defectos múltiples, síndrome antifosfolípido) |
| Moderado | Posición aórtica+1 FR: FA, ictus/AIT previo >6 m, DM, IC, edad> 75 años | CHA2DS2-VASc 5-6 Ictus/AIT>3 m | TEV 3-12 meses previos Trombofilia no severa (heterocigosis para factor v Leiden o mutación 20210 A de la protrombina) TEV recurrente TEV+cáncer activo |
| Bajo | Posición aórtica sin factores riesgo | CHA2DS2-VASc 1-4 Sin ictus/AIT previo | TEV> 12 meses |
AIT: accidente isquémico transitorio; DM: diabetes mellitus; FA: fibrilación auricular; FR: factor de riesgo; IC: insuficiencia cardíaca; TEV: tromboembolismo venoso.
CHA2DS2-VASc: 1 punto para insuficiencia cardíaca, hipertensión, diabetes mellitus, sexo femenino, edad 65-74 años y patología vascular (arteriopatía periférica, cardiopatía isquémica o placa de aorta complicada) y 2 puntos para edad> 75 años y antecedentes de ictus, accidente isquémico transitorio o embolia periférica.
Adaptado de Vivas et al.1.
Este grupo de intervenciones estaría constituido por cirugías menores, sin necesidad de circulación extracorpórea, y que en algunos casos se pueden realizar con anestesia local.
Se estima que hasta un tercio de los pacientes a los que se les implanta un dispositivo de electroestimulación cardíaca se encuentran con tratamiento anticoagulante8. Asimismo, está demostrado que el implante de estos dispositivos intravenosos es una técnica segura sin la necesidad de interrumpir la anticoagulación8. De manera que, siempre y cuando el paciente se encuentre dentro del rango terapéutico establecido de INR y no por encima de él, el procedimiento se puede realizar sin tener que suspender el tratamiento anticoagulante9.
Esto podría aplicarse también al caso de la ventana pericárdica subxifoidea, excepto en aquellos casos en los que el derrame pericárdico sea hemático (sangrado poscirugía o derrame pericárdico agudo tras perforación por intervencionismo), en el que la reversión de la anticoagulación de forma urgente podría estar indicada10,11.
Intervenciones con riesgo de sangrado moderado-altoEste grupo incluye la gran mayoría de intervenciones realizadas dentro del campo de la cirugía cardiovascular.
En el caso de los antagonistas de vitamina K, que son los fármacos más comunes en este contexto, se requiere siempre una determinación de INR como máximo 24 h antes de la cirugía. En base a esto, se recomienda intervenir siempre con un valor de INR inferior a 1,5. Para ello, existe un consenso generalizado, tal y como se refleja en el mencionado documento, de suspender el tratamiento anticoagulante oral entre 3 y 5 días antes de la intervención (5 días según las guías europeas), siempre y cuando el INR previo se encuentre en el rango terapéutico12,13.
Los anticoagulantes orales de acción directa, tales como los inhibidores de la trombina (dabigatrán) o los inhibidores del factor Xa (rivaroxabán, el apixabán o el edoxabán), tienen un efecto y una duración mucho más predecible, por lo que su suspensión dependerá de la función renal del paciente y del riesgo hemorrágico de la intervención14, aunque en líneas generales se recomienda suspenderlos al menos 48 h antes del procedimiento (en el caso del dabigatrán, en pacientes con insuficiencia renal —aclaramiento de creatinina<50ml/min/1,73 m2— debe suspenderse al menos 4 días antes de la cirugía).
La administración de terapia puente se recomienda para pacientes con alto riesgo tromboembólico (válvulas protésicas mecánicas, fibrilación auricular con lesión valvular asociada o con un CHA2DS2-VASc mayor de 4, antecedentes de evento agudo isquémico reciente, trombofilia severa o presencia de trombo en el ápex de ventrículo izquierdo)15,16.
Pese a la ausencia de ensayos aleatorizados que respalden esta evidencia, la utilización de heparina no fraccionada es la única aprobada por las guías actuales (con una evidencia iB).
Sin embargo, y a pesar de que en comparación con la heparina de bajo peso molecular la terapia puente con heparina no fraccionada se relaciona con una menor tasa de reintervenciones por sangrado en el postoperatorio de cirugía cardíaca, la primera no requiere ingreso hospitalario para su administración y puede hacerse de forma ambulatoria, por lo que se utiliza como alternativa en la mayoría de casos programados (recomendación iiaC)17.
De acuerdo con el documento recientemente publicado, la terapia puente se debe iniciar cuando el INR es menor que 2 o tras haber omitido de 2 a 3 dosis del anticoagulante oral cuando el último INR se desconoce.
En cuanto a los tiempos de suspensión de estos fármacos, se recomienda detener la perfusión de heparina no fraccionada al menos 6 h antes de la cirugía, mientras que la última dosis de heparina de bajo peso molecular debe administrarse al menos 12 h antes de la intervención en caso de estar pautada 2 veces al día.
Estas recomendaciones se pueden aplicar también a la cirugía cardíaca pediátrica, donde se mantienen prácticamente idénticas, pese a la escasez de evidencia disponible. De hecho, y según el riesgo tromboembólico que presente el paciente, según algunos autores se podría evitar la terapia puente en pacientes con bajo riesgo tromboembólico, administrarse heparina de bajo peso molecular en los de riesgo intermedio y administrar heparina de bajo peso molecular seguida de heparina no fraccionada en pacientes con alto riesgo de trombosis18,19.
Anticoagulación y cirugía urgenteNo es infrecuente la situación de tener que intervenir a un paciente de manera urgente o emergente, sin disponer del tiempo adecuado para poder suspender con seguridad el tratamiento anticoagulante.
En estos casos, una determinación del INR (en el caso de tratarse de antagonistas de vitamina K) o los test cualitativos, como el tiempo de tromboplastina parcial activado o el tiempo de protrombina para los anticoagulantes de acción directa, deben realizarse obligatoriamente antes del procedimiento20.
En caso de no poder diferir la cirugía, se puede contemplar la posibilidad de la reversión con vitamina K (5mg intravenosa, subcutánea u oral), la administración de complejo protrombínico (25 UI de factor ix/kg) o la utilización agentes hemostáticos adecuados21. Siempre hay que individualizar el riesgo-beneficio de aplicar esta medida, ya que existen pacientes con alto riesgo tromboembólico, como aquellos portadores de prótesis mecánicas en posición mitral.
Reintroducción del tratamiento anticoagulanteEn una gran parte de procedimientos de cirugía cardíaca se va a requerir la administración posquirúrgica de tratamiento anticoagulante. Esto puede ser bien reintroduciendo el tratamiento que tomaba previamente, o bien introduciendo de novo la anticoagulación a causa del mismo procedimiento quirúrgico (implante de material protésico).
En líneas generales, y excepto en el caso de que el paciente presente un alto riesgo hemorrágico tras la cirugía, el inicio de la anticoagulación se suele recomendar a las 24 h de la intervención.
El grado de anticoagulación requerido según el tipo de procedimiento se encuentra ampliamente detallado tanto en las guías europeas de medicación perioperatoria, como en las del manejo de la enfermedad valvular22.
Si el paciente presenta un alto riesgo trombótico (prótesis mecánica en posición mitral o tricúspide, antecedente de accidente cerebrovascular, etc.), hasta alcanzar el rango deseado de INR, se debe administrar terapia puente con heparina de no fraccionada, o utilizar como alternativa heparina de bajo peso molecular subcutánea.
Tratamiento antiagreganteLos fármacos antiagregantes son de uso prácticamente generalizado en el paciente con cardiopatía isquémica. Se estima, además, que entre un 5 y un 20% de los pacientes tras intervencionismo percutáneo van a precisar una intervención quirúrgica dentro de los 12 meses siguientes al implante de un stent23. Esta cirugía en muchos casos puede ser de revascularización coronaria.
Se considera además que el número de pacientes con doble terapia antiagregante plaquetaria (DAP), que se considera la combinación de tratamiento con aspirina con un inhibidor oral del receptor P2Y12 plaquetario para el adenosín difosfato, ha crecido durante los últimos años, siendo aproximadamente 2 millones de pacientes al año los que reciben este tratamiento tras un infarto de miocardio en Europa24.
Todo ello hace que un alto porcentaje de los pacientes que se someten a cirugía cardiovascular se encuentren en tratamiento con antiagregación, tanto simple como doble.
Pese a estos hechos, no existen estudios aleatorizados que nos ayuden a tomar una decisión en este tipo de pacientes, ya que la mayoría de la evidencia disponible todavía se basa en estudios observacionales y en consenso de expertos.
Riesgo trombóticoEn función de la causa por la que el paciente está recibiendo el tratamiento antiagregante, se puede establecer una clasificación según el riesgo trombótico (tabla 3).
Estratificación del riesgo tromboembólico del paciente con tratamiento antiagregante (adaptado del Documento de Consenso acerca del manejo perioperatorio y periprocedimiento del tratamiento antitrombótico de Vivas D. et al.)
| Motivo de la antiagregación | ||||
|---|---|---|---|---|
| Riesgo | Síndrome Coronario Agudo | Enfermedad Coronaria Estable | Enfermedad Cerebrovascular | Enfermedad Arterial Periférica |
| Alto | Si ICP+SM/SLF/BLFa o CRC: <6 mc Si tratamiento médico: <1 m | Si ICP+SM/SLF/BLFa: <1-3 mc | Ictus/AIT <1 m | |
| Moderado | Si ICP+SM/SLF/BLFa o CRC: 6-12 mb Si tratamiento médico: 1-6 mb | Si ICP+SM/SLF/BLFa: 3-6 mb | <1 m implante de stent carotídeo electivo | <1 m desde el eventod |
| Bajo | Si ICP+SM/SLF/BLFa o CRC:> 12 mb Si tratamiento médico:> 6 mb | Si ICP+SM/SLF/BLFa:> 6 mb | > 1 m ictus/AIT y/o implante de stent carotídeo electivo | > 1 m desde el evento |
AIT: accidente isquémico transitorio; BLF: balón liberador de fármaco; CRC: cirugía de revascularización coronaria; DM: diabetes mellitus; ICP: intervencionismo coronario percutáneo; IRC: insuficiencia renal crónica; SLF: stent liberador de fármaco; SM: stent metálico; TCI: tronco coronario izquierdo.
En caso de SLF de primera generación (rapamicina, paclitaxel) y stent con armazón vascular bioabsorbible, se ha de considerar riesgo trombótico elevado durante los primeros 12 meses tras ICP y moderado si> 12 meses tras ICP.
El riesgo trombótico aumenta de moderado a alto y de bajo a moderado si asocia más de uno de los siguientes factores de riesgo: ictus/AIT previo, DM, IRC, ICP complejo (stents largos, múltiples, bifurcaciones, TCI, vasos únicos, solapamiento, vasos <2,5mm o injertos de vena safena).
El riesgo se debe incrementar un grado si presenta alguna de las siguientes características clínicas: revascularización con SLF autoexpandible o en oclusiones crónicas.
Adaptado de Vivas et al.1.
En general, aquellos pacientes con mayor perfil trombogénico son aquellos a los que se les ha implantado un stent liberador de fármacos de primera generación o un stent con armazón vascular bioabsorbible, las angioplastias percutáneas complejas (implante de stent largos o múltiples, o angioplastias en bifurcaciones, en el tronco coronario izquierdo, en vasos de escaso calibre o en injertos de vena safena), aquellos con antecedentes de diabetes mellitus o insuficiencia renal crónica y los que reciben antiagregación tras un síndrome coronario agudo. En este grupo de pacientes, se recomienda mantener la antiagregación al menos 6 meses tras el procedimiento percutáneo.
Cuándo suspender el tratamiento antiagregante antes de la cirugíaAntiagregación simplePese a que se ha demostrado que los pacientes intervenidos de cirugía cardíaca y que se encuentran en tratamiento con aspirina durante los 5-7 días previos a la intervención tienen un mayor riesgo de sangrado postoperatorio25 (medido como drenaje a través de los tubos), esto no influye en la necesidad de reexploración por sangrado, en la mortalidad ni en los eventos adversos isquémicos coronarios postoperatorios. Sí que se traduce, no obstante, en una mayor utilización de productos sanguíneos (con la consecuente morbilidad asociada26,27).
Sin embargo, la no suspensión del tratamiento con ácido acetilsalicílico antes de la cirugía aporta también evidentes beneficios, como la reducción de la tasa de infartos tardíos o de revascularización repetida28.
Por todo ello, la interrupción del tratamiento con aspirina no se recomienda antes de la cirugía cardíaca. Solo determinados casos podrían requerir su interrupción, como aquellos pacientes que rechazan la transfusión, cirugías de alto riesgo de sangrado o reintervenciones, insuficiencia renal severa, enfermedades hematológicas o déficits congénitos de función plaquetaria. En caso de necesidad de suspenderlo, se debe hacer entre al menos 5 días antes de la intervención2.
En el caso de la monoterapia con clopidogrel, algunos estudios observacionales han demostrado un aumento del débito hemático postoperatorio por los tubos de drenaje, una mayor transfusión de productos sanguíneos, mayor tasa de reintervención, ingresos más prolongados y una mayor mortalidad29,30. Sin embargo, esta tasa de complicaciones se reduce drásticamente cuando este fármaco se suspende al menos 5 días antes de la cirugía.
Por ello, se recomienda suspender el clopidogrel al menos 5 días antes de la intervención, a no ser que exista riesgo incontrolable de isquemia.
Esto mismo se puede aplicar a otros tipos de antiagregantes, como el prasugrel (que se recomienda suspenderlo 7 días antes de la cirugía) o el ticagrelor (3 días antes de la cirugía).
Además, las pruebas de función plaquetaria preoperatorias pueden ayudar a tomar la decisión de cuándo suspender el fármaco inhibidor del P2Y12, pudiendo reducir el tiempo de espera hasta la cirugía en pacientes tratados con clopidogrel en un 50%.
Doble antiagregación plaquetariaAl igual que en la monoterapia, la aspirina se puede mantener sin un aumento significativo del riesgo de sangrado, mientras que el otro agente se recomienda su interrupción con un margen de seguridad adecuado para evitar las complicaciones ya mencionadas31.
Sin embargo, suspender la DAP tras el implante de un stent puede derivar en fatales consecuencias, según el contexto de implante del stent (síndrome coronario agudo, enfermedad coronaria estable), la anatomía de las lesiones (bifurcación, lesión en el tronco coronario izquierdo), el tipo de stent implantado (los liberadores de fármacos de las primeras generaciones tienen un perfil mucho más trombogénico) y el tiempo transcurrido desde el implante.
En líneas generales, se recomienda retrasar la cirugía electiva hasta al menos un mes tras el implante de stent, siempre y cuando se pueda mantener la aspirina, y suspendiendo el otro fármaco al menos 5 días antes de la intervención32,33.
No obstante, cada caso debe ser individualizado, analizando el riesgo-beneficio de la suspensión de la doble antiagregación, teniendo en cuenta los factores que pueden favorecer un mayor riesgo de sangrado, así como posibles causas y consecuencias de la trombosis del stent. Aquellos pacientes diabéticos, por ejemplo, o a los que se les ha realizado una angioplastia compleja, tienen un mayor perfil trombogénico, debiendo posponerse la cirugía electiva hasta al menos 6 meses tras el implante del stent.
Se dispone de poca evidencia sobre el uso de terapia puente y el uso de antagonistas de GPIIb/IIIa, como el eptifibatide o el tirofibán, y solo se recomiendan en casos muy determinados, donde el riesgo de la suspensión de la doble antiagregación es prohibitivo34. La suspensión de estos fármacos se recomienda al menos 4 h antes de la intervención. Más recientemente, se ha demostrado la eficacia y seguridad del tratamiento puente con el cangrelor, que presenta una vida media ultracorta y que ha demostrado no aumentar las complicaciones hemorrágicas periquirúrgicas2.
Cirugía urgente y tratamiento antiagreganteNo es infrecuente, en el contexto de la cirugía de la cardiopatía isquémica, la situación de indicación de cirugía urgente (sobre todo de revascularización coronaria) en un paciente que se encuentra con DAP y en el que la intervención no se puede demorar.
En estos casos, se considera que ninguna cirugía emergente debe suspenderse pese al hecho de encontrarse el paciente con doble tratamiento antiagregante, pudiendo utilizar productos plaquetarios y haciendo una buena hemostasia quirúrgica para minimizar el sangrado33.
En casos menos urgentes que no requieren intervención de urgencia, el clopidogrel se puede suspender 48 h antes de la cirugía.
Reintroducción del tratamiento antiagreganteSe recomienda iniciar el tratamiento antiagregante con ácido acetilsalicílico (100mg/24h) durante las primeras 24 h después de la cirugía en los casos en los que está indicado.
En caso de que exista un alto riesgo trombótico y el paciente se encontrara previamente con doble antiagregación plaquetaria, se puede administrar una dosis de carga de clopidogrel (300-600mg), prasugrel (60mg) o ticagrelor (180mg).
En el caso contrario, es decir, que exista un alto riesgo hemorrágico, la reintroducción se puede diferir hasta 48-72 h tras la intervención.
En el caso particular de la cirugía de revascularización coronaria, está demostrado que la administración de aspirina de forma indefinida tras la cirugía disminuye la tasa de eventos adversos isquémicos y aunque esta evidencia es menor a partir del año de la cirugía en cuanto a permeabilidad del injerto de arteria mamaria izquierda, las recomendaciones generales abogan por mantener este tratamiento de por vida31.
Menor grado de evidencia existe en cuanto a la doble antiagregación tras la cirugía coronaria24, sobre todo en aquellos casos en los que el paciente no recibía DAP previamente a la intervención, aunque en las últimas guías europeas de manejo de medicación perioperatoria en cirugía cardíaca se apuesta por administrar DAP a todo paciente revascularizado tras un síndrome coronario agudo, independientemente del método de revascularización2. Se ha demostrado que la DAP con clopidogrel disminuye la tasa de oclusión de los injertos venosos y la mortalidad a 30 días, sobre todo en aquellos pacientes revascularizados quirúrgicamente sin circulación extracorpórea10,35,36. Sin embargo, el TRITON-TIMI 38 y el PLATO compararon la DAP con prasugrel y ticagrelor, respectivamente, obteniendo mejores resultados que con el clopidogrel (aunque con un mayor sangrado con el prasugrel)37,38.
La doble antiagregación se debe reintroducir durante los 7 primeros días tras la cirugía, aunque es recomendable hacerlo durante las primeras 48 h en ausencia de riesgo de sangrado.
ConclusiónLa publicación del Documento de Consenso acerca del manejo perioperatorio y periprocedimiento del tratamiento antitrombótico sirve para homogeneizar la práctica clínica en cuanto al manejo del paciente con tratamiento antitrombótico en el contexto de una cirugía o intervencionismo. Este documento, con ciertas particularidades aplicadas a nuestro campo de la cirugía cardiovascular, puede servir como guía de actuación ante estos pacientes que cada vez son más frecuentes en la práctica diaria.
Conflicto de interesesNo.